超声弹性成像联合血清E-cadherin和PGRMC1评估乳癌新辅助化疗疗效的价值
[摘要]目的探讨超声弹性成像(UE)参数联合血清E-钙黏附蛋白(E-cadherin)、孕激素膜受体膜组分1(PGRMC1)评估乳癌新辅助化疗(NAC)疗效的价值。
方法选取2019年3月—2022年3月我院收治的124例行4个周期NAC(每个周期21 d)的乳癌病人,病人化疗前后均行UE检查。依据NAC后的病理检查结果将病人分为缓解组与未缓解组。采用酶联免疫吸附试验法检测血清E-cadherin、PGRMC1水平,通过受试者工作特征曲线下面积(AUC)评估UE、E-cadherin、PGRMC1三者单独及联合检测对乳癌病人NAC疗效的预测价值。
结果NAC后UE结果与病理结果的Kappa系数为0.783(P<0.05)。与缓解组相比,未缓解组NAC后弹性应变率比值(SR)、弹力成像评分(UES)、E-cadherin、PGRMC1显著增加(t=2.571~14.073,P<0.05);未缓解组NAC后SR、UES、E-cadherin、PGRMC1降低幅度低于缓解组,差异有统计学意义(t=14.625~50.773,P<0.05)。SR、UES、E-cadherin、PGRMC1诊断乳癌病人NAC后缓解的AUC分别为0.795、0.701、0.764、0.814,E-cadherin与PGRMC1水平并联再与UE串联后联合诊断的AUC为0.903。
结论UE参数联合血清E-cadherin、PGRMC1对乳癌NAC疗效具有较高的诊断效能。
[关键词]乳腺肿瘤;肿瘤辅助疗法;弹性成像技术;钙黏着糖蛋白类;孕激素膜受体膜组分1;诊断
[中图分类号]R737.9;R445.1
[文献标志码]A
[文章编号]2096-5532(2024)04-0548-04doi:10.11712/jms.2096-5532.2024.60.137
[开放科学(资源服务)标识码(OSID)]
[网络出版]https://link.cnki.net/urlid/37.1517.R.20240930.0917.001;2024-09-3014:06:38
Value of ultrasound elastography combined with serum E-cadherin and progesterone receptor membrane component 1 in evaluating the efficacy of neoadjuvant chemotherapy for breast cancer
LIU Yujie, WANG Heng, WU Di, HAN Ying, LIU Yiqun
(Ultrasound Diagnosis Department of Qinhuangdao First Hospital, Qinhuangdao 066000, China)
; [Abstract]ObjectiveTo investigate the value of ultrasound elastography (UE) combined with serum E-cadherin and progesterone receptor membrane component 1 (PGRMC1) in evaluating the efficacy of neoadjuvant chemotherapy (NAC) for breast cancer.
MethodsA total of 124 breast cancer patients who were admitted to our hospital and underwent four cycles of NAC (21 days per cycle) from March 2019 to March 2022 were enrolled, and UE examination was performed before and after chemotherapy. According to the pathological examination results after NAC, the patients were divided into remission group and non-remission group. ELISA was used to measure the serum levels of E-cadherin and PGRMC1, and the area under the ROC curve (AUC) was used to investigate the value of UE, E-cadherin, and PGRMC1 used alone or in combination in predicting the efficacy of NAC in breast cancer patients.
ResultsThe Kappa coefficient between UE and pathological results after NAC was 0.783 (P<0.05). Compared with the remission group, the non-remission group had significant increases in elastic strain rate ratio (SR), ultrasound elastography score (UES), E-cadherin, and PGRMC1 after NAC (t=2.571-14.073,P<0.05), and compared with the remission group, the non-remission group had a significantly lower degree of reductions in SR, UES, E-cadherin, and PGRMC1 after NAC (t=14.625-50.773,P<0.05). SR, UES, E-cadherin, and PGRMC1 used alone had an AUC of 0.795, 0.701, 0.764, and 0.814, respectively, in the diagnosis of remission after NAC in breast cancer patients, while E-cadherin and PGRMC1 combined with UE had an AUC of 0.903.
ConclusionUE parameters combined with serum E-cadherin and PGRMC1 have a good performance in predicting the efficacy of NAC in breast cancer.
[Key words]breast neoplasms; neoadjuvant chemotherapy; elasticity imaging techniques; cadherins; progesterone receptor membrane component 1; diagnosis
乳癌位居女性癌症死亡首位,严重威胁女性健康[1]。术前新辅助化疗(NAC)+手术治疗是中期乳癌病人的优选治疗方法[2]。尽早判断乳癌病人对NAC是否有反应,对制定个体化治疗方案,提高生存率具有重要意义。超声弹性成像(UE)可用于评估乳癌NAC疗效[3-4]。E-钙黏附蛋白(E-cadherin)是一种肿瘤转移抑制基因,可用来评估乳癌病人的NAC疗效[5]。孕激素膜受体膜组分1(PGRMC1)是一种新型膜激素受体,可作为评估乳癌病人预后的生物学指标[6]。但是UE联合血清E-cadherin、PGRMC1评估乳癌病人NAC疗效的研究少有报道。本研究旨在探讨UE参数联合血清E-cadhe-
rin、PGRMC1对乳癌NAC疗效的诊断价值。现将结果报告如下。
1资料与方法
1.1研究对象
选取秦皇岛市第一医院2019年3月—2022年3月收治的124例乳癌病人,年龄32~75岁,平均(51.22±11.59)岁。纳入标准:①乳癌诊断标准参照相关文献[7];②行穿刺活检证实为Ⅱ、Ⅲ期乳癌;③乳腺肿瘤可测量,直径在3~13 cm;④NAC前后均行UE检查,同时检测NAC后血清E-cadherin、PGRMC1水平;⑤NAC采用TE化疗方案(表柔比星75 mg/m2、多西他赛75 mg/m2);⑥行NAC(4个周期)后休息1~2周,再行保乳手术或改良根治术;⑦病理资料齐全。排除标准:①合并其他恶性肿瘤者;②合并高血压、糖尿病、慢性感染者;③中途退出研究者。依据NAC后的病理检查结果将病人分为缓解组与未缓解组。所有病人及家属均知情同意。本研究获我院伦理委员会批准。
1.2UE检查
利用线阵探头频率为6~15 MHz的彩色多普勒超声诊断仪(LOGIQS8型,购自美国GE公司),由同一位工作年限≥5年的乳腺弹性超声诊断医生进行检查。首先行常规乳腺超声检查,观察病灶声像特征,记录病灶最大直径,待图像稳定后启动弹性成像模式行UE检查,选择适宜的取样框(感兴趣区为病灶面积的2~3倍),保证探头垂直于病灶组织并给予适宜的压力,获得满意压力曲线图像时获取弹性图像并储存。测量指标包括弹性应变率比值(SR)、弹力成像评分(UES)[8]。每个病灶测量3次,取平均值。
1.3血清E-cadherin和PGRMC1水平检测
乳癌病人NAC后UE检查前取空腹静脉血5 mL,离心取上清液,采用酶联免疫吸附试验法检测血清E-cadherin、PGRMC1水平,试剂盒购自美国ASSAYPRO公司,所有操作按照说明书进行。
1.4UE、E-cadherin、PGRMC1联合检查
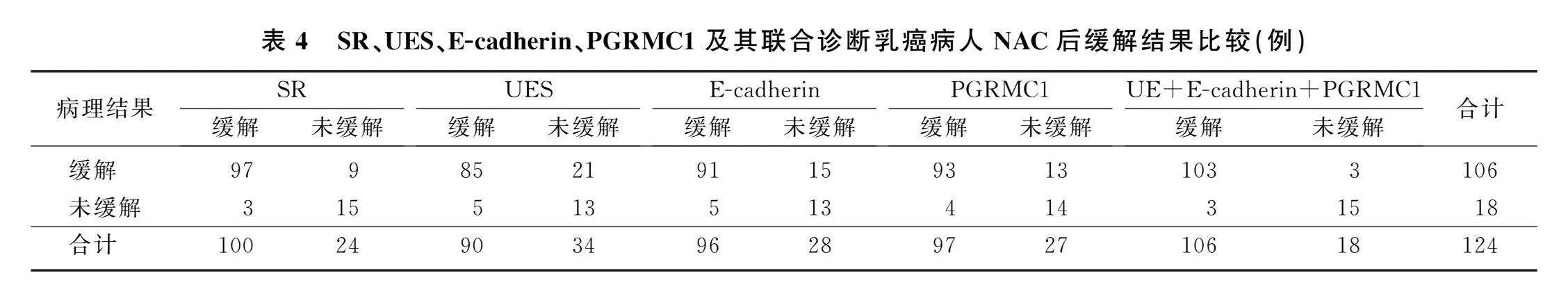
UE、E-cadherin、PGRMC1三者中≥2项缓解则认定为联合检查缓解。以病理学检查结果为金标准,评估UE、E-cadherin、PGRMC1三者单独及联合检测对乳癌病人NAC疗效的诊断价值。
1.5NAC疗效评价
1.5.1UE检查参照文献标准评价NAC疗效[9]。①有效:SUE图像评分1~3分;②无效:SUE图像评分为4~5分。
1.5.2病理学评价参照文献标准评价NAC疗效[10]。①1级:病人肿瘤细胞密度较化疗前无变化;②2级:病人肿瘤细胞密度较化疗前下降<30%;③3级:病人肿瘤细胞密度较化疗前下降30%~90%;④4级:病人肿瘤细胞密度较化疗前下降>90%;⑤5级:病人肿瘤全部消失,镜下未见浸润癌残留。≤2级为未缓解,≥3级为缓解。
1.6统计学分析
采用SPSS 25.0软件进行数据统计分析。计数资料以例数和百分数表示,组间比较采用χ2检验。计量资料以±s表示,两组间比较采用成组t检验。采用Kappa系数分析UE结果与病理学结果的一致性。采用Pearson相关系数分析UE参数与血清E-cadherin、PGRMC1水平的相关性。采用受试者工作特征(ROC)曲线下面积(AUC)、灵敏度、特异度、准确度、约登指数评估UE和血清E-cadherin、PGRMC1三者单独及联合检测对NAC疗效的诊断价值。P<0.05为差异有统计学意义。
2结果
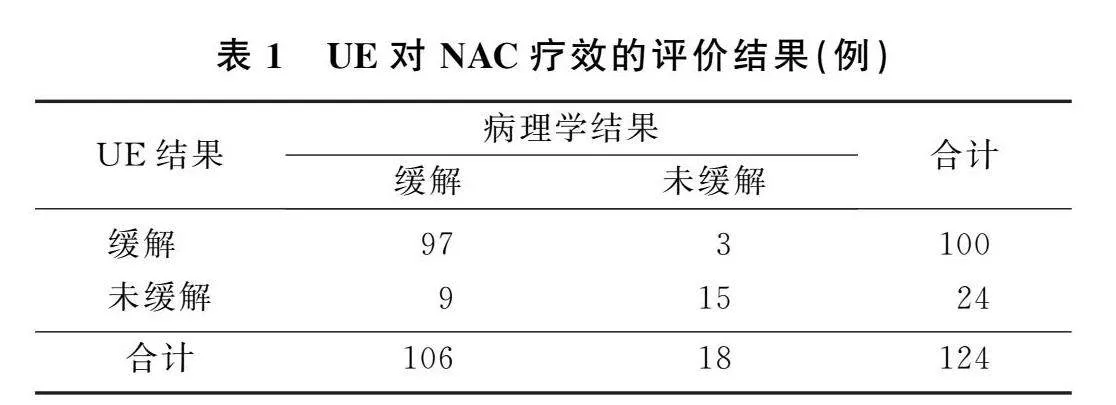
2.1UE评估NAC疗效
UE评估NAC疗效的灵敏度为91.51%,特异度为83.33%,准确度为90.32%。NAC后UE结果与病理学结果的Kappa系数为0.783(P<0.05)。见表1。
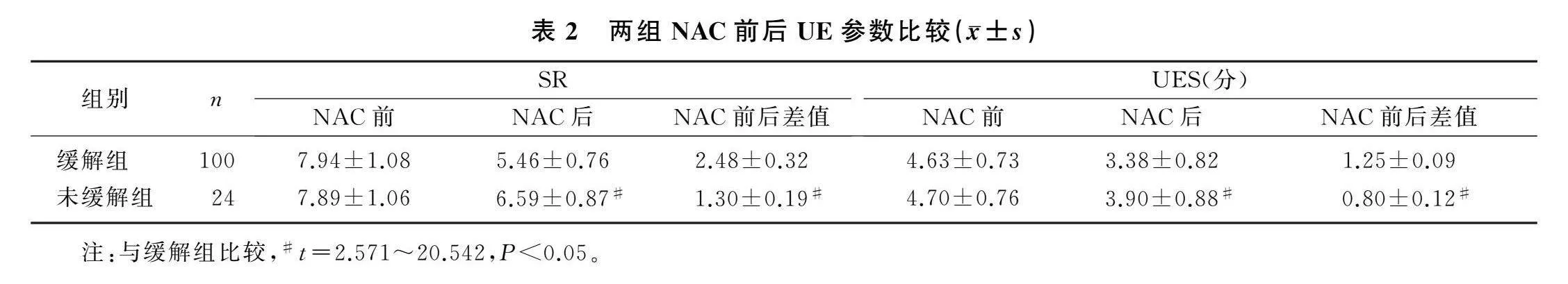
2.2两组NAC前后UE参数比较
与缓解组相比,未缓解组NAC后SR、UES显著增加(t=6.538、2.571,P<0.05);未缓解组NAC后SR、UES降低幅度低于缓解组,差异有统计学意义(t=17.314、20.542,P<0.05)。见表2。
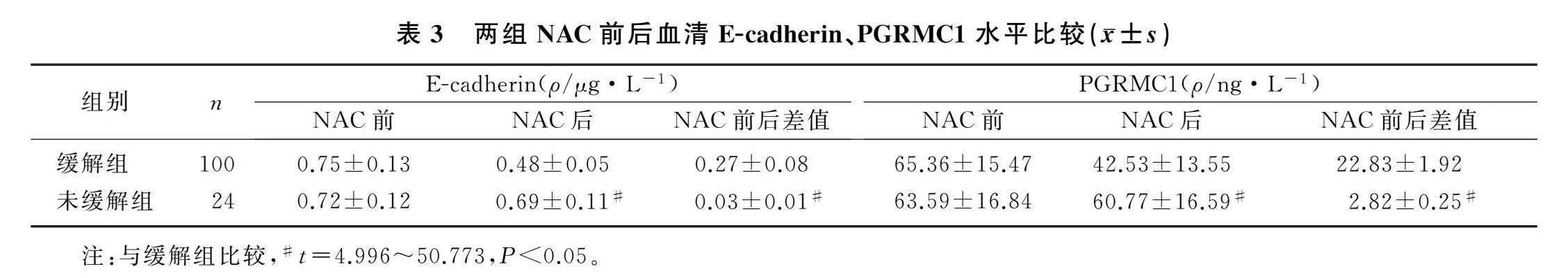
2.3两组NAC前后血清E-cadherin、PGRMC1水平比较
与缓解组相比,未缓解组NAC后血清E-cadherin、PGRMC1水平显著增加(t=14.073、4.996,P<0.05);未缓解组NAC后的血清E-cadherin、PGRMC1水平降低幅度低于缓解组,差异有统计学意义(t=14.625、50.773,P<0.05)。见表3。
2.4乳癌病人血清E-cadherin、PGRMC1水平与UE参数的相关性
乳癌病人血清E-cadherin水平与SR、UES呈正相关(r=0.635、0.704,P<0.001),其血清PGRMC1水平与SR、UES评分也呈正相关(r=0.602、0.614,P<0.001)。
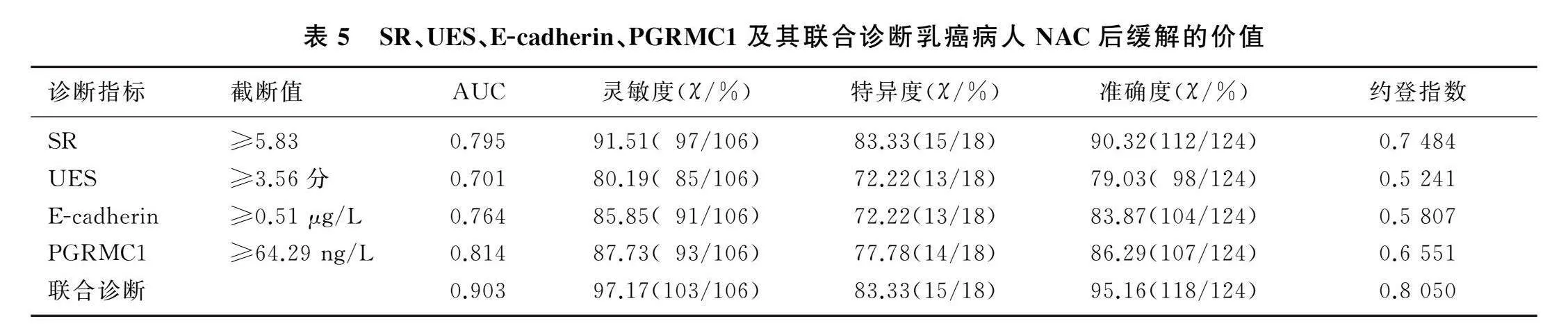
2.5UE参数联合血清E-cadherin、PGRMC1水平诊断乳癌病人NAC疗效的价值
SR、UES、E-cadherin、PGRMC1诊断乳癌病人NAC后缓解的AUC分别为0.795、0.701、0.764、0.814,E-cadherin与PGRMC1水平并联再与UE串联后联合诊断的AUC为0.903。见表4、5。
3讨论
NAC后肿瘤内部会发生不同程度的改变,UE可对组织硬度信息进行客观的判断[11]。UE的原理是基于组织间弹性系数的差异,通过施加振动产生应变差异,从而提取与组织弹性相关的参数,对病灶进行定性、定量的评价与诊断[3,12]。UE对评估乳癌病人NAC病理完全缓解具有一定的价值[13]。本文研究结果显示,UE评估NAC疗效与病理学检查结果具有良好的一致性,与袁莹莹等[14]的研究结果相一致。本文研究结果显示,UE参数对评估NAC疗效具有一定的价值,这可能是因为化疗药物破坏了肿瘤组织血管,降低了血氧供应,导致肿瘤细胞的破坏、裂解,进而使肿瘤组织及周边组织的硬度相应减小[15]。
血清肿瘤标志物水平在诊断肿瘤、判断NAC疗效、指导治疗、监测复发或转移、评估预后方面至关重要[16]。E-cadherin属于CDH1编码的钙黏蛋白,其异常表达与肿瘤发生相关,且其组织表达的降低可以通过提高肿瘤细胞侵袭、增殖、转移等途径促进肿瘤的进展[17]。有研究显示,E-cadherin是乳癌病人发生远处转移的预测指标[18]。纪术峰等[19]的研究表明,血清PGRMC1水平在乳癌病人NAC前后变化显著,PGRMC1有可能成为评估乳癌病人NAC疗效的指标。本研究结果显示,血清E-cadherin、PGRMC1水平评估病人NAC疗效的灵敏度、特异度均较高,提示E-cadherin、PGRMC1水平可能在乳癌发生发展中起关键作用,也可能影响NAC疗效。可能是由于肿瘤细胞浸润、增殖引起癌组织中E-cadherin、PGRMC1的缺失、脱落,使二者更有效地释放入血,导致病人的血清E-cadherin、PGRMC1水平明显升高;经NAC后,二者的血清水平均显著下降。由此可见,检测血清E-cadherin、PGRMC1水平有利于评估乳癌病人NAC的疗效。本文研究结果显示,SR、UES与血清E-cadherin、PGRMC1水平呈正相关,说明乳癌病人NAC后血清E-cadherin、PGRMC1水平的下降可能是导致SR、UES下降的原因之一。可能是因为NAC后,乳癌病人的肿瘤细胞破坏、裂解,导致E-cadherin、PGRMC1在病人中的表达下降,也使肿瘤组织及周边组织硬度相应减小。
综上所述,本研究采用无创的检查方法(UE)和简单的血清学指标(E-cadherin、PGRMC1)对乳癌病人NAC效果进行评估,结果表明UE参数联合血清E-cadherin、PGRMC1诊断乳癌病人NAC疗效具有较高的诊断效能。但本研究样本量不大,且缓解组与非缓解组在病例数上相差较大,后续需增大样本量进行深入探讨。
[参考文献]
[1]李洪波,郑雪松,王文慧. 超声联合Ki-67在乳腺癌新辅助化疗疗效评价中的应用价值[J]. 北华大学学报(自然科学版), 2021,2LyrmLzBuppd4KPviAwqUhA==2(6):788-791.
[2]王锴,郭向婷,宗守凯. C反应蛋白/白蛋白、血小板/淋巴细胞比率与乳腺癌患者病理特征、新辅助化疗疗效的相关性[J]. 川北医学院学报, 2022,8(8):1032-1036.
[3]赵倩颖,纪晓惠,石可心. 超声造影及弹性成像评估乳腺癌新辅助化疗效果的研究进展[J]. 中华超声影像学杂志, 2021,7(3):272-276.
[4]张鹏飞,王茂,余湛. 彩色多普勒血流成像联合超声弹性成像在乳腺癌临床诊断、新辅助化疗疗效评估中的应用价值[J]. 癌症进展, 2022,20(11):1133-1136.
[5]魏鹏,陈鹏. 乳腺癌患者E-钙黏附蛋白、肌切蛋白的表达水平与新辅助化疗疗效的相关性[J]. 海南医学, 2022,33(7):853-856.
[6]赵越,阮祥燕,程姣姣,等. 乳腺癌中PGRMC1表达与临床病理参数的相关性[J]. 首都医科大学学报, 2022,43(3):350-356.
[7]中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2021年版)[J]. 中国癌症杂志, 2021,31(10):954-1040.
[8]邓亚云,李海芬,冯丽,等. 超声弹性成像联合血清TFF1、PGRMC1检测在乳腺癌早期筛查中的诊断价值[J]. 分析仪器, 2022,8(5):80-85.
[9]ITOH A, UENO E, TOHNO E, et al. Breast disease: clinical application of US elastography for diagnosis[J]. Radiology, 2006,239(2):341-350.
[10]WANG W, LIU Y H, ZHANG H, et al. Prognostic value of residual cancer burden and Miller-Payne system after neoadjuvant chemotherapy for breast cancer[J]. Gland Surgery, 2021,10(12):3211-3221.
[11]FERNANDES J, SANNACHI L, TRAN W T, et al. Monitoring breast cancer response to neoadjuvant chemotherapy using ultrasound strain elastography[J]. Translational Oncology, 2019,12(9):1177-1184.
[12]WEISMANN C. Ultrasound elastography techniques in breast cancer[J]. Der Radiologe, 2021,61(2):170-176.
[13]孙家宝,张蕾,崔浩,等. 超声评估乳腺癌新辅助化疗后病理完全缓解的临床应用价值[J]. 中华超声影像学杂志, 2021,30(5):420-425.
[14]袁莹莹,陈孑孑,何莉莉,等. 超声弹性成像与超声造影在乳腺癌新辅助化疗效果评估中的应用效果观察[J]. 湖南中医药大学学报, 2020,6(S01):102-104.
[15]左建建,泮旭铭,沈健,等.MRI联合肿瘤标志物在妇科卵巢良、恶性肿瘤诊断中的应用研究[J]. 中国医刊,2021,56(2):200-204.
[16]彭美霞,陈锦鹏,黄智奇,等. 血清nectin-4、25-(OH)D、E-cadherin评估乳腺癌FAC方案新辅助化疗效果的临床研究[J]. 临床和实验医学杂志, 2021,20(21):2296-2299.
[17]杜文英,贾维. 三阴性乳腺癌组织p53、Ki-67、Twist及E-cadherin的表达及其意义[J]. 实用医院临床杂志, 2021,18(6):84-87.
[18]ZHOU W X, WU M, LIN H X, et al. Potential value of tumor stiffness and sE-cadherin in predicting the response to neoadjuvant therapy in HER2-positive breast cancers[J]. Future Oncology, 2022,18(25):2817-2825.
[19]纪术峰,杨华锋,吴爱国. PGRMC1参与调控乳腺癌细胞增殖及化疗敏感度的实验[J]. 肿瘤防治研究, 2012,39(2):123-126.
(本文编辑周晓彬)

