高尿酸血症小鼠模型构建及其对肠屏障损伤的影响

[摘要]目的构建稳定的肠屏障损伤高尿酸血症小鼠模型。
方法采用不同浓度腺嘌呤(Ade)和氧嗪酸钾(PO)灌胃小鼠,分别在第3、7、14和21天检测血清尿酸、尿素氮、肌酐水平和肠渗透性,检测空肠、回肠和结肠中紧密连接蛋白Occludin、ZO-1和Claudin-1的表达。
结果高浓度的Ade和PO导致小鼠尿酸升高(F=25.453~518.039,P<0.01)、体质量降低(F=6.900~43.724,P<0.05)。50 mg/kg Ade和125 mg/kg PO连续灌胃7 d导致小鼠尿酸升高(P<0.05),可持续升高至21 d(P<0.05),同时肠渗透性升高(F=28.563~185.808,P<0.05)并与尿酸水平呈正相关性(r=0.876 9,P<0.05)。与正常小鼠相比,Occludin和ZO-1在高尿酸血症小鼠回肠和结肠中表达降低(t=3.164、3.678,P<0.05),Claudin-1在空肠中表达降低(t=2.670,P<0.05)。
结论采用50 mg/kg Ade和125 mg/kg PO连续灌胃7 d可构建肠屏障损伤的高尿酸血症小鼠模型。
[关键词]高尿酸血症;肠;容积渗克分子浓度;疾病模型,动物
[中图分类号]R589.9;R322.45
[文献标志码]A
[文章编号]2096-5532(2024)04-0508-05doi:10.11712/jms.2096-5532.2024.60.121
[开放科学(资源服务)标识码(OSID)]
[网络出版]https://link.cnki.net/urlid/37.1517.R.20240829.1158.003;2024-08-3107:00:03
Establishment of a mouse model of hyperuricemia with intestinal barrier injury
ZHU Xianju, LUQiulan, HU Heming(Laboratory Department of Qingdao Eighth People’s Hospital, Qingdao 266000, China) ; [Abstract]ObjectiveTo establish a stable mouse model of intestinal barrier injury induced by hyperuricemia.
Methods
The mice were given different concentrations of adenine (Ade) and potassium oxazinate (PO) by gavage, and serum uric acid, urea nitrogen, creatinine, and intestinal permeability were measured on days 3, 7, 14, and 21. The expression levels of tight junction proteins Occludin, ZO-1, and Claudin-1 in the jejunum, ileum, and colon were measured.
ResultsThe high concentrations of Ade and PO induced a significant increase in uric acid (F=25.453-518.039,P<0.01) and a significant reduction in body weight (F=6.900-43.724,P<0.05). Administration of 50 mg/kg Ade and 125 mg/kg PO by gavage for 7 consecutive days induced a significant increase in uric acid (P<0.05), which continued to rise until day 21 (P<0.05), and there was also a significant increase in intestinal permeability (F=28.563-185.808,P<0.05), which was positively correlated with the level of uric acid (r=0.876 9,P<0.05). Compared with normal mice, the mice with hyperuricemia had significant reductions in the expression levels of Occludin and ZO-1 in the ileum and the colon (t=3.164,3.678;P<0.05), as well as a significant reduction in the expression level of Claudin-1 in the jejunum (t=2.670,P<0.05).
ConclusionAdministration of 50 mg/kg Ade and 125 mg/kg PO by gavage for 7 consecutive days can establish a mouse model of hyperuricemia with intestinal barrier injury.
[Key words]hyperuricemia; intestines; osmolar concentration; disease models, animal
高尿酸血症是一种常见的代谢性疾病,除导致痛风外,高尿酸血症还被认为是代谢综合征和心血管疾病的风险因素之一[1-2]。基因敲除技术是构建高尿酸血症模型的一种重要手段,通过CRISPR/Cas9技术敲除与尿酸代谢或尿酸排泄相关的基因(如尿酸酶UOX基因、尿酸转运蛋白SLC2A9基因等)可构建稳定的高尿酸血症模型[3-5]。但基因敲除构建的高尿酸血症小鼠模型常存在不易繁殖、死亡率高等问题。药物诱导主要采用一些尿酸合成酶抑制剂或尿酸排泄抑制剂例如氧嗪酸钾(PO)等药物构建高尿酸血症模型,饮食诱导主要采用提供高嘌呤饮食或补充尿酸前体物[6]。单一的药物或者饮食可以快速升高尿酸水平,但不能长期维持。目前常联合使用PO和腺嘌呤(Ade)构建高尿酸血症模型[7-8]。但目前大部分研究构建的高尿酸血症模型为大鼠模型,采用药物诱导构建高尿酸血症小鼠模型的研究较少。肠道在维持体内代谢平衡和免疫系统调控中起着至关重要的作用[9]。肠屏障损伤被认为与多种代谢性疾病的发生和发展密切相关[10-12]。建立一种稳定的高尿酸血症小鼠模型,并研究其肠屏障的变化及机制对于研究高尿酸血症的发病机制和寻找潜在的治疗途径具有重要意义。本研究构建一种稳定的肠屏障损伤的高尿酸血症小鼠模型,研究肠道与高尿酸血症之间的关系,为未来该病的治疗开辟新的道路。
1材料与方法
1.1实验动物
C57BL/6J品系雄性小鼠(6周龄左右)购自北京维通利华实验动物技术有限公司。小鼠被饲养在青岛大学附属医院动物实验中心的SPF级动物房中,可自由获取水和食物。在适应性饲养(正常饮食和正常饮水)1周后,开始进行实验处理。所有实验操作均符合动物实验伦理要求,并且获得青岛大学附属医院实验动物福利伦理委员会批准(AHQU-MAL2018-079)。
1.2高尿酸血症小鼠模型构建
采用Ade和PO灌胃的方式构建高尿酸血症小鼠模型。将小鼠随机分为6组,每组6只,分别接受以下处理。正常组(Con组):C57BL/6J小鼠接受正常标准饮食,并灌胃同实验组等体积的5 g/L羧甲基纤维素钠;高尿酸血症第1组(100 mg/kg Ade+500 mg/kg PO):每天灌胃100 mg/kg Ade和500 mg/kg PO;高尿酸血症第2组(50 mg/kg Ade+250 mg/kg PO):每天灌胃50 mg/kg Ade和250 mg/kg PO;高尿酸血症第3组(50 mg/kg Ade+250 mg/kg PO (2 d)):每2 d灌胃1次,每次灌胃50 mg/kg Ade和250 mg/kg PO;高尿酸血症第4组(25 mg/kg Ade+125 mg/kg PO):每天灌胃25 mg/kg Ade和125 mg/kg PO;高尿酸血症第5组(50 mg/kg Ade+125 mg/kg PO):每天灌胃50 mg/kg Ade和125 mg/kg PO。PO溶解于5 g/L羧甲基纤维素钠中。实验过程中,相对于正常组,当小鼠体质量下降了10%~15%时,终止实验。21 d后,小鼠被安乐处死,收集血清及空肠、回肠和结肠组织,保存于-80 ℃低温冰箱中。
1.3尿酸、肌酐和尿素氮的检测
分别于灌胃后的第3、7、14和21天,小鼠禁食过夜,采集其血液,以3 500 r/min离心5 min,收集血清。使用全自动生化分析仪检测血清中尿酸、肌酐和尿素氮水平。
1.4小鼠肠渗透性检测
使用异硫氰酸荧光素标记的葡聚糖(FD4)测定小鼠的肠道通透性。所有小鼠禁水4 h以后,灌胃400 mg/kg体质量的FD4,并在4 h后采集其血液。使用多功能酶标仪测量血清中FD4的荧光强度,检测的激发波长为485 nm,发射波长为528 nm。根据标准曲线计算出FD4浓度,FD4浓度代表肠渗透性的大小。
1.5RNA的提取及反转录
加入总RNA抽提试剂Trizol后,将结肠组织研磨成匀浆液,加入氯仿,混匀,离心取上清液,加入同体积异丙醇,离心,弃上清液,用体积分数0.75乙醇洗涤3次,沉淀为总RNA。使用QuickDrop超微量紫外可见分光光度仪测定RNA浓度及纯度。反转录体系:All-In-One 5×RT Master Mix 4 μL,总 RNA 5 μL,无核酶水11 μL。以上反应体系混合均匀,于37 ℃ 15 min、60 ℃ 10 min、95 ℃ 3 min条件下反应,反转录产物为cDNA。
1.6荧光定量PCR
荧光定量PCR反应体系:BlasTaq 2×qPCR MM 10.0 μL,上游引物 0.5 μL,下游引物 0.5 μL,cDNA 2.0 μL,无核酶水17.0 μL。反应条件:95 ℃ 3 min;95 ℃ 15 s,60 ℃ 60 s,40个循环。引物序列见表1。
1.7统计分析
采用SPSS 17.0软件对数据进行统计分析。定量数据以±s表示,两组均数的比较采用两独立样本比较的t检验;多组均数随时间变化比较采用重复测量方差分析,两两比较采用Tukey检验。相关性检验采用Pearson相关性分析。P<0.05为差异有统计学意义。
2结果
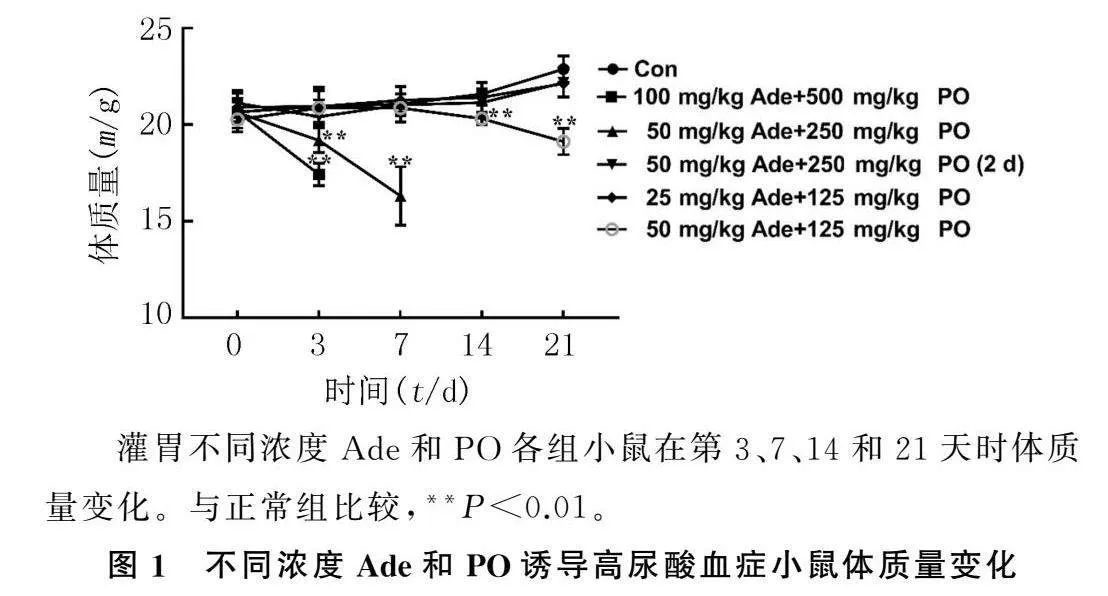
2.1Ade和PO诱导的高尿酸血症小鼠的体质量变化当采用100 mg/kg Ade+500 mg/kg PO和
50 mg/kg Ade+250 mg/kg PO诱导时,分别在第3、7天时小鼠体质量减少量低于正常小鼠体质量的20%,终止该组实验。重复测量的方差分析显示,F浓度=12.723,P<0.001;F时间=8.375,P<0.001;F浓度*时间=9.071,P<0.001。灌胃之前和灌胃第3、7天时,各组小鼠体质量之间差异无统计学意义(F=0.037~2.245,P>0.05)。第14天时,不同浓度处理组小鼠体质量之间的差异具有统计学意义(F=6.901,P<0.05),50 mg/kg Ade+125 mg/kg PO组小鼠体质量显著低于正常组(P<0.01)。建模第21天时,不同浓度处理组小鼠体质量比较差异具有统计学意义(F=43.724,P<0.01),50 mg/kg Ade+125 mg/kg PO组小鼠体质量显著低于正常组(P<0.01)。见图1。
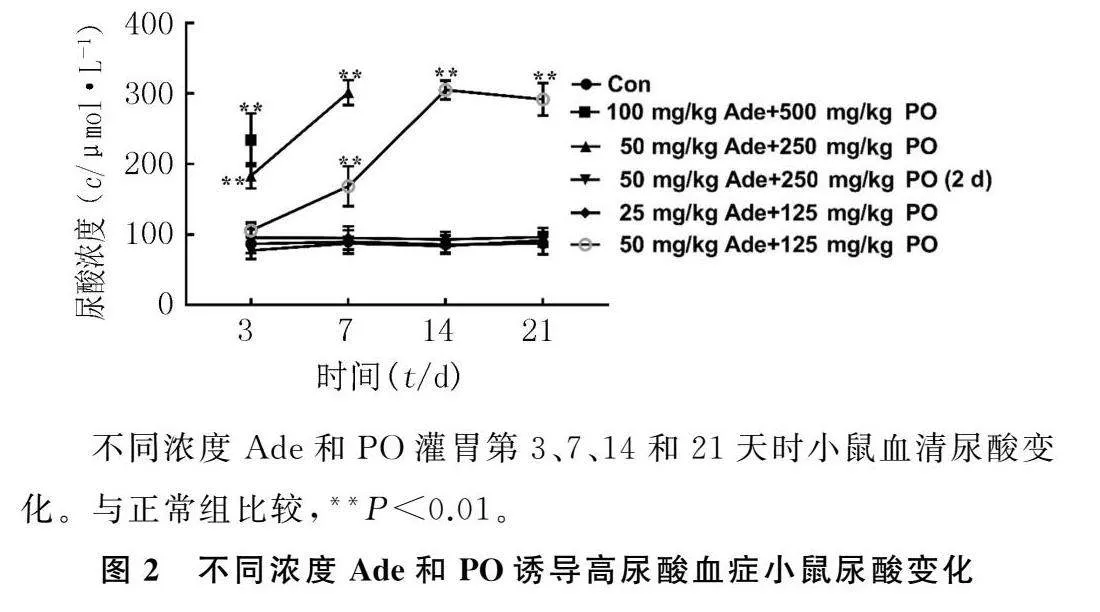
2.2Ade和PO诱导的高尿酸血症小鼠尿酸变化
重复测量方差分析结果显示,F浓度=159.443,P<0.001;F时间=107.273,P<0.001;F浓度*时间=99.518,P<0.001。灌胃第3天时,各组小鼠的尿酸差异无统计学意义(F=3.034,P>0.05)。第7天时,各组小鼠的尿酸水平差异有统计学意义(F=25.453,P<0.01),50 mg/kg Ade+125 mg/kg PO组小鼠尿酸水平显著高于正常组(P<0.01)。在第14天时,各组小鼠的尿酸水平差异有统计学意义(F=518.039,P<0.01),50 mg/kg Ade+125 mg/kg PO组小鼠尿酸水平高于正常组(P<0.01)。第21天时,各组小鼠的尿酸水平差异有统计学意义(F=232.211,P<0.01),50 mg/kg Ade+125 mg/kg PO组小鼠尿酸水平高于正常组(P<0.01)。100 mg/kg Ade+500 mg/kg PO组和50 mg/kg Ade+250 mg/kg PO组小鼠尿酸水平从第3天开始高于正常组小鼠(P<0.01)。见图2。
2.3Ade和PO诱导的高尿酸血症小鼠尿素氮和肌酐的变化
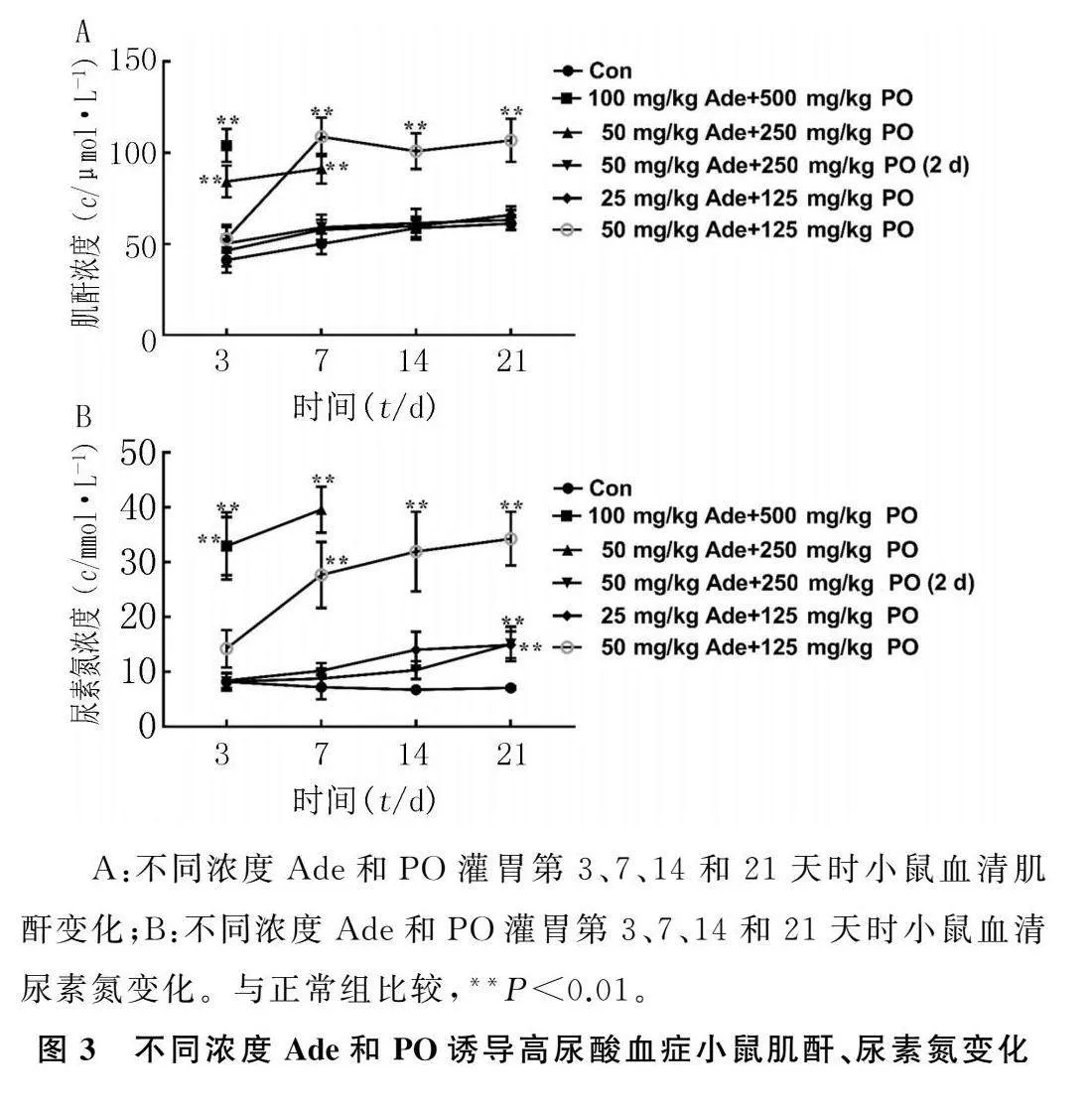
重复测量方差分析显示,肌酐、尿素氮F浓度=123.244、97.092,P<0.001;F时间=64.808、36.101,P<0.001;F浓度*时间=11.924、13.130,P<0.001。第3天时,正常组、50 mg/kg Ade+250 mg/kg PO(2 d)、 50 mg/kg Ade+125 mg/kg PO及25 mg/kg Ade+125 mg/kg PO各组小鼠的肌酐、尿素氮差异无统计学意义(F=2.2390、1.569,P>0.05)。采用100 mg/kg Ade+500 mg/kg PO及50 mg/kg Ade+250 mg/kg PO灌胃诱导的高尿酸血症小鼠血清肌酐、尿素氮水平在第3天时均高于正常组小鼠(P<0.01)。在第7天时,各组小鼠肌酐、尿素氮的差异具有统计学意义(F=77.675、47.127,P<0.01),50 mg/kg Ade+125 mg/kg PO诱导的高尿酸血症小鼠肌酐和尿素氮显著高于正常小鼠(P<0.01)。第14天时,各组小鼠肌酐、尿素氮比较差异具有统计学意义(F=48.469、44.953,P<0.01),50 mg/kg Ade+125 mg/kg PO诱导的高尿酸血症小鼠肌酐和尿素氮高于正常小鼠(P<0.01)。第21天时,各组小鼠肌酐、尿素氮的差异有统计学意义(F=55.872、80.966,P<0.01),50 mg/kg Ade+125 mg/kg PO诱导的高尿酸血症小鼠肌酐、尿素氮水平高于正常小鼠(P<0.01)。见图3A、B。
A:不同浓度Ade和PO灌胃第3、7、14和21天时小鼠血清肌酐变化;B:不同浓度Ade和PO灌胃第3、7、14和21天时小鼠血清尿素氮变化。与正常组比较,**P<0.01。
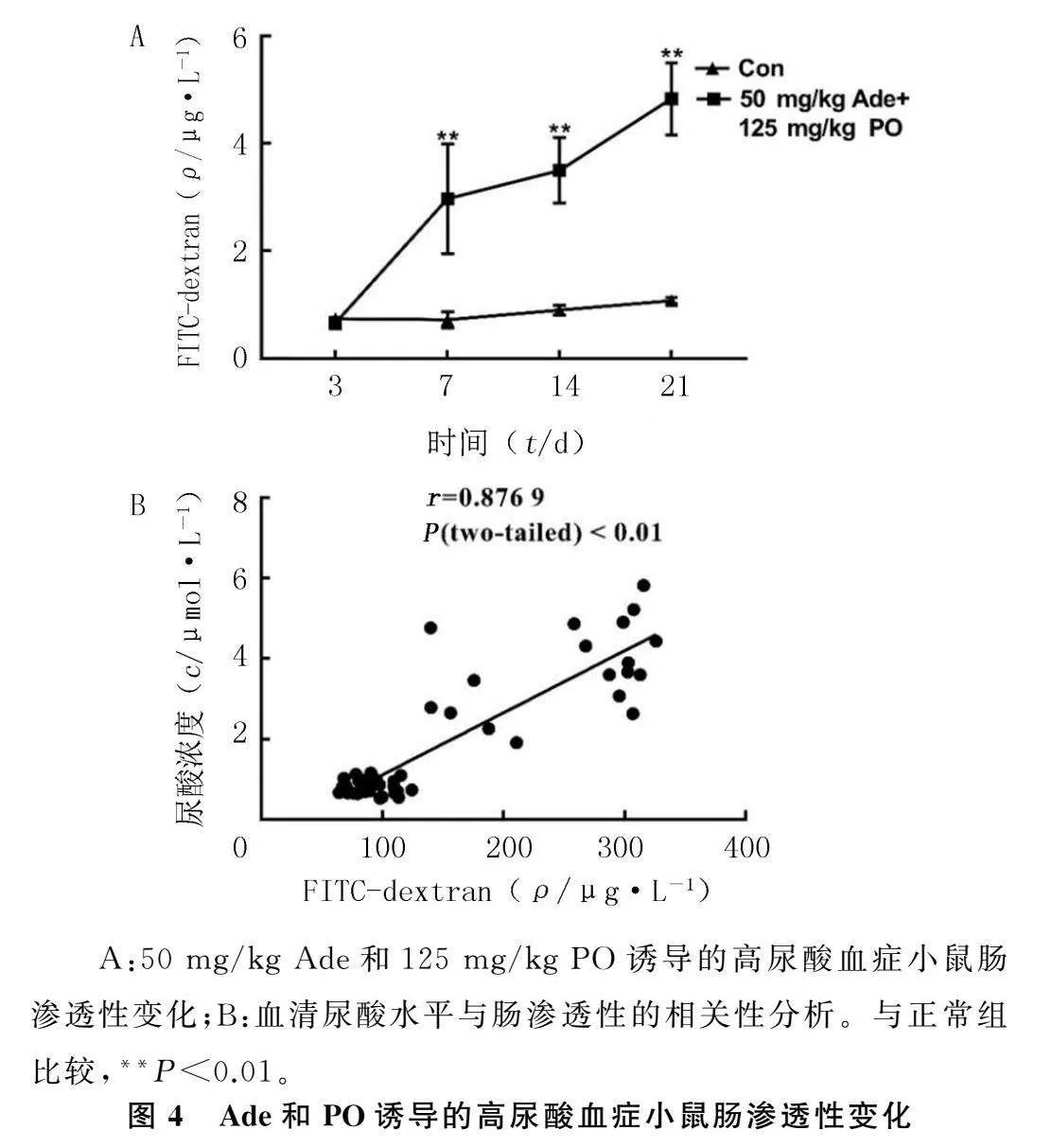
2.4Ade和PO诱导的高尿酸血症小鼠肠渗透性变化
重复测量方差分析显示,F浓度=172.161,P<0.001;F时间=49.938,P<0.001;F浓度*时间=36.387,P<0.001。在第3天时,两组小鼠肠渗透性的差异无统计学意义(F=2.310,P>0.05);第7、14、21天时,两组小鼠肠渗透性的差异均有统计学意义(F=28.563~185.808,P<0.01)。见图4A。肠渗透性与血清尿酸水平呈正相关性(r=0.876 9,P<0.01)。见图4B。
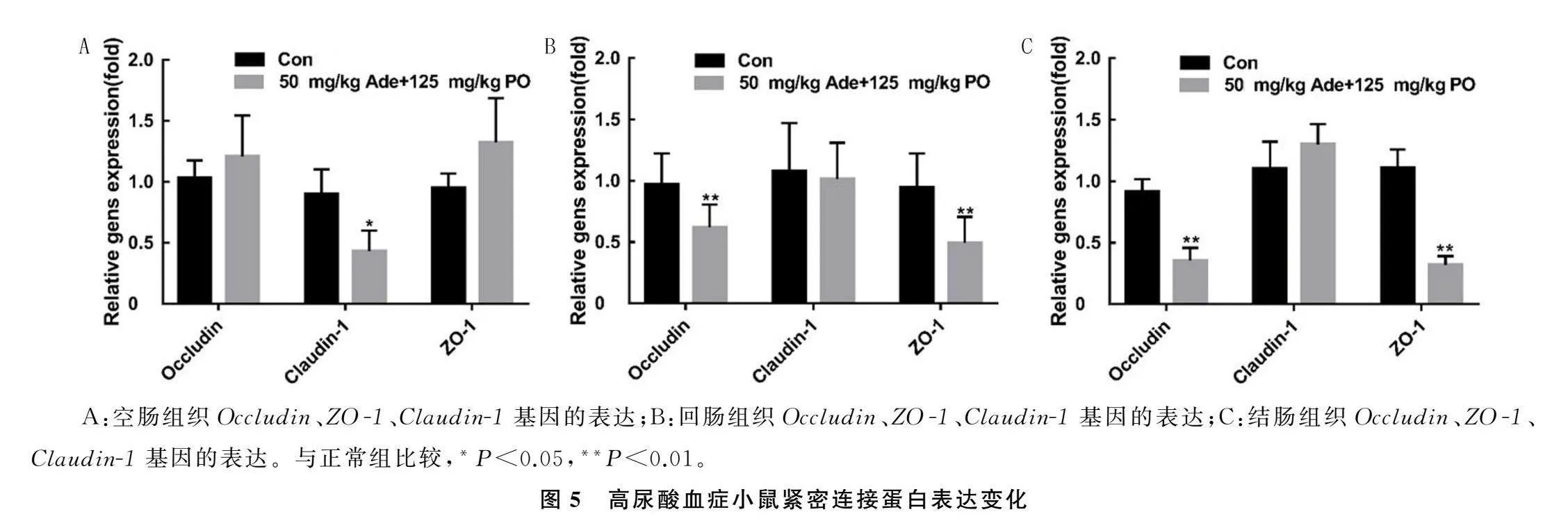
2.5高尿酸血症小鼠紧密连接蛋白表达变化
在空肠中,与正常组相比,50 mg/kg Ade+125 mg/kg PO组小鼠Claudin-1的表达量降低(t=2.670,P=0.016),见图5A。在回肠中,50 mg/kg Ade+125 mg/kg PO组小鼠Occludin和ZO-1的表达量低于正常组(t=3.164、3.678,P<0.01)。见图5B。在结肠中,50 mg/kg Ade+125 mg/kg PO组小鼠Occludin和ZO-1的表达量低于正常组(t=9.040、13.215,P<0.01)。见图5C。
A:50 mg/kg Ade和125 mg/kg PO诱导的高尿酸血症小鼠肠渗透性变化;B:血清尿酸水平与肠渗透性的相关性分析。与正常组比较,**P<0.01。
A:空肠组织Occludin、ZO-1、Claudin-1基因的表达;B:回肠组织Occludin、ZO-1、Claudin-1基因的表达;C:结肠组织Occludin、ZO-1、Claudin-1基因的表达。
与正常组比较,*P<0.05,**P<0.01。
图5高尿酸血症小鼠紧密连接蛋白表达变化
3讨论
本研究结果显示,50 mg/kg的Ade及125 mg/kg的PO连续灌胃7 d可成功构建高尿酸血症小鼠模型,高尿酸水平可持续至21 d。伴随着尿酸的升高,肠渗透性也升高并与尿酸水平呈正相关。紧密连接蛋白Occludin和ZO-1在回肠和结肠中表达降低,Claudin-1在空肠中表达降低,表明紧密连接蛋白参与调控高尿酸血症小鼠肠渗透性。高尿酸血症是由于尿酸产生增多或排泄减少而引起的一种代谢性疾病,除了引起痛风外,还与糖尿病、高血压、动脉粥样硬化等多种代谢性疾病的发生密切相关[13]。构建合适的高尿酸血症模型对研究高尿酸血症及相关的并发症具有重要意义。目前,高尿酸血症模型主要分为基因修饰和环境诱导的高尿酸血症模型。高尿酸血症大鼠模型构建的研究较多[7,14-16],但对高尿酸血症小鼠模型构建的研究较少。且在不同的研究中,不同的抑制剂用量、诱导期、给药方法导致所得模型实际上无法进行比较[17-19]。
肠屏障损伤被认为与多种代谢性疾病的发生和发展密切相关[20]。建立一种肠屏障损伤的高尿酸血症小鼠模型对于深入研究高尿酸血症的发病机制和寻找潜在的治疗途径具有重要的意义。本研究结果显示,随着尿酸浓度的升高,模型小鼠肠渗透性也不断增高,肠渗透性和尿酸水平呈正相关,与邹通等[21-22]研究的尿酸酶基因敲除的高尿酸血症小鼠类似,均现肠屏障损伤。肠屏障损伤可能是尿酸升高的重要影响因素[23]。肠渗透性增加可导致肠道
菌群及有害代谢产物通过肠屏障进入循环系统,进而进入各个靶器官,增加系统性炎症反应,引起各种代谢性疾病的发生[24]。紧密连接蛋白在维持肠屏障功能中起着重要的作用,紧密连接蛋白Occludin、ZO-1和Claudin-1的表达降低会导致肠屏障损伤、肠渗透性增加。
综上所述,采用50 mg/kg Ade及125 mg/kg PO连续灌胃7d可构建稳定的高尿酸血症小鼠模型,模型小鼠尿酸水平可持续升高至21 d,同时伴随着肠屏障损伤,其肠渗透性与尿酸水平呈正相关。
[参考文献]
[1]KIM S C, DI CARLI M F, GARG R K, et al. Asymptomatic hyperuricemia and coronary flow reserve in patients with metabolic syndrome[J]. BMC Rheumatology, 2018,2:17.
[2]SUNAGAWA S, SHIRAKURA T, HOKAMA N, et al. Activity of xanthine oxidase in plasma correlates with indices of insulin resistance and liver dysfunction in patients with type 2 diabetes mellitus and metabolic syndrome: a pilot exploratory study[J]. Journal of Diabetes Investigation, 2019,10(1):94-103.
[3]YU Y, ZHANG N, DONG X X, et al. Uricase-deficient rat is generated with CRISPR/Cas9 technique[J]. PeerJ, 2020,8:e8971.
[4]LU J, HOU X, YUAN X, et al. Knockout of the urate oxidase gene provides a stable mouse model of hyperuricemia associated with metabolic disorders[J]. Kidney International, 2018,93(1):69-80.
[5]DEBOSCH B J, KLUTH O, FUJIWARA H, et al. Early-onset metabolic syndrome in mice lacking the intestinal uric acid transporter SLC2A9[J]. Nature Communications, 2014,5:4642.
[6]岳义松,张雯,谢逸菲,等. 高尿酸血症实验动物模型研究进展[J]. 中国药理学通报, 2023,39(2):201-206.
[7]张培,苗志敏,李长贵,等. 慢性高尿酸血症大鼠模型建立方法的探讨[J]. 青岛大学医学院学报, 2010,46(3):219-221.
[8]李兰,程冬旗,袁玉佳,等. 不同剂量氧嗪酸钾联合腺嘌呤诱导大鼠高尿酸肾损伤模型的建立与评价[J]. 华西医学, 2021,36(5):643-650.
[9]MCCALLUM G, TROPINI C. The gut microbiota and its biogeography[J]. Nature Reviews Microbiology, 2024,22(2):105-118.
[10]MARTEL J, CHANG S H, KO Y F, et al. Gut barrier disruption and chronic disease[J]. Trends in Endocrinology and Metabolism, 2022,33(4):247-265.
[11]PELLEGRINI C, FORNAI M, D’ANTONGIOVANNI V, et al. The intestinal barrier in disorders of the central nervous system[J]. The Lancet Gastroenterology & Hepatology, 2023,8(1):66-80.
[12]MEHANDRU S, COLOMBEL J F. The intestinal barrier, an arbitrator turned provocateur in IBD[J]. Nature Reviews Gastroenterology & Hepatology, 2021,18(2):83-84.
[13]BARDIN T, RICHETTE P. Impact of comorbidities on gout and hyperuricaemia: an update on prevalence and treatment options[J]. BMC Medicine, 2017,15(1):123.
[14]马通军,尹潍. 建立大鼠高尿酸血症模型的新方法[J]. 中华医学会全国风湿病学年会论文汇编, 2003.
[15]吴燕升,万强,史丽强,等. 多种方法探索高尿酸血症大鼠模型的建立[J]. 中国中西医结合肾病杂志, 2018,19(1):7-10.
[16]阿依努·艾力,布威阿依谢姆·努尔麦麦提,阿迪拉·阿扎提,等. 雌性大鼠和雄性大鼠高尿酸血症动物模型的动态比较[J]. 心血管病学进展, 2023,44(3):277-282.
[17]WEN S S, WANG D, YU H Y, et al. The time-feature of uric acid excretion in hyperuricemia mice induced by potassium oxonate and adenine[J]. International Journal of Molecular Sciences, 2020,21(15):5178.
[18]GUAN J, HUANG X Q, DONG J L, et al. A novel mouse model of hyperuricemia and gouty nephropathy[J]. Chinese Medical Journal, 2020,133(16):2012-2014.
[19]张馨,崔娜,侯俊玲,等. 急性慢性高尿酸血症大鼠模型的建立[J]. 世界中医药, 2023,18(16):2309-2313,2318.
[20]BONA M D, TORRES C H M, LIMA S C V C, et al. Intestinal barrier permeability in obese individuals with or without metabolic syndrome: a systematic review[J]. Nutrients, 2022,14(17):3649.
[21]邹通,孟瑾,宋淼,等. 高尿酸血症小鼠肠渗透性增加的差异表达基因分析[J]. 青岛大学学报(医学版), 2022,58(6):805-811.
[22]LV Q L, XU D X, MA J F, et al. Uric acid drives intestinal barrier dysfunction through TSPO-mediated NLRP3 inflammasome activation[J]. Inflammation Research: Official Journal of the European Histamine Research Society, 2021,70(1):127-137.
[23]PAN L B, HAN P, MA S R, et al. Abnormal metabolism of gut microbiota reveals the possible molecular mechanism of nephropathy induced by hyperuricemia[J]. Acta Pharmaceutica Sinica B, 2020,10(2):249-261.
[24]徐雁云,陈民利. 肠道菌群与肠屏障互作影响动脉粥样硬化形成的研究进展[J]. 中国实验动物学报, 2022,30(7):973-982.
(本文编辑周晓彬)

