东北地区3个树种不同器官氮磷含量及计量特征
摘要:【目的】探究东北地区生态习性各异的山杨(Populus davidiana)、水曲柳(Fraxinus mandshurica)和东北红豆杉(Taxus cuspidata)地上地下器官氮(N)、磷(P)养分分配模式,为深入揭示树种间养分分配策略与权衡关系提供理论参考。【方法】以野外山杨、水曲柳和东北红豆杉成年植株为研究对象,对比分析3个树种地上器官叶片枝条和地下器官粗根细根N、P含量以及叶与枝、根N、P分配比例,采用标准主轴回归斜率检验3个树种地上、地下器官N与P元素之间及地上与地下器官养分双向运输N、P同一元素的增长关系。【结果】①山杨与水曲柳叶片N、P含量接近,山杨与水曲柳叶片N、P含量分别显著高于、低于东北红豆杉针叶相应数值(Plt;0.05);东北红豆杉枝条N、P含量最高;3个树种粗根N含量接近,水曲柳粗根P含量及细根N、P含量均最高。②水曲柳叶片与枝条、山杨叶片与粗根N、P含量比均最高,水曲柳叶片与细根N、P含量比最低。③山杨和东北红豆杉地上器官、地下器官N与P含量分别为异速、等速关系,且地下器官N与P元素间的变化斜率仅为地上部分的1/2;而水曲柳地上器官、地下器官两元素之间的变化斜率相似,均为显著大于1的异速增长关系。山杨地上与地下双向P、东北红豆杉上行方向P含量斜率均为相应N含量的一半,东北红豆杉下行方向N、P关系均不显著,水曲柳上行方向N、P含量斜率相似,下行方向P含量斜率是N的2/3左右。【结论】与山杨和东北红豆杉相比,水曲柳倾向于将N和P养分分配到代谢活跃的叶片和细根,且其地上(地下)器官N与P含量、地上与地下N、P含量变化速率具有协调一致性。
关键词:氮磷计量;养分分配;种间差异;山杨;水曲柳;东北红豆杉
中图分类号:S718"""""" 文献标志码:A开放科学(资源服务)标识码(OSID):
文章编号:1000-2006(2024)05-0147-09
Nitrogen, phosphorus contents and stoichiometric characteristics in different organs" of three tree species in northeast China
SUN Huizhen, LI Shan, LIU Shanshan, WANG Xingchang
(School of Ecology, Key Laboratory of Sustainable Forest Ecosystem Management-Ministry of Education, Northeast Forestry University, Harbin 150040, China)
Abstract: 【Objective】The objective of this study is to investigate the nitrogen (N) and phosphorus (P) allocation patterns in the above- and below-ground organs of three different tree species in northeast China, namely Populus davidiana, Fraxinus mandshurica and Taxus cuspidata, and to provide theoretical insights into the trade-offs and allocation strategies of nutrient distribution among tree species.【Method】Mature individuals of P. davidiana, F. mandshurica and T. cuspidata were selected as research subjects. The N and P contents in aboveground organs, i.e., leaves, twigs and belowground organs, i.e., coarse roots, fine roots, were analyzed and the allocation ratios of N and P contents in the" leaves, twigs and roots were calculated. Standardized major axis regressions were employed to examine the relationships of N and P elements between aboveground (belowground) organs of three tree species and the bidirectional nutrient transport of the same elements between aboveground and belowground organs.【Result】(1)The N and P contents in the" leaves of P. davidiana and F. mandshurica were similar. However, the N and P contents in the leaves of these two species were significantly higher and lower, respectively, compared to T. cuspidata (Plt;0.05). The twigs of T. cuspidata exhibited the highest N and P contents, while F. mandshurica had the highest P content in coarse roots and N and P contents in fine roots. The N content in coarse roots was similar among the three species. (2)The ratios of N and P contents in leaves to twigs and leaves to coarse roots were the highest in F. mandshurica and P. davidiana, respectively, while the ratios of leaves to fine roots were the lowest in F. mandshurica. (3)For P. davidiana and T. cuspidata, the aboveground and belowground organs showed an allometric and isometric relationship respectively between N and P contents, with the scaling exponent in belowground being approximately half of that in aboveground. In contrast, F. mandshurica exhibited similar scaling exponents aboveground and belowground, both exhibiting significantly greater than 1 allometric relationship. For P. davidiana, the slopes of both aboveground and belowground P in both directions are half of the corresponding N values. For T. cuspidata, the slopes of P content in the upward direction were also half of the corresponding N values, and the downward N and P relationships were not significant. For F. mandshurica, the slopes of N and P content in the upward direction were similar, whereas in the downward direction, the P content slope was approximately 2/3 of N.【Conclusion】In contrast to P. davidiana and T. cuspidata, F. mandshurica tended to allocate N and P to metabolically active organs such as leaves and fine roots. The relationships between N and P in aboveground (or belowground) organs and N and P between above- and below-ground showed distinct coordinations for F. mandshurica compared to P. davidiana and T. cuspidata.
Keywords:nitrogen and phosphorus stoichiometry; nutrient allocation; inter-specific variation; Populus davidiana; Fraxinus mandshurica; Taxus cuspidata
为了获得最佳功能,森林中处于同一生境的多个树种在长期适应过程中形成了各自的形态、生理和代谢特征。在植物生态化学计量方面,每个树种可能拥有独特的元素组成、计量及分配特征,在森林内占据着不同养分生态位[1]。氮(N)和磷(P)是调节树木生长发育的两大生命元素,它们不仅是树木细胞结构物质的基本组成部分,还在蛋白质和遗传物质的合成与转化方面发挥重要作用[2]。N和P化学计量综合反映了树木营养状态、利用状况以及生长限制性元素的重要指标[3]。
植物生态化学计量研究为构建植物个体到生态系统普适理论提供了新思路[4]。若想实现微观至宏观尺度的联系和转换,需开展特定生态系统多尺度、多要素的化学计量研究[5]。已有研究多集中在全球、全国或某一树种分布区域的大尺度N和P元素计量[6-7],而局域尺度上共存树种的相关研究并不多[8-11]。树木由叶、枝、根等构件组成的个体,其中枝条和粗根是由结构与生理功能截然不同的皮和木质部两大部分构成,联系着树木地上地下两端最为活跃的叶片和细根,是树木营养双向运输的咽喉部位。在同等的外部元素供应条件下,树木不同组织器官N和P含量及其分配格局,与其结构特性和功能属性紧密相关[7,12-13]。以往大多研究关注叶片、枝条、细根单一器官,或者集中在叶片细根、或叶片小枝两个器官[13-15],较少将树木叶枝根不同器官视为一个整体或者从地上与地下器官关系研究N和P元素特征及与环境适应能力[3],缺乏对树木整体或者地上地下器官之间化学计量的关联认知。因此,探究局域尺度生态属性各异的树种地上地下器官N和P元素计量,有助于深入理解种间养分资源竞争能力的差异,诠释不同树种为适应环境对自身养分的调控能力,从而揭示树种间养分利用策略[1,11]。
山杨(Populus davidiana)和水曲柳(Fraxinus mandshurica)是东北东部山区天然次生林的先锋树种和更新优势明显的树种,分布范围较广。东北红豆杉(Taxus cuspidata)分布于黑龙江省部分地区和吉林省长白山地区,属于极小种群物种。3个树种生态学特性差异较大:山杨是杨柳科(Salicaceae)杨属(Populus)落叶阔叶阳性散孔树种,水曲柳是木犀科(Oleaceae)梣属(Fraxinus)落叶阔叶耐阴环孔大乔木;东北红豆杉为红豆杉科(Taxaceae)红豆杉属(Taxus)常绿针叶耐阴无孔乔木。山杨、水曲柳和东北红豆杉最大年龄比约为1∶2∶4,外在表现不同的树种可能与体内N和P养分含量及分配有关。目前已有山杨叶枝根[16-17]、水曲柳叶片或多个器官[11,18]N和P元素含量及计量比相关研究,对红豆杉属的南方红豆杉(T. wallichiana var. mairei)2年生针叶[19]、红豆杉(T. wallichiana var. chinensis)2龄针叶[20]或混合的多年生针叶[21]以及红豆杉幼树3龄针叶[22]N和P含量及其计量比特征有一定研究,与东北红豆杉相关的化学计量报道少见,而且以上研究均未涉及树种N和P养分分配模式。为此,本研究以野外自然生长的山杨、水曲柳和东北红豆杉成年植株为研究对象,比较生态习性各异的3个树种叶枝根N、P含量及其两者在地上和地下器官之间平衡关系,探究不同树种对N和P营养元素需求及限制性元素,以期深入揭示山杨、水曲柳和东北红豆杉体内养分分配和权衡关系,为相关研究提供新视角。
1 材料与方法
1.1 试验材料采集与处理
山杨和水曲柳的采样地点位于黑龙江省尚志市帽儿山森林生态系统定位站(126°20′~126°25′E, 45°20′~45°35′N),东北红豆杉的采样地点位于黑龙江省穆棱东北红豆杉自然保护区(130°00′~130°28′E,43°49′~44°06′N)。以上两个采样地点主要土壤类型均为暗棕壤,气候类型均属于典型的大陆性温带季风气候。帽儿山生态站平均海拔400 m,平均坡度10°~15°。年均气温2.8 ℃,最高和最低气温分别为32 ℃、-31 ℃左右,无霜期120~140 d;年均降水量629 mm,主要集中在7—8月;全年平均蒸发量为884 mm。原有植被阔叶红松林经过采伐、经营、火烧、开垦等不同程度的干扰,形成现有的天然次生林和人工林。穆棱东北红豆杉自然保护区平均海拔600 m,年均气温3.5 ℃,最高和最低气温分别为21.8 ℃、-18.3 ℃左右,无霜期126 d。年均降水量530 mm,主要集中在7月;主要植被是以红松(Pinus koraiensis)为主的温带针阔混交林。
山杨、水曲柳和东北红豆杉均为雌雄异株树种。为了避免因性别导致种内数据变异大,野外观察山杨、水曲柳和东北红豆杉繁殖器官,确定植株性别。选取生境、生长状况相似的山杨和水曲柳雌树和雄树各6株,东北红豆杉雌雄植株各4株作为样树,山杨、水曲柳和东北红豆杉胸径分别为(23.9±0.7) cm、(27.0±0.9) cm和(55.0±3.6) cm。在生长旺盛的7—8月选择晴朗天气的5∶00—7∶00,人工爬树截取样树南向树冠中上部小枝后,装入放有湿毛巾的黑色塑料袋中。在样树周围,去除地表杂质和土壤,根据根系走向,挖出树干南向整条侧根,装入有编号的黑色塑料袋中。同时采集样树周围半径2 m范围内0~10 cm和gt;10~20 cm土壤,装入塑封袋,编号,与植物样品一并带回实验室。
根据枝条上芽鳞痕确定枝条年龄,随机抽取1年生枝条上健康完整的当年生叶片(东北红豆杉当年生针叶较小,采用1年生针叶)各20枚放入备有湿润滤纸的编号塑封袋内,用于叶性状测定;再将小枝分为皮和木质部。叶片、皮和木质部立即经微波炉高温(600 W)杀青90 s。根系清洗后立即杀青,按照直径分为粗根(≥2~10 mm)和细根(lt;2 mm),粗根分成皮和木质部。
1.2 叶性状指标测定
首先通过万分之一电子天平(AR2140,New Jersey,美国)称量叶片鲜质量(mF,g),随后利用扫描仪(LiDE 120,Canon,中国)扫描叶片,通过Batch软件确定叶面积(LA,式中记为AL,cm2)。最后样品在65 ℃烘箱烘干至质量恒定(M,式中记为M)。计算比叶面积(SLA,式中记为SLA,cm2/g),SLA=AL/M;叶含水率(LWC,式中记为CLW),CLW =(mF-M)/mF×100%。
1.3 植物和土壤C、N、P含量测定
完成叶性状测定的叶片与之前杀青的叶片按照同一树种分性别混合,将叶片、枝和粗根的皮或木质部、细根装入有编号的信封,置于65 ℃烘箱烘干至质量恒定、粉碎、备用。采用 Multi N/C 2100分析仪和HT1300 Solids Module分析仪(Analytik Jena AG,Jena,德国)测定植物及土壤碳(C)含量(mg/g)。利用AQ400全自动间断化学分析仪(SEAL Analytical lnc.,美国)测定样品氮(N)、磷(P)含量(mg/g)。然后计算碳氮比(质量分数比,下同)、碳磷比和氮磷比,文中分别以C/N、C/P、N/P表示。
1.4 数据处理
运用方差分析法检验3个树种的叶性状参数、不同深度土壤和植物组织器官C、N、P含量和计量比,以及叶与枝条、粗根或细根同一元素之比的差异,并用Duncan进行多重比较,显著水平均为0.05。植物样品C含量(质量分数)在50%左右,变化较小,因此主要分析N与P含量关系。采用SPSS 21.0完成。鉴于性别对同一树种叶性状参数、土壤及组织器官C、N、P含量及计量比均无显著影响,分析时合并同一树种雌雄植株数据。
采用标准化主轴(SMA)分析3个树种地上器官叶片枝条、地下器官粗根细根或地上地下所有器官合并的整体N与P(N-P)的关系;或者地上器官叶片枝条与地下器官粗根细根对同一元素N、P利用的趋同和趋异程度。地上与地下器官N、P关系分为上行方向[细根→粗根木质部→枝条木质部→叶片,N↑、P↑]和下行方向[叶片→枝条皮→粗根皮→细根,N↓、P↓]分别进行分析。
将异速生长方程:y=axb两边取对数,转化为:lg y=lg a+blg x。在分析元素之间的关系时,y表示N含量,x表示P含量;分析同一元素在地上和地下器官之间的关系时,y、x分别表示地上和地下同一元素含量。lg a为截距,b为斜率。当b=1时,表示两个变量呈现等速比例关系;bgt;1或blt;1时,两者为异速关系。以上分析通过SMATR 2.0完成,利用SigmaPlot 14.0完成作图。
2 结果与分析
2.1 3个树种叶性状及土壤特征
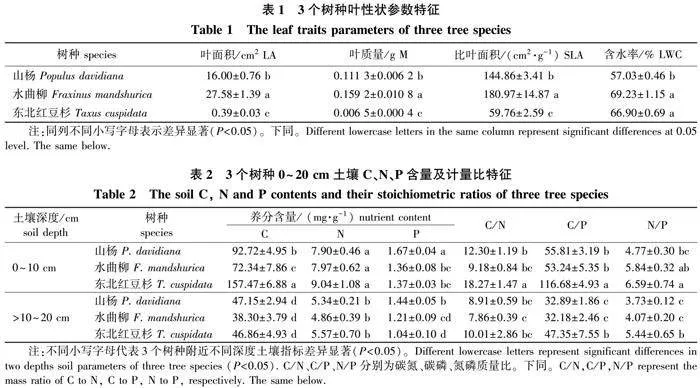
3个树种同一叶性状指标差异显著(Plt;0.05)(表1)。其中叶面积、叶质量、SLA从高到低依次为水曲柳、山杨、东北红豆杉(Plt;0.05),水曲柳和东北红豆杉叶片含水率相似,均显著高于山杨(Plt;0.05)。
同一树种土壤参数均随深度增加而降低(表2)。除了0~10 cm土壤C含量由高到低依次为东北红豆杉>山杨>水曲柳(Plt;0.05),3个树种10~20 cm土壤C含量、0~10 cm或>10~20 cm同一深度土壤N含量均接近(Pgt;0.05);水曲柳和东北红豆杉同一深度土壤P含量相似(Pgt;0.05),均显著低于山杨相应深度指标(Plt;0.05)。3个树种>10~20 cm土壤C/N无显著差异,东北红豆杉与水曲柳0~10 cm土壤N/P无显著差异。此外,东北红豆杉C/N、C/P、N/P均显著高于山杨和水曲柳同一深度土壤相应指标(Plt;0.05),而且后两者之间无显著差异(Pgt;0.05)。
2.2 3个树种组织器官N、P含量及其分配特征
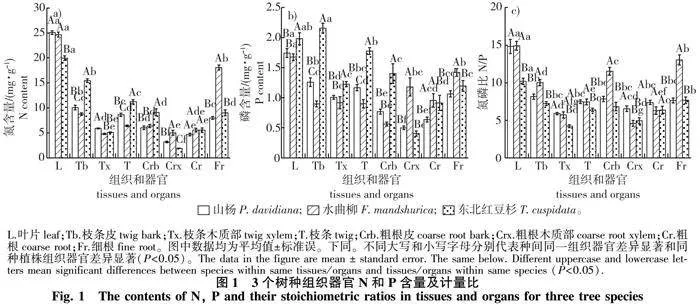
山杨与水曲柳叶片N、P含量(分别为25.08、24.67 mg/g;1.74、1.68 mg/g)以及N/P(分别为14.83、14.90)无显著差异(Pgt;0.05)(图1)。
山杨与水曲柳叶片N、P含量及N/P分别显著高于、低于和高于东北红豆杉针叶(Plt;0.05)。由于3个树种枝皮N、P含量显著高于相应的木质部(除水曲柳枝条皮和木质部P含量无显著差异),故3个树种枝条同一元素含量排序与皮相同,由高到低依次为:东北红豆杉gt;山杨gt;水曲柳(Plt;0.05)。东北红豆杉、山杨和水曲柳枝条N含量分别为11.27、8.63、6.41 mg/g、P含量分别为1.78、1.17、0.90 mg/g。但N/P排序与以上枝条元素含量排序相反,为山杨和水曲柳显著高于东北红豆杉(Plt;0.05)。地下部分的粗根N或P含量因水曲柳和东北红豆杉皮和木质部排序截然相反,山杨两个元素含量均居中,最终体现为3个树种粗根N含量相似,水曲柳粗根P含量显著高于山杨,东北红豆杉居中,且与以上两个树种无显著差异,三者N/P相似。水曲柳的细根N、P含量及N/P分别为18.08、1.42 mg/g和13.03,以上指标均显著高于山杨和东北红豆杉(Plt;0.05),而且后两者同一指标之间无显著差异。
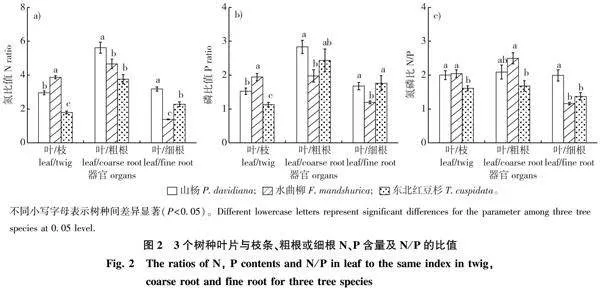
山杨和东北红豆杉器官间N、P含量排序由高到低均为:叶片gt;枝条gt;细根gt;粗根;而水曲柳为叶片gt;细根gt;枝条gt;粗根(图1)。3个树种叶片与枝根同一元素比例存在差异(图2)。山杨、水曲柳和东北红豆杉叶片与枝条N(P,括号内为P的数值,下同。)比值分别为3.0、3.9、1.8(1.5、1.9、1.1)。其值水曲柳最高,其次为山杨,东北红豆杉最低(Plt;0.05)。然而水曲柳叶片与细根的N、P含量比值分别为1.4、1.2,显著低于山杨和东北红豆杉(Plt;0.05)。其中山杨叶片与细根N含量比值最高,东北红豆杉居中;这两个树种以上器官P含量比值相似。山杨、水曲柳和东北红豆杉叶片与粗根N(P)比值排序与以上指标有所不同,其N(P)比值分别为5.6、4.7、3.8(2.8、2.0、2.4)。山杨均为最高,水曲柳和东北红豆杉同一数值均无显著差异。对于叶片与枝条或粗根的N/P,水曲柳与山杨相似,高于东北红豆杉(Plt;0.05);叶片与细根该值排序是山杨显著高于水曲柳和东北红豆杉(Plt;0.05),且后两者数值相似。
2.3 3个树种地上地下器官之间N和P含量关系
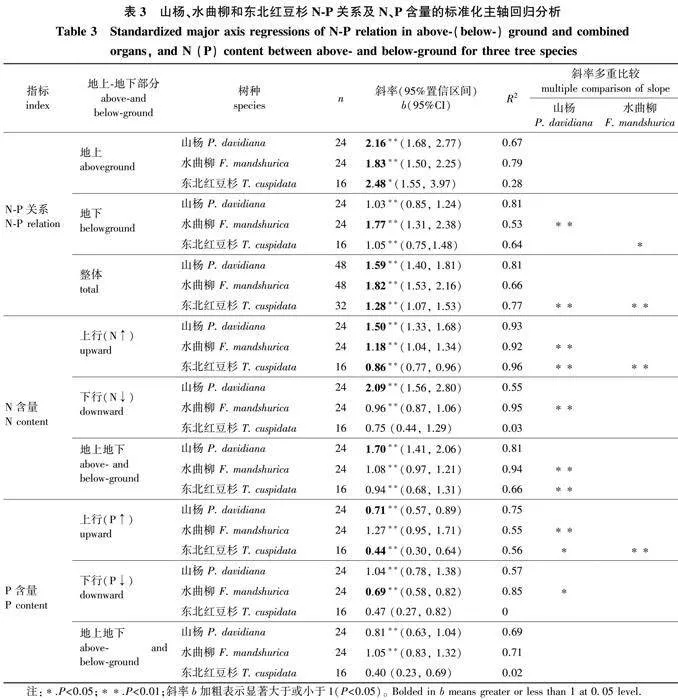
虽然山杨、水曲柳和东北红豆杉地上地下所有器官整体上N-P均呈现斜率显著大于1的异速增长关系(Plt;0.05),b分别为1.59、1.82和1.28(表3)。其中山杨和水曲柳的斜率相似,均显著高于东北红豆杉。但是分为地上、地下部分时,结果有所不同。山杨、水曲柳和东北红豆杉地上叶片枝条N-P关系的b分别为2.16、1.83和2.48,3个斜率相似,而且仍为显著大于1的异速增长关系。然而山杨和东北红豆杉地下粗根细根两元素含量接近等速关系,而且其斜率仅为地上部分的1/2;水曲柳地下器官N与P含量之间的斜率与地上相似,仍为大于1的异速关系。
山杨、水曲柳和东北红豆杉地上叶片枝条和地下粗根细根的N含量关系显著(表3)。山杨斜率显著高于水曲柳和东北红豆杉(Plt;0.05),而且后两者之间无显著差异。即山杨地上地下之间N元素是显著大于1的异速增长关系,水曲柳和东北红豆杉地上地下N元素均是接近等速变化关系。然而按照养分上行方向,3个树种地上与地下N元素呈现斜率差异显著的异速变化关系。其中山杨和水曲柳b显著大于1,东北红豆杉显著小于1(Plt;0.05);反过来,按照下行方向来看,山杨地上与地下N含量仍为斜率显著大于1的异速关系,水曲柳是等速关系,而东北红豆杉该方向地上地下N含量关系不显著。相应地,山杨和水曲柳地上与地下之间的P含量为斜率相似的等速关系,而东北红豆杉两者之间无显著关系。按照上行方向,3个树种斜率差异显著,其中水曲柳是等速关系,而山杨和东北红豆杉均为斜率显著小于1的异速关系;反方向看,山杨地上与地下P含量是等速关系,而水曲柳斜率是显著小于1的异速关系,东北红豆杉两者之间则无明显关系。
3 讨 论
3.1 不同器官N、P含量、比值及其分配的种间差异
叶枝根N和P含量及分配特征反映了树木在一定生境条件下从土壤中吸收、运移、利用和储存能力,与其自身生理特征及环境适应策略密切相关[6]。通常短命、生长快速的落叶阔叶树种N和P含量及N/P高于长命、生长缓慢的常绿针叶树种[3,10,14,23]。本研究山杨、水曲柳和东北红豆杉叶枝根种间养分含量比较结果并不一致。对于地下部分,东北红豆杉粗根N、P含量与两个阔叶树种相似,细根养分与山杨相似,显著低于水曲柳。在土壤N、P养分供应能力相似情况下,粗根主要负责运输和储存,生理活性较低,不需要高的N或P投资[2]。但生理代谢活跃的细根需要N和P生产所需的酶和蛋白质。与东北红豆杉与山杨外生菌根相比,水曲柳为内生菌根,细根具有低的直径、高的比根长,木质化程度低,根系呼吸速率高和寿命短等特点,属于典型的快速回报类型,因而该种细根养分吸收周转速率最高[24-25]。但是东北红豆杉地上部分的枝条N、P含量均为最高,山杨其次,水曲柳最低(Plt;0.05)。这可能因为常绿针叶树种依靠多年生针叶及相应年龄的绿色枝条对养分多重回收,有效地储藏养分,尽量减少因输导组织管胞对N和P养分吸收和输送效率低及营养物质转运所消耗高能量的弊端。或是与该种枝条所支撑的常绿针叶与山杨和水曲柳落叶阔叶性状不同有关。东北红豆杉针叶叶面积、质量不及阔叶的5%,SLA是后两者的1/3~1/2,枝条为不断更新的常绿针叶提供充足的养分储备。然而水曲柳和山杨枝条是为当年短期内全部新生、寿命不足5个月的叶片提供养分。由于水曲柳枝条支持的叶面积、质量和SLA是山杨的1.3~1.6倍,导致该种枝条养分低于后者。东北红豆杉养分含量高的枝条支撑的针叶P含量仍显著高于山杨和水曲柳,这是对温带地区春秋季节的低温和冬季严寒胁迫的环境适应[26];而针叶N含量显著低于山杨和水曲柳,可能因为针叶SLA不到两个阔叶树种的一半,厚度大、面积小、光补偿点低的耐阴针叶意味着生产单位叶面积需要消耗更多的N来构建保卫结构,以增加叶肉细胞密度及光能吸收机构[27],因而针叶N含量低。由于该种针叶N含量小于20 mg/g,P含量大于1.0 mg/g,N/P仅为10.19。不论按照N/P小于14[28]、N/P小于10[29-30]还是叶片N和P含量标准[31],东北红豆杉均存在一定程度N限制,这与温带针叶林普遍存在N限制的结果一致[32]。山杨和水曲柳同为落叶阔叶树种,尽管叶性状有所差异,但落叶阔叶树种为了快速生长,充分利用雨热同期的短暂生长季,极力保证寿命短的光合器官营养需求。因而两个树种叶片N、P含量相似。且N含量大于20 mg/g,P含量大于1.0 mg/g,N/P大于14,不存在N或P元素的限制。
叶与其他器官之间的N、P含量比值,提供了相同营养物质在光合器官(叶)相对于结构储存(枝条粗根)及吸收器官(细根)的分配模式。叶与枝条(粗根)N、P含量之比越高,表明树木将N、P更多地分配到叶,为单位叶面积提供更多的N、P,直接参与光合作用过程,从而增强光合能力。而较少地将N、P分配到枝条或粗根,可以降低呼吸强度,有效地积累碳,延长器官寿命[33-34]。一般地,与被子植物相比,裸子植物分配到针叶的养分元素高于木质部分[34],即后者针叶与枝条/粗根养分比值应该高。但本研究东北红豆杉针叶与枝条N、P含量比值最低,水曲柳最高,山杨居中;该种针叶与粗根N、P含量比值与水曲柳相似,山杨均为最高。说明东北红豆杉并没有将养分集中在光合器官,分配至运输储存器官养分较高,致使呼吸强度高,减少了碳积累。相反,水曲柳、山杨将养分分配到枝条或粗根养分比值最低,具有明显的聚集养分至叶片特征。意味着山杨和水曲柳枝条或粗根养分比值低的维持呼吸和较高的光合产量,对于树木整体而言达到最大碳收获。另外,从3个树种光合器官叶片与吸收器官细根N、P含量比值来看,水曲柳以上指标均最低。说明该种养分分配对策是代谢活性器官叶片和细根分配较多养分,保证地上和地下重要器官的养分吸收与分配的一致性,有利于抢占地上及地下稀缺资源,实现功能最大化,达到最优生长。
3.2 树种间地上地下部分N与P含量相关关系
由于树木体内N与P元素共同涉及细胞基本结构,协同完成部分相关紧密的生理功能,因此二者之间具有高度的耦合关系[35]。本研究3个树种地上、地下及地上地下所有器官N与P含量的显著正相关关系也证实了以上观点。其中阔叶树种山杨和水曲柳整体水平N与P含量斜率相似,与本地10个共存阔叶树种N与P斜率相似结果一致[11]。而针叶树种东北红豆杉斜率显著低于两个阔叶树种,表明该种N与P元素在体内变化速率与阔叶树木内部并不存在一致的协同关系。虽然3个树种体内N与P均为斜率显著大于1的异速增长关系,但是将树木分为地上和地下两部分时,山杨和东北红豆杉地上器官、地下器官N-P分别为显著大于1的异速增长、等于1的等速关系,而且地下器官两元素的斜率仅为地上部分的1/2。水曲柳地上、地下器官两元素之间仍是显著大于1的异速增长关系,而且两者斜率相似。表明该种不论地上还是地下器官,N含量的增长速率均快于P含量的增长速率,符合树木将供给受限制的N元素优先分配给代谢活动旺盛器官的规律[36]。同时也证实树木单一器官或地上、地下几个器官组合的N-P关系与整体水平结果不一致[11]。
树木地上与地下器官之间同种元素含量的关系反映了元素功能在体内的耦联关系。本研究3个树种地上与地下器官同一元素含量(除了东北红豆杉P元素)表现为同增同减特点,说明树木地上和地下器官N、P含量之间分配存在相互作用[7]。但是3个树种地上和地下器官之间N、P含量变化速率明显不同。与山杨地上与地下器官N含量为显著大于1的异速、P含量为等速,东北红豆杉N含量为等速、P含量无显著关系相比,水曲柳地上与地下器官之间N、P元素均为等速增长,即该种地上N、P含量增长速率与地下相应元素增长速率相同,表明该种地上地下同一元素变化的一致性。按照养分运输方向来看,东北红豆杉上行方向P含量的斜率是N值的一半,而且均为显著小于1的异速增长关系;下行方向N、P含量关系均不显著。虽然山杨地上与地下双向N、P均存在显著关系,但山杨地上与地下双向P含量变化斜率均仅为相应N值的一半。然而水曲柳上行方向地上与地下N、P含量斜率相似,下行方向P含量斜率是N值的2/3左右。以上说明水曲柳无论按照养分上行、下行,还是地上地下整体之间,N、P含量变化速率具有明显的协调一致关系;而东北红豆杉和山杨不存在这种关系。
根系吸收的营养元素在树木体内的运输包括木质部向上运输、韧皮部向上向下双向运输,另外木质部与韧皮部之间横向运输极为活跃[2]。树木体内元素通过韧皮部和木质部在地上器官和地下器官形成了养分循环再循环过程。该过程对于调节树木地上和地下器官生长及养分利用至关重要[37]。本研究枝条与粗根皮(木质部)的N、P含量梯度、枝条或粗根皮与相应木质部N、P含量比值由低到高依次均为水曲柳、山杨和东北红豆杉。符合因导管(管胞)筛管(筛胞)输导组织解剖结构的差别,养分运输能力由高到低依次为环孔材树种、散孔材、无孔材的规律[38]。本研究仅在生长旺盛的7月对比分析了3个树种整株水平移动性较强的N和P元素化学计量特征。温带地区不同功能型树木养分元素平衡状况及其计量指标可能会随着萌芽、完全展叶以及落叶等关键物候期的变化而变化。今后有待加强该方面研究。
在相似的土壤养分供应条件下,3个树种叶枝根N和P含量、叶与枝根养分相对分配比例、树木地上或地下器官N与P以及地上地下器官之间N、P同一元素变化速率反映了树木自身结构和代谢需求,形成的不同养分适应策略。与落叶阔叶树种相比,东北红豆杉利用针叶寿命长的优势,有效地进行N或P养分回收,保存枝条养分能力强,维持较高的针叶N和P含量[6,21],提高养分利用效率,减少对外界养分依赖,表现为慢生长策略。虽然落叶阔叶树种山杨和水曲柳均极力保证寿命短的光合器官营养需求,但与山杨相比,水曲柳拥有叶片和细根养分高、枝条低的黄金分配格局。水曲柳地上(地下)器官N与P含量、地上地下之间N、P双向运输达到协调一致关系。这种关系对于树木生长而言,可能比养分绝对含量更为重要[28,39]。表明该种在生长代谢过程中的整体性以及养分在地上、地下器官之间的分配遵循着一定规律,有力地保障了该种在群落中的竞争优势。综上可见,在同一气候区域,相似土壤条件下,生态习性截然相反的山杨、水曲柳和东北红豆杉具有各自养分分配和利用策略,体现了树种对养分元素的自身调控能力[12],占据不同生态位达到一定的平衡。
致谢 黑龙江帽儿山森林生态系统国家野外科学观测研究站对本研究提供支持和帮助。
参考文献(reference):
[1]SARDANS J, PEUELAS J. Climate and taxonomy underlie different elemental concentrations and stoichiometries of forest species: the optimum “biogeochemical niche”[J]. Plant Ecol, 2014, 215(4): 441-455. DOI:10.1007/s11258-014-0314-2.
[2]蒋高明. 植物生理生态学[M]. 北京: 高等教育出版社, 2004: 128-132. JIANG G M. Plant Ecophysiology[M]. Beijing: Higher Education Press, 2004: 128-132.
[3]田地, 严正兵, 方精云. 植物生态化学计量特征及其主要假说[J]. 植物生态学报, 2021, 45(7): 682-713. TIAN D, YAN Z B, FANG J Y. Review on characteristics and main hypotheses of plant ecological stoichiometry[J]. Chin J Plant Ecol, 2021, 45(7): 682-713. DOI: 10.17521/cjpe.2020.0331.
[4]贺金生, 韩兴国. 生态化学计量学:探索从个体到生态系统的统一化理论[J]. 植物生态学报, 2010, 34(1): 2-6. HE J S, HAN X G. Ecological stoichiometry: searching for unifying principles from individuals to ecosystems[J]. Chin J Plant Ecol, 2010, 34(1): 2-6. DOI: 10.3773/j.issn.1005-264x.2010.01.002.
[5]卢建男, 刘凯军, 王瑞雄, 等. 中国荒漠植物-土壤系统生态化学计量学研究进展[J]. 中国沙漠, 2022, 42(2): 173-182. LU J N, LIU K J, WANG R X, et al. Research advances in stoichiometry of desert plant-soil system in China[J]. J Desert Res, 2022, 42(2): 173-182. DOI: 10.7522/j.issn.1000-694X.2021.00109.
[6]ELSER J J, FAGAN W F, DENNO R F, et al. Nutritional constraints in terrestrial and freshwater food webs[J]. Nature, 2000, 408(6812):578-580. DOI:10.1038/35046058.
[7]陈美玲, 崔君滕, 邓蕾, 等. 黄土高原两种针叶树种不同器官水碳氮磷分配格局及其生态化学计量特征[J]. 地球环境学报, 2018, 9(1): 54-63. CHEN M L, CUI J T, DENG L, et al. Distribution patterns and ecological stoichiometry of water, carbon, nitrogen and phosphorus in different organs of two conifer species on the Loess Plateau[J]. J Earth Environ, 2018, 9(1): 54-63. DOI: 10.7515/JEE182004.
[8]杨婷, 钟全林, 李宝银, 等. 3种功能型林木幼苗叶片与细根碳氮磷化学计量特征及其异速关系[J]. 应用生态学报, 2020, 31(12): 4051-4057. YANG T, ZHONG Q L, LI B Y, et al. Stoichiometry of carbon, nitrogen and phosphorus and their allometric relationship between leaves and fine roots of three functional tree seedlings[J]. Chin J Appl Ecol, 2020, 31(12): 4051-4057. DOI: 10.13287/j.1001-9332.202012.004.
[9]张耀艺, 倪祥银, 杨静, 等. 中亚热带同质园不同树种氮磷重吸收及化学计量特征[J]. 应用生态学报, 2021, 32(4): 1154-1162. ZHANG Y Y, NI X Y, YANG J, et al. Nitrogen and phosphorus resorption and stoichiometric characteristics of different tree species in a mid-subtropical common-garden, China[J]. Chin J Appl Ecol, 2021, 32(4): 1154-1162. DOI: 10.13287 /j.1001-9332.202104.003.
[10]赵瑞, 王传宽, 全先奎, 等. 黑龙江省帽儿山温带阔叶树种不同器官的生态化学计量特征[J]. 林业科学, 2021, 57(2): 1-11. ZHAO R, WANG C K, QUAN X K, et al. Ecological stoichiometric characteristics of different organs of broadleaf tree species in a temperate forest in Maoershan area, Heilongjiang Province[J]. Sci Silvae Sin, 2021, 57(2): 1-11. DOI: 10.11707/j.1001-7488.20210201.
[11]MINDEN V, KLEYER M. Internal and external regulation of plant organ stoichiometry[J]. Plant Biol (Stuttg), 2014, 16(5): 897-907. DOI:10.1111/plb.12155.
[12]YANG X, TANG Z Y, JI C J, et al. Scaling of nitrogen and phosphorus across plant organs in shrubland biomes across northern China[J]. Sci Rep, 2014, 4: 5448. DOI: 10.1038/srep05448.
[13]REICH P B, OLEKSYN J. Global patterns of plant leaf N and P in relation to temperature and latitude[J]. Proc Natl Acad Sci USA, 2004, 101(30): 11001-11006. DOI:10.1073/pnas.0403588101.
[14]YAN Z B, LI P, CHEN Y H, et al. Nutrient allocation strategies of woody plants: an approach from the scaling of nitrogen and phosphorus between twig stems and leaves[J]. Sci Rep, 2016, 6: 20099. DOI: 10.1038/srep20099.
[15]沙刚, 黄庆阳, 徐明怡, 等. 五大连池新期火山熔岩台地4种乔木植物化学计量及其内稳性特征[J]. 中南林业科技大学学报, 2022, 42(9): 127-138. SHA G, HUANG Q Y, XU M Y, et al. Stoichiometry and homeostasis characteristics of four arbor species at the new stage Volcanic Lava Platform of the Wudalianchi area[J]. J Central South Univ For amp; Technol, 2022, 42(9): 127-138. DOI: 10.14067/j.cnki.1673-923x.2022.09.014.
[16]王亚东, 魏江生, 周梅, 等. 大兴安岭南段不同生长衰退程度山杨林生态化学计量特征[J]. 土壤通报, 2021, 52(4): 854-864. WANG Y D, WEI J S, ZHOU M, et al. Ecological of stoichiometric characteristics of Populus davidiana forests with different growth and decline degrees in southern Daxing’anling[J]. Chin J Soil Sci, 2021, 52(4): 854-864. DOI: 10.19336/j.cnki.trtb.2020052701.
[17]郝玉琢, 周磊, 吴慧, 等. 4种类型水曲柳人工林叶片-凋落物-土壤生态化学计量特征比较[J]. 南京林业大学学报(自然科学版), 2019, 43(4): 101-108. HAO Y Z, ZHOU L, WU H, et al. Comparison of ecological stoichiometric characteristics of leaf-litter-soil in four types of Fraxinus mandshurica plantations[J]. J Nanjing For Univ (Nat Sci Ed), 2019, 43(4): 101-108. DOI: 10.3969/j.issn.1000-2006.201806021.
[18]罗芊芊, 周志春, 邓宗付, 等. 南方红豆杉天然居群叶片的表型性状和氮磷化学计量特征的变异规律[J]. 植物资源与环境学报, 2021, 30(1): 27-35. LUO Q Q, ZHOU Z C, DENG Z F, et al. Variation law of phenotypic traits and nitrogen and phosphorus stoichiometric characteristics of leaf of natural populations of Taxus wallichiana var. mairei[J]. J Plant Resour Environ, 2021, 30(1): 27-35. DOI: 10.3969/j.issn.1674-7895.2021.01.04.
[19]张志录, 刘中华, 陈明辉. 伏牛山区红豆杉不同叶龄叶片性状对海拔梯度的响应[J]. 福州大学学报(自然科学版), 2019, 47(2): 265-271, 278. ZHANG Z L, LIU Z H, CHEN M H. Effects of altitude gradient on the leaf traits at different leaf age of Taxus chinensis in Funiu area[J]. J Fuzhou Univ (Nat Sci Ed), 2019, 47(2): 265-271, 278. DOI: 10.7631/issn.1000-2243.18234.
[20]陈黎, 刘成功, 钱莹莹, 等. 南方红豆杉人工林针叶C、N、P化学计量特征[J]. 南京林业大学学报(自然科学版), 2021, 45(5): 53-61. CHEN L, LIU C G, QIAN Y Y, et al. Stoichiometric characteristics of C, N, P of Taxus chinensis var. mairei plantation needles[J]. J Nanjing For Univ (Nat Sci Ed), 2021, 45(5): 53-61. DOI: 10.12302/j.issn.1000-2006.202103051.
[21]杨克彤, 陈国鹏. 红豆杉幼树异龄叶的功能性状[J]. 应用生态学报, 2022, 33(2): 329-336. YANG K T, CHEN G P. Functional traits of leaves with different ages of Taxus wallichiana var. chinensis saplings[J]. Chin J Appl Ecol, 2022, 33(2): 329-336. DOI: 10.13287/j.1001-9332.202202.003.
[22]AUGUSTO L, DE SCHRIJVER A, VESTERDAL L, et al. Influences of evergreen gymnosperm and deciduous angiosperm tree species on the functioning of temperate and boreal forests[J]. Biol Rev, 2015, 90(2): 444-466. DOI: 10.1111/brv.12119.
[23]温璐宁. 东北地区21种乔木根系形态及组织化学特征[D]. 哈尔滨: 东北林业大学, 2019. WEN L N. Root morphology and histochemical characteristics of 21 tree species in northeast China [D]. Harbin: Northeast Forestry University, 2019.
[24]师伟, 王政权, 刘金梁, 等. 帽儿山天然次生林20个阔叶树种细根形态[J]. 植物生态学报, 2008, 32(6): 1217-1226. SHI W, WANG Z Q, LIU J L, et al. Fine root morphology of twenty hardwood species in Maoershan natural secondary forest in northeastern China[J]. Chinese Journal of Plant Ecology, 2008, 32(6): 1217-1226. DOI: 10.3773/j.issn.1005-264x.2008.06.002.
[25]张林, 罗天祥. 植物叶寿命及其相关叶性状的生态学研究进展[J]. 植物生态学报, 2004, 28(6): 844-852. ZHANG L, LUO T X. Advances in ecological studies on leaf lifespan and associated leaf traits[J]. Chinese Journal of Plant Ecology, 2004, 28(6): 844-852. DOI: 10.17521/cjpe.2004.0110.
[26]HENRY H A L, AARSSEN L W. On the relationship between shade tolerance and shade avoidance strategies in woodland plants[J]. Oikos, 1997, 80(3): 575-582. DOI:10.2307/3546632.
[27]KOERSELMAN W, MEULEMAN A F M. The vegetation N∶P ratio: a new tool to detect the nature of nutrient limitation[J]. J Appl Ecol, 1996, 33(6): 1441-1450. DOI:10.2307/2404783.
[28]GSEWELL S. N∶P ratios in terrestrial plants: variation and functional significance[J]. New Phytol, 2004, 164(2): 243-266. DOI: 10.1111/j.1469-8137.2004.01192.x.
[29]YAN Z B, TIAN D, HAN W X, et al. An assessment on the uncertainty of the nitrogen to phosphorus ratio as a threshold for nutrient limitation in plants[J]. Ann Bot, 2017, 120(6): 937-942. DOI:10.1093/aob/mcx106.
[30]WU T G, YU M K, WANG G G, et al. Leaf nitrogen and phosphorus stoichiometry across forty-two woody species in southeast China[J]. Biochem Syst Ecol, 2012, 44: 255-263. DOI: 10.1016/ j.bse.2012.06.002.
[31]ELSER J J, BRACKEN M E S, CLELAND E E, et al. Global analysis of nitrogen and phosphorus limitation of primary producers in freshwater, marine and terrestrial ecosystems[J]. Ecol Lett, 2007, 10(12): 1135-1142. DOI: 10.1111/j.1461-0248.2007.01113.x.
[32]MARTIN J G, KLOEPPEL B D, SCHAEFER T L, et al. Aboveground biomass and nitrogen allocation of ten deciduous southern Appalachian tree species[J]. Can J For Res, 1998, 28(11): 1648-1659. DOI:10.1139/x98-146.
[33]EISSENSTAT D M, WELLS C E, YANAI R D, et al. Building roots in a changing environment: implications for root longevity[J]. New Phytol, 2000, 147(1): 33-42. DOI:10.1046/j.1469-8137.2000.00686.x.
[34]ELSER J J, FAGAN W F, KERKHOFF A J, et al. Biological stoichiometry of plant production: metabolism, scaling and ecological response to global change[J]. New Phytol, 2010, 186(3): 593-608. DOI: 10.1111/j.1469-8137.2010.03214.x.
[35]ZHANG J H, HE N P, LIU C C, et al. Variation and evolution of C:N ratio among different organs enable plants to adapt to N-limited environments[J]. Glob Chang Biol, 2020, 26(4): 2534-2543. DOI: 10.1111/gcb.14973.
[36]MARSCHNERT H, KIRKBY E A, ENGELS C. Importance of cycling and recycling of mineral nutrients within plants for growth and development[J]. Bot Acta, 1997, 110(4): 265-273. DOI: 10.1111/j.1438-8677.1997.tb00639.x.
[37]成俊卿. 中国木材志[M]. 北京: 中国林业出版社, 1992. CHENG J Q. Wood records of China[M]. Beijing: China Forestry Publishing House, 1992.
[38]GREN G I. Stoichiometry and nutrition of plant growth in natural communities[J]. Annu Rev Ecol Evol Syst, 2008, 39(1): 153-170. DOI: 10.1146/annurev.ecolsys.39.110707.173515.
(责任编辑 孟苗婧 郑琰燚)
基金项目:中央高校基本科研业务费专项资金项目(2572019CP14,2572018BA05)。
第一作者:孙慧珍(sunhz-cf@nefu.edu.cn),副教授。
引文格式:孙慧珍,李杉,刘珊珊,等. 东北地区3个树种不同器官氮磷含量及计量特征[J]. 南京林业大学学报(自然科学版),2024,48(5):147-155.
SUN H Z, LI S, LIU S S, et al. Nitrogen, phosphorus contents and stoichiometric characteristics in different organs of three tree species in northeast China[J]. Journal of Nanjing Forestry University (Natural Sciences Edition),2024,48(5):147-155.

