元宝枫嫩枝扦插技术及生根过程的生理生化分析


摘要:【目的】研究不同处理对元宝枫嫩枝扦插生根的影响,筛选出适合元宝枫嫩枝扦插的最佳处理,分析营养物质含量、酶活性变化与插穗生根的关系,初步探究元宝枫的生根机理。【方法】以幼化和3年生的元宝枫母树为材料,分析生长调节剂(IBA、NAA、生根液)浓度、采穗部位(上部、下部)、幼化处理和扦插时间(6月和9月)等因素对元宝枫扦插生根的影响,调查生根率、愈伤率、根数、根长等生根指标,测定生根过程中营养物质(可溶性糖和可溶性蛋白)含量、氧化酶[过氧化物酶(POD)、多酚氧化酶(PPO)、吲哚乙酸氧化酶(IAAO)]活性的变化。【结果】IBA和NAA处理的最适质量浓度分别为500和800 mg/L,生根率分别为59.3%和52.7%;生根液处理的最适浓度为体积分数1.43%(稀释70倍),生根率为43.9%,三者之间差异显著,经生长调节剂处理后插穗各生根指标均优于对照。此外,6月扦插的生根效果优于9月,幼化处理插穗生根效果优于3年生母树,上部插穗扦插生根效果优于下部插穗,且上述处理均达到显著差异水平。插穗生根过程中,处理组可溶性糖含量的变化呈现先下降后上升的变化趋势,可溶性蛋白含量、POD及PPO活性整体呈先上升后下降的变化趋势;而IAAO活性呈下降—上升—下降的变化趋势。对照变化趋势与处理组大致相同,但处理组峰值出现时间均比对照提前了5~10 d。【结论】元宝枫不定根发生属于混合生根类型。幼化母树的上部插穗使用IBA 500 mg/L处理各生根指标均达到最优,生根率为81.3%。生长调节剂处理可以提高营养物质代谢速度和相关酶合成进程,对插穗生根有促进作用。
关键词:元宝枫; 生长调节剂; 嫩枝扦插; 营养物质; 氧化酶
中图分类号:S792.35""""" 文献标志码:A开放科学(资源服务)标识码(OSID):
文章编号:1000-2006(2024)05-0123-08
Softwood cutting technology for" Acer truncatum and physiological and biochemical analysis during rooting process
WANG Yuxiao1, ZHANG Bin2, MA Qiuyue3*, FU Wei1, KANG Zhen4, ZHU Changhong4, LI Shuxian1
(1.Co-Innovation Center for Sustainable Forestry in Southern China, College of Forestry and Grassland, Nanjing Forestry University, Nanjing 210037, China; 2.The Third Geological and Mineral Exploration Institute of Gansu Bureau of Geology and Mineral Resources,Lanzhou"" 730050,China; 3. Jiangsu Academy of Agricultural Sciences, Nanjing""" 210014, China; 4.Forestry Science and Technology Spreading Station in Xiangyang," Xiangyang" 441022, China)
Abstract: 【Objective】 In order" to" investigate the effects of different treatments on the rooting of softwood cuttings of Acer truncatum and find" the best treatment method. We analyzed the relationship between changes in nutrient content, oxidase activity, and rooting of cuttings, and preliminarily explored the rooting mechanism of A. truncatum. 【Method】 Using rejuvenated A. truncatum trees and three-year-old A. truncatum mother trees as study materials, we conducted an analysis of the effects of growth regulators [indole-3-butyric acid (IBA) and 1-naphthaleneacetic acid (NAA)" and a rooting solution], cutting positions (upper and lower parts), rejuvenation, and cutting time (June and September) on the rooting of A. truncatum. Furthermore, we examined the rate of root growth, callus formation, number of roots, root length, and other indicators of root development. Additionally, changes in nutrient contents (soluble sugar and soluble protein) and changes in oxidase activity [peroxidase (POD), polyphenol oxidase (PPO), and indole-3-acetic acid oxidase (IAAO)] were measured during the rooting process. 【Result】 The optimum IBA and NAA concentrations were 500 and 800 mg/L respectively, and the rooting rates were 59.3% and 52.7%, respectively. The optimal concentration for the rooting solution was a 1.43% volume fraction" (70-fold) dilution, which achieved a rooting rate of 43.9%. Significant differences were observed among the three treatments, with all rooting indexes of cuttings treated with growth regulators performed better than those of the control. Additionally, the rooting effect of cuttings in June was better than that in September; the rooting effect of rejuvenated mother trees was better than that of 3-year-old trees; and the rooting effect of upper cuttings was better than that of lower cuttings. There were substantial differences observed following these treatments. During the rooting of the cuttings, the changes in the soluble sugar content following the treatment displayed a decreasing trend followed by an increasing trend. The soluble protein content, POD activity, and PPO activity initially increased and then decreased. However, the IAAO activity displayed a trend of decrease-increase-decrease. The control group exhibited a similar changing trend to that of the treatment group, but the peak time for the treatment group was 5-10 days earlier than that of the control. 【Conclusion】 The adventitious root formation of A. truncatum was categorized as a mixed rooting type. When the upper cuttings of rejuvenated mother trees were treated with IBA 500 mg/L, all rooting indexes were optimized, and the rooting rate peaked at 81.3%. Growth regulator treatment can improve the metabolism rate of nutrients and the synthesis process of related oxidase, and has a facilitative effect on the rooting of cuttings.
Keywords:Acer truncatum; growth regulator; softwood cutting; nutrient; oxidase
元宝枫(Acer truncatum)为无患子科(Sapindaceae)槭属(Acer)落叶乔木,又名元宝槭、平基槭,因其种子像古代“金锭”而得名[1]。元宝枫是我国北方地区重要的乡土树种,主要分布在秦岭以北的吉林、辽宁、内蒙古、山东、河南、江苏北部等地,其树形优美,叶片秋季变黄或变红,具有很高的观赏价值[2]。元宝枫适应性较强,耐旱、耐寒、萌蘖力强,病虫害较少,此外还具有较强的吸附粉尘、净化空气的作用[3]。元宝枫种子是重要的食品、医药和化工原料[4],种仁含油率可达48%[5],其中不饱和脂肪酸含量高达90%以上,种子中还含有一种稀有物质——神经酸,其对于治疗阿尔茨海默病、记忆力减退等具有重要作用[6-7]。
元宝枫种子繁殖周期长、出苗不整齐,且实生苗分化较大,严重制约了优良品种的推广和应用[8]。扦插繁殖能够保持母本优良性状,同时具有取材方便、成苗快、繁殖系数高等优点[9]。目前关于元宝枫扦插繁殖技术已有报道,李岱龙等[10]和施雷等[11]发表了促进元宝枫扦插生根的专利,生根率可达80%以上,但是以上扦插的处理方法繁琐,插穗容易霉变,存在育苗周期长的缺陷,育苗成本高且生根时间较长,不适合大规模生产;此外,以对影响元宝枫扦插的因素以及营养物质、酶活性对扦插生根的影响也鲜有报道。本研究以幼化和3年生的元宝枫为材料,从生长调节剂浓度、采穗部位和扦插时间等方面,探究最适合其扦插生根的条件,同时研究营养物质含量、酶活性变化与插穗生根的关系,旨在进一步了解元宝枫的生根特性,为扦插育苗生产提供理论指导。
1 材料与方法
1.1 试验地概况
试验地点位于江苏省南京市溧水区南京朋合农业开发有限公司(119°05′E,31°45′N)。扦插池位于公司的塑料大棚内,大棚上方设有喷水设施和遮阳网。扦插基质为泥炭、珍珠岩和蛭石体积比7∶2∶1的混合基质,将配好的基质铺于扦插床上,厚约20 cm,扦插前1周用质量分数1‰高锰酸钾溶液浸透基质消毒。
1.2 试验材料
以江苏省农业科学研究院白鹿苑基地的3年生元宝枫(实生苗)及其幼化(3年生母树在2020年春天平茬)母树做采穗植株,选择生长健壮、芽饱满且无病虫害的当年生枝条做插条。于阴雨天剪取插条,将其剪成长度为8~10 cm的插穗,上端保留1片叶子,插穗上端平切(距上芽约1 cm),下端45°斜切,每根插穗至少保留2~3个饱满芽。
1.3 研究方法
1.3.1 生长调节剂对扦插生根的影响
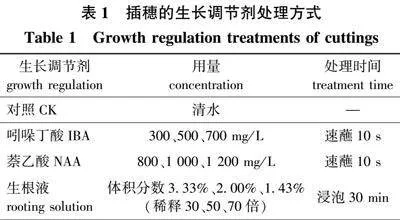
采用随机区组试验设计,于2020年6月16日从3年生元宝枫母树上剪取插穗,用吲哚丁酸(IBA)、萘乙酸(NAA)、生根液(中国林业科学研究院,主要成分为萘乙酸、吲哚丁酸、氨基酸、腐殖酸)处理,详见表1。以清水处理作对照,每个重复30根插穗,重复3次。
1.3.2 扦插时间对生根的影响
分别于2020年6月16日和9月14日两个不同时间,从3年生元宝枫母树上剪取插条,采用500 mg/L的IBA溶液速蘸插穗基部10 s后再进行扦插。以清水处理为对照,每重复30根插穗,重复3次。
1.3.3 幼化处理和采穗部位对扦插生根的影响
2020年6月16日从3年生及其幼化的母树上分别剪取插条,分上部、下部制作插穗,采用500 mg/L的IBA溶液速蘸插穗基部10 s。以清水处理为对照;每重复30根插穗,重复3次。
1.3.4 营养物质及其酶活性对扦插生根的影响
2020年6月16日从3年生母树上剪取插条,取上部插穗,在500 mg/L IBA中速蘸10 s后开始扦插,对照在清水中处理相同时间。从扦插当天(CK)开始每间隔10 d取样1次,直至60 d生根结束,每次分别取40根插穗,将插穗用清水洗净、擦干,迅速将插穗基部2 cm左右的韧皮部剥下,将样品剪碎混合均匀后做好标记,放入-80" ℃超低温冰箱保存,用于各生理指标的测定。
参照李合生[12]的方法进行可溶性糖含量、可溶性蛋白含量测定;过氧化物酶(POD)、多酚氧化酶(PPO)、吲哚乙酸氧化酶(IAAO)活性测定参照高俊凤[13]的方法。
1.4 扦插及插后管理
扦插深度1~2 cm。扦插完成后,立即浇水至基质湿润、叶片表面覆一层水膜即可。盖上塑料薄膜,加盖遮阴网,保持扦插环境的湿度在90%以上,棚内温度低于30 ℃。扦插后,每隔10~14 d用质量分数1.00‰~1.25‰的多菌灵和百菌清交替消毒。
1.5 相关指标测定
扦插后每10 d取样1次,观察插穗基部开始膨大、愈伤组织出现、不定根出现以及插穗生根的时间,扦插60 d时统计愈伤率(%)、生根率(%)、平均根数(条)和平均根长(cm),计算根系指数。
根系指数为生根率、平均根长与平均根数之积。
1.6 数据处理
使用Excel整理试验数据、制作图表,使用SPSS 25.0对数据进行方差分析和多重比较。
2 结果与分析
2.1 元宝枫扦插生根进程观察
元宝枫嫩枝扦插生根过程插穗的变化情况见图1。扦插第10天,插穗基部开始膨大,产生愈伤组织(图1b);扦插后第20天,插穗基部切口处的愈伤组织处出现白色芽状不定根(图1c)。扦插60 d后,不定根由白色转为褐色,生根率不再增加,插穗生根基本结束。生根进程观察还发现,元宝枫存在愈伤组织生根(图1e)和皮部生根(图1f),为混合生根型树种。
2.2 生长调节剂对元宝枫嫩枝扦插生根的影响
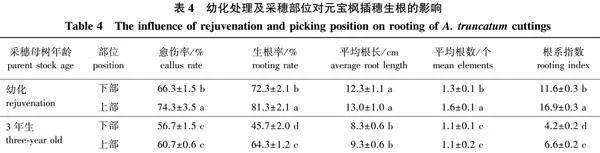
本试验插穗在生长调节剂、生根液中处理的时间不同,故设置了2个CK组。由生长调节剂对元宝枫插穗生根的影响结果(表2)可知,当插穗在清水中分别浸泡10 s(CK1)、30 min(CK2)时,除后者的愈伤率显著高于前者处理外,其他各项测定指标均无显著差异,表明插穗在清水中浸泡时间的长短对插穗生根不会有较大影响。生长调节剂种类和浓度对元宝枫扦插生根有重要影响,处理后的插穗各生根指标均优于CK,说明生长调节剂处理促进了插穗生根,提高了生根率:采用NAA处理后,其生根率均在44.0%以上,显著高于CK对照组的32.2%。3个NAA处理中,当质量浓度为800 mg/L时生根率最高,达到52.7%,显著高于另外2个处理;而愈伤率、平均根数、根系指数3个指标,均是1 000 mg/L处理显著高于另外2个浓度的处理。不同浓度的IBA处理中,当质量浓度为500 mg/L时生根率最高,达到59.3%,显著高于对照和其他2个浓度的处理,平均根长、平均根数、根系指数3个测定指标均是在低质量浓度300 mg/L下处理效果最好,而愈伤率则是3个处理间差异不显著。生根液处理在低浓度(体积分数1.43%,稀释70倍)时生根率最高,为43.9%,显著高于对照和其他两个浓度;平均根长在高浓度(30倍)时达到最大,其他指标均是低浓度(70倍)高于其他浓度的处理。以上结果说明,生长调节剂的种类、浓度对生根率的影响不尽相同:从生根率指标来看,500 mg/L是IBA处理的最适浓度,生根率为59.3%;800 mg/L是NAA处理的最适浓度,生根率为52.7%,并且这两个处理间差异显著,这2个处理的生根效果优于生根液处理组,后者的最高生根率仅为43.9%。
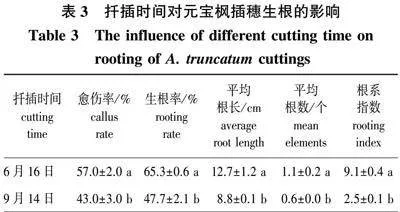
2.3 扦插时间对插穗生根的影响
分别在6、9月两个不同时间,以3年生元宝枫母树剪取的枝条为材料,采用500 mg/L的IBA处理10 s后的扦插结果见表3。6月插穗生根率为65.3%,比9月的生根率(47.7%)提高了17.6%,二者之间差异显著;6月扦插的愈伤率、平均根长、平均根数、根系指数均高于9月,且达到显著水平。
2.4 幼化处理及采穗部位对插穗生根的影响
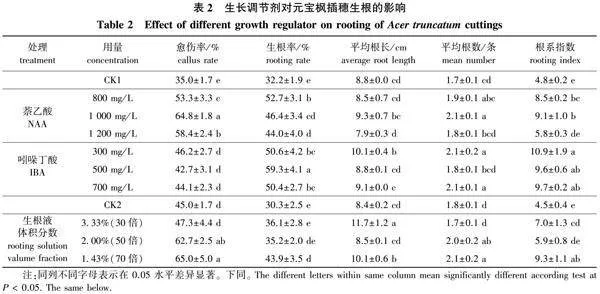
由幼化处理及采穗部位对元宝枫插穗生根的影响结果(表4)可知,幼化处理和采穗部位对元宝枫插穗生根有较大影响:幼化后的平均生根率为76.8%,相比较3年生母树的平均生根率(55.0%)提高了39.6%,幼化材料各生根指标也优于3年生母树。本试验还发现上部插穗的生根效果优于下部插穗,幼化元宝枫的上部插穗各生根指标均达到最高,生根率为81.3%,与下部的生根率72.3%间差异显著;幼化上部插穗愈伤率、平均根数、根系指数均显著高于幼化下部插穗,但平均根长指标间差异不显著;3年生母树,上部、下部插穗各指标变化规律与幼化相同。综合比较,从两个不同年龄母树采集的插穗经过IBA 500 mg/L处理后,各个处理之间差异显著,生根率由高到低依次是:幼化上部(81.3%)>幼化下部(72.3%)>3年生上部(64.3%)>3年生下部(45.7%),并且处理之间差异显著。
2.5 扦插生根过程中营养物质含量的变化
2.5.1 可溶性糖含量的变化
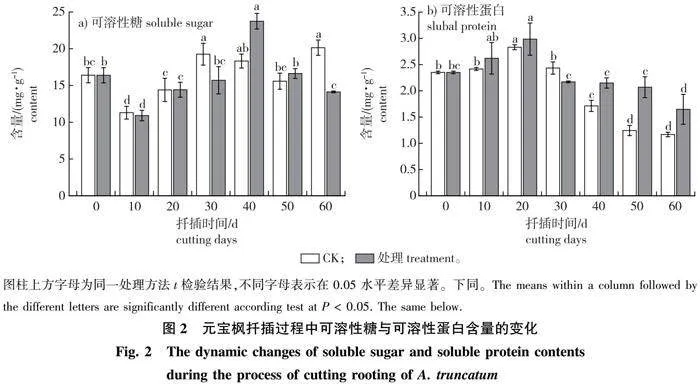
以经过500 mg/L IBA 处理的3年生元宝枫母树上部插穗为研究对象,测定其生根过程中可溶性糖含量的变化,结果表明,其含量整体呈现先下降后上升再下降的变化趋势(图2a)。扦插10 d时,处理组可溶性糖含量到达生根过程的最低值,较0 d时下降了32.9%;10 d后含量逐渐上升,扦插40 d时达到峰值,可溶性糖含量为23.7 mg/g;扦插40~60 d阶段,可溶性糖含量略有下降,但结果间差异不显著。CK在扦插60 d时达到最大值,峰值出现时间比处理组推迟了20 d,并且该最大值较处理组低了3.6 mg/g。
2.5.2 可溶性蛋白含量的变化
处理组生根过程中插穗基部可溶性蛋白含量呈先上升后下降再缓慢变化的趋势(图2b):扦插20 d时,可溶性蛋白含量达到峰值(2.9 mg/g),较0 d(2.4 mg/g)增加了26.9%;20~30 d的不定根形成阶段,可溶性蛋白消耗加快,含量下降,30 d时可溶性蛋白含量略有下降,说明插穗内可溶性蛋白的消耗和形成达到一种相对平衡状态。CK可溶性蛋白含量变化趋势与处理组基本相同,也是在扦插后20 d到达峰值(2.8 mg/g),但略低于处理组的峰值。在随后的下降过程中,CK组的下降幅度更大,扦插60 d时,对照组的含量较处理组低了41.1%。
2.6 酶活性的变化
2.6.1 POD活性的变化
生根过程中,处理组插穗基部POD活性整体呈先上升后下降再略微升高的变化趋势(图3a)。扦插10 d时POD活性急剧上升并达到峰值398.7 U/(g·min),较0 d时的70.0 U/(g·min)增加了5.69倍;之后POD活性持续下降;50 d后略有上升。CK组变化趋势同处理组,但整个扦插生根过程中,处理组的POD活性整体高于CK,处理组最大值较CK增加了40.6%,且比CK提前10 d达到峰值。由此可知,IBA处理有利于提高插穗体内POD活性来增强扦插过程的抗逆性,促进插穗不定根的形成。
2.6.2 PPO活性的变化
生根过程中插穗基部PPO活性处理组呈先上升后下降再缓慢变化的趋势(图3b)。处理组在扦插0~10 d,PPO活性先急剧上升,从4.6 U/(g·min)上升到5.8 U/(g·min),上升了26.1%;10~20 d时PPO活性急剧下降,较最高值下降了38.5%;随后各测定时间点PPO活性差异不显著,趋于缓慢变化中。CK组的变化趋势略有不同,0~10 d先呈下降趋势,10 d时PPO活性下降了15.2%;10~20 d上升到峰值5.2 U/(g·min),较10 d时上升了33.3%;20~30 d又急剧下降,随后趋于平缓。整个扦插生根过程中,处理组扦插初期插穗内PPO活性上升速度比CK快,提前10 d达到峰值,且处理组峰值[5.8 U/(g·min)]高于CK峰值[5.2 U/(g·min)],这可能正是激素处理利于插穗生根的原因之一。
2.6.3 IAAO活性的变化
扦插生根过程中处理组插穗内部IAAO活性呈“下降—上升—下降”的变化趋势(图3c):扦插后0~10 d,处理组IAAO活性下降至最低值,较0 d时下降了30.9%;10~30 d,插穗内IAAO活性快速上升,较最低值上升了3倍;40~60 d时IAAO活性再次下降,较峰值降低了40.8%。CK组IAAO活性的变化趋势与处理组有较大差异,整体呈“上升—下降—上升—下降”的“M”形变化趋势。扦插后0~20 d,IAAO活性快速上升,较0 d上升了159%;20~30 d期间,IAAO活性显著性下降;30~50 d再次上升,并达到峰值731.6 U/(g·min); 60 d时再次快速下降至496.3 U/(g·min)。处理组IAAO活性在扦插10 d后开始上升,CK组则是在30 d后才开始再次上升,比处理组延迟了20 d。整个扦插生根过程中,处理组IAAO活性的变化幅度均高于CK。
3 讨 论
3.1 生长调节剂、扦插时间及幼化处理对元宝枫扦插生根的影响
插穗不定根形成是扦插成活的关键。生长调节剂对插穗不定根的形成具有重要作用,采用适当生长调节剂处理后插穗愈伤率、生根率、根长、根数等指标都会有显著提高,从而缩短育苗周期,降低生产成本[14-15]。本研究中生根率最高的处理为:IBA 500 mg/L速蘸10 s,生根率为59.3%;其次是NAA 800 mg/L处理,生根率为52.7%。生长调节剂处理生根率均显著高于对照的清水处理,说明生长调节剂处理可以显著提高元宝枫的生根效果。王艺等[16]在武当玉兰(Magnolia sprengeri)的扦插研究中同样发现,NAA、IBA处理可以显著提高插穗的生根率。
本研究还发现:6月扦插生根各项指标均高于9月,这是由于6月植物细胞的分生能力强,插穗生理代谢旺盛,且6月降水充沛,插穗体内水分较多,更有利于插穗生根。其他学者在大埔杜鹃(Rhododendron taipaoense)[17]和侧柏(Platycladus orientalias)[18]扦插研究中得出与本研究一致的结论。还有,插穗年龄越小,细胞全能性越高,分裂、分化能力越强,生根也比较容易[19]。本研究从幼化的母树剪取的插穗生根率均高于3年生母树,可见母树年龄对元宝枫扦插生根有较大影响。郑先波等[20]也发现,采用主干平埋法幼化榛(Corylus heterophylla),嫩枝扦插成活率可以提高到90%以上。此外,由于插条不同部位的营养物质含量及木质化程度不同,其对生根也有较大影响。袁利利[21]在对元宝枫的研究中也发现,不同部位插穗生根率由大到小的顺序为中段gt;上段gt;下段。本研究表明,上部插穗各处理生根率显著大于下部插穗,幼化母树的上部插穗采用IBA 500 mg/L处理后,生根率达到81.3%,其他各项生根指标均是上部插穗高于下部插穗,可见采穗部位对元宝枫扦插生根有较大影响,这与美国白梣(Fraxinus americana)[22]的研究结果一致。
3.2 营养物质含量和酶活性变化与元宝枫插穗生根的关系
过氧化物酶(POD)主要参与生长素代谢和酚类物质的合成,在适应逆境环境以及根原基形成过程中起重要作用,是酶促防御系统的关键酶之一[23-25]。吕庚鑫等[25]认为扦插初期植物感知到受伤信号,POD酶活性上升,以利于清除伤口处产生的活性氧与自由基,进而促进根原基的诱导与愈伤组织的形成。这与本研究愈伤组织形成期(0~10 d)元宝枫 POD的活性迅速增加至峰值相一致。在插穗切口愈合、基部膨大和愈伤组织形成阶段,需要消耗大量碳水化合物、含氮化合物以维持插穗旺盛的代谢活动[26-27]。该阶段插穗自身的应急机制会产生大量的蛋白酶类物质,参与大分子营养物质的水解代谢,可溶性蛋白含量增加[25,28],这与本研究扦插初期元宝枫插穗内可溶性糖、可溶性蛋白含量的变化趋势相吻合。
随后的不定根形成阶段,元宝枫插穗的代谢活动进一步增强,插穗内其他储存物质(如淀粉等)分解为可被插穗直接利用的可溶性糖,此外插穗保留叶片的光合作用,也会使可溶性糖含量持续增加[29-30]。随着不定根的伸长,插穗内可溶性糖和可溶性蛋白的消耗和积累逐渐达到了一种平衡状态。此外,本研究处理组插穗体内的营养物质质量分数高于清水对照组,说明IBA处理能加快元宝枫插穗生根过程中各营养物质的活性,促进其根系形成。
以往的研究表明,IAA在扦插生根过程中起着重要作用。插穗内较高浓度的IAA有利于愈伤组织的产生,低浓度的IAA可加快根系伸长区细胞的分化[25]。酚类物质的产生对生根有抑制作用,而多酚氧化酶(PPO)能够催化酚类物质与IAA结合,形成生根辅助因子“IAA-酚酸复合物”[31],因此高活性PPO有利于促进伤口愈合和不定根形成[21],本研究元宝枫扦插初期PPO活性增长至峰值再次证明PPO在愈伤组织形成阶段起到了重要作用。吲哚乙酸氧化酶(IAAO)可以分解植物体内IAA,因此IAAO也可以调节插穗内IAA水平,对生根进程起着重要调控作用[32]。扦插初期元宝枫插穗IAAO活性的降低,也可以从另一个方面使IAA得以积累。扦插后30 d时IAAO活性达到峰值,前期积累过量的IAA快速分解,有利于不定根的形成。扦插后30~60 d,插穗内IAAO酶活性逐渐下降并趋于稳定,IAA含量升高到一定适宜的水平,使得根系更好地伸长生长,促进根系形态建成[33-34]。总的来说,元宝枫插穗生根与营养物质和酶活性密切相关,在扦插不同时期均呈现一定的规律性,而不同树种生根过程中营养物质和酶活性的变化规律呈现出一定的差异,表明生根过程中激素与营养物质的关系是既独立又相互联系,并通过相互作用来影响生根。
综上所述,本研究对元宝枫的扦插繁殖技术进行了探究,结果表明扦插时间、幼化处理、生长调节剂处理均对元宝枫扦插繁殖有显著影响,为元宝枫无性繁殖提供理论依据。但元宝枫生根机制较为复杂,影响插穗生根的其他生理生化因素以及生根过程中插穗体内激素含量变化还有待进一步研究。本研究还发现,元宝枫扦插生根数量较少,根系质量不是太理想,故仍需要大量实践探索,并且还需要结合分子手段,进一步深入研究元宝枫扦插繁殖的生根机制。
参考文献(reference):
[1]傅立国. 中国高等植物-第七卷[M]. 青岛:青岛出版社, 2001. FU L G. Higher plants of China: Vol. 7[M]. Qingdao: Qingdao Publishing House, 2001.
[2]李悦, 蔡亚南, 任安琦, 等. 盐碱胁迫对元宝枫幼苗生长和生理特性的影响[J]. 东北林业大学学报, 2022, 50(8): 5-14,21. LI Y, CAI Y N, REN A Q, et al. Effects of saline-alkali stress on growth and physiological characteristics of Acer truncatum seedlings[J]. J Northeast For Univ, 2022, 50(8):5-14,21. DOI:10.13759/j.cnki.dlxb.2022.08.002.
[3]王琨, 刘少波, 张娜, 等. 元宝枫研究进展[J]. 西北林学院学报, 2021, 36(3): 152-157,280. WANG K, LIU S B, ZHANG N, et al. Research progress on Acer truncatum[J]. J Northwest For Univ, 2021, 36(3): 152-157,280. DOI: 10.3969/j.issn.1001-7461.2021.03.23
[4]王性炎, 王妹清. 新资源食品:元宝枫籽油[J]. 中国油脂, 2011, 36(9):56-59. WANG X Y, WANG M Q. New resource food: Acer truncatum seed oil[J]. China Oils"" Fats, 2011, 36(9): 56-59.
[5]马秋月, 王亚楠, 李淑顺, 等. 元宝枫种子发育过程中油脂积累与可溶性糖、蛋白质之间的关系[J]. 江苏农业学报, 2021, 37(4): 982-989. MA Q Y, WANG Y N, LI S S, et al. The lipid accumulation and its relationship with soluble sugar and protein in Acer truncatum Bunge seeds development[J]. Jiangsu J Agric Sci, 2021, 37(4):982-989. DOI: 10.3969/j.issn.1000-4440.2021.04.022
[6]MA Q Y, SUN T L, LI S S, et al. The" Acer truncatum genome provides insights into nervonic acid biosynthesis[J]. Plant J, 2020, 104(3): 662-678. DOI: 10.1111/tpj.14954.
[7]谷荣辉. 中国乡土树种元宝枫的化学成分及代谢组学研究[D]. 北京: 中央民族大学, 2019. GU R H. Chemical constituents and metabolomics of Acer truncatum, an arbor species native in China[D]. Beijing: Minzu University of China, 2019.
[8]张洪波. 元宝枫优树繁育技术研究[D]. 北京:北京林业大学, 2016. ZHANG H B. Study on regeneration technique of Acer truncatum elite trees[D]. Beijing: Beijing Forestry University, 2016.
[9]赵瑞, 沈永宝. 林木扦插繁殖研究进展[J]. 种子, 2019, 38(9): 57-66. ZHAO R, SHENG Y B. Research advances in tree cutting propagation[J]. Seed, 2019, 38(9): 57-66. DOI: 10.16590/j.cnki.1001-4705.2019.09.057.
[10]李岱龙, 王文文, 王娟, 等. 一种元宝枫扦插育苗方法. CN105830708A[P]. 2016. LI D L, WANG W W, WANG J, et al. A cutting seedling method of Acer truncatum. CN105830708A[P]. 2016.
[11]施雷, 张超. 一种元宝枫树扦插方法. CN105993802A[P]. 2016. SHI L, ZHANG C. A cutting method of Acer truncatum. CN105993802A[P]. 2016.
[12]李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000. LI H S. Principles and techniques of plant physiological and biochemical experiment[M]. Beijing: Higher Education Press, 2000.
[13]高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006. GAO J F. Experimental guidance for plant physiology[M]. Beijing: Higher Education Press, 2006.
[14]贾娟, 姚延寿, 史敏华, 等. 生根剂促进槭树植物扦插繁殖的研究进展[J]. 西北林学院学报, 2010, 25(4): 107-109,134. JIA J, YAO Y S, SHI M H, et al. Advances in the researchers of rooting agent in cutting propagation of Aceraceae plants[J]. J Northwest For Univ, 2010, 25(4): 107-109,134.
[15]郑巧巧, 兰思仁, 刘雪蝶, 等. 生长调节剂对‘香妃’含笑扦插生根及相关酶活性的影响[J]. 中南林业科技大学学报, 2020, 40(5): 67-76. ZHENG Q Q, LAN S R, LIU X D, et al. Effects of growth regulators on rooting and correlative enzyme activities of Michelia figo ‘Xiangfei’ cuttings[J]. J Central South Univ For Technol, 2020, 40(5): 67-76. DOI: 10.14067/j.cnki.1673-923x.2020.05.009.
[16]王艺, 贾忠奎, 马履一, 等. 4种植物生长调节剂对红花玉兰嫩枝扦插生根的影响[J]. 林业科学, 2019, 55(7): 35-45. WANG Y, JIA Z K, MA L Y, et al. Effects of four plant growth regulators on rooting of the softwood cutting of Magnolia wufengensis[J]. Sci Silvae Sin, 2019, 55(7): 35-45. DOI:10.11707/j.1001-7488.20190704.
[17]魏茂胜. 不同处理对茶绒杜鹃扦插生根与生长的影响[J]. 森林与环境学报, 2019, 39(1): 27-31. WEI M S. Effects of different treatments on the rooting and growth of Rhododendron apricum[J]. J For Environ, 2019, 39(1): 27-31. DOI:10.13324/j.cnki.jfcf.2019.01.005.
[18]魏黔春, 江泽平, 刘建锋, 等. 侧柏古树扦插试验及插穗营养物质变化[J]. 南京林业大学学报(自然科学版), 2020, 44(1): 63-71. WEI Q C, JIANG Z P, LIU J F, et al.Effects of several factors on rooting of cutting propagation of ancient Platycladus orientalias and the changes of nutritive material[J]. J Nanjing For Univ (Nat Sci Ed), 2020, 44(1): 63-71. DOI:10. 3969/j.issn.1000-2006.201903057.
[19]卜晓婷, 乔孝禄, 徐晓华, 等. 母树年龄、采穗时期和抑制物质对纳塔栎生根的影响[J].东北林业大学学报, 2022, 50(2): 11-16,28. BU X T, QIAO X L, XU X H, et al. Effects of parent stock age, cutting time and rooting inhibitors on stem cutting of Quercus nuttallii[J]. J Northeast For Univ, 2022, 50(2): 11-16,28. DOI: 10.13759/j.cnki.dlxb.2022.02.013.
[20]郑先波, 王昊, 谭彬, 等. 埋干幼化处理对榛扦插生根的影响[J]. 经济林研究, 2016, 34(2): 147-151. ZHENG X B, WANG H, TAN B, et al. Effects of rejuvenating treatments through burying trunk on cutting rooting in Corylus[J]. Nonwood For Res, 2016, 34(2): 147-151. DOI: 10.14067/j.cnki.1003-8981.2016.02.027.
[21]袁利利. 华北五角枫扦插繁殖技术及生根机理的研究[D]. 泰安: 山东农业大学, 2012. YUAN L L. The studies on the propagation techniques and rooting mechanism of stem cuttings of Acer truncatum Bunge[D]. Taian: Shandong Agricultural University, 2012.
[22]薛满满, 常雪薇, 李春明, 等. 美国白蜡嫩枝扦插生根特性[J]. 中南林业科技大学学报, 2022, 42(4): 40-48. XUE M M, CHANG X W, LI C M, et al. The rooting characteristics of Fraxinus americana softwood cuttings[J]. J Central South Univ For Technol, 2022, 42(4): 40-48. DOI: 10.14067/j.cnki.1673-923x.2022.04.005.
[23]NEGISHI N, OISHI M, KAWAOKA A. Chemical screening for promotion of adventitious root formation in" Eucalyptus globulus[J]. BMC Proc, 2011, 5(S7): 139. DOI: 10.1186/1753-6561-5-S7-P139.
[24]侯江涛, 沈聪聪, 张毅芳, 等. 植物扦插繁殖生根机理研究综述[J]. 安徽农业科学, 2019, 47(19): 1-3,6. HOU J T, SHEN C C, ZHANG Y F, et al. Review on rooting mechanism of plant cuttings propagation[J]. J Anhui Agric Sci, 2019, 47(19): 1-3,6. DOI: 10.3969/j.issn.0517-6611.2019.19.001.
[25]吕庚鑫, 孟益德, 庆军, 等. ‘华仲6号’杜仲嫩枝扦插生根的解剖及生理变化[J]. 林业科学, 2022, 58(2): 113-124. LV G X, MENG Y D, QING J, et al. Changes of anatomical structure and physiology during softwood cutting rooting of Eucommia ulmoides ‘Huazhong No. 6’[J]. Sci Silvae Sin, 2022, 58(2): 113-124. DOI: 10.11707/j.1001-7488.20220212.
[26]RAPAKA V K, BESSLER B, SCHREINER M, et al. Interplay between initial carbohydrate availability, current photosynthesis and adventitious root formation in" Pelargonium cuttings[J]. Plant Sci, 2005, 168(6): 1547-1560. DOI: 10.1016/j.plantsci.2005.02.006.
[27]ZHANG J, SHI Y, ZHANG X Z, et al. Melatonin suppression of heat-induced leaf senescence involves changes in abscisic acid and cytokinin biosynthesis and signaling pathways in perennial ryegrass (Lolium perenne L.)[J]. Environ Exp Bot, 2017, 138: 36-45.DOI: 10.1016/j.envexpbot.2017.02.012.
[28]梁玉堂, 龙庄如. 树木营养繁殖原理和技术[M]. 北京: 中国林业出版社, 1993. LIANG Y T, LONG Z R. Principles and techniques of vegetative propagation of trees[M]. Beijing: China Forestry Publishing House, 1993.
[29]乔孝禄, 卜晓婷, 徐晓华, 等. 纳塔栎嫩枝扦插生根过程中的生理变化[J]. 中南林业科技大学学报, 2021, 41(4): 86-92. QIAO X L, BU X T, XU X H, et al. Rooting characteristics of Quercus nuttallii softwood cuttings and its physiological changes[J]. J Central South Univ For Technol, 2021, 41(4): 86-92. DOI: 10.14067/j.cnki.1673-923x.2021.04.010.
[30]刘欢, 刘济明, 骆畅, 等. GGR-6对米槁插穗生根过程中生理动态的影响[J]. 东北林业大学学报, 2021, 49(10): 42-46,64. LIU H, LIU J M, LUO C, et al. Effect of GGR-6 on physiological dynamics of Cinnamomum migao H. W. Li cuttings during rooting[J]. J Northeast For Univ, 2021, 49(10): 42-46,64. DOI: 10.13759/j.cnki.dlxb.2021.10.008.
[31]SOMKUWAR R G, BONDAGE D D, SURANGE M S, et al. Rooting behaviour, polyphenol oxidase activity, and biochemical changes in grape rootstocks at different growth stages[J]. Turkish J Agric For, 2011, 35(3): 281-287. DOI: 10.3906/tar-0911-62.
[32]PEDREIRA J, TERESA HERRERA M, ZARRA I, et al. The overexpression of AtPrx37, an apoplastic peroxidase, reduces growth in Arabidopsis[J]. Physiol Plant, 2011, 141(2): 177-187. DOI: 10.1111/j.1399-3054.2010.01427.x.
[33]凡莉莉, 薛磊, 赖金莉, 等. 大头典竹扦插过程中营养物质和氧化酶活性变化研究[J]. 竹子学报,2018, 37(1): 54-59. FAN L L, XUE L, LAI J L, et al. Change of nutrient content and oxidase activities during cutting propagation of Dendrocalamopsis beecheyana[J]. J Bamboo Res[J], 2018,37(1):54-59. DOI: 10.19560/j.cnki.issn1000-6567.2018.01.009.
[34]吴红, 陆辉, 高克利, 等. 生长调节剂对青钱柳扦插生根及生根过程中保护酶系统的影响[J]. 北方园艺, 2019(20): 106-111.WU H, LU H, GAO K L, et al. Effects of growth regulators on rooting characteristics and protective enzyme system of Cyclocarya paliurus cuttings[J]. North Hortic, 2019(20): 106-111. DOI: 10.11937/bfyy.20191100.
(责任编辑 吴祝华)
基金项目:国家自然科学基金项目(32001357,32471929);江苏省青年基金(面上项目)(BK20211139);江苏高校优势学科建设工程资助项目(PAPD)。
第一作者:王玉虓(wangyux1997@163.com)。
*通信作者:马秋月(yue.870808@163.com),副研究员。
引文格式:王玉虓,张斌,马秋月,等. 元宝枫嫩枝扦插技术及生根过程的生理生化分析[J]. 南京林业大学学报(自然科学版),2024,48(3):123-130.
Softwood cutting technology for" Acer truncatum and physiological and biochemical analysis during rooting process[J]. Journal of Nanjing Forestry University (Natural Sciences Edition),2024,48(3):123-130.

