隔药饼灸对动脉粥样硬化兔血清Ox-LDL、IFN-γ表达的影响


〔摘要〕 目的 观察隔药饼灸对动脉粥样硬化(atherosclerosis, AS)兔血清氧化低密度脂蛋白(oxidized low-density lipoprotein,Ox-LDL)、干扰素(interferon-γ, IFN-γ)的影响,探讨隔药饼灸抗AS的作用机制。方法 将18只新西兰兔随机分为正常组、模型组、隔药饼灸组,每组6只。正常组给予普通饲料喂养,其余2组给予高脂饲料喂养,其中隔药饼灸组边造模边干预:2组穴位(巨阙、天枢、丰隆;心俞、肝俞、脾俞)交替行隔药饼灸干预,每穴灸4壮,每日1次,干预12周。HE染色观察主动脉组织病理变化,比色法检测总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、低密度脂蛋白胆固醇(low density liporotein cholesterol, LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)含量,ELISA法检测Ox-LDL、IFN-γ含量。结果 与正常组比,模型组主动脉内皮明显增厚,平滑肌排列絮乱,泡沫细胞大量聚集,血清TC、TG、LDL-C、Ox-LDL、IFN-γ含量均显著升高(P<0.05,P<0.001),HDL-C含量显著下降(P<0.001)。与模型组比,隔药饼灸组主动脉内皮结构完整,平滑肌排列整齐,少见泡沫细胞,血清TC、TG、LDL-C、ox-LDL、IFN-γ含量均显著下降(P<0.05,P<0.01,P<0.001),HDL-C含量明显升高(P<0.05)。结论 隔药饼灸可能通过降低AS兔血清Ox-LDL、IFN-γ含量,减少巨噬细胞脂质摄取,抑制泡沫细胞形成,发挥抗AS的作用。
〔关键词〕 动脉粥样硬化;隔药饼灸;氧化低密度脂蛋白;干扰素-γ;泡沫细胞;脂质
〔中图分类号〕R245 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.09.009
Effects of moxibustion on medicines on serum expressions of Ox-LDL and IFN-γ in rabbits with atherosclerosis
YI Hongfen1, CHEN Xinyu1, PENG Han1, XIAO Mengxia1, OUYANG Lizhi1, LIU Honghua2*, LIU Mailan1*
1. School of Acupuncture-moxibustion, Tuina and Rehabilitation, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. School of Nursing, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To observe the effects of moxibustion on medicines on serum levels of oxidized low-density lipoprotein (Ox-LDL) and interferon-γ (IFN-γ) in rabbits with atherosclerosis (AS), and to explore the anti-AS mechanism of moxibustion on medicines. Methods Eighteen New Zealand rabbits were randomly divided into normal group, model group, and moxibustion on medicines group, with six rabbits in each group. The normal group was fed a normal diet, while the other two groups were fed a high-fat diet. The moxibustion on medicines group received intervention during the modeling process. Alternating moxibustion on medicines was applied to two sets of acupoints ["Juque" (CV14), "Tianshu" (S25), "Fenglong" (S40); "Xinshu" (BL15), "Ganshu"(BL18), and "Pishu"(BL20)] , with four cones per acupoint, once daily for 12 weeks. The pathological changes of aorta were observed using HE staining. Total cholesterol (TC), triglyceride (TG), low density liporotein cholesterol (LDL-C), and high density lipoprotein cholesterol (HDL-C) content were measured by colorimetric method. Ox-LDL and IFN-γ levels were determined by ELISA. Results Compared with the normal group, the model group showed significant thickening of the aortic endothelium, disordered arrangement of smooth muscle cells, and massive accumulation of foam cells. Serum content of TC, TG, LDL-C, Ox-LDL, and IFN-γ were significantly elevated (P<0.05, P<0.001), while HDL-C content was significantly lower (P<0.001). Compared with the model group, the moxibustion on medicines group showed intact aortic endothelial structure, orderly arrangement of smooth muscle cells, and rare foam cells. Serum content of TC, TG, LDL-C, ox-LDL, and IFN-γ were significantly lower (P<0.05, P<0.01, P<0.001), while HDL-C content was significantly higher (P<0.05). Conclusion Moxibustion on medicines may exert anti-AS effects by decreasing serum content of Ox-LDL and IFN-γ in rabbits with AS, thereby reducing macrophage lipid uptake and inhibiting the formation of foam cells.
〔Keywords〕 atherosclerosis; moxibustion on medicines; oxidized low density lipoprotein; interferon-γ; foam cells; lipids
动脉粥样硬化(atherosclerosis, AS)是由多因素导致的一种炎性致病性动脉疾病,是心血管疾病的主要发病原因。研究表明,动脉血管壁内血脂代谢紊乱,富含脂质的泡沫细胞形成与聚集是AS早期主要病变特征[1]。泡沫细胞释放大量炎性细胞因子、基质金属蛋白酶及其他炎症介质,促进AS炎症反应[2]。同时,泡沫细胞在血管壁内堆积形成脂质条纹,参与粥样斑块形成[3]。研究发现,巨噬细胞吞噬大量的氧化低密度脂蛋白(oxidized low-density lipoprotein, Ox-LDL)和巨噬细胞胆固醇流出的不平衡会促进泡沫细胞的形成[4-5]。Ox-LDL作为致AS的关键脂蛋白,促使巨噬细胞转变为泡沫细胞,释放炎性因子,导致动脉血管炎症和粥样斑块形成[6]。干扰素(interferon-γ, IFN-γ)是经典的巨噬细胞激活因子,启动巨噬细胞促进Ox-LDL摄取,并通过信号传导通路介导巨噬细胞脂质代谢,阻碍胆固醇反向转运,促进脂质超载和泡沫细胞形成[7]。
中医学认为,AS归属于“胸痹”“脉痹”“偏枯”等疾病范畴,其病机为本虚标实,以脏腑亏虚为本,以痰瘀毒邪为标,痰瘀互结是AS的主要病理机制,辨治多从痰、瘀、毒入手[8-9]。隔药饼灸是一种综合性的中医传统特色疗法,采用活血化瘀、行气导滞、化痰通络的药饼配方(丹参、山楂、泽泻、大黄、郁金)和强心利脉、化痰除湿、去瘀排毒的脏腑辨证取穴处方(心俞、脾俞、肝俞、巨阙、天枢、丰隆)[10],可降低血脂水平,调节脂质代谢[11-12],抑制炎症反应[13-14]。但隔药饼灸抗炎、抗AS的具体作用机制还需进一步阐明。本研究观察隔药饼灸对血清Ox-LDL、IFN-γ表达的影响,探讨隔药饼灸抗AS的作用机制。
1 材料与方法
1.1 动物与分组
3月龄普通级新西兰纯种兔18只,雄性,体质量1.5~2.5 kg,购自湖南太平生物有限公司[动物许可证号:SCXK(湘)2020-0005]。每只兔分笼圈养于湖南中医药大学动物中心实验室,饲养温度20~25 ℃,湿度50%~70%。
1.2 主要仪器与试剂
酶标仪(美国Thermo公司,型号:MultiskanFC);石蜡包埋机、手动轮转式切片机(德国莱卡公司,型号分别为EG1150、HistoCore BIOCUT R);倒置荧光显微镜(德国蔡司公司,型号:Axio Vert. A1);高速低温离心机(美国Scilogex公司,型号:D3024R)。
苏木素-伊红染液(武汉谷歌生物科技有限公司,批号:G1005);4%组织细胞固定液(北京索莱宝科技有限公司,批号:P1110);乙醇、二甲苯(中国医药集团有限公司,批号分别为10009257、100234192);甘油三酯(triglyceride, TG)测定试剂盒、总胆固醇(total cholesterol, TC)测定试剂盒、低密度脂蛋白胆固醇(low density liporotein cholesterol, LDL-C)测定试剂盒、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)测定试剂盒(南京建成生物工程研究所,批号分别为A110-1-1、A111-1-1、A113-1-1、A112-1-1);IFN-γ ELISA试剂盒、Ox-LDL ELISA试剂盒(武汉Elabscience公司,批号分别为E-EL-R0009c、E-EL-H6021)。
1.3 分组与造模
18只实验兔适应性喂养1周后,将其随机分为正常组、模型组、隔药饼灸组,每组6只。正常组喂养普通饲料12周,模型组与隔药饼灸组采用高胆固醇饮食喂养120 g/d,其中隔药饼灸组边造模边干预,连续12周。高胆固醇饮食配方:胆固醇1%、蛋白粉10%、猪油5%、正常粗颗粒饲料84%、丙硫氧嘧啶[10 mg/(kg·d)]。AS模型成功标准[15]:兔TC值高于正常血清TC含量(1~2 mmol/L)3倍以上,血清TG和LDL-C显著升高(P<0.05),且解剖可见腹主动脉有脂质粥样斑块凸出。
1.4 干预方法
将隔药饼灸组兔以仰卧位捆绑于固定台上,参照《实验针灸学》,并根据兔子骨骼和体型取巨阙、天枢(双侧)、丰隆(双侧)、心俞(双侧)、肝俞(双侧)、脾俞(双侧),穴位处局部剪毛,穴位聚维酮碘溶液消毒后涂抹凡士林并沾上厚0.5 cm、直径1 cm的药饼(将丹参、山楂、郁金、大黄、泽泻按照等比例进行粉碎成末),将0.5 cm的艾炷放在药饼上点燃施灸,待艾炷燃尽后更换另一壮,每穴连续灸4壮,每日1次,两组穴位(Ⅰ组:巨阙、天枢、丰隆;Ⅱ组:心俞、肝俞、脾俞)隔日交替施灸,连续治疗12周。
1.5 标本采集
3%戊巴比妥钠(1 mL/kg)经兔耳缘静脉麻醉注射,取腹主动脉血液样本,3 000 r/min半径16 cm离心15 min,分离血清,置于-80 ℃冰箱中保存。取血后将主动脉及其根部相连心脏组织一同取出,PBS反复漂洗,并用2 mL无菌冻存管采集主动脉组织,置入干冰,所有样本采集结束即刻转入-80 ℃冰箱保存。
1.6 指标检测
1.6.1 HE染色观察腹主动脉组织病理变化 将兔腹主动脉组织用4%多聚甲醛固定,依次放入乙醇、二甲苯Ⅰ、二甲苯Ⅱ进行脱水,石蜡包埋、成块切片,烘干脱蜡并进行苏木精、伊红染色,中性树胶封片后于显微镜下分析主动脉组织形态。
1.6.2 比色法检测TC、TG、LDL-C、HDL-C含量 分别取各组兔血液样本10 μL,依次加入TC、TG、LDL-C、HDL-C试剂盒中的工作液1 mL,混匀,取200 μL混合液转移至96孔板,37 ℃孵育10 min。酶标仪在510 nm波长下检测各孔的吸光度值。根据公式计算各指标含量:指标含量=[(样本吸光度值-空白吸光度值)/(标准对照吸光度值-空白吸光度值)]×标准品浓度。
1.6.3 ELISA法检测Ox-LDL、IFN-γ含量 取出血清样品,置于冰上融化,将Ox-LDL、IFN-γ标准品离心,加入稀释液配制成所需浓度的工作液,确保标准品完全溶解并混匀。向微孔板的标准孔和测试孔中分别加入标准品和待测样品,封板后在37 ℃下孵育90 min,去除孵育液,加入生物素化抗体工作液,孵育60 min。反复洗涤后加入酶结合物工作液,孵育30 min,并用底物溶液TMB进行显色,之后加入终止液停止反应。在450 nm波长下测量各孔的吸光度值,最后根据标准曲线,计算每个组织的指标含量。
1.7 统计学分析
采用SPSS 25.0统计软件进行数据分析,所有检测数据均以“x±s”表示。组间比较时,若数据符合正态性且方差齐,则采用LSD法,若方差不齐则使用Tamhane方法进行方差分析;若数据不符合正态分布,则选择秩和检验进行分析。P<0.05时,认为差异具有统计学意义。
2 结果
2.1 各组兔腹主动脉组织病理变化
正常组:主动脉血管内皮结构完整,中膜平滑肌细胞排列整齐;模型组:主动脉血管内皮明显增厚,中膜平滑肌排列絮乱,泡沫细胞大量聚集;隔药饼灸组:主动脉血管内皮结构完整,血管中膜平滑肌排列整齐,血管内皮增厚被抑制,少见泡沫细胞。详见图1。
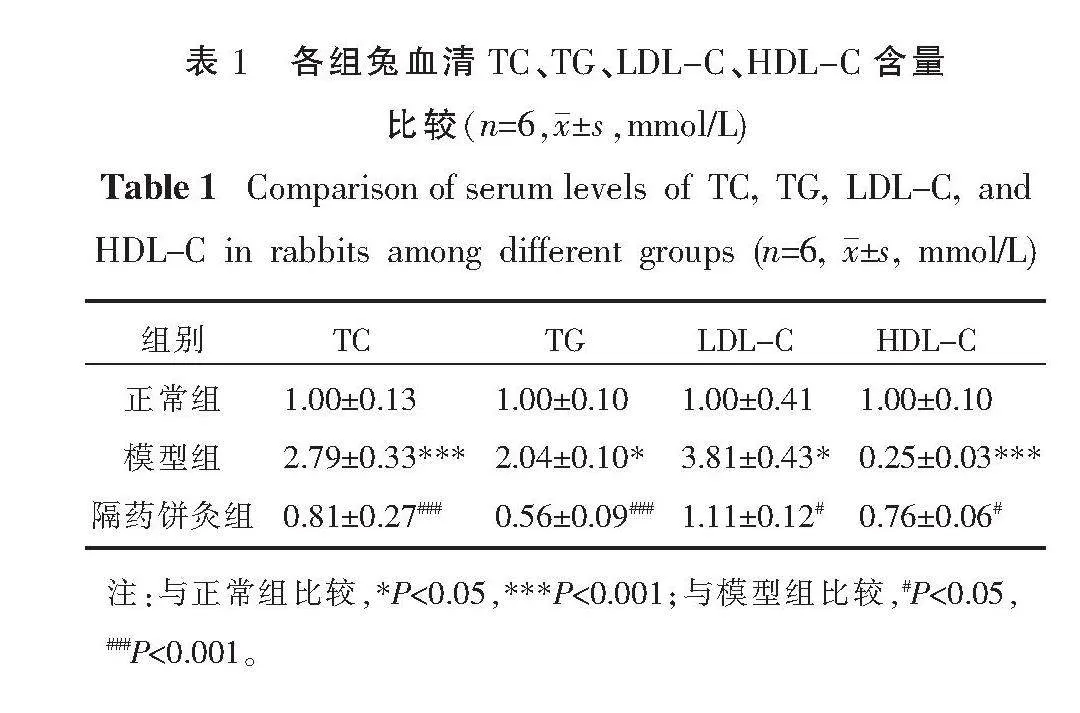
2.2 各组兔血清TC、TG、LDL-C、HDL-C含量变化
与正常组相比,模型组血清TC、TG、LDL-C含量均升高(P<0.05,P<0.001),HDL-C含量显著下降(P<0.001);与模型组相比,隔药饼灸组血清TC、TG、LDL-C含量均下降(P<0.05,P<0.001),HDL-C含量升高(P<0.05)。详见表1。
2.3 各组兔血清Ox-LDL、IFN-γ含量变化
与正常组相比,模型组兔血清Ox-LDL、IFN-γ含量均明显上升(P<0.001);与模型组相比,隔药饼灸组Ox-LDL、IFN-γ含量均下降(P<0.05,P<0.01)。详见表2。
3 讨论
AS是一种以脂质代谢失常为特征的慢性炎性动脉疾病,其病变过程涉及动脉内膜的脂质沉积、泡沫细胞积聚、炎性细胞浸润及粥样斑块形成。目前,AS模型建立的方法主要为单纯高脂饲料喂养,高脂饲料喂养引起的血脂水平异常是导致AS的主要因素[16]。兔在脂肪代谢和AS病变演化等方面与人类相似,通过表达血浆胆固醇酯转移蛋白(cholesteryl ester transfer protein,CETP),增加对胆固醇的敏感性,并且经高脂饲料喂养后可快速形成粥样斑块[17-18]。新西兰兔因其性格温顺,有较强的适应性、繁殖性及抗病力等特点,成为AS模型中最常用的模型动物。研究表明,AS模型制备成功的标准主要以血脂水平变化和病理形态学显示粥样斑块为主,而血脂指标主要包括TC、TG、LDL-C、HDL-C等[19-20]。本研究以新西兰兔为研究对象,采用高脂饲料喂养12周,其结果显示,与正常组比,模型组血清TC、TG、LDL-C均明显升高,HDL-C明显降低,HE染色见大量泡沫细胞和脂质斑块形成,提示AS模型制备成功。
脂质代谢紊乱是AS的主要病理基础,血脂异常是其最常见的危险因素,故目前AS的治疗手段主要以调节血脂为主。周莉等[21]发现,神阙透刺结合中药治疗可调整肥胖伴高脂血症患者的脂质代谢,具有减肥和降脂的双重作用。杨海艳[22]在治疗老年冠状AS性心脏病并高同型半胱氨酸的研究中发现,温针灸结合西药常规治疗可显著降低其血脂水平。徐驲等[23]通过研究发现,健脾化浊调脂颗粒可降低AS患者TC、TG、LDL-C水平,提高HDL-C水平,改善其血脂状态,发挥治疗AS的作用。本课题组前期研究表明,隔药饼灸能有效降低血清TC、TG、LDL-C等含量,升高HDL-C含量,调节血脂水平与脂质代谢,发挥抗AS的作用[11-12, 24]。本研究结果显示,与模型组比,隔药饼灸组TC、TG、LDL-C明显降低,HDL-C明显升高,与前期研究结果一致,表明隔药饼灸可通过调节血脂水平影响AS的发展。
泡沫细胞形成与聚集是AS病变的关键环节,泡沫细胞参与AS炎症反应和粥样斑块形成,促进AS的发展。研究发现,泡沫细胞的形成是巨噬细胞脂质摄取与流出的动态失衡而导致,这与Ox-LDL增加、胆固醇流出减少等因素密切相关[3]。Ox-LDL作为AS早期发病关键分子,经LDL在血管内皮下累积及其氧化修饰形成,与清道夫受体(scavenger receptors, SRS)结合增加单核细胞-内皮细胞黏附[25-26],加速巨噬细胞泡沫化[27]。凝集素样氧化低密度脂蛋白受体-1(lectin-like oxidized low-density lipoprotein receptor-1,LOX-1)是Ox-LDL在内皮细胞中的主要受体,Ox-LDL与LOX-1结合,介导细胞间黏附分子1、血管细胞黏附分子1等多种黏附分子和趋化因子的释放,促进巨噬细胞吞噬大量的Ox-LDL,使Ox-LDL在巨噬细胞累积,形成泡沫细胞[28-29]。研究发现,Ox-LDL与清道夫受体CD36结合,可激活丝裂原活化激酶1和丝裂原活化激酶2,上调CD36表达,进一步促进Ox-LDL的摄取,加速巨噬细胞向泡沫细胞分化[30]。
IFN-γ是一种与先天免疫和适应性免疫有关的关键细胞因子,由T细胞和巨噬细胞产生,已在AS患者的冠状动脉中检测到[31]。IFN-γ可增加趋化因子CXC配体16和清道夫受体A的表达,启动巨噬细胞产生趋化因子和细胞毒性分子,促进巨噬细胞摄取Ox-LDL形成泡沫细胞[32]。此外,研究发现,IFN-γ通过信号转导与转录激活因子1依赖性途径抑制ATP结合盒转运子A1表达[33],减少巨噬细胞载脂蛋白E合成[34],从而减少胆固醇流出。DONG等[35]证实,IFN-γ可减轻巨噬细胞中腺嘌呤核苷三磷酸结合盒亚家族G成员1介导的胆固醇外流,导致巨噬细胞中的胆固醇累积,促进泡沫细胞的生成。本研究结果发现,与正常组比,模型组血清Ox-LDL、IFN-γ显著上升;与模型组比,隔药饼灸组Ox-LDL、IFN-γ明显下降。这提示隔药饼灸可能通过降低AS血清Ox-LDL、IFN-γ的表达,减少巨噬细胞对Ox-LDL的摄取及细胞内胆固醇的累积,降低巨噬细胞内脂质堆积,抑制泡沫细胞形成,从而发挥抗AS的作用。
综上所述,隔药饼灸可调节AS血脂水平,可能通过降低AS兔血清Ox-LDL、IFN-γ含量,抑制泡沫细胞形成,缓解AS进程,发挥抗AS的作用。
参考文献
[1] GOLIA E, LIMONGELLI G, NATALE F, et al. Inflammation and cardiovascular disease: From pathogenesis to therapeutic target[J]. Current Atherosclerosis Reports, 2014, 16(9): 435.
[2] LISCO G, GIAGULLI V A, DE PERGOLA G, et al. The pathogenic role of foam cells in atherogenesis: Do they represent novel therapeutic targets?[J]. Endocrine, Metabolic & Immune Disorders Drug Targets, 2022, 22(7): 765-777.
[3] 刘子歌, 刘 洋, 宋国瑞, 等. 泡沫细胞在动脉粥样硬化形成过程中的作用研究进展[J]. 陕西医学杂志, 2020, 49(10): 1363-1366, 封3.
[4] LUSIS A J. Atherosclerosis[J]. Nature, 2000, 407(6801): 233-241.
[5] SHASHKIN P, DRAGULEV B, LEY K. Macrophage differentiation to foam cells[J]. Current Pharmaceutical Design, 2005, 11(23): 3061-3072.
[6] 李玉成, 杨 楠, 海鹏丽. 氧化低密度脂蛋白及脂联素在动脉粥样硬化中的作用研究进展[J]. 国际检验医学杂志, 2023, 44(19): 2402-2406.
[7] VOLOSHYNA I, LITTLEFIELD M J, REISS A B. Atherosclerosis and interferon-γ: New insights and therapeutic targets[J]. Trends in Cardiovascular Medicine, 2014, 24(1): 45-51.
[8] 张 艳, 宫丽鸿, 礼 海. 浅谈动脉粥样硬化的中医病因病机[J]. 时珍国医国药, 2010, 21(5): 1125-1126.
[9] 刘美之, 郎艳松, 张鑫月, 等. 从痰、瘀、毒论治动脉粥样硬化研究进展[J]. 中医杂志, 2014, 55(9): 800-803.
[10] 吴雪芬, 易丽贞, 刘 欣, 等. 隔药饼灸治疗动脉粥样硬化的研究进展[J]. 时珍国医国药, 2020, 31(3): 688-690.
[11] 严 洁, 常小荣, 岳增辉, 等. 隔药饼灸对高脂血症兔血脂含量的影响[J]. 中国中医药科技, 2004, 11(6): 358.
[12] 岳增辉, 何新群, 常小荣, 等. 隔药饼灸对动脉粥样硬化兔血清载脂蛋白A及载脂蛋白B水平的影响[J]. 中国中医药信息杂志, 2011, 18(9): 33-34.
[13] 岳增辉, 严 洁, 常小荣, 等. 隔药饼灸对兔高脂血症合并动脉粥样硬化血管内皮细胞粘附因子E选择素mRNA表达的影响[J]. 中国中医药信息杂志, 2006, 13(7): 37-39.
[14] 章海凤, 刘 密, 常小荣, 等. 隔药饼灸对动脉粥样硬化兔主动脉内皮细胞NF-κB及ICAM-1mRNA表达的影响[J]. 中华中医药杂志, 2013, 28(4): 914-917.
[15] 王园园, 龙民慧, 周磊磊, 等. 兔动脉粥样硬化动物模型的建立和评价[J]. 实验动物科学, 2008, 25(3): 18-21.
[16] 杨 静, 任 星, 杨巧宁, 等. 基于中国知网动脉粥样硬化动物实验的文献计量学分析[J]. 世界中医药, 2021, 16(23): 3539-3544.
[17] FERENCE B A, KASTELEIN J J P, GINSBERG H N, et al. Association of genetic variants related to CETP inhibitors and statins with lipoprotein levels and cardiovascular risk[J]. JAMA, 2017, 318(10): 947-956.
[18] PETHE?魻 G L, KEREKES A, MIH?魣LFFY M, et al. Disruption of the NOX5 gene aggravates atherosclerosis in rabbits[J]. Circulation Research, 2021, 128(9): 1320-1322.
[19] 张梦云, 严 光, 方文祥, 等. 高脂饲养兔和豚鼠建立动脉粥样硬化模型比较[J]. 中国临床保健杂志, 2015, 18(5): 503-506.
[20] 闫朝勃, 伍先明, 张 宁, 等. 艾灸对ApoE-/-动脉粥样硬化小鼠SIRT1/FOXO3a信号通路的影响[J]. 针刺研究, 2024, 49(4): 376-383.
[21] 周 莉, 史丹蕾. 神阙穴透刺结合中药治疗肥胖病伴高脂血症脾虚湿阻型的临床研究[J]. 上海医药, 2018, 39(8): 20-23.
[22] 杨海艳. 温针灸治疗老年冠状动脉粥样硬化性心脏病并高同型半胱氨酸的探讨[J]. 中国实用医药, 2020, 15(17): 153-155.
[23] 徐 驲, 李毅然, 黄浪浪, 等. 健脾化浊调脂颗粒调节肠道菌群紊乱治疗动脉粥样硬化的临床研究[J]. 中国中医药现代远程教育, 2023, 21(18): 47-49.
[24] 岳增辉, 何新群, 常小荣, 等. 隔药饼灸对动脉粥样硬化兔血脂的调节作用[J]. 中国中医药现代远程教育, 2011, 9(5): 47-48.
[25] 和晓莹, 秦智琦, 段 琦, 等. 氧化低密度脂蛋白激活PYHIN1/Caspase1炎症复合体信号通路增强主动脉内皮细胞黏附的机制研究[J]. 中国分子心脏病学杂志, 2021, 21(5): 4248-4252.
[26] WANG Z W, CHEN J, ZENG Z L, et al. The LOX-1 receptor ectopically expressed in the liver alleviates atherosclerosis by clearing Ox-LDL from the circulation[J]. Molecular Medicine, 2022, 28(1): 26.
[27] 张 强. Ox-LDL在动脉粥样硬化中的致病机制及检测方法研究进展[J]. 国际检验医学杂志, 2018, 39(19): 2432-2436.
[28] PLOTKIN J D, ELIAS M G, DELLINGER A L, et al. NF-κB inhibitors that prevent foam cell formation and atherosclerotic plaque accumulation[J]. Nanomedicine: Nanotechnology, Biology, and Medicine, 2017, 13(6): 2037-2048.
[29] FU Z W, ZHOU E C, WANG X, et al. Oxidized low-density lipoprotein-induced microparticles promote endothelial monocyte adhesion via intercellular adhesion molecule 1[J]. American Journal of Physiology Cell Physiology, 2017, 313(5): C567-C574.
[30] 刘庆艳. Interleukin-34对巨噬细胞源性泡沫细胞形成的调控研究[D]. 北京: 中国人民解放军医学院, 2017.
[31] RANJBARAN H, SOKOL S I, GALLO A, et al. An inflammatory pathway of IFN-gamma production in coronary atherosclerosis[J]. Journal of Immunology, 2007, 178(1): 592-604.
[32] WUTTGE D M, ZHOU X H, SHEIKINE Y, et al. CXCL16/SR-PSOX is an interferon-gamma-regulated chemokine and scavenger receptor expressed in atherosclerotic lesions[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2004, 24(4): 750-755.
[33] PANOUSIS C G, ZUCKERMAN S H. Interferon-gamma induces downregulation of Tangier disease gene (ATP-binding-cassette transporter 1) in macrophage-derived foam cells[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2000, 20(6): 1565-1571.
[34] BRAND K, MACKMAN N, CURTISS L K. Interferon-gamma inhibits macrophage apolipoprotein E production by posttranslational mechanisms[J]. The Journal of Clinical Investigation, 1993, 91(5): 2031-2039.
[35] DONG M Y, ZHANG Y, XU C B, et al. Interferon-γ decreases ATP-binding cassette subfamily G member 1-mediated cholesterol efflux through small ubiquitin-like modifier/ubiquitin-dependent liver X receptor-α degradation in macrophages[J]. Biotechnology and Applied Biochemistry, 2021, 68(6): 1412-1420.
本文引用: 易洪芬, 陈昕羽, 彭 涵, 肖孟霞, 欧阳里知, 刘红华, 刘迈兰. 隔药饼灸对动脉粥样硬化兔血清Ox-LDL、IFN-γ表达的影响[J]. 湖南中医药大学学报, 2024, 44(9): 1614-1619.
〔收稿日期〕2024-05-16
〔基金项目〕国家自然科学基金面上项目(82074559);湖南省青年科技创新人才项目(2022RC1222);湖南省中医药管理局一般课题(202206);长沙市杰出创新青年培养计划项目(kq1905036);湖南省教育厅优秀青年项目(22B0377)。
〔通信作者〕*刘迈兰,女,博士,教授,博士研究生导师,E-mail:445007305@qq.com;刘红华,女,博士,副教授,E-mail:735291123@qq.com。

