逍遥散及其拆方对Erastin诱导的LO-2肝细胞系铁死亡的影响

〔摘要〕 目的 探讨逍遥散及其拆方对Erastin诱导肝细胞铁死亡的影响及机制。方法 使用铁死亡诱导剂Erastin诱导肝细胞LO-2铁死亡,用逍遥散及各功效拆方(逍遥散去疏肝药组、逍遥散去健脾药组、逍遥散去养血药组)的含药血清进行干预,阳性对照药使用铁死亡抑制剂Ferrostatin-1。通过CCK-8检测细胞活力,ELISA法检测细胞上清液中谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase, AST)水平,比色法检测细胞中丙二醛(malondialdehyde, MDA)、还原型谷胱甘肽(reduced glutathione, GSH)、Fe2+等含量,荧光酶标仪检测脂质过氧化活性氧(reactive oxygen species, ROS),RT-PCR检测细胞中谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)、前列腺素内过氧化物合酶2(prostaglandin-endoperoxide synthase 2, PTGS2)、铁调素(hepcidin)、膜铁转运蛋白(ferroportin, FPN1)mRNA表达,Western blot检测细胞中骨形态发生蛋白6(bone morphogenetic protein 6, BMP6)、铁调素调节蛋白(hemojuvelin, HJV)、Smad同源物4(mothers against decapentaplegic homolog 4, SMAD4)蛋白表达。结果 erastin诱导肝细胞铁死亡后,细胞活力较对照组显著下降(P<0.05),细胞外上清液中ALT、AST含量显著上升(P<0.05),细胞中MDA、ROS、Fe2+、PTGS2与hepcidin mRNA表达及BMP6/HJV/Smad4信号通路蛋白显著上升(P<0.05),GSH含量及GPX4、FPN1 mRNA表达显著下降(P<0.05)。除逍遥散去养血药组在Smad4蛋白表达方面与模型组无显著差异(P>0.05),逍遥散及各功效拆方及阳性对照药Ferrostatin-1均能显著逆转上述指标的变化(P<0.05)。与整方组疗效比较,逍遥散去疏肝药组AST、MDA、GSH、ROS、Fe2+、BMP6、hepcidin、FPN1指标具有显著差异(P<0.05);除逍遥散去健脾药组在Smad4蛋白表达方面与整方组无显著差异(P>0.05),逍遥散去健脾药组及逍遥散去养血药组对所检测指标均有显著改善(P<0.05)。结论 逍遥散可抑制Erastin诱导的肝细胞铁死亡,其机制可能与调控 BMP6/HJV/SMAD4 信号通路及其下游 hepcidin-ferroportin 轴有关,而逍遥散各功效拆方均在一定程度上参与了逍遥散抑制肝细胞铁死亡的过程。
〔关键词〕 逍遥散;铁死亡;Erastin;hepcidin-ferroportin轴;BMP6/HJV/Smad4信号通路;丙二醛;过氧化活性氧
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.09.007
Effects of Xiaoyao Powder and its disassembled formulas on Erastin-induced ferroptosis in hepatocyte LO-2 cell line
CAO Mengxing1, LI Yong2, QUE Renye1
1. Department of Spleen and Stomach Diseases, Shanghai Hospital of Integrated Chinese and Western Medicines of Shanghai University of Chinese Medicine, Shanghai 200082, China; 2. Department of Spleen and Stomach Diseases, Shanghai Hospital of Chinese Medicine of Shanghai University of Chinese Medicine, Shanghai 200071, China
〔Abstract〕 Objective To explore the effects of Xiaoyao Powder and its disassembled formulas on Erastin-induced ferroptosis in hepatocytes and the related mechanism. Methods Ferroptosis of hepatocyte LO-2 was induced by Erastin and intervened by the medicated serum of Xiaoyao Powder and its disassembled formulas (Xiaoyao Powder without liver-soothing medicines, Xiaoyao Powder without spleen-strengthening medicines, Xiaoyao Powder without blood-nourishing medicines). Ferroptosis inhibitor Ferrostatin-1 was used as the positive control drug. The cell viability was evaluated by CCK-8. The levels of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) in the cell supernatant were examined by ELISA, and the content of malondialdehyde (MDA), reduced glutathione (GSH), and Fe2+ in the cells were determined by colorimetry. Fluorescence enzyme-linked immunosorbent assay was used to check lipid peroxidation-related reactive oxygen species (ROS), RT-PCR was used to examine the mRNA expressions of glutathione peroxidase 4 (GPX4), prostaglandin-endoperoxide synthase 2 (PTGS2), hepcidin, and ferroportin (FPN1) in the cells, and Western blot was used to check the expressions of bone morphogenetic protein 6 (BMP6), hemojuvelin (HJV), and mothers against decapentaplegic homolog 4 (Smad4) protein in the cells. Results After ferroptosis induced by Erastin, the viability of hepatocytes decreased significantly compared with the control group (P<0.05); the content of ALT and AST in the extracellular supernatant increased significantly (P<0.05); the contents of MDA, ROS, and Fe2+, the mRNA expressions of PTGS2 and hepcidin, and the protein level of BMP6/HJV/Smad4 signaling pathway in the cells increased significantly (P<0.05), while the content of GSH and the mRNA expressions of GPX4 and FPN1 decreased significantly (P<0.05). Except for the group of Xiaoyao Powder without blood-nourishing medicines showing no significant difference in Smad4 protein expression compared with the model group (P>0.05), groups of Xiaoyao Powder and its disassembled formulas, as well as the positive control drug Ferrostatin-1 showed significant reversed changes in the aforementioned indicators (P<0.05). There were significant differences in AST, MDA, GSH, ROS, Fe2+, BMP6, hepcidin and FPN1 between Xiaoyao Powder without liver-soothing medicines group and Xiaoyao Powder group (P<0.05). Compared with Xiaoyao Powder, the group of Xiaoyao Powder without spleen-strengthening medicines showed no significant difference in Smad4 protein expression (P>0.05), while both groups of Xiaoyao Powder without spleen-strengthening medicines and Xiaoyao Powder without blood-nourishing medicines showed significant differences in the detected indicators (P<0.05). Conclusion Xiaoyao Powder can inhibit Erastin-induced ferroptosis in hepatocytes, and its mechanism may be related to the regulation of BMP6/HJV/Smad4 signal pathway and its downstream hepcidin-ferroportin axis. To some extent, each disassembled formula of it involves in the process of inhibiting ferroptosis in hepatocytes.
〔Keywords〕 Xiaoyao Powder; ferroptosis; Erastin; hepcidin-ferroportin axis; BMP6/HJV/Smad4 signaling pathway; malondialdehyde; reactive oxygen species
铁在机体内参与细胞增殖、氧气运输和储存、DNA修复、维持造血功能、增强免疫等生理功能[1-2],是构成血红蛋白、肌红蛋白等许多蛋白质的主要成分,是人体不可缺少的微量元素之一。机体具有严格的铁调控机制来维持铁稳态,一般是通过食物吸收及循环铁来保证足量的铁发挥其生理效应,又能防止铁过量产生毒性[3]。肝脏是铁贮存主要场所之一,铁过载时会使细胞发生ATP水平降低、氧化应激损伤、溶酶体功能减退、细胞内钙稳态的破坏、DNA的损伤,最终导致肝细胞坏死。库普弗细胞可被肝脏过多的铁激活,将其内吞至细胞中,分泌细胞因子、ROS等活化肝星状细胞[4],导致细胞外基质的沉积,促使肝纤维化发生。
细胞内过多的铁可引起细胞损伤,在很长的一段时间内研究者们将铁过载引起的细胞死亡归因于氧化应激诱导的细胞坏死,而DIXON等[5]首次发现并报道了一种新型细胞死亡方式铁死亡(ferroptosis)后,为铁代谢紊乱疾病研究领域指引了新的方向。铁死亡是一种依赖于脂质过氧化反应驱动的非凋亡性细胞死亡方式,其发生过程需要细胞内富含可利用的铁。铁死亡是一个全新的细胞死亡模式,它在形态学、生物化学及遗传学方面与凋亡、焦亡、自噬等有着明显的不同。在形态学方面,发生铁死亡的细胞主要表现为线粒体体积缩小,双层膜密度增加,线粒体嵴减少或消失[5-6]。在生化方面,谷胱甘肽(reduced glutathione, GSH)耗竭,GPX4活性下降,脂质氧化物不能经GPX4催化的GSH还原反应代谢,继而二价铁离子以类似芬颌反应的方式氧化脂质产生大量过氧化活性氧(reactive oxygen species, ROS),促使细胞发生铁死亡[5-6]。
逍遥散出自《太平惠民和剂局方·卷九·治妇人诸疾》,具有疏肝、健脾、养血作用[7-8],临床上多用于治疗慢性肝脏疾病。方中柴胡顺肝之性,使之不郁[9],为君药。因肝藏血,肝血不足导致肝之疏泄功能失常,白芍收敛肝阴并养血柔肝体,柴胡配白芍而无伤阴之弊;当归能够养血和血,与白芍并用,可以增强补养阴血的功效,白芍、当归为臣药。柴胡、白芍、当归三药并用,达到补肝体而助肝用之效。方中薄荷可疏散肝经郁遏之气,透达肝经之郁热[10];茯苓及白术二味药均可健脾祛湿,恢复脾的运化功能,从而使气血生化有源;炙甘草益气和中,缓肝之急;煨生姜能辛散达3osNKEC6+2kflIroybfTBw==郁,五味药共为佐药。八药合用,相辅相成,使肝郁可舒,血虚可养,脾虚可复,神明可安[11],共奏疏肝解郁、健脾和营之效。铁代谢与血液形成有关,如《灵枢·决气》云:“中焦受气取汁,变化而赤,是谓血也。”《素问·六节脏象论篇》载:“肝……其充在筋,以生血气。”这些描述充分说明了脾胃主运化及肝主疏泄的作用在人体化生血液过程中的重要作用。肝主疏泄藏血,脾胃收纳水谷,赖肝气疏泄得以输布精微。脾胃与肝脏在铁的吸收转运及参与血液生成中都发挥极重要的作用,临床上一些患者因肝失疏泄,脾失运化,不能将铁通过血液循环转运至造血器官,沉积于肝脏导致纤维化的发生。故认为铁代谢紊乱原因之一是肝失疏泄、脾失运化,治疗上应着重“疏肝健脾”[12]。
逍遥散是临床上多用于治疗慢性肝脏疾病,具有疏肝健脾养血功效的方剂[12]。本课题组前期研究发现,恩替卡韦联合逍遥散治疗肝郁脾虚型乙型肝炎肝硬化患者的铁过载优于单用恩替卡韦[12]。本实验研究拟构建肝细胞铁死亡模型,观察逍遥散抑制铁死亡的效果及机制,以及逍遥散疏肝、健脾、养血3个功效发挥的作用。
1 材料与方法
1.1 细胞来源和试剂
LO-2细胞系购买于复旦大学IBS细胞库。丙二醛(malondialdehyde, MDA)(批号:A003-1-2)、还原型谷胱甘肽(reduced glutathione, GSH)比色法试剂盒(批号:A006-2-1)购自南京建成生物科技有限公司;辣根酶标记山羊抗鼠IgG(批号:GB23301)、辣根酶标记山羊抗兔IgG(批号:GB23303)购自赛维尔生物公司;β-actin抗体(Cell Signaling Technology公司,批号:4970S);RIPA裂解液(批号:P0013B)、PMSF蛋白酶抑制剂(批号:ST506)、1.5M Tris-HCl(pH8.8)(批号:ST789)、1.0M Tris-HCl(pH6.8)(批号:ST768)、10%SDS(批号:ST628)、四甲基乙二胺(批号:ST728)、Western blot一抗二抗稀释液(批号:P0023)、BCA蛋白浓度测定试剂盒(批号:P0009)、SDS-PAGE蛋白上样缓冲液(5×)(批号:P0015)、脱脂奶粉(批号:P0216)、超敏ECL化学发光试剂盒(批号:P0018S)均购自上海碧云天生物技术有限公司;PVDF膜(美国Millipore公司,批号:IPFL07810);DMEM培养基(江苏凯基生物科技有限公司,批号:KGM12800-500);逆转录试剂盒(日本Takara公司,批号:RR047A);去铁胺(上海源叶生物科技有限公司,批号:B70140)。
1.2 实验动物
清洁级雄性SD成年大鼠购于上海斯莱克实验动物有限责任公司[SCXK(沪)2013-0016],饲养于上海市中医医院动物房清洁级大鼠饲养室,饲养环境是恒温(25±2) ℃、湿度50%~80%,自由摄食、饮水。本动物实验遵循“实验动物关爱和使用指南”,已通过上海市中医医院实验中心动物实验伦理与福利委员会审核,伦理号:2020333。
1.3 含药血清制备
称取逍遥散(柴胡15 g、白芍15 g、当归15 g、白术15 g、茯苓15 g、甘草7.5 g),加水1 500 mL煮沸,保持沸腾20 min,加入薄荷和煨姜,继续煎煮10 min,煎煮液过5层纱布,滤液浓缩至2 g/mL(按生药量计),经冷冻干燥制成粉末,以蒸馏水配制成混悬液。逍遥散各拆方组按逍遥散去疏肝药组(去柴胡、薄荷)、逍遥散去养血药组(去当归、白芍)、逍遥散去健脾药组(去茯苓、白术、甘草) 混悬液制作方法同上。按大鼠体质量10 mL/kg灌胃给药,铁死亡抑制剂Ferrostatin-1用浓度为2.5 μmol/kg的水溶液(10 mL/kg)灌胃给药,对照组予灌胃等量蒸馏水。每天给药1次,连续7 d。实验期间自由摄食、饮水。末次给药24 h后,腹主动脉采血,以6 000 r/min×10 min冷冻离心,收集上清液,将收集好的血清于56 ℃水浴中灭活30 min,0.22 μm滤膜过滤灭菌,-80 ℃冻存备用。
1.4 细胞分组及干预
用含有10%热灭活胎牛血清的DMEM完全培养基在37 ℃、5% CO2完全饱和湿度条件下常规培养,每48 h更换培养基,细胞生长铺满培养瓶底80%后,用0.25%胰蛋白酶联合0.02% EDTA消化传代,实验选用对数生长期细胞。将LO-2细胞接种于细胞培养板中,分为对照组、模型组、逍遥散全方组、逍遥散去疏肝药组、逍遥散去健脾药组、逍遥散去养血药组、Ferrostatin-1组。对照组加DMEM完全培养基,模型组采用铁死亡诱导剂Erastin(5 μmol/L)进行造模,其他药物组添加相应药物进行干预,各组干预24 h后行相应指标检测。
1.5 检测指标及方法
1.5.1 肝细胞细胞活力、功能及铁死亡指标检测 使用CCK-8检测各组细胞活力;采用ELISA法检测各组细胞上清液中谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)的含量,使用比色法检测MDA、GSH含量,均按照试剂说明书操作进行。
1.5.2 脂质过氧化ROS检测 PBS充分清洗药物干预后的细胞,加入1 mL探针工作液充分覆盖细胞,于37 ℃避光孵育10 min,再用预热的PBS轻洗细胞3次;用10 μg/mL浓度的Hoechst 33342工作液1 mL充分覆盖细胞,于37 ℃避光孵育30 min,用预热的PBS轻洗细胞3次,加入2 mL/孔细胞培养液;置于荧光酶标仪或荧光显微镜,于激发波长为488~535 nm、发射波长610 nm检测荧光强度,ROS结果以荧光度值表示。
1.5.3 LO-2肝细胞BMP6/HJV/Smad4信号通路蛋白表达检测 使用PMSF的(强)RIPA裂解液提取细胞蛋白,BCA蛋白试剂盒检测蛋白含量。以SDS-PAGE凝胶进行电泳分离蛋白,并转移至0.45 μm孔径的PVDF膜。用脱脂奶粉与含TBST配制5%脱脂奶粉封闭液,条带浸没在封闭液中室温慢摇3 h。封闭完成后,用TBST漂洗3次,每次5 min,使用TBST配制适合浓度的一抗,将目标条带浸没于BMP6、HJV、Smad4、β-actin抗体中,4 ℃孵育过夜,用TBST漂洗。使用TBST配制适合浓度的HRP标记二抗,将目标条带浸于二抗中,避光室温慢摇孵育1 h。用TBST漂洗后,ECL显色液覆盖全膜,最后应用Bio-Rad ChemiDocTM XRS+系统与Image Lab软件曝光。
1.6 LO-2肝细胞GPX4、PTGS2及hepcidin-ferroportin轴mRNA表达检测
采用RT-PCR法检测:按步骤提取各组细胞总RNA,测各样本RNA浓度及纯度。在无核酸酶的离心管中每个样本加入1 μg RNA样本,5×g DNA digester Mix 2 μL,gDNA Eraser 1 μL, RNase freeH2O补足至10 μL,42 ℃水浴加热2 min;在上述10 μL体系中加入反转录试剂,反应条件:37 ℃,15 min,85 ℃,5 s,得到的 cDNA -20 ℃保存备用。然后进行荧光定量PCR实验,引物见表1。在无核酸酶的离心管中加入TB Green Premix Ex Taq 10 μL,加上下游引物各0.4 μL,加入第1步得到的cDNA模板2 μL,ddH2O补足至20 μL,混匀,实时上机检测。反应条件:95 ℃ 30 s预变性,95 ℃ 5 s变性,60 ℃ 30 s 退火,同时收集荧光,40个循环。用相对表达量=2-△△Ct公式分析计算各个组的表达情况。
1.7 统计学方法
采用Image J软件、SPSS 24.0软件进行统计学作图、分析,数据采用“x±s”表示,组间比较采用单因素方差分析,均采用双侧检验,P<0.05被认为差异有统计学意义。
2 结果
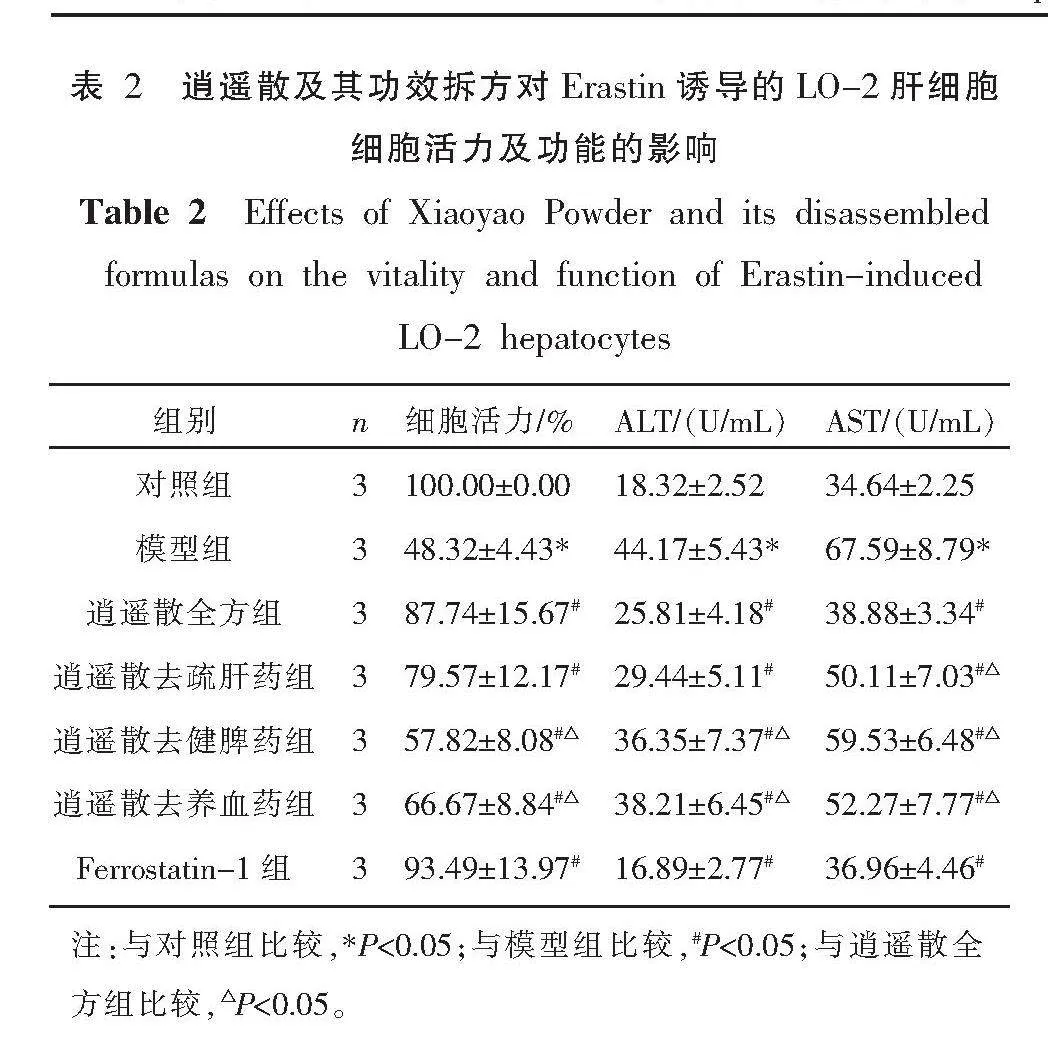
2.1 逍遥散及其功效拆方对Erastin诱导的LO-2肝细胞细胞活力及功能的影响
与对照组比较,模型组细胞活力显著下降,细胞外上清液中ALT、AST含量显著上升(P<0.05)。逍遥散全方及各拆方组干预后细胞活力显著上升,ALT、AST含量显著下降,阳性对照药物具有相似的作用(P<0.05)。与全方组比较,逍遥散去疏肝药组细胞活力和ALT指标无显著差异(P>0.05),AST显著降低(P<0.05);逍遥散去健脾药组和逍遥散去养血药组细胞活力、ALT、AST 3个指标疗效均显著降低(P<0.05)。详见表2。
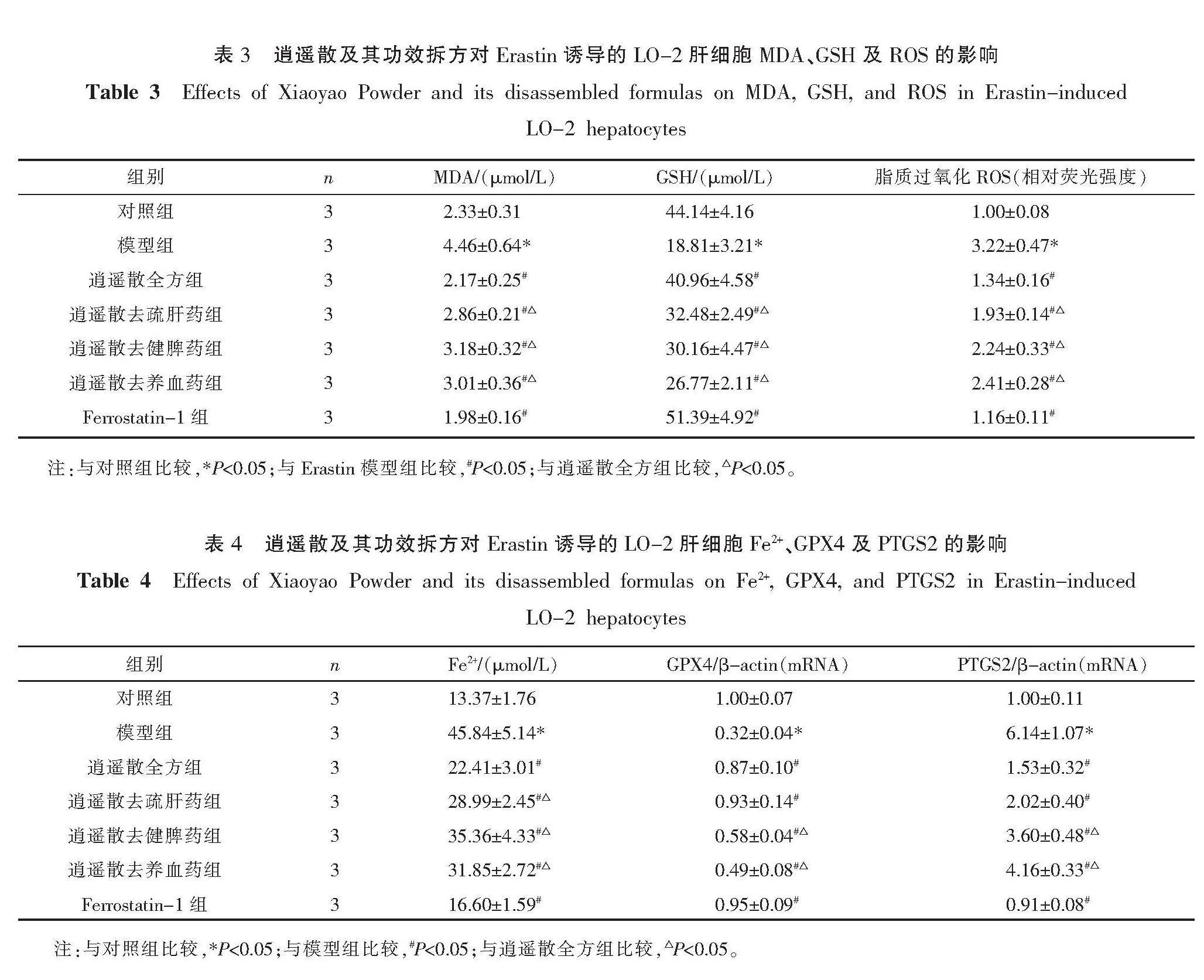
2.2 逍遥散及其功效拆方对Erastin诱导的LO-2肝细胞铁死亡的影响
相较于对照组,模型组细胞中MDA及ROS显著上升(P<0.05),GSH显著下降(P<0.05)。逍遥散全方及各拆方组干预后可显著降低细胞中MDA、ROS含量,提高GSH含量(P<0.05),阳性对照药物具有相似的作用(P<0.05)。与全方组比较,3个拆方组在改善MDA、ROS、GSH三者方面疗效均显著降低(P<0.05)。详见表3。
与对照组比较,模型组细胞中Fe2+含量及PTGS2 mRNA表达显著上升,GPX4 mRNA表达显著下降(P<0.05)。逍遥散全方及各拆方组干预后可显著降低细胞中Fe2+含量及PTGS2 mRNA表达显著下降,GPX4 mRNA表达显著上升,阳性对照药物具有相似的作用(P<0.05)。与全方组疗效比较,逍遥散去疏肝药组在改善Fe2+含量方面疗效降低(P<0.05),在改善PTGS2、GPX4 mRNA表达方面无显著差异(P>0.05);逍遥散去健脾药组与逍遥散去养血药组在改善Fe2+、GPX4及PTGS2三者方面疗效均显著降低(P<0.05)。详见表4。
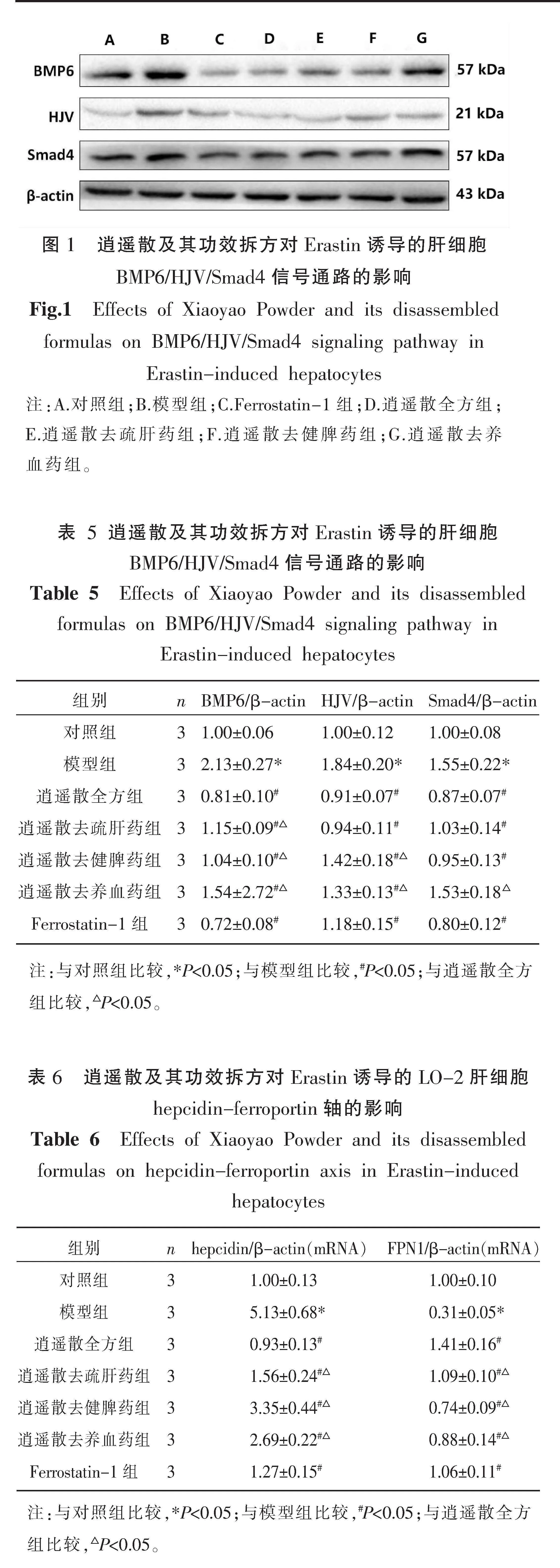
2.3 逍遥散及其功效拆方对Erastin诱导的LO-2肝细胞BMP6/HJV/Smad4信号通路的影响
相较于对照组,模型组细胞中BMP6/HJV/Smad4信号通路蛋白表达显著上升(P<0.05)。逍遥散全方组、逍遥散去疏肝药组、逍遥散去健脾药组及阳性对照药物干预后均可显著降低细胞中BMP6/HJV/Smad4信号通路蛋白表达(P<0.05),逍遥散去养血药组可显著减低细胞中BMP6、HJV蛋白表达(P<0.05),但对Smad4蛋白表达无显著影响(P>0.05)。与全方组比较,逍遥散去疏肝药组BMP6蛋白表达水平降低(P<0.05),对HJV及Smad4蛋白表达无显著差异(P>0.05);逍遥散去健脾药组BMP6、HJV蛋白表达水平降低(P<0.05),Smad4蛋白表达水平无显著性差异(P>0.05)。逍遥散去养血药组在改善BMP6/HJV/Smad4信号通路蛋白表达方面疗效均显著降低(P<0.05)。详见图1、表5。
2.4 逍遥散及其功效拆方对Erastin诱导的LO-2肝细胞hepcidin-ferroportin轴的影响
与对照组比较,模型组细胞中hepcidin mRNA表达显著上升,FPN1 mRNA表达显著下降(P<0.05)。逍遥散全方组及各拆方组干预后可显著降低细胞中hepcidin mRNA表达,提高FPN1 mRNA表达,阳性对照药物具有相似的作用(P<0.05)。与全方比较,3个拆方组在改善hepcidin-ferroportin mRNA表达方面疗效均显著降低(P<0.05)。详见表6。
3 讨论
在遗传学方面,对于铁死亡的发生及调控机制的研究尚处于起始阶段,铁死亡是多基因调控的。目前认为,细胞内Fe2+的蓄积及GPX4活性抑制是Lipid-ROS生成并诱导铁死亡发生的两个关键因素。HSC能摄取膜铁转运蛋白从库普弗细胞转运到细胞外的铁。通过细胞的转铁蛋白受体1(TfR1)连接含三价铁的转铁蛋白,将三价铁转化为HSC可储存的铁[13]。研究发现,大量的铁沉积于肝组织可形成HSC活化的外环境,会促进肝纤维化的发展,甚至导致肝硬化的发生[14]。Ferrostatin-1作为一种特异性铁死亡抑制剂,可通过抑制ROS蓄积降低脂质过氧化作用,保护Erastin诱导的铁死亡[15]。有研究发现,利用高铁蓄积的血色病小鼠模型发现高铁蓄积小鼠肝脏可发生显著的肝细胞铁死亡,而通过缺铁饲料或Ferrostatin-1清除铁死亡能明显改善肝纤维化等铁过载引发的病理损伤,提示铁过载可能是通过诱导肝细胞发生铁死亡进而活化肝星状细胞引起肝纤维化的发生[16],而抑制肝细胞铁死亡可逆转肝纤维化的进展[17]。
铁调素是肝细胞分泌的HAMP基因编码的肽类物质,铁调素在缺氧、炎症、铁过载等情况下可通过调节小肠对铁的吸收、巨噬细胞对铁的回收以及肝细胞对铁的储存来调节机体铁水平[18-19]。hepcidin与铁输出蛋白FPN1结合,诱导FPN1内化及降解作用,抑制FPN1向外转运细胞内铁,导致细胞内铁过载,并调节十二指肠对铁的吸收以及巨噬细胞对铁的循环再利用[12,20]。近年研究发现,hepcidin受很多因素的调节,如机体铁的营养状况、炎症、贫血和缺氧均可影响hepcidin的表达变化。其中研究最多且与肝脏关系较密切的有两条:即贫血,缺氧,铁过载通过BMP6/HJV/Smad4信号通路在肝脏实现调节hepcidin的表达;炎症通过IL-6/JAK2/STAT3信号通路在肝脏、巨噬细胞促进hepcidin的表达,同时BMP6/HJV/Smad4信号通路可以协同增强IL-6/JAK2/STAT3信号通路。
本研究提出假说逍遥散通过疏肝健脾功效抑制肝细胞铁死亡,机制可能与调控BMP6/HJV/Smad4及其下游hepcidin-ferroportin轴有关。因此,设置铁死亡抑制剂Ferrostatin-1为阳性对照药物,观察逍遥散及其拆方对肝细胞LO-2铁死亡的影响。实验结果表明,逍遥散可抑制LO-2肝细胞系的铁死亡,主要表现在降低Fe2+与铁死亡标志物MDA、ROS、PTGS2的含量,上调GSH含量及GPX4的表达,降低细胞脂质过氧化作用,缓解细胞铁死亡的发生。通过进一步检测铁过载通路BMP6/HJV/Smad4及hepcidin-ferroportin轴,发现逍遥散可以降低铁调素hepcidin及其上游通路BMP6/HJV/Smad4的表达,上调膜铁转运蛋白ferroportin的含量,从而促进机体对铁的回收与储存来减轻铁过载。通过拆方实验,将逍遥散拆分为逍遥散去疏肝药、逍遥散去养血药以及逍遥散去健脾药3组,发现与逍遥散全方疗效相比,逍遥散去疏肝药、逍遥散去健脾药及逍遥散去养血药在改善肝细胞活力、功能及铁死亡方面均有明显差异,如逍遥散去健脾药在改善Erastin诱导的肝细胞细胞活力及功能下降的疗效,低于逍遥散全方;逍遥散去养血药在改善铁死亡标志物MDA、ROS、GSH、PTGS2、GPX4及Fe2+含量的疗效,低于逍遥散全方;逍遥散去疏肝药在改善铁死亡通路蛋白BMP6及hepcidin-ferroportin的表达,低于逍遥散全方。说明逍遥散全方无论去除疏肝药、养血药或健脾药均对其抑制肝细胞铁死亡的疗效有影响,提示逍遥散疏肝、养血以及健脾的功效都参与了机体铁代谢的平衡。
逍遥散调控铁过载通路BMP6/HJV/Smad4及其下游hepcidin-ferroportin轴,抑制肝细胞铁死亡,其疏肝、养血、健脾功效均参与了这个过程,为探索逍遥散治疗肝病提供了新的靶点和思路。课题组前期研究发现,在改善肝郁脾虚型乙肝肝硬化患者肝纤维化方面,逍遥散联合恩替卡韦疗效优于单用恩替卡韦,联合用药改善患者铁过载水平[12]。逍遥散可改善慢性铁过载诱导的大鼠肝纤维化,方中疏肝药、健脾药、养血药均对改善铁过载及肝纤维化有一定作用[21]。但逍遥散治疗肝纤维化的分子机制仍需进一步研究。本次研究结果不仅完善了逍遥散组方功效的理论认知,更为逍遥散调节机体铁代谢提供了实验基础,为中药复方的临床使用提供了基础医学的理论依据。
综上所述,逍遥散可抑制Erastin诱导的肝细胞铁死亡,其机制可能与调控BMP6/HJV/Smad4信号通路及其下游hepcidin-ferroportin轴有关,而逍遥散各功效拆方均在一定程度上参与了逍遥散抑制肝细胞铁死亡的过程。
参考文献
[1] RAMOS-ALONSO L, WITTMAACK N, MULET I, et al. Molecular strategies to increase yeast iron accumulation and resistance[J]. Metallomics: Integrated Biometal Science, 2018, 10(9): 1245-1256.
[2] GANZ T, NEMETH E. Iron homeostasis in host defence and inflammation[J]. Nature Reviews Immunology, 2015, 15(8): 500-510.
[3] 林鹏展, 田 菲, 张 林, 等.中医药干预铁死亡机制的研究进展[J]. 湖南中医药大学学报, 2021, 41(2): 318-322.
[4] ANDERSON E R, SHAH Y M. Iron homeostasis in the liver[J]. Comprehensive Physiology, 2013, 3(1): 315-330.
[5] DIXON S J, LEMBERG K M, LAMPRECHT M R, et al. Ferroptosis: An iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5):1060-1072.
[6] GAO M H, MONIAN P, JIANG X J. Metabolism and iron signaling in ferroptotic cell death[J]. Oncotarget, 2015, 6(34): 35145-35146.
[7] 甄雪燕, 代逸丹, 赵 歆. 从明代文献看逍遥散的发展[J]. 中医学报, 2022, 37(9): 2020-2026.
[8] 李卓娴, 徐丽静, 夏 猛. 逍遥散类方治疗肝癌的研究进展[J]. 环球中医药, 2022, 15(8): 1491-1496.
[9] 杨婧雯, 苗 香, 梁文青, 等. 逍遥散治郁证辨析[J]. 中国中医基础医学杂志, 2023, 29(1): 52-55.
[10] 李 萌, 祁向争, 周 月. 逍遥散及其化裁方治疗慢性胃炎临床研究进展[J]. 中国民族民间医药, 2023, 32(17): 65-69.
[11] 葛冰景, 肖铁刚, 周 薏, 等. 逍遥散联合恩替卡韦治疗肝郁脾虚型乙肝后肝硬化代偿期30例临床研究[J]. 江苏中医药,2020, 52(11): 28-31.
[12] 葛冰景, 周 薏, 肖铁刚, 等. 逍遥散联合恩替卡韦对肝郁脾虚型乙型肝炎肝硬化代偿期患者纤维化及铁代谢的影响[J]. 湖南中医药大学学报, 2021, 41(2): 296-302.
[13] 江 远, 张 玲, 钟肖英, 等. 铁沉积对大鼠肝纤维化影响的机制研究[J]. 实用肝脏病杂志, 2015, 18(2): 173-177.
[14] ANGELI J P F, PRONETH B, HAMMOND V J, et al. Inactivation of the ferroptosis regulator Gpx4 triggers acute renal failure in a therapeutically relevant mechanism[J]. Free Radical Biology and Medicine, 2014, 76: S77-S78.
[15] 陈 浩, 李小枫, 王 华. 铁死亡调控肝纤维化中的作用机制研究进展[J]. 药学学报, 2021, 56(11): 2916-2922.
[16] WANG H, AN P, XIE E J, et al. Characterization of Ferroptosis in Murine Models of Hemochromatosis[J]. Hepatology, 2017, 66(2): 449-465.
[17] WU A M, FENG B, YU J, et al. Fibroblast growth factor 21 attenuates iron overload-induced liver injury and fibrosis by inhibiting ferroptosis[J]. Redox Biology, 2021, 46: 102131.
[18] VIATTE L, VAULONT S. Hepcidin, the iron watcher[J]. Biochi?鄄
mie, 2009, 91(10): 1223-1228.
[19] 李余佳, 王 玲, 金 春, 等. 铁死亡的调控机制及其在肝疾病中的作用研究进展[J]. 中国药理学与毒理学杂志, 2019, 33(4): 307-31.
[20] 刘玉洁, 耿 惠. 铁调素受体-膜铁转运蛋白的研究进展[J]. 重庆医学, 2016, 45(8): 1110-1113.
[21] 周 薏, 葛冰景, 肖铁刚, 等. 逍遥散及其功效拆方对慢性铁过载诱导的肝纤维化的影响[J]. 云南中医学院学报, 2021, 44(1): 17-23, 41.
本文引用: 曹梦醒, 李 勇, 阙任烨. 逍遥散及其拆方对Erastin诱导的LO-2肝细胞系铁死亡的影响[J]. 湖南中医药大学学报, 2024, 44(9): 1601-1607.
〔收稿日期〕2023-07-10
〔基金项目〕国家自然科学基金项目(81873157,81573775);上海市科学技术委员会科研计划项目(19YF1445200);上海市虹口区卫生健康委员会中医药科研基金项目(HKQGYQY-ZYY-2022-08)。
〔通信作者〕*阙任烨,男,博士,主治医师,E-mail:824492@qq.com。

