黄芪甲苷调控Nrf2/HO-1信号通路对血管内皮细胞氧化损伤的影响




〔摘要〕 目的 基于细胞实验研究黄芪甲苷(astragaloside Ⅳ, AST-Ⅳ)调控核转录因子红系2相关因子2/血红素加氧酶-1(nuclear factor-erythroid 2-related factor 2/heme oxygenase-1, Nrf2/HO-1)信号通路对血管内皮氧化损伤的影响。方法 采用1-棕榈酰基-2-(5'-氧-戊酰基)-sn-甘油-3-磷酸胆碱[1-palmitoyl-2-(5-oxovaleroyl)-sn-glycero-3-phosphocholine, POVPC]刺激血管内皮细胞24 h建立血管内皮细胞氧化损伤模型,随机分为模型(Model)组(35 μmol/L POVPC)、AST-Ⅳ低剂量(AST-L)组(35 μmol/L POVPC+50 μmol/L AST-Ⅳ)、AST-Ⅳ高剂量(AST-H)组(35 μmol/L POVPC+100 μmol/L AST-Ⅳ)及AST-Ⅳ高剂量+ML385(Nrf2抑制剂)(AST-H+ML385)组(35 μmol/L POVPC+100 μmol/L AST-Ⅳ+5 μmol/L ML385),以正常未处理细胞作为对照(Control)组。免疫荧光鉴定大鼠胸主动脉内皮细胞(aortic vascular endothelium cell, AVEC),CCK-8检测AST-Ⅳ细胞增殖情况,Transwell小室检测AVEC迁移情况,Matrigel基质胶检测细胞血管形成功能,鬼笔环肽染色检测细胞骨架结构,DCFH-DA荧光探针检测细胞活性氧(reactive oxygen species, ROS)水平,试剂盒法检测细胞培养上清液中超氧化物歧化酶(superoxide dismutase, SOD)水平,RT-qPCR和Western blot检测Nrf2和HO-1的 mRNA及蛋白表达情况。结果 免疫荧光鉴定所提取的细胞,可特异性表达血管性血友病因子(von willebrand factor, vWF),鉴定为AVEC。与Control组相比,Model组细胞活力、迁移能力和血管形成功能显著下降(P<0.01),细胞骨架破坏明显,细胞内ROS水平显著上升(P<0.01),细胞培养上清液中SOD含量显著减少(P<0.01),细胞中Nrf2和HO-1的mRNA及蛋白表达水平下调(P<0.01或P<0.05)。与Model组比较,AST-L组及AST-H组细胞活力、迁移能力和血管形成功能显著升高(P<0.01),细胞骨架破坏得到较好修复,细胞内ROS水平显著下降(P<0.01),细胞培养上清液中SOD含量显著增加(P<0.01),细胞中Nrf2和HO-1的mRNA及蛋白表达水平显著上调(P<0.01),且以AST-H组效果更为显著(P<0.01)。与AST-H组比较,AST-H+ML385组迁移能力和血管形成功能显著下降(P<0.01),细胞骨架破坏增加,细胞内ROS水平显著上升(P<0.01),细胞培养上清液中SOD含量显著减少(P<0.01),细胞中Nrf2和HO-1的mRNA及蛋白表达水平显著下调(P<0.01)。结论 AST对血管内皮氧化损伤具有保护作用,且有一定的剂量依赖性,其机制可能是通过激活Nrf2/HO-1信号通路发挥作用。
〔关键词〕 心血管疾病;黄芪甲苷;Nrf2/HO-1信号通路;氧化损伤;血管内皮细胞
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.09.006
Effects of astragaloside Ⅳ on oxidative damage of vascular endothelial cells by regulating Nrf2/HO-1 signaling pathway
TAN Wei1,2, FU Xinying1,2, YANG Renyi1,2, MA Lu1,2, DING Huang1,2, LIU Xiaodan1,2, ZHANG Wei1,2*
1. School of Integrated Chinese and Western Medicine, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Hunan Key Laboratory of Integrated Chinese and Western Medicine for Prevention and Treatment of Heart and
Brain Diseases, Changsha, Hunan 410208, China
〔Abstract〕 Objective To explore the effects of astragaloside Ⅳ (AST-Ⅳ) on vascular endothelial oxidative damage by modulating the nuclear factor-erythroid 2-related factor 2/heme oxygenase-1 (Nrf2/HO-1) signaling pathway, based on cell experiments. Methods An endothelial cell oxidative damage model was established by stimulating vascular endothelial cells with 1-palmitoyl-2-(5-oxovaleroyl)-sn-glycero-3-phosphocholine (POVPC) for 24 hours. The cells were randomly divided into model group (35 μmol/L POVPC), low-dose AST-Ⅳ (AST-L) group (35 μmol/L POVPC+50 μmol/L AST-Ⅳ), high-dose AST-Ⅳ (AST-H) group (35 μmol/L POVPC+100 μmol/L AST-Ⅳ), and high-dose AST-Ⅳ+ ML385 (Nrf2 inhibitor) (AST-H+ML385) group (35 μmol/L POVPC+100 μmol/L AST-Ⅳ+5 μmol/L ML385). Untreated normal cells were used as the control group. Rat aortic vascular endothelium cells (AVECs) were identified by immunofluorescence. The proliferation of AST-Ⅳ cells was tested by CCK-8 assay. Transwell chambers were utilized to evaluate AVEC migration, while Matrigel matrix gel was employed to assess angiogenic function of the cells. The cytoskeletal structure was determined by phalloidin staining, reactive oxygen species (ROS) levels were measured by the DCFH-DA fluorescence probe, and superoxide dismutase (SOD) levels in cell culture supernatants were measured by kit method. The mRNA and protein expressions of Nrf2 and HO-1 were determined by RT-qPCR and Western blot. Results The expression of extracted cell surface marker von willebrand factor (vWF) was determined by immunofluorescence and was identified as AVEC. Compared with control group, the cell viability, migration ability, and angiogenic function in Model group decreased significantly (P<0.01), with obvious cytoskeleton disruption, a significant increase in intracellular ROS level (P<0.01), a significant decrease in SOD content in the cell culture supernatant (P<0.01), and downregulated mRNA and protein expression levels of Nrf2 and HO-1 in cells (P<0.01 or P<0.05). Compared with model group, AST-L group and AST-H group showed significantly increased cell viability, migration ability, and angiogenic function (P<0.01), with better repair of cytoskeleton disruption, a significant decrease in intracellular ROS level (P<0.01), a significant increase in SOD content in the cell culture supernatant (P<0.01), and significantly upregulated mRNA and protein expression levels of Nrf2 and HO-1 in cells (P<0.01), with more pronounced effects in AST-H group (P<0.01). Compared with AST-H group, AST-H+ML385 group showed significantly decreased migration ability and angiogenic function (P<0.01), increased cytoskeleton disruption, a significant increase in intracellular ROS level (P<0.01), a significant decrease in SOD content in the cell culture supernatant (P<0.01), and significantly downregulated mRNA and protein expression levels of Nrf2 and HO-1 in cells (P<0.01). Conclusion AST has protective effects on vascular endothelial oxidative damage, with a certain dose dependence, and its mechanism may involve the activation of Nrf2/HO-1 signaling pathway.
〔Keywords〕 cardiovascular disease; astragaloside Ⅳ; Nrf2/HO-1 signaling pathway; oxidative damage; vascular endothelial cell
心血管疾病(cardiovascular disease, CVD)是医疗领域的棘手问题,其死亡率在我国城乡居民疾病死亡构成比中占据首位[1]。研究发现,引起CVD发生发展的病理因素众多,发病机制复杂,其中,血管内皮损伤是CVD的始动因素与共同病理基础,可引发血液流变学及血液动力学异常,引起糖尿病、高血压和动脉粥样硬化(atherosclerosis, AS)等疾病,推动心血管危机事件的发生[2-4]。血管内皮细胞(vascular endothelial cell, VEC)是血管内皮的主要组成部分,当氧化还原平衡被破坏时,抗氧化物质超氧化物歧化酶(superoxide dismutase, SOD)消耗,引起活性氧(reactive oxygen species, ROS)大量累积,最终导致血管内皮氧化损伤,进而推进CVD的发生发展[5]。1-棕榈酰基-2-(5'-氧-戊酰基)-sn-甘油-3-磷酸胆碱[1-palmitoyl-2-(5-oxovaleroyl)-sn-glycero-3-phosphocholine, POVPC]是氧化低密度脂蛋白中参与AS发生发展的一种重要氧化磷脂,可激活内皮细胞,诱导炎症反应,破坏内皮功能,因其生物活性稳定,被广泛应用于CVD相关研究中[6-7]。核转录因子红系2相关因子2/血红素加氧酶-1(nuclear factor-erythroid 2-related factor 2/heme oxygenase-1, Nrf2/HO-1)是心血管系统中调控氧化应激反应的重要通路,具有抗氧化、抗炎、减少细胞凋亡和抑制血管钙化等作用,能够抑制ROS的产生,减少SOD的消耗,进而抑制氧化损伤,延缓CVD的发生发展[8-10]。课题组前期研究结果表明,补阳还五汤苷类组分具有减轻炎症反应,保护血管内皮的作用[11-12]。黄芪是补阳还五汤发挥心脑血管效应的主要药物,而黄芪甲苷(astragaloside Ⅳ, AST-Ⅳ)是黄芪的主要药效物质[12]。同时,有研究证明AST-Ⅳ具有抗炎、抗氧化的功效[13-14]。因此,我们推测AST-Ⅳ也能发挥复方的相关作用,如抑制VEC氧化损伤,保护VEC。
本研究通过POVPC诱导主动脉血管内皮细胞(aortic vascular endothelium cell, AVEC)建立细胞氧化损伤模型,以Nrf2/HO-1信号通路为靶点,探究AST-Ⅳ对血管内皮氧化损伤的保护作用。
1 材料
1.1 动物
SPF级8周龄雄性SD大鼠2只,购自湖南斯莱克景达实验动物有限公司,大鼠体质量200~250 g,饲养于湖南中医药大学SPF级屏障系统,使用标准动物饲料喂养,温度为恒温(25±2) ℃,室内明暗周期为12 h一循环。动物实验过程均符合伦理学要求,动物生产许可证号:SCXK(湘)2019-0004。本研究通过湖南中医药大学动物实验中心伦理审查(审批号:LL2022072703)。
1.2 主要试剂
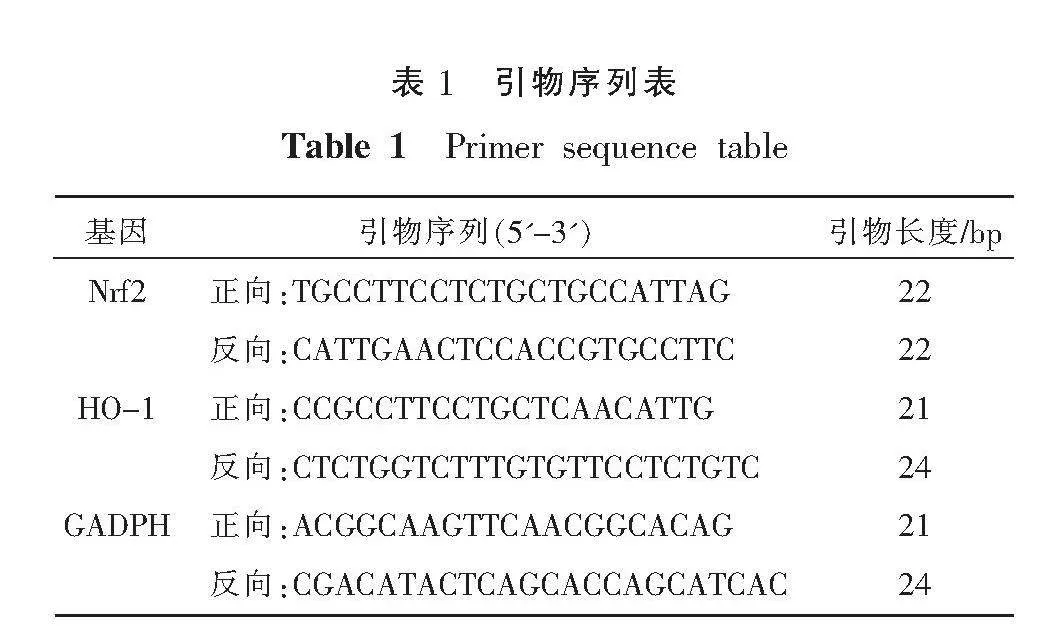
AST-Ⅳ(成都埃法生物科技有限公司,批号:84687-43-4);DEM/F12、PBS缓冲液、胎牛血清(武汉普诺赛生命科技有限公司,批号:WHB823G041、WHB823P091、SA230608);ML385(美国MedChemexpress公司,批号:24435);POVPC、CCK-8检测试剂盒(美国APE-BIO公司,批号:C360111346294、货号:K1018);ROS测定试剂盒、罗丹明标记鬼笔环肽、DAPI溶液、抗荧光衰减封片剂、(北京索莱宝科技有限公司,批号:2307002、A426D011、2308001、20220224);结晶紫染色液(北京索莱宝科技有限公司,货号:CA1610);总SOD测试盒(羟胺法)(南京建成生物有限公司,货号:A000-1-1);Matrigel基质胶、Transwell小室(美国康宁公司,货号:356234、3422);Nrf2(武汉三鹰生物技术有限公司,批号:16396-1-AP);HO-1(成都正能生物技术有限责任公司,货号:R24541);兔抗血管性血友病因子(von willebrand factor, vWF)多克隆抗体(北京博奥森生物技术有限公司,批号:BS-0586R);FITC标记山羊抗兔IgG(H+L)(武汉三鹰生物技术有限公司,货号:SA00003-2)。
1.3 主要仪器
CO2培养箱(美国赛默飞公司,型号:3427);超净工作台(苏州安泰技术有限公司,型号:SW-CJ-1FD);倒置荧光显微镜、正置荧光显微镜(德国Zeiss公司,型号:Axio Vert.A1、Axio scope 5);全景扫描仪(匈利亚3D HISTECH公司,型号:Pannoramic MIDI);电泳槽、转印槽、多功能酶标成像系统仪、Gel DocXR+凝胶成像系统(美国Bio-Rad公司,型号:1658001、1703930、Cytation3、Chemi DocTM XRS+)。
2 方法
2.1 AVEC的提取与鉴定
参照前期研究方法[15],选用SD大鼠,分离其胸主动脉,提取培养AVEC。将分离的AVEC使用DMEM/F12(含10%胎牛血清、1%链霉素、1%青霉素)完全培养基培养,并且使用免疫荧光法鉴定细胞表面标志物vWF的表达。将AVEC加入含玻璃片的24孔板中生长24 h,使用4%多聚甲醛将处于对数生长期的AVEC固定。PBS缓冲液清洗后加入vWF(1:200),室温孵育2 h。待孵育结束后PBS清洗3次,加入荧光二抗(1∶200)室温孵育1 h。爬片清洗后进行DAPI核染,抗荧光淬灭封片剂封片,荧光显微镜观察。
2.2 AVEC氧化损伤模型建立、分组及给药
选择3~6代生长良好的AVEC进行实验。根据以往研究结果[16],选择POVPC 35 μmol/L构建内皮细胞氧化损伤模型。参照AST-Ⅳ毒性实验选择合适的作用浓度,ML385采用5 μmol/L[17]作为干预浓度。将对数生长期的AVEC随机分为对照(Control)组、模型组(Model组,35 μmol/L POVPC)、AST-Ⅳ低剂量组(AST-L组,35 μmol/L POVPC+50 μmol/L AST-Ⅳ)、AST-Ⅳ高剂量组(AST-H组,35 μmol/L POVPC+100 μmol/L AST-Ⅳ)和AST-Ⅳ高剂量+ ML385组(AST-H+ML385组,35 μmol/L POVPC+100 μmol/L AST-Ⅳ+5 μmol/L ML385)。培养24 h后,收集细胞及其上清液用于后续实验研究。
2.3 CCK-8法检测AST-Ⅳ毒性与给药后细胞增殖情况
将2~6代处于对数生长期的AVEC用胰酶消化,终止消化后接种于96孔板中,细胞密度约为1×106个/mL,每孔接种细胞悬液100 μL,置于37 ℃、5% CO2培养箱中培养24 h。细胞加药处理,培养24 h后,每孔加入1% CCK-8溶液100 μL,放置于培养箱中避光培养30~60 min,酶标仪测定450 nm处的吸光度(A)。细胞存活率=(A实验组-A空白组)/(A对照组-A空白组)×100%。
2.4 Transwell小室测定AVEC迁移能力
将对数生长期的AVEC用胰酶消化,接种于24孔板中培养24 h。AVEC加药处理后,用胰酶消化。终止消化后800 r/min离心5 min(离心半径为16 cm)。使用无血清培养基重悬,调整密度为1×106个/mL,取100 μL接种于小室上室。在24孔板下室中加入600 μL含15% FBS的完全培养基,放入培养箱中培养24 h。取出小室,弃去培养基,用棉签轻轻擦拭上室。取新的24孔板加入600 μL 4%多聚甲醛固定液,将小室放入后固定20 min。弃固定液,0.2%结晶紫染色10 min,PBS清洗3次,风干后随机选择5个视野进行镜检。
2.5 Matrigel基质胶成管实验测定AVEC血管形成功能
将Matrigel基质胶提前放置于4 ℃融化,加入至提前预冷的96孔板中,每孔50 μL。放置于培养箱中凝固。AVEC分组处理后,培养24 h,用胰酶消化。终止消化后800 r/min离心5 min(离心半径为16 cm),使用无血清培养基重悬,调整密度为1×106个/mL。将细胞悬液加入配制好的Matrigel胶上(100 μL/孔,1×105个细胞),放入细胞培养箱中培养4~8 h,显微镜观察、拍照。采用Image J进行图像分析,每张图像取相同放大倍数视野,计数血管形成的节点、网格数目、血管总长度、血管分支长度,并进行统计分析。
2.6 荧光显微镜观察AVEC骨架形态
将AVEC接种于含细胞爬片的24孔板中,细胞密度约为1×105个/mL,每孔接种细胞悬液500 μL,放入培养箱培养24 h。AVEC加药处理后,培养24 h,PBS清洗1次。加入4%多聚甲醛固定20 min。3%BSA(PBS配制)封闭30 min,加入配制好的鬼笔环肽(1∶500)300 μL(3% BSA配制),室温孵育30 min。PBS 清洗3次,DAPI染核6 min,PBS清洗3次后,抗荧光衰减封片剂封片,荧光显微镜下观察细胞骨架形态、纤维丝排列情况、结构是否断裂缺失等。
2.7 DCFH-DA荧光探针检测细胞ROS水平
将AVEC用胰酶消化,终止消化后接种于24孔板中,细胞密度约为1×105个/mL,每孔接种细胞悬液500 μL,放入培养箱培养24 h。AVEC加药处理后,培养24 h,加入DCFH-DA探针应用液(300 μL/孔,1∶1 000)。置于培养箱中孵育30 min,避光,弃去培养液,无血清培养基清洗3次,荧光显微镜观察检测,采用Image J软件,测定相同面积下的荧光强度,以平均荧光强度定量细胞内ROS水平。
2.8 试剂盒法检测AVEC培养液中SOD水平
细胞加药处理后,收集细胞培养上清液,按试剂盒说明书步骤配制试剂及应用液。将细胞培养上清液加入96孔板中,与相应试剂用旋涡混匀器充分混匀,置37 ℃恒温水浴40 min。加入显色液混匀,室温放置10 min,酶标仪测定波长550 nm处的吸光度,计算上清液中SOD的含量。
2.9 RT-qPCR检测Nrf2和HO-1 mRNA表达水平
AVEC加药处理后,培养24 h,使用总RNA试剂盒从细胞中提取总RNA,逆转录合成cDNA,随后进行PCR扩增。反应条件按试剂盒的操作说明进行。内参使用GAPDH,数据分析采用2-ΔΔCt法。各基因及其内参的扩增引物序列由上海生工生物有限公司合成。详见表1。
2.10 Western blot法检测细胞内相关蛋白表达水平
收集处理后的细胞,用BCA法测定浓度后,加入上样缓冲液,金属浴15 min变性,储存于4 ℃备用。配制10%的分离胶和5%的浓缩胶,浓缩胶恒压60 V,当蛋白电泳至分离胶位置,更改电压为80 V电泳,待溴酚蓝电泳至下端2~5 mm时结束电泳,200 mA恒流转膜一定时间。5%脱脂奶粉室温封闭1 h,TBST洗3次,每次10 min。一抗 HO-1(1∶600)、Nrf2(1∶2 000)4 ℃孵育过夜。TBST洗3次,每次10 min。二抗(1∶8 000)37 ℃孵育1 h 后,再用TBST洗 3次,每次10 min。加入ECL发光液,使用数码成像发光仪曝光显影。采用Image J软件分析条带灰度。以β-actin作为内参,目的蛋白与内参蛋白的比值作为蛋白相对表达量。
2.11 统计学分析
实验数据使用SPSS 23.0软件进行统计,计量资料以“x±s”表示,若满足正态性、方差齐性则采用单因素方差分析LSD法检验进行组间比较;方差不齐时,采用Dunnett T3检验。P<0.05表示差异具有统计学意义。
3 结果
3.1 大鼠AVEC鉴定
免疫荧光结果显示,所提取的细胞可特异性表达vWF,显示绿色荧光,鉴定为AVEC。详见图1。
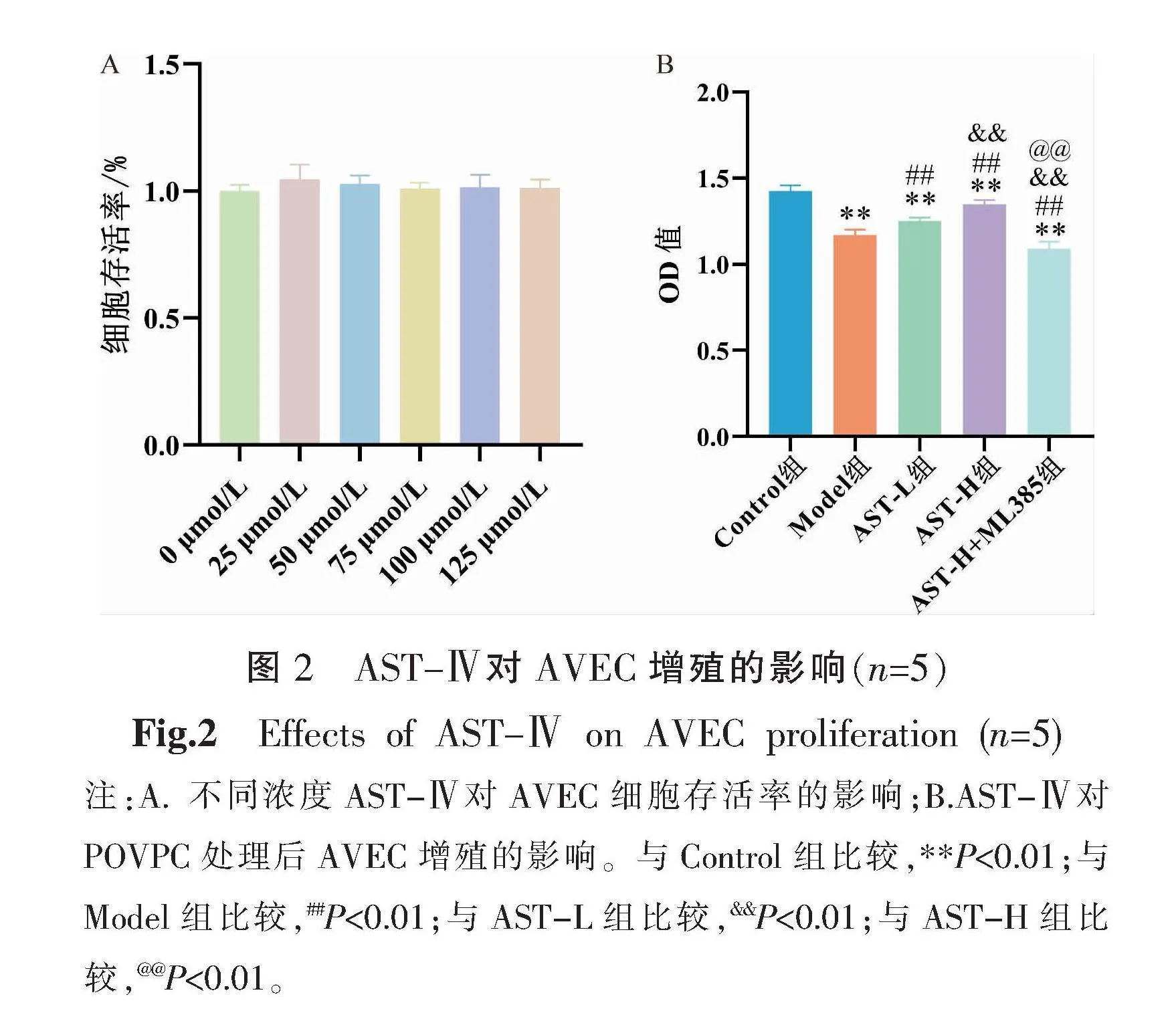
3.2 AST-Ⅳ对AVEC增殖的影响
与0 μmol/L AST-Ⅳ比较,梯度剂量的AST-Ⅳ干预AVEC,细胞存活率差异无统计学意义(P>0.05),提示AST-Ⅳ对内皮细胞无明显毒性。因此,后期实验选用50 μmol/L AST-Ⅳ干预浓度作为低剂量组,100 μmol/L AST-Ⅳ干预浓度作为高剂量组。与Control组相比,Model组AVEC增殖活力明显下降(P<0.01);与Model组比较,AST-L组及AST-H组细胞活力显著上升(P<0.01),且AST-H组细胞活力强于AST-L组(P<0.01);与AST-H组比较,AST-H+ML385组细胞活力明显下降(P<0.01)。详见图2。
3.3 AST-Ⅳ对AVEC迁移能力的影响
与Control组比较,Model组细胞迁移数量明显减少(P<0.01);与Model组比较,AST-L组及AST-H组细胞迁移数量明显增多(P<0.01),且AST-H组细胞迁移数量高于AST-L组(P<0.01);与AST-H组比较,AST-H+ML385组细胞迁移数量明显下降(P<0.01)。详见图3。
3.4 AST-Ⅳ对AVEC血管形成功能的影响
与Control组比较,Model组血管形成的节点数和血管形成个数既网格数显著降低(P<0.01),血管形成的血管总长度和血管分支长度显著缩短(P<0.01);与Model组比较,AST-L组及AST-H组血管形成的节点数和网格数显著升高(P<0.01),血管总长度和血管分支总长度显著增长(P<0.01),且AST-H组血管形成的节点数、网格数高于AST-L组(P<0.01),血管总长度、血管分支总长度长于AST-L组(P<0.01);与AST-H组比较,AST-H+ML385组AVEC血管形成的节点数和网格数下降(P<0.01),血管总长度和血管分支长度显著缩短(P<0.01)。详见图4。
3.5 AST-Ⅳ对AVEC细胞骨架形态的影响
经鬼笔环肽染色后,细胞骨架F-肌动蛋白(F-actin)表现为红色荧光。Control组细胞内骨架微丝排列均匀整齐,细胞间连接完整,无明显断裂。与Control组比较,Model组内皮细胞内骨架微丝排列紊乱,纤维丝出现交叉或断裂,细胞间连接不完整,细胞骨架破坏;与Model组比较,AST-L组及AST-H组细胞骨架修复,细胞间连接较完整,骨架微丝分布整齐,且以AST-H组骨架修复更为完善;与AST-H组比较,AST-H+ML385组对于细胞骨架的修复作用被减弱。详见图5。
3.6 AST-Ⅳ对AVEC ROS水平的影响
与Control组比较,Model组细胞内ROS荧光强度显著增加(P<0.01);与Model组比较,AST-L组及AST-H组细胞内ROS荧光强度显著下降(P<0.01),且AST-H组细胞内ROS水平低于AST-L组(P<0.01);与AST-H组比较,AST-H+ML385组细胞内ROS水平升高(P<0.01)。详见图6。
3.7 AST-Ⅳ对AVEC SOD水平的影响
与Control组比较,Model组SOD含量显著降低(P<0.01);与Model组比较,AST-L组及AST-H组SOD含量显著升高(P<0.01),且AST-H组SOD水平高于AST-L组(P<0.01);与AST-H组比较,AST-H+ML385组SOD水平显著降低(P<0.01)。详见图7。
3.8 AST-Ⅳ对AVEC Nrf2、HO-1 mRNA表达的影响
与Control组比较,Model组细胞内Nrf2、HO-1 mRNA表达水平显著降低(P<0.01);与Model组比较,AST-L组及AST-H组细胞内Nrf2、HO-1 mRNA表达水平显著升高(P<0.01),且AST-H组Nrf2、HO-1 mRNA表达水平高于AST-L组(P<0.01);与AST-H组比较,AST-H+ML385组Nrf2、HO-1 mRNA表达水平显著降低(P<0.01)。详见图8。
3.9 AST-Ⅳ对AVEC Nrf2、HO-1蛋白表达水平的影响
与Control组比较,Model组细胞内Nrf2和HO-1蛋白表达水平显著降低(P<0.05或P<0.01);与Model组比较,AST-L组及AST-H组细胞内Nrf2和HO-1蛋白表达水平显著升高(P<0.01),且AST-H组Nrf2和HO-1蛋白表达水平高于AST-L组(P<0.01);与AST-H组比较,AST-H+ML385组Nrf2和HO-1蛋白表达水平显著降低(P<0.01)。详见图9。
4 讨论
CVD是常见的严重威胁生命健康的疾病,具有高发病率、高死亡率、高致残率[18-20]。AS作为CVD的病理基础,主要表现为血管内脂质浸润、血管平滑肌细胞增殖及表型转化、斑块形成或破裂钙化、血栓形成等病理过程,最终导致血管功能发生障碍[20-22]。引起AS发生的病理机制十分复杂,其中,氧化应激在疾病发展过程中可诱导VEC损伤。一方面,血管完整性破坏引起单核细胞募集,血小板黏附聚集,引起局部血栓形成[23];另一方面,受损的VEC分泌大量生物因子,引起平滑肌细胞增殖,细胞外基质大量分泌,加速AS的进展[24]。因此,抑制氧化损伤,保护VEC,是防治AS的重要手段之一。
中医学认为,气虚血瘀是AS临床最常见的病机之一,益气活血法是治疗AS的基本治疗法则之一[25]。益气活血法主方补阳还五汤对于AS发展阶段的脂质沉积、炎症浸润、平滑肌细胞增殖、巨噬细胞表型转化均具有显著的抑制作用[25-26]。AST-Ⅳ是补阳还五汤中的主要苷类物质,也是中药黄芪的提取物,可抑制CVD发展中的氧化应激、减少炎症浸润与细胞凋亡,但其对于VEC保护、抗氧化应激的作用机制尚不明确[27-29]。
本研究提取了原代细胞,免疫荧光染色结果显示所提取的细胞可特异性表达vWF,鉴定为AVEC。为明确高浓度的AST-Ⅳ对于AVEC是否有毒性作用,采用CCK-8检测梯度浓度的AST-Ⅳ对AVEC细胞活力的影响,因此选定AST-Ⅳ的干预剂量。利用POVPC建立AVEC氧化损伤模型,AVEC增殖、迁移、血管形成功能显著下降,骨架结构显著破坏,提示POCPC破坏了VEC的形态结构和基本功能。ROS过度产生及清除不足是引起机体氧化、抗氧化功能紊乱的主要原因之一,大量ROS的蓄积可改变组织细胞中蛋白质的结构,损害其功能[30]。SOD是一种清除氧自由基的酶,可通过酶促反应催化氧自由基降解,保护组织细胞,维持机体氧化与抗氧化平衡[31]。POVPC作用于AVEC后,氧化应激产物ROS水平显著上升,抗氧化物质SOD水平显著下降,提示POVPC可诱导氧化应激的产生;AST-Ⅳ作用后,AVEC细胞活力、迁移和血管形成功能显著升高,同时伴随细胞骨架的修复,氧化应激产物ROS水平降低及抗氧化物质SOD水平升高,提示AST-Ⅳ具有抗氧化应激、保护AVEC的药理作用,且具有一定的剂量依赖性。Nrf2是调节细胞氧化应激反应的关键因子,当细胞受到氧化应激及其他病理因素刺激时,细胞启动转录过程,激活一系列抗氧化酶,清除氧化损伤产物ROS等[31-32]。HO-1是受Nrf2调控的下游抗氧化酶之一,其本身及诱导产生的内源性保护物质也可发挥抗炎、抗氧化的作用。因此,Nrf2/HO-1信号通路激活也将减轻氧化应激产物对于VEC的损伤,延缓AS的进展[33-35]。ML385是Nrf2的抑制剂,可与Nrf2结合并抑制其下游靶基因表达[36]。在AST-Ⅳ高剂量作用下,应用ML385减轻了AST-Ⅳ对AVEC细胞活力、迁移、血管形成功能的保护作用,抑制了细胞结构的恢复,同时减轻了AST-Ⅳ对于AVEC的抗氧化应激作用。Nrf2、HO-1
mRNA及蛋白的检测结果显示,POVPC可引起AVEC出现Nrf2/HO-1通路抑制,而AST-cKT0LlsG9vkkUdck1aQXDA==Ⅳ干预后,激活Nrf2/HO-1信号通路,诱导AVEC保护作用,并且AST-H的通路激活作用更为显著;但ML385干预后,AST-H对于Nrf2/HO-1的激活作用也被部分逆转,说明AST-Ⅳ可能通过激活Nrf2/HO-1信号通路抑制氧化损伤,保护血管内皮。
综上所述,AST-Ⅳ可通过激活Nrf2/HO-1信号通路,增强AVEC增殖、迁移、血管形成功能,促进细胞结构的修复,增强抗氧化能力,对POVPC诱导的AVEC损伤有一定的抑制作用,提示AST-Ⅳ可能成为抗AS的有效中药单体成分。本研究可为靶向中医药复方单体成分及精准医疗提供一定的研究基础。
参考文献
[1] 马丽媛, 王增武, 樊 静, 等. 《中国心血管健康与疾病报告2022》要点解读[J]. 中国全科医学, 2023, 26(32): 3975-3994.
[2] NOALE M, LIMONGI F, MAGGI S. Epidemiology of cardiovascular diseases in the elderly[J]. Advances in Experimental Medicine and Biology, 2020, 1216: 29-38.
[3] PICH?魪 M E, TCHERNOF A, DESPR?魪S J P. Obesity phenotypes, diabetes, and cardiovascular diseases[J]. Circulation Research, 2020, 126(11): 1477-1500.
[4] GUIEU R, RUF J, MOTTOLA G. Hyperhomocysteinemia and cardiovascular diseases[J]. Annales De Biologie Clinique, 2022, 80(1): 7-14.
[5] 刘彩霞, 邓常清. 中药及复方改善血管内皮细胞氧化应激损伤的研究进展[J]. 湖南中医药大学学报, 2021, 41(1): 151-158.
[6] LI Y, ZHANG Y X, NING D S, et al. Simvastatin inhibits POVPC-mediated induction of endothelial-to-mesenchymal cell transition[J]. Journal of Lipid Research, 2021, 62: 100066.
[7] HAN Z Y, HU H D, YIN M Z, et al. HOXA1 participates in VSMC-to-macrophage-like cell transformation via regulation of NF-κB p65 and KLF4: A potential mechanism of atherosclerosis pathogenesis[J]. Molecular Medicine, 2023, 29(1): 104.
[8] ZHANG Q, LIU J, DUAN H, et al. Activation of Nrf2/HO-1 signaling: An important molecular mechanism of herbal medicine in the treatment of atherosclerosis via the protection of vascular endothelial cells from oxidative stress[J]. Journal of Advanced Research, 2021, 34: 43-63.
[9] MANSOURI A, REINER ?譕, RUSCICA M, et al. Antioxidant effects of statins by modulating Nrf2 and Nrf2/HO-1 signaling in different diseases[J]. Journal of Clinical Medicine, 2022, 11(5): 1313.
[10] ZHANG Q, WANG L, WANG S Q, et al. Signaling pathways and targeted therapy for myocardial infarction[J]. Signal Transduction and Targeted Therapy, 2022, 7: 78.
[11] 傅馨莹, 孙正骥, 龙清吟, 等. 补阳还五汤苷类组分介导NF-κB通路抗动脉粥样硬化炎症反应的机制研究[J]. 中国中药杂志, 2023, 48(1): 202-210.
[12] FU X Y, SUN Z J, LONG Q Y, et al. Glycosides from Buyang Huanwu Decoction inhibit atherosclerotic inflammation via JAK/STAT signaling pathway[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2022, 105: 154385.
[13] WANG Z X, WU Y C, PEI C X, et al. Astragaloside Ⅳ pre-trea?鄄
tment attenuates PM2.5-induced lung injury in rats: Impact on autophagy, apoptosis and inflammation[J]. Phytomedicine: Intern?鄄ational Journal of Phytotherapy and Phytopharmacology, 2022, 96: 153912.
[14] ZHANG X Q, QU H Y, YANG T, et al. Astragaloside Ⅳ attenuate MI-induced myocardial fibrosis and cardiac remodeling by inhibiting ROS/caspase-1/GSDMD signaling pathway[J]. Cell Cycle, 2022, 21(21): 2309-2322.
[15] YAN F C, DING H, SUN Z J, et al. Glycoside combinations of Buyang Huanwu Decoction ameliorate atherosclerosis via STAT3, HIF-1, and VEGF[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 2023, 396(6): 1187-1203.
[16] 马 露, 杨 雷, 邓常清, 等. 基于PI3K/Akt通路研究内皮祖细胞来源外泌体协同丹参酮ⅡA对血管内皮细胞氧化损伤的保护作用[J]. 中国中药杂志, 2023, 48(23): 6423-6433.
[17] JI L L, MOGHAL N, ZOU X R, et al. The NRF2 antagonist ML385 inhibits PI3K-mTOR signaling and growth of lung squamous cell carcinoma cells[J]. Cancer Medicine, 2023, 12(5): 5688-5702.
[18] ZHAO D, LIU J, WANG M, et al. Epidemiology of cardiovascular disease in China: Current features and implications[J]. Nature Reviews Cardiology, 2019, 16(4): 203-212.
[19] VALK R, HAMMILL J, GRIP J. Saturated fat: Villain and bogeyman in the development of cardiovascular disease?[J]. European Journal of Preventive Cardiology, 2022, 29(18): 2312-2321.
[20] YI H J, LEE D H, HONG B Y, et al. The long-term functional effect of thrombectomy on patients with middle cerebral artery occlusion who exhibit moderate to severe disability[J]. Medicina, 2021, 57(5): 509.
[21] TANG H Y, CHEN A Q, ZHANG H, et al. Vascular smooth muscle cells phenotypic switching in cardiovascular diseases[J]. Cells, 2022, 11(24): 4060.
[22] FAN J L, WATANABE T. Atherosclerosis: Known and unknown[J]. Pathology International, 2022, 72(3): 151-160.
[23] TABARES-GUEVARA J H, VILLA-PULGARIN J A, HERNANDEZ J C. Atherosclerosis: Immunopathogenesis and strategies for immunotherapy[J]. Immunotherapy, 2021, 13(14): 1231-1244.
[24] 林云钗, 王 航, 周 强. LINC00707靶向miR-30c-5p对ox-LDL诱导的人血管平滑肌细胞增殖、迁移及炎症因子的影响[J]. 中国药理学通报, 2023, 39(10): 1829-1835.
[25] 潘 杨, 周明学, 郭家娟. 益气活血中药防治动脉粥样硬化的研究[J]. 中国中医基础医学杂志, 2021, 27(2): 362-366.
[26] 李菀榆, 龙清吟, 傅馨莹, 等. 补阳还五汤和黄芪当归配伍对动脉粥样硬化小鼠炎症反应的影响[J]. 中国中药杂志, 2023, 48(15): 4164-4172.
[27] 张红珍, 刘建春, 王 青, 等. 补阳还五汤含药鼠血清对血管平滑肌细胞Rho 激酶及TFmRNA、基质金属蛋白酶MMP-2mRNA、MMP-9mRNA表达的影响[J]. 中华中医药学刊, 2021, 39(1): 17-21.
[28] LENG B, ZHANG Y J, LIU X R, et al. Astragaloside Ⅳ suppresses high glucose-induced NLRP3 inflammasome activation by inhibiting TLR4/NF-κB and CaSR[J]. Mediators of Inflammation, 2019, 2019: 1082497.
[29] CHENG S Y, ZHANG X X, FENG Q, et al. Astragaloside Ⅳ exerts angiogenesis and cardioprotection after myocardial infarction via regulating PTEN/PI3K/Akt signaling pathway[J]. Life Sciences, 2019, 227: 82-93.
[30] HEUSCH G, ANDREADOU I, BELL R, et al. Health position paper and redox perspectives on reactive oxygen species as signals and targets of cardioprotection[J]. Redox Biology, 2023, 67: 102894.
[31] 徐 畅, 宋艺兰, 姜京植, 等. 川芎嗪通过AMPK/NF-κB和Nrf-2/HO-1途径减轻过敏性气道炎症和氧化应激的实验研究[J]. 免疫学杂志, 2021, 37(2): 100-106.
[32] SHEN Y M, LIU X J, SHI J H, et al. Involvement of Nrf2 in myocardial ischemia and reperfusion injury[J]. International Journal of Biological Macromolecules, 2019, 125: 496-502.
[33] HE F, RU X L, WEN T. NRF2, a transcription factor for stress response and beyond[J]. International Journal of Molecular Sciences, 2020, 21(13): 4777.
[34] CHEN X H, WAN W G, GUO Y, et al. Pinocembrin ameliorates post-infarct heart failure through activation of Nrf2/HO-1 signaling pathway[J]. Molecular Medicine, 2021, 27(1): 100.
[35] WANG Y R, YANG C X, ELSHEIKH N A H, et al. HO-1 reduces heat stress-induced apoptosis in bovine granulosa cells by suppressing oxidative stress[J]. Aging, 2019, 11(15): 5535-5547.
[36] XIAN P P, HEI Y, WANG R, et al. Mesenchymal stem cell-derived exosomes as a nanotherapeutic agent for amelioration of inflammation-induced astrocyte alterations in mice[J]. Theranostics, 2019, 9(20): 5956-5975.
本文引用: 谭 维, 傅馨莹, 杨仁义, 马 露, 丁 煌, 刘晓丹, 张 伟. 黄芪甲苷调控Nrf2/HO-1信号通路对血管内皮细胞氧化损伤的影响[J]. 湖南中医药大学学报, 2024, 44(9): 1592-1600.
〔收稿日期〕2023-11-14
〔基金项目〕国家自然科学基金项目(82174218);湖南省科技创新计划资助项目(2023SK2021);湖南省科技创新领军人才项目(2023RC1066)。
〔通信作者〕*张 伟,男,博士,教授,博士研究生导师,E-mail:zhangwei1979@hnucm.edu.cn。

