滋阴明目方对视网膜色素变性rd10小鼠PERK-ATF4信号通路的影响
〔摘要〕 目的 研究滋阴明目方对视网膜色素变性小鼠的影响及其可能机制。方法 将60只rd10小鼠随机分为模型组(等量生理盐水)、维生素A(Vitamin A, VitA)组[VitA 750 IU/(kg·d)]及滋阴明目方低、中、高剂量组[滋阴明目方水煎液13.5、27、54 g/(kg·d)],12只C57BL/6小鼠作为空白组(等量生理盐水),均灌胃干预28 d。HE染色观察视网膜组织病理改变,TUNEL法检测视网膜组织凋亡,微滴式数字PCR和免疫荧光双染检测视网膜组织蛋白激酶样内质网激酶(protein kinase RNA-like endoplasmic reticulum kinase, PERK)、活化转录因子4(activating transcription factor 4, ATF4)mRNA和蛋白的表达。结果 与空白组比较,模型组小鼠视网膜明显萎缩、变薄,视网膜色素上皮(retinal pigment epithelial, RPE)细胞不可见,外核层消失,视网膜厚度减小(P<0.01),小鼠视网膜细胞数量明显减少,存在大量凋亡细胞;PERK、ATF4 mRNA和蛋白表达量升高(P<0.01)。与模型组比较,VitA组和滋阴明目方各剂量组视网膜状况改善,厚度均增加(P<0.01);细胞数量增多,凋亡细胞减少;PERK、ATF4 mRNA表达量降低(P<0.01)。与模型组比较,VitA组和滋阴明目方中、高剂量组PERK、ATF4蛋白表达量降低(P<0.01);滋阴明目方低剂量组ATF4蛋白表达量降低(P<0.01)。与滋阴明目方低剂量组比较,滋阴明目方高剂量组视网膜厚度增加(P<0.05),滋阴明目方中、高剂量组ATF4蛋白表达量及PERK mRNA表达量降低(P<0.01)。与VitA组相比,滋阴明目方高剂量组ATF4蛋白表达量降低(P<0.05),滋阴明目方中、高剂量组PERK mRNA表达量降低(P<0.01)。结论 滋阴明目方可改善小鼠视网膜的形态,减少视网膜组织的凋亡,其分子机制可能与调控PERK-ATF4信号通路有关。
〔关键词〕 视网膜色素变性;滋阴明目方;rd10小鼠;PERK-ATF4信号通路;凋亡;内质网应激
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.09.003
Effects of Ziyin Mingmu Formula on PERK-ATF4 signaling pathway in rd10 mice with retinitis pigmentosa
XIE Wei1, SONG Houpan1, PENG Jun2, XU Jian3, OU Chen2*, PENG Qinghua1,2*
1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China; 3. Shanghai Oriental Hospital, Shanghai 200120, China
〔Abstract〕 Objective To study the effects and the possible mechanisms of Ziyin Mingmu Formula (ZYMMF) on mice with retinitis pigmentosa (RP). Methods Sixty rd10 mice were randomized into model group (equal volume of saline), Vitamin A (VitA) group [VitA 750 IU/(kg·d)], and low-, medium-, and high-dose ZYMMF groups [ZYMMF decoction 13.5, 27, 54 g/(kg·d)]. Twelve C57BL/6 mice were used as the blank group (equal volume of saline). All groups were administered by gavage for 28 days. HE staining was used to observe the pathological changes in retinal tissue, TUNEL assay was used to check the apoptosis in retinal tissue, and droplet digital PCR and immunofluorescence double staining were used to examine the mRNA and protein expressions of protein kinase RNA-like endoplasmic reticulum kinase (PERK) and activating transcription factor 4 (ATF4) in retinal tissue. Results Compared with the blank group, the model group showed significant retinal atrophy and thinning, with the retinal pigment epithelial (RPE) cells being invisible, the outer nuclear layer disappearing, and a decrease in retinal thickness (P<0.01), along with a significant reduction in the number of retinal cells and the presence of a large number of apoptotic cells; the mRNA and protein expression levels of PERK and ATF4 increased (P<0.01). Compared with the model group, the VitA group and each dose group of ZYMMF showed improvement in retinal condition and increased thickness (P<0.01); the number of cells increased and the number of apoptotic cells decreased; the mRNA expression levels of PERK and ATF4 decreased (P<0.01). Compared with the model group, the protein expression levels of PERK and ATF4 in the VitA group and the medium- and high-dose ZYMMF groups decreased (P<0.01); the protein expression level of ATF4 in the low-dose ZYMMF group was reduced (P<0.01). Compared with the low-dose ZYMMF group, the high-dose ZYMMF group showed an increase in retinal thickness (P<0.05), and the medium- and high-dose ZYMMF groups showed a decrease in protein expression of ATF4 and mRNA expression of PERK (P<0.01). Compared with the VitA group, the high-dose ZYMMF group showed a decrease in protein expression of ATF4 (P<0.05), and the medium- and high-dose ZYMMF groups exhibited a decrease in mRNA expression of PERK (P<0.01). Conclusion ZYMMF can improve the morphology of mouse retina and reduce the apoptosis of retinal tissue, and its molecular mechanism may be related to the regulation of PERK-ATF4 signaling pathway.
〔Keywords〕 retinitis pigmentosa; Ziyin Mingmu Formula; rd10 mice; PERK-ATF4 signaling pathway; apoptosis; endoplasmic reticulum stress
视网膜色素变性(retinitis pigmentosa, RP)是一组遗传性视网膜疾病,其特征是进行性的感光细胞和视网膜色素上皮(retinal pigment epithelial, RPE)细胞凋亡,引起视力下降[1]。RP是世界范围内常见的致盲性眼病,其发病率大约为1/4 000,全世界有超过200万患者受此疾病的困扰[2]。蛋白激酶样内质网激酶(protein kinase RNA-like endoplasmic reticulum kinase, PERK)是Ⅰ型内质网应激跨膜受体;活化转录因子4(activating transcription factor 4, ATF4)是内质网应激转录因子[3]。PERK-ATF4信号通路是内质网应激反应的重要通路,激活此通路可以使感光细胞和RPE细胞凋亡[4]。RP归属于中医学“高风内障”范畴,主要病机为先天禀赋不足或后天目失所养,致神光衰微。肾藏精,肝藏血,精与血二者相互为用,相互滋生,故临床上治疗RP多以滋补肝肾,活血明目为基本法则。本研究团队从事RP的防治研究多年,总结出滋阴明目方治疗本病[5-6]。前期研究表明,滋阴明目方可增加视网膜厚度,改善视网膜功能[7]。本研究以rd10小鼠为研究对象,探讨滋阴明目方治疗RP的可能作用机制。
1 材料
1.1 实验动物
实验动物RP模型鼠选用纯合子基因突变小鼠rd10(C57种系,Pde6b,-/-),购于美国杰克森实验室,动物合格证编号:1911A11353。对照动物选用同种系C57BL/6小鼠,由湖南中医药大学动物实验中心采购,动物合格证编号:430727211103058731。本动物实验方案通过湖南中医药大学动物实验中心伦理审查,批准编号:LL2021042805。小鼠饲养于SPF级动物房,室温控制在23~25 ℃,湿度控制在55%左右,12 h规律昼夜循环,自由饮水饮食。
1.2 实验药物
滋阴明目方:熟地黄(产地:河南,批号:2108203)、枸杞子(产地:宁夏,批号:NG21112803)、黄精(产地:河北,批号:2021102508)、丹参(产地:山东,批号:TH21102403)、川芎(产地:四川,批号:2106076)、怀牛膝(产地:河南,批号:TH21092601)。所有药材均购自湖南中医药大学第一附属医院药房。维生素A软胶囊(青岛双鲸药业有限公司,批号:190915,国药准字:H37023082,规格:5 000 IU)。
1.3 实验试剂
HE染色液(批号:G1005,武汉赛维尔生物科技有限公司);TUNEL凋亡检测试剂盒(批号:KTA2010,美国Abbkine公司);12~230 kDa Wes分离试剂盒(批号:SM-W004)、Wes抗兔检测试剂盒(批号:DM-001)均购自美国ProteinSimple公司;PERK抗体(批号:5683)、ATF4抗体(批号:11815)均购自美国Cell Signaling Technology公司;QX200 ddPCR EvaGreen Supermix(批号:1864034,美国BIO-RAD公司)。
1.4 实验仪器
JB-P5型包埋机(武汉俊杰电子有限公司);RM2016型病理切片机(上海徕卡仪器有限公司);Panoramic MIDI型全景扫描仪(匈牙利3D HISTECH公司);T100型梯度PCR仪、QX100型微滴式数字PCR系统(美国BIO-RAD公司)。
2 方法
2.1 药物配制
制备滋阴明目方水煎液,组方剂量为:熟地黄、枸杞子、黄精、丹参、川芎、怀牛膝各15 g。药物用蒸馏水浸泡2 h后加水煎煮2次,每次1 h,合并煎液。浓缩药液,4 ℃冰箱保存备用。
2.2 动物分组及给药
将60只rd10小鼠进行雌雄合笼繁育,所有实验鼠从出生后第29天开始用药观察。采用随机数字表法将rd10小鼠随机分为5组,每组12只,分别为:模型组、维生素A(Vitamin A, VitA)组、滋阴明目方低剂量组、滋阴明目方中剂量组、滋阴明目方高剂量组。C57BL/6小鼠12只,为空白组。动物给药剂量按动物与人体质量等效剂量折算,折算系数W=9.01[8]。滋阴明目方低剂量组给予13.5 g/(kg·d)-1,相当于成人的临床剂量。按照1∶2∶4比例设定低、中、高剂量,则滋阴明目方中剂量组剂量为27 g/(kg·d),滋阴明目方高剂量组剂量为54 g/(kg·d)。VitA组给予750 g/(kg·d)维生素A软胶囊。空白组和模型组给予等体积的生理盐水。各组均灌胃28 d,每日1次。
2.3 HE染色观察视网膜组织病理改变
麻醉小鼠,将标本摘除,眼球固定液固定标本,常规石蜡包埋、切片。将石蜡切片依次放入二甲苯Ⅰ(20 min)、二甲苯Ⅱ(20 min)、二甲苯Ⅲ(20 min)、无水乙醇Ⅰ(5 min)、无水乙醇Ⅱ(5 min)、75%乙醇(5 min),然后水浸洗。将切片放入苏木素染液染色5 min,水浸洗,分化液分化,水浸洗,返蓝液返蓝,水浸洗。再将切片依次放入85%、95%梯度乙醇脱水各5 min,伊红染液染色5 min。按顺序依次放入无水乙醇Ⅰ(5 min)、无水乙醇Ⅱ(5 min)、无水乙醇Ⅲ(5 min)、二甲苯Ⅰ(5 min)、二甲苯Ⅱ(5 min)。风干后中性树胶封片,最后在全景扫描仪下观察视网膜组织病理改变,使用CaseViewer 2.4软件测量视网膜外核层厚度。
2.4 TUNEL法检测视网膜组织凋亡
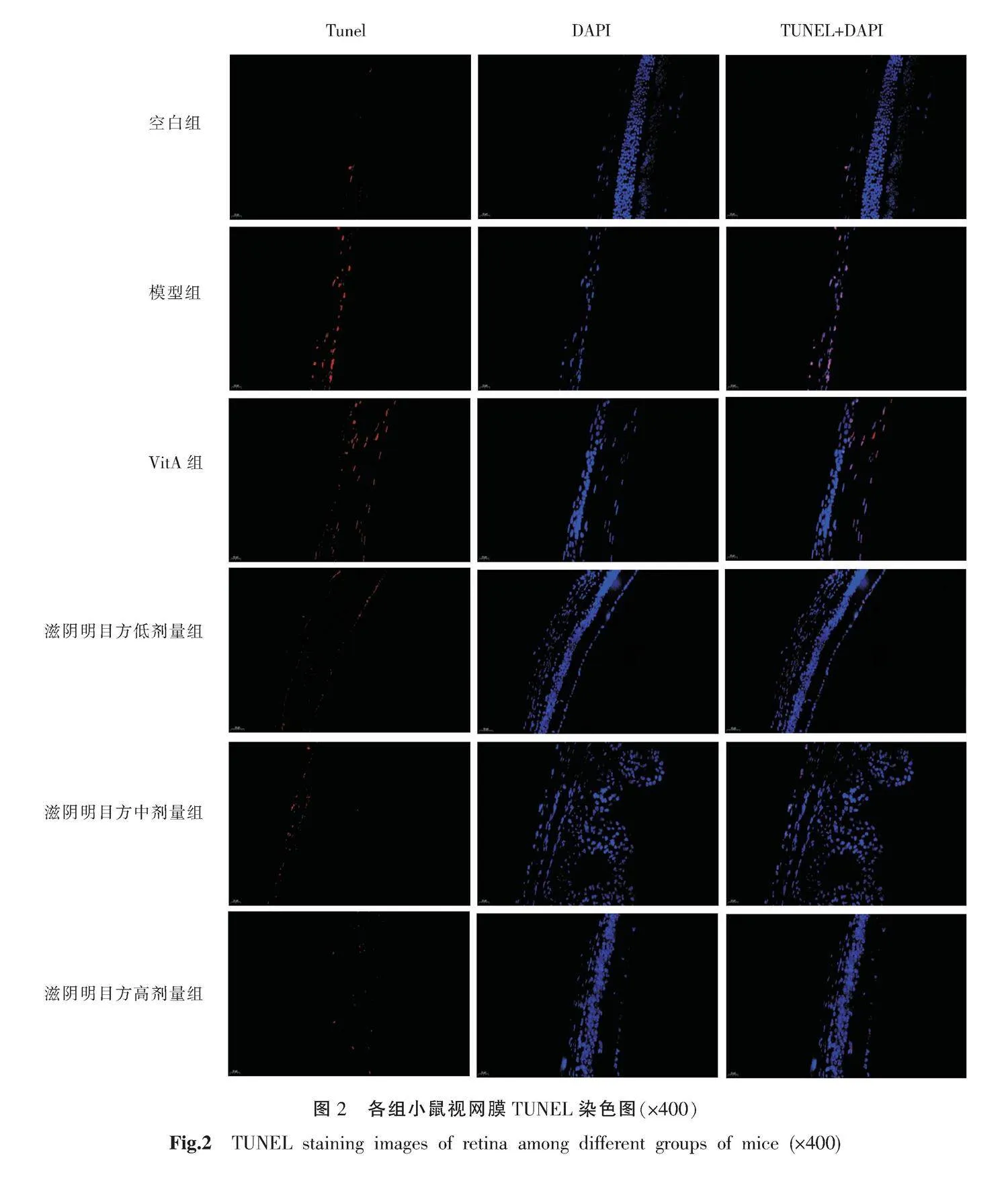
将石蜡切片依次放入二甲苯Ⅰ(15 min)、二甲苯Ⅱ(15 min)、无水乙醇Ⅰ(5 min)、无水乙醇Ⅱ(5 min)、85%乙醇(5 min)、75%乙醇(5 min),然后水浸洗。用组化笔在组织周围画圈,在圈内滴加蛋白酶K工作液覆盖组织,37 ℃孵育25 min,PBS洗涤3次。加入破膜工作液孵育30 min,PBS洗涤3次。然后滴加50 μL反应混合液,37 ℃孵育2 h后,PBS洗涤,行DAPI核染色10 min,抗荧光淬灭封片剂封片。使用全景切片扫描仪采集图像。
2.5 微滴式数字PCR检测视网膜组织mRNA的表达
使用RNA提取试剂盒从视网膜组织中提取总RNA,逆转录试剂盒将mRNA逆转录为cDNA。配制微滴式数字PCR反应液:1 μL cDNA、1 μL引物、8 μL 无酶无菌水和10 μL预混液。采用微流控微滴发生仪制备微滴后,将微滴转移到96孔PCR板上,封膜仪封膜,于梯度PCR仪上进行扩增。扩增条件为95 ℃、5 min;95 ℃、30 s,58 ℃、1 min,40个循环;4 ℃、5 min,90 ℃、5 min;4 ℃保温,升降温速度
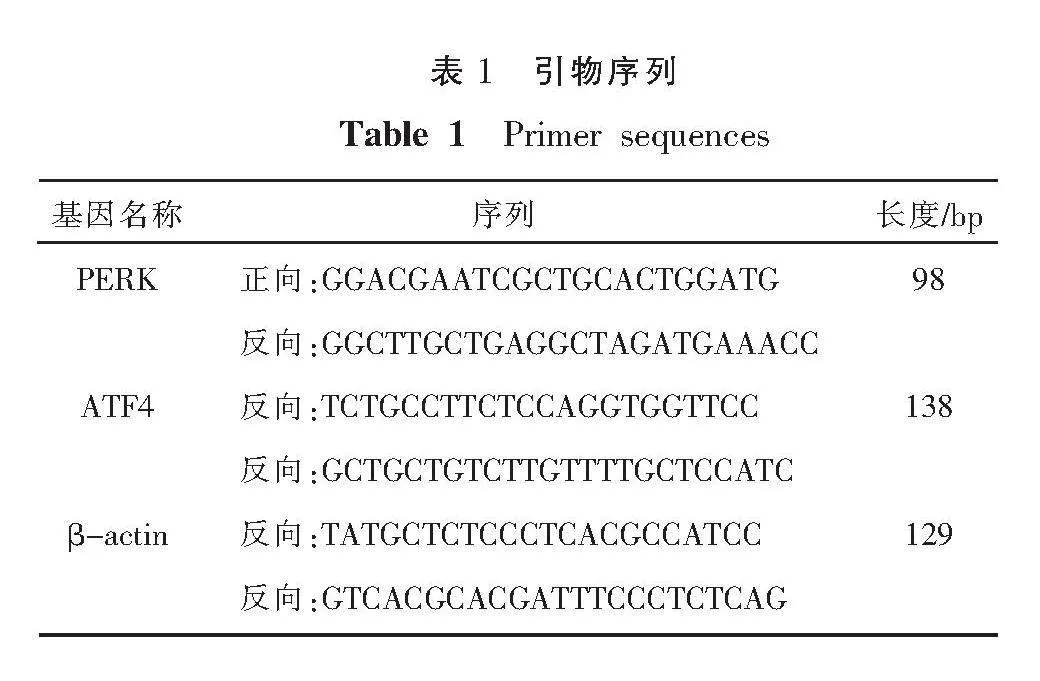
≤2 ℃/s。然后用微滴式单分子核酸检测仪检测微滴,结果用QuantaSoft 1.7软件进行分析。引物序列见表1。
2.6 免疫荧光双染检测视网膜组织蛋白的表达
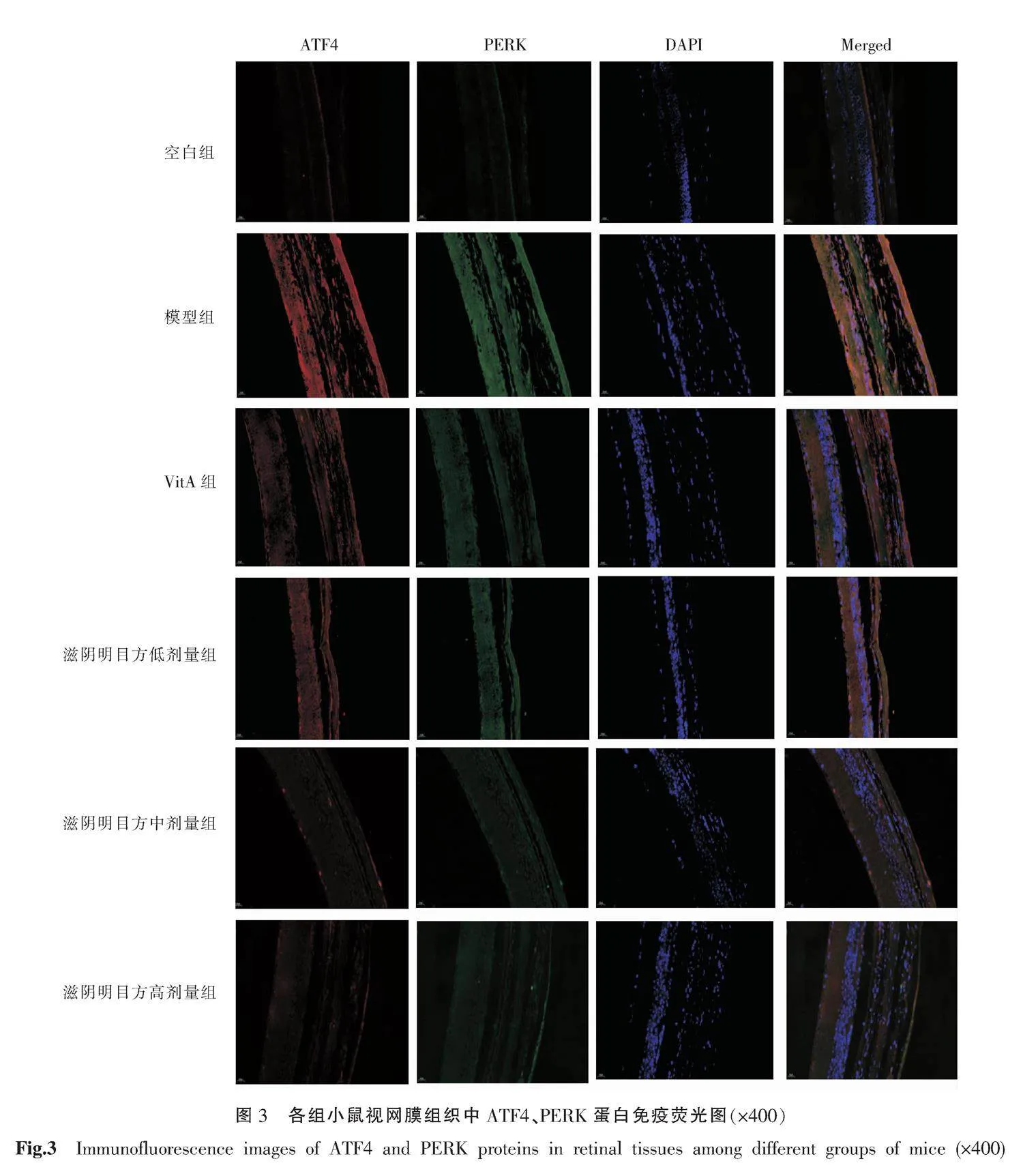
将石蜡切片依次置于二甲苯(10 min)及100%、95%、85%、75%梯度乙醇(各10 min),然后水浸洗。用EDTA抗原修复缓冲液于微波炉中对切片进行抗原修复后,加入3% H2O2,置于室温10 min以灭活内源性酶。用组化笔圈出视网膜组织,加入自发荧光淬灭剂,滴加血清,室温封闭20 min。加入PERK和ATF4一抗(1∶200),4 ℃孵育过夜。PBS浸洗后滴加稀释好的荧光二抗,37 ℃避光孵育1 h。滴加DAPI避光孵育5 min,抗荧光淬灭封片剂封片。使用全景切片扫描仪采集图像,Image-Pro Plus 6.0软件分析荧光强度。
3 结果
3.1 各组小鼠视网膜组织病理改变
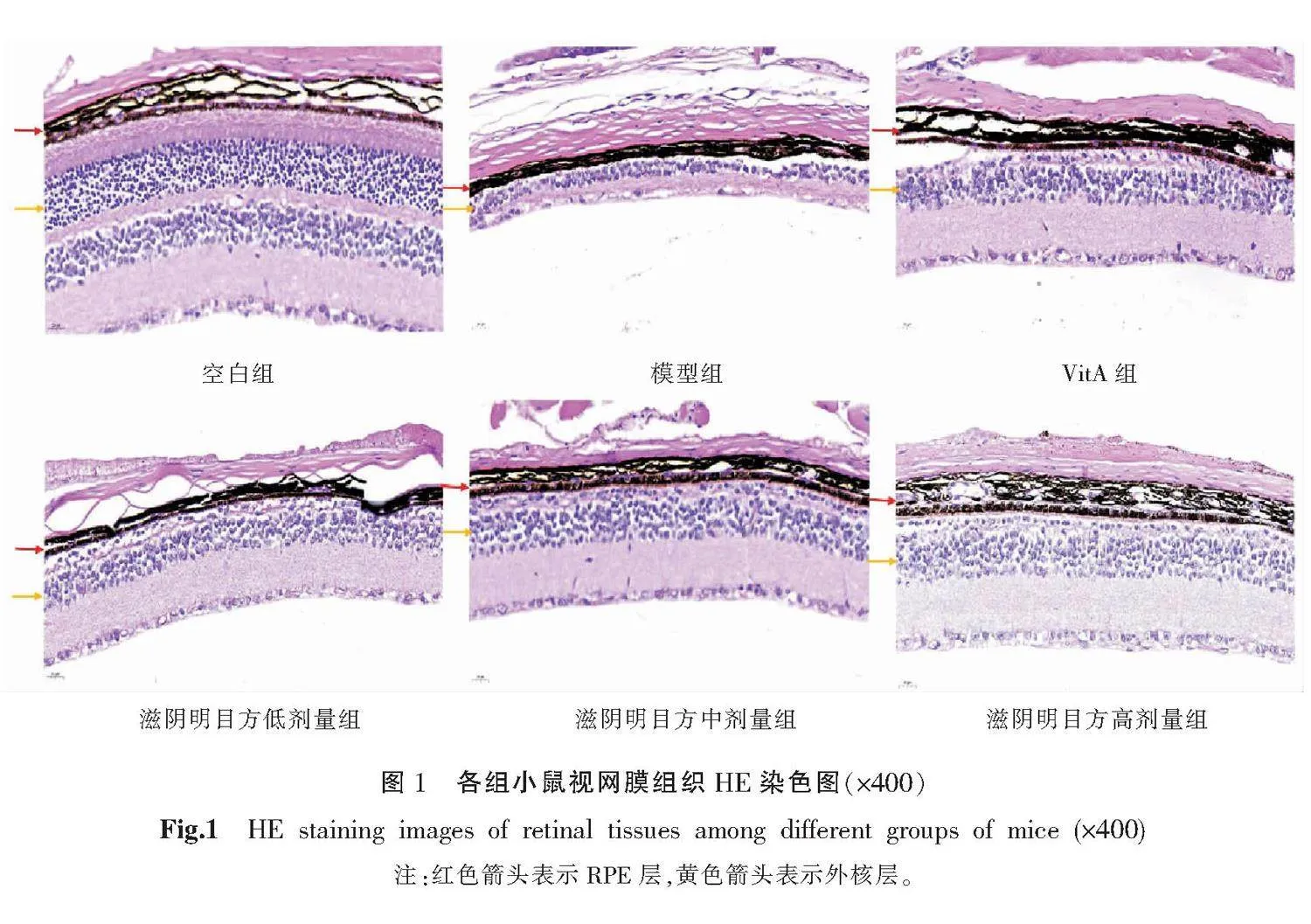
空白组小鼠视网膜各层结构完整,排列紧密。模型组小鼠视网膜明显萎缩RPE细胞不可见,外核层消失。VitA组和滋阴明目方低剂量组小鼠视网膜萎缩,RPE细胞可见,外核层模糊可见。滋阴明目方中剂量组小鼠视网膜稍变薄,可见RPE细胞,外核层模糊可见。滋阴明目方高剂量组小鼠视网膜各分层较清楚,可见RPE细胞,外核层清晰可见,细胞核排列整齐。详见图1。
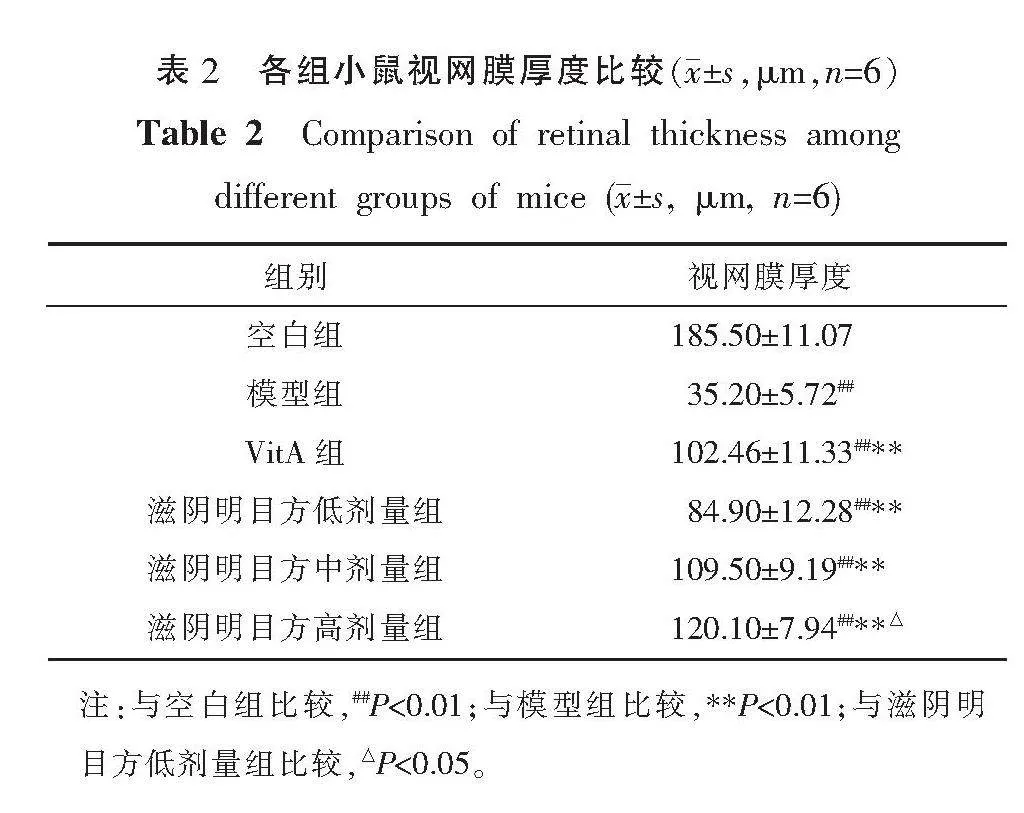
与空白组比较,各组视网膜厚度均减小(P<0.01)。与模型组比较,VitA组和滋阴明目方低、中、高剂量组视网膜厚度均增加(P<0.01)。与滋阴明目方低剂量组比较,滋阴明目方高剂量组视网膜厚度增加(P<0.05)。详见表2。
3.2 各组小鼠视网膜组织凋亡情况比较
空白组小鼠视网膜细胞核排列紧密,细胞数量正常,凋亡细胞少。模型组小鼠视网膜细胞数量明显减少,存在大量凋亡细胞。VitA组小鼠视网膜细胞核排列紊乱,细胞数量减少,可见凋亡细胞。滋阴明目方低、中、高剂量组小鼠视网膜细胞数量正常,可见少量凋亡细胞。详见图2。
3.3 各组小鼠视网膜组织PERK、ATF4 mRNA表达量比较
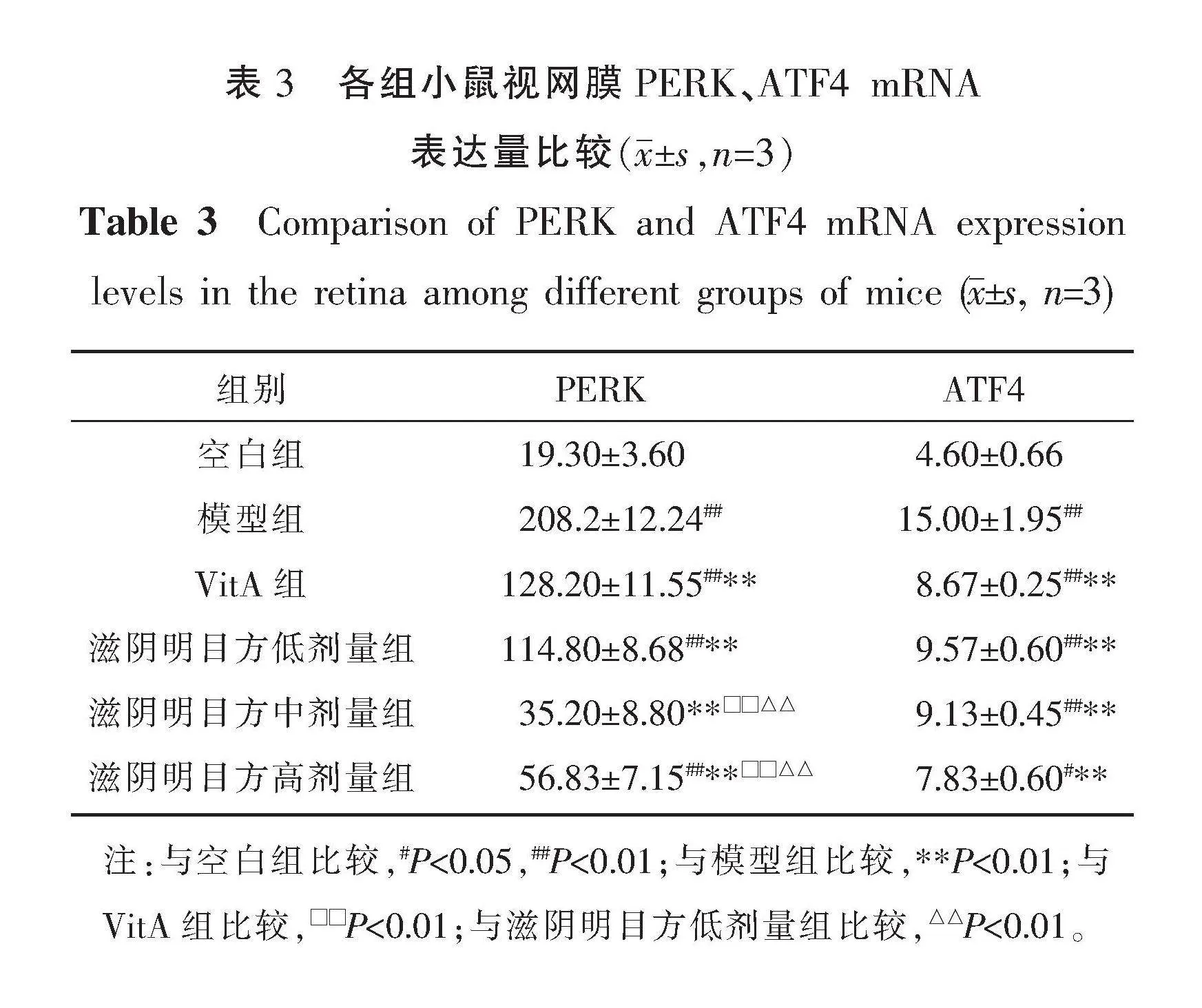
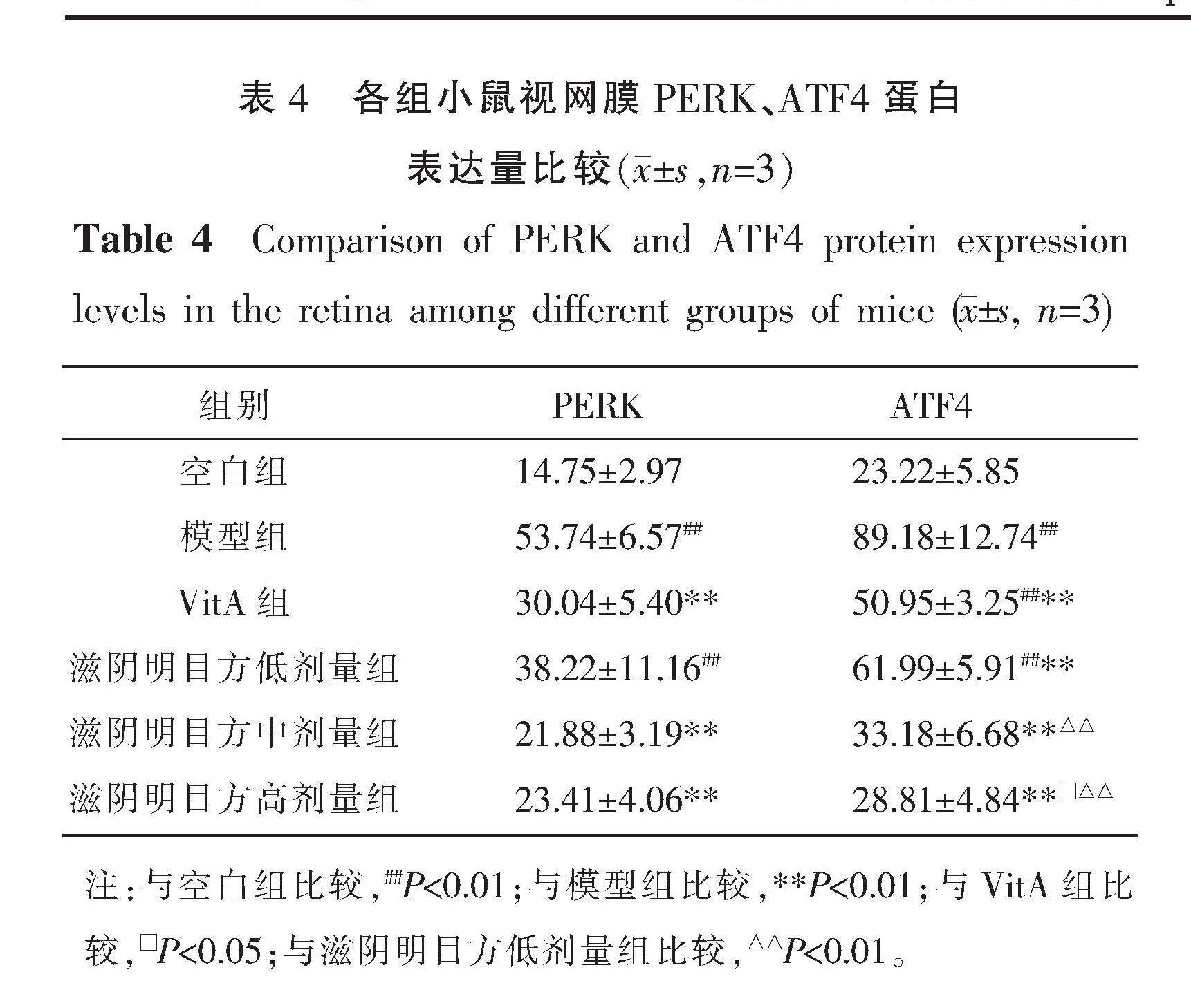
与空白组相比,模型组PERK、ATF4 mRNA表达量升高(P<0.01)。与模型组相比,VitA组和滋阴明目方低、中、高剂量组PERK、ATF4 mRNA表达量降低(P<0.01)。与VitA组和滋阴明目方低剂量组相比,滋阴明目方中、高剂量组PERK mRNA表达量降低(P<0.01)。详见表3。
3.4 各组小鼠视网膜组织PERK、ATF4蛋白表达量比较
与空白组相比,模型组PERK、ATF4蛋白表达量增加(P<0.01)。与模型组相比,VitA组和滋阴明目方中、高剂量组PERK、ATF4蛋白表达量降低(P<0.01),滋阴明目方低剂量组ATF4蛋白表达量降低(P<0.01)。与VitA组相比,滋阴明目方高剂量组ATF4蛋白表达量降低(P<0.05)。与滋阴明目方低剂量组比较,滋阴明目方中、高剂量组ATF4蛋白表达量均降低(P<0.01)。详见表4、图3。
4 讨论
RP归属于中医学“高风内障”范畴,该病名始见于《证治准绳·杂病》。在病因病机方面,《杂病源流犀烛·目病源流》记载:“亦有生成如此,并有父母遗体。”提示该病由父母遗传而来,治疗较困难。中医学认为内障疾病多属虚,先天不足为虚,病久亦至虚,此与RP的致病特点及病程一致[9]。RP早期临床表现为夜盲,暗环境下周边视野缺损;中期夜盲明显,眼底出现骨细胞样色素沉着、视网膜血管变细、视乳头萎缩;晚期出现管状视野,视力严重下降甚至完全失明[10]。本实验运用滋阴明目方治疗RP,滋阴明目方由川芎、丹参、枸杞子、黄精、怀牛膝、熟地黄组方而成。现代研究表明,川芎嗪对视网膜缺血再灌注损伤具有保护作用,抗炎和抗凋亡可能是其发挥作用的机制[11]。枸杞子中的胡萝卜素能促进视网膜内视紫红质的再生或合成,有效保护视神经[12]。黄精多糖能逆转视网膜电图振幅的降低,缓解视网膜血管的异常和渗漏,减少视网膜TUNEL阳性细胞,抑制视网膜神经节细胞凋亡[13]。
rd10小鼠携带一种自发突变的PDE6基因,视杆细胞变性始于18 d,视锥细胞随后死亡,至35 d时视网膜光感受器基本死亡[14]。本实验使用的RP动物模型为rd10小鼠,通过HE染色检测rd10小鼠视网膜组织,结果验证符合RP模型。
细胞凋亡是程序性细胞死亡形式,长期以来被认为是RP的主要发病机制[15-16]。有研究证实,P23H小鼠视网膜感光细胞的退化是由于内质网应激诱导自噬激活,导致细胞凋亡[17]。本实验通过TUNEL染色检测小鼠视网膜组织凋亡情况,发现滋阴明目方可减少视网膜组织的凋亡。PERK-ATF4信号通路是内质网应激介导细胞凋亡的关键通路[18]。当内质网应激发生后,葡萄糖调节蛋白78(glucose regulated protein 78 kDa, GRP78)与跨膜蛋白PERK发生解离,同时与未折叠蛋白结合,激活下游相关信号通路[19]。PERK通过激活真核翻译起始因子2α磷酸化,促使ATF4表达量增加,并且由细胞质进入细胞核,进而激活下游一系列信号转导通路,最终诱导细胞凋亡[20]。既往研究表明,将小鼠感光细胞孵育于蓝光下,可观察到S视蛋白聚集,引起内质网应激,激活PERK、ATF4[21]。本研究通过微滴式数字PCR和免疫荧光双染检测PERK-ATF4 mRNA和蛋白在小鼠视网膜组织中的表达,发现rd10小鼠视网膜组织内质网应激反应相关因子表达升高,提示滋阴明目方可降低其表达。
综上所述,本研究选用RP模型rd10小鼠,研究滋阴明目方对RP的疗效。研究发现,滋阴明目方可改善小鼠视网膜的形态,减少视网膜组织的凋亡,其分子机制可能与调控PERK-ATF4信号通路有关。本研究为滋阴明目方在RP临床治疗的应用提供了依据。
参考文献
[1] 欧 晨, 王 英, 徐 剑, 等. 视网膜色素变性治疗研究进展[J]. 国际眼科杂志, 2018, 18(9): 1608-1611.
[2] ZHU T, LI H, WEI X, et al. Novel homozygous variant in ARL2BP associated with retinitis pigmentosa, situs inversus, and male infertility in a Chinese patient[J]. Clinical Genetics, 2023, 103(4): 472-477.
[3] 段书众, 于文会, 张 华, 等. 小檗碱通过PERK-ATF4通路对高糖诱导的血管平滑肌细胞钙化的改善作用[J]. 中成药, 2022, 44(10): 3325-3328.
[4] XU W Q, TAO M Z, HU Z C, et al. Minocycline induces apoptosis of photoreceptor cells by regulating ER stress[J]. Experimental Eye Research, 2020, 190: 107887.
[5] 欧 晨, 宋厚盼, 谢 薇, 等. 滋阴明目方调控GRP78/IRE1/ATF6通路改善视网膜色素变性的体外研究[J]. 北京中医药大学学报, 2024, 47(6): 773-781.
[6] 谢 薇, 彭 俊, 宋厚盼, 等. 基于PERK/ATF4/CHOP信号通路研究滋阴明目方含药血清对衣霉素诱导的ARPE-19细胞的作用机制[J]. 湖南中医药大学学报, 2024, 44(5): 785-790.
[7] 曾梅艳, 熊 萌, 仇婧玥, 等. 滋阴明目丸干预视网膜色素变性的效应与机制研究[J]. 中国中医药信息杂志, 2023, 30(7):88-93.
[8] OU C, JIANG P F, TIAN Y, et al. Fructus Lycii and Salvia miltiorrhiza Bunge extract alleviate retinitis pigmentosa through Nrf2/HO-1 signaling pathway[J]. Journal of Ethnopharmacology, 2021, 273: 113993.
[9] 胡 鑫, 孙浩楠, 白世淼. 基于“五轮学说”探讨脏腑辨证在RP的应用[J]. 中国中医眼科杂志, 2024, 34(6): 558-562.
[10] 世界中医药学会联合会眼科分会. 原发性视网膜色素变性国际中医临床实践指南[J]. 中国中医眼科杂志, 2023, 33(4): 301-304.
[11] 张雅丽, 王国海, 孟祥波. 川芎嗪减轻大鼠视网膜缺血-再灌注损伤的作用及机制探究[J]. 临床和实验医学杂志, 2021, 20(12): 1245-1248.
[12] 苏保洲. 枸杞子活性成分药理作用研究进展[J]. 江苏中医药, 2022, 54(3): 78-81.
[13] WANG Y, QIN S C, PEN G Q, et al. Original Research: Potential ocular protection and dynamic observation of Polygonatum sibiricum polysaccharide against streptozocin-induced diabetic rats' model[J]. Experimental Biology and Medicine, 2017, 242(1): 92-101.
[14] GARGINI C, TERZIBASI E, MAZZONI F, et al. Retinal organization in the retinal degeneration 10 (rd10) mutant mouse: A morphological and ERG study[J]. The Journal of Comparative Neurology, 2007, 500(2): 222-238.
[15] LEE S J, EMERY D, VUKMANIC E, et al. Metabolic transcriptomics dictate responses of cone photoreceptors to retinitis pigmentosa[J]. Cell Reports, 2023, 42(9): 113054.
[16] 欧 晨, 彭 俊, 蒋鹏飞, 等. 枸杞丹参对rd10小鼠感光细胞凋亡及氧化应激的影响[J]. 时珍国医国药, 2020, 31(11): 2580-2582.
[17] QIU Y Y, YAO J Y, JIA L, et al. Shifting the balance of autophagy and proteasome activation reduces proteotoxic cell death: A novel therapeutic approach for restoring photoreceptor homeostasis[J]. Cell Death & Disease, 2019, 10(8): 547.
[18] LIU C Y, ZHANG A H. ROS-mediated PERK-eIF2α-ATF4 pathway plays an important role in arsenite-induced L-02 cells apoptosis via regulating CHOP-DR5 signaling[J]. Environmental Toxicology, 2020, 35(10): 1100-1113.
[19] OU C, XIE W, JIANG P F, et al. Lycium barbarum L. and Salvia miltiorrhiza Bunge protect retinal pigment epithelial cells through endoplasmic reticulum stress[J]. Journal of Ethnopharmacology, 2022, 296: 115519.
[20] 张欣欣, 辛 鑫, 吴振华, 等. 大黄泄浊方对5/6肾切除大鼠肾脏保护作用及对PERK/ATF4/CHOP通路的影响[J]. 时珍国医国药, 2022, 33(12): 2908-2913.
[21] OOE E, TSURUMA K, KUSE Y, et al. The involvement of ATF4 and S-opsin in retinal photoreceptor cell damage induced by blue LED light[J]. Molecular Vision, 2017, 23: 52-59.
本文引用: 谢 薇, 宋厚盼, 彭 俊, 徐 剑, 欧 晨, 彭清华. 滋阴明目方对视网膜色素变性rd10小鼠PERK-ATF4信号通路的影响[J]. 湖南中医药大学学报, 2024, 44(9): 1568-1574.
〔收稿日期〕2024-05-06
〔基金项目〕国家自然科学基金面上项目(82074196,82004427);湖南省自然科学基金项目(2023JJ40474);湖南省教育厅科学研究项目(23B0347);湖南省眼科疾病(中医)临床医学研究中心(2023SK4038)。
〔通信作者〕*彭清华,男,博士,教授,博士研究生导师,E-mail:pengqinghua@hnucm.edu.cn;欧 晨,男,博士,主治医师,E-mail:465325286@qq.com。

