肺炎支原体检测专利技术分析
摘 要:【目的】对肺炎支原体检测相关专利进行梳理,为肺炎支原体检测技术的发展及相关产品的研发提供参考。【方法】以HimmPat专利数据库作为数据源,对肺炎支原体检测相关专利的申请量趋势、技术来源地、专利布局分布、重要申请人及其技术发展进行分析,并对药智数据库中已批准上市相关产品进行统计分析。【结果】肺炎支原体检测相关专利近年来呈快速增长趋势,专利布局主要分布在中国和美国。酶联免疫法和胶体金法为主流检测方法,产品类型以IgM检测试剂盒为主,国内重点企业也对该检测技术分支进行了专利布局。【结论】相关创新主体应关注新的技术发展,培育高价值专利,在产品更新换代中推动产业技术不断升级。
关键词:肺炎支原体;检测;专利分析
中图分类号:G306 文献标志码:A 文章编号:1003-5168(2024)15-0134-06
DOI:10.19968/j.cnki.hnkj.1003-5168.2024.15.029
Patent Analysis of Mycoplasma Pneumoniae Detection Technology
CAI Yupin WANG Yao
(Patent Examination Cooperation (Beijing) Center of the Patent Office, CNIPA, Beijing 100160, China)
Abstract: [Purposes] This paper summarizes the patents related to Mycoplasma pneumoniae detection, and provides reference for the development of Mycoplasma pneumoniae detection technology and the research and development of related products. [Methods] Using the HimmPat patent database as the data source, the application trend, technology origin, patent layout distribution, important applicants and their technological developments of patents related to Mycoplasma pneumoniae detection were analyzed, and statistical analysis was conducted on the relevant approved marketed products in Yaozh database. [Findings] Patents related to Mycoplasma pneumoniae detection have shown a rapid growth trend in recent years, with patent layout mainly distributed in China and the United States. Enzyme-linked immunosorbent assay (ELISA) and colloidal gold method are the mainstream detection methods for approved marketed products, and IgM testing kits are the main product types. Key domestic enterprises also laid out patents for this detection technology branch. [Conclusions] Relevant innovation entities should pay attention to new technological developments, cultivate high-value patents, and promote the continuous upgrading of industrial technology in product updates and replacements.
Keywords: Mycoplasma pneumoniae; detection; patent analysis
0 引言
肺炎支原体(Mycoplasma pneumonia,MP)是一种非典型病原体,无细胞壁,大小介于细菌和病毒之间,能独立存活,经呼吸道粉末传播。肺炎支原体感染是社区获得性肺炎最常见的病因之一,其中儿童和老人为主要易感人群[1]。目前肺炎支原体的检测方法主要有分离培养、抗原检测、血清学抗体检测和分子生物学检测技术。肺炎支原体分离培养作为传统的检测手段,是判断肺炎支原体感染的“金标准”。但由于肺炎支原体对培养环境要求苛刻且生长缓慢,该方法操作烦琐、阳性率低,从而难以作为临床常规检测手段使用。肺炎支原体抗原检测方法主要有ELISA定量法、免疫层析法、抗体-捕获酶-免疫测定法(Ag-EIA)、量子点标记抗体检测抗原[2]。这些方法耗时费力,敏感性较低,并且检测过程需要肺炎支原体特异性抗体,临床应用受阻[3]。肺炎支原体IgM抗体一般在感染后一周左右出现,可作为早期感染的诊断指标。由于IgM抗体检测方法具有敏感性和特异性高、操作方便等优点,因此该方法在临床诊断中被广泛采用[4]。目前,分子生物学方法,如PCR技术也是国内外发展较快的检测支原体肺炎的方法之一。PCR可分为普通PCR和实时荧光定量PCR,实时荧光定量PCR具有快速、特异性强、灵敏度高等特点,对肺炎支原体的诊断价值优于普通PCR法。但由于其需要特殊仪器设备和对技术要求较高,操作不当或环境受到污染会导致结果出现假阳性,因而在社区或县级医院难以普及[5]。本文对肺炎支原体检测领域的全球专利申请进行统计和分析,对其技术发展路线进行梳理总结,以期为我国相关产业发展和临床应用提供研发基础。
1 数据来源和研究方法
本研究以HimmPat数据库收录的肺炎支原体检测相关的全球专利申请作为数据来源。截至2024年01月05日,检索到相关专利申请4 069件,通过简单同族合并,共得到1 379件专利申请族(2022—2023年的部分专利申请尚未公开,数据仅供参考)。基于上述检索结果,对全球肺炎支原体检测相关专利的申请量、技术来源国和目标国、重要申请人进行分析,并对相关技术路线进行梳理。
2 结果分析
2.1 专利申请量趋势
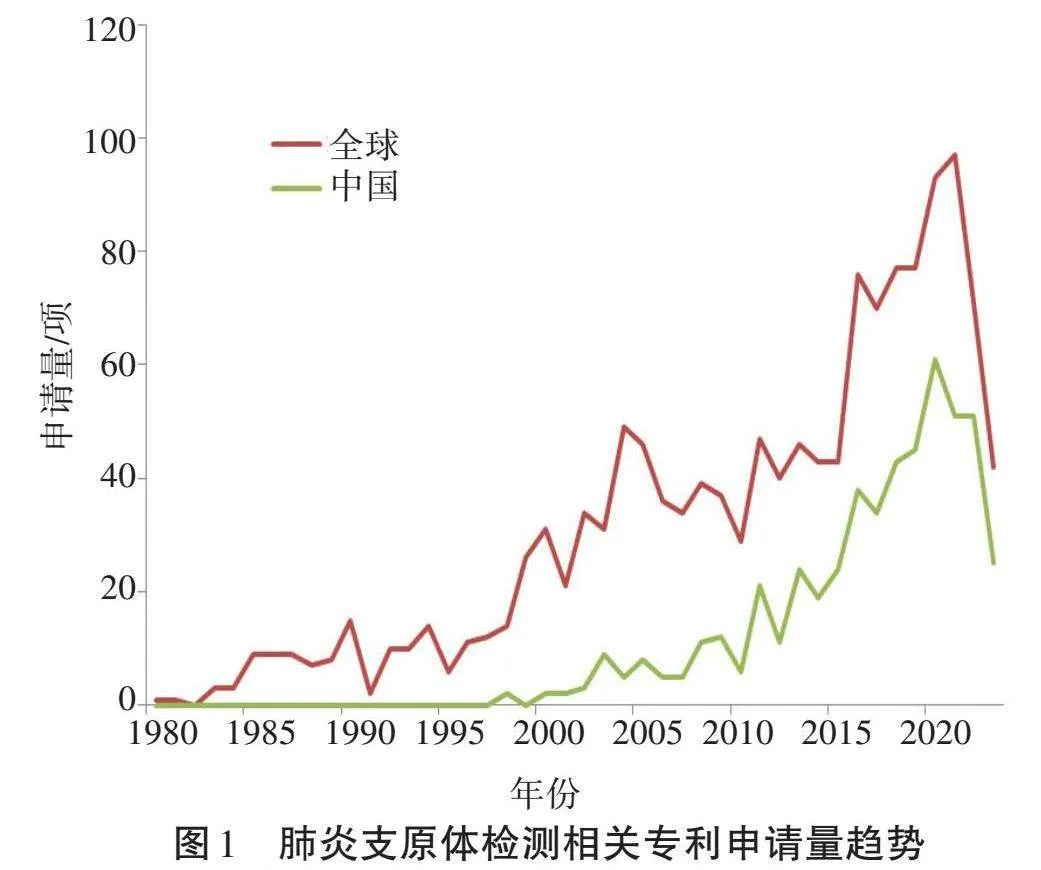
肺炎支原体检测相关专利申请量趋势如图1所示。由图1可知,全球专利申请量总体呈增长趋势,并可大致分为3个阶段。第一阶段1980—1998年为技术萌芽期,该阶段专利申请量较少,且全部专利申请均来自国外。第二阶段1999—2015年为技术发展期,在该阶段专利申请量明显增多,同时开始出现中国专利申请并大致呈增长趋势。第三阶段2016年至今为快速发展期,该阶段的专利申请数量显著增加,且来自中国的专利申请量占申请总量的一半左右。此外,全球和中国专利申请量数据均呈现出一定的周期性,每隔3~5年出现一次申请高峰。如全球申请量在1990年、1994年、2000年、2004年、2011年和2016年出现峰值,该波动周期也与肺炎支原体的流行周期相对应[6]。
2.2 技术来源地和专利布局地分布
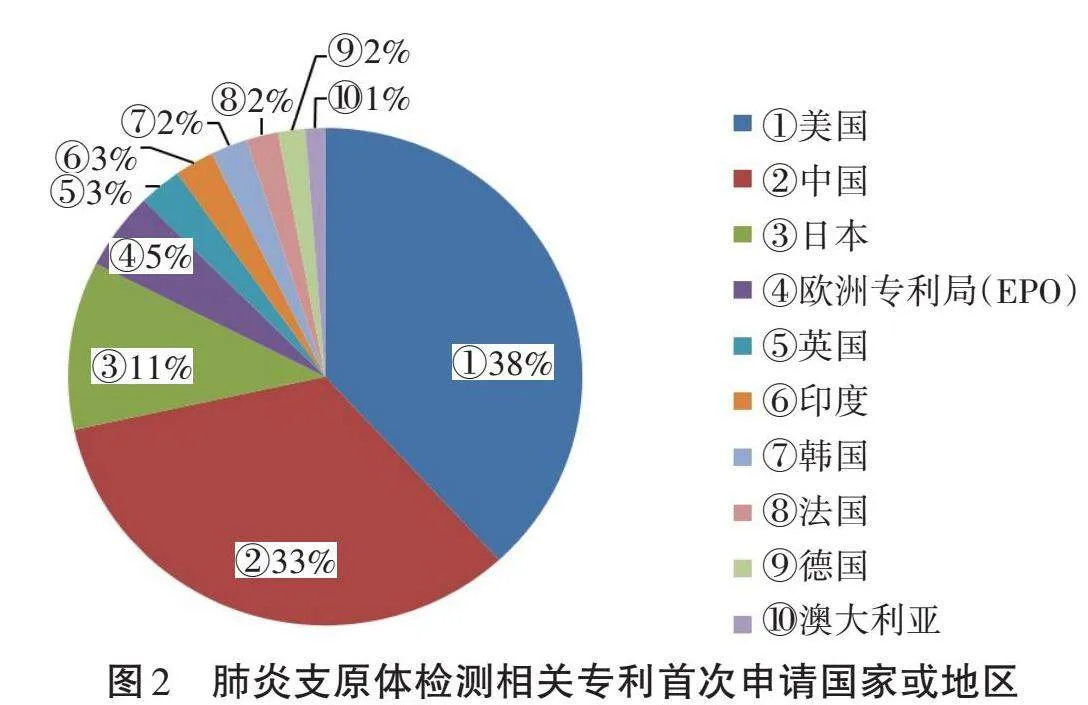
通过对肺炎支原体相关专利首次申请的国家/地区进行分析,可以看出该国家/地区的研发能力和投入度。图2显示了排名前十的肺炎支原体检测相关专利申请来源国家/地区。由图2可知,来自美国的专利申请量排在第一位,共有493件相关专利申请,占全部数量的38%。中国排在第二位,共有431件相关专利申请,占比33%,说明中国在该领域同样也具有强劲的研发实力。申请量紧随其后的依次是日本、欧洲专利局、英国、印度、韩国、法国、德国和澳大利亚。
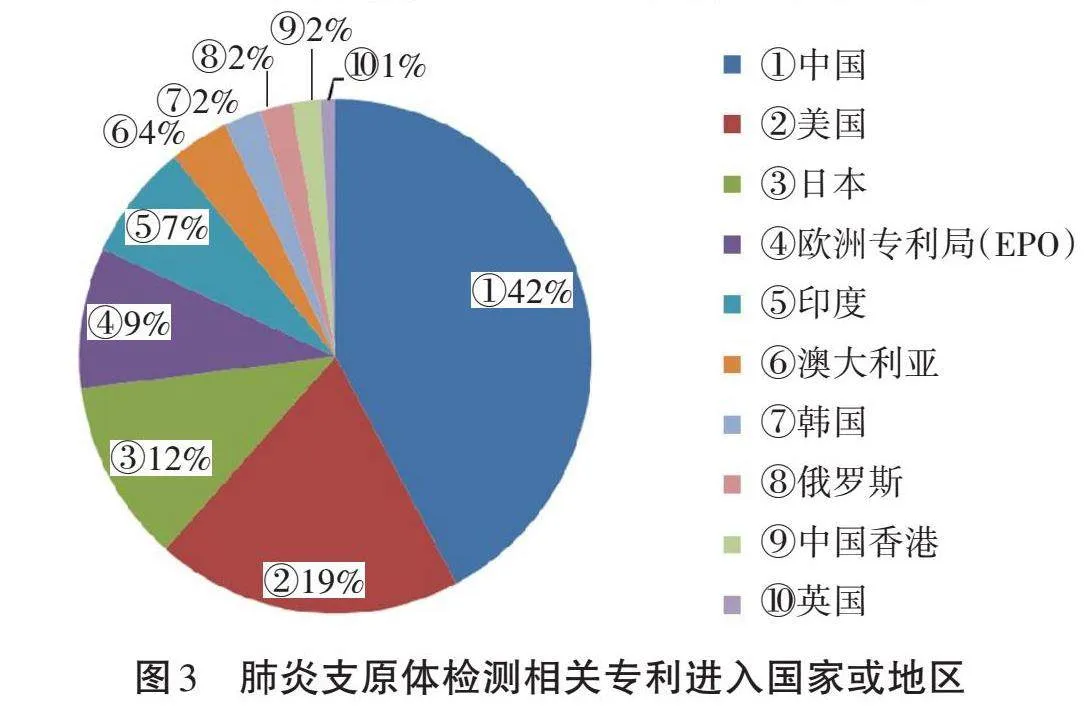
专利申请的目标国家/地区可以从某种意义上反映该国家或地区的技术消费市场。排名前十的肺炎支原体检测相关专利进入的目标国家/地区如图3所示。由图3可知,进入中国的相关专利申请量位居首位,占总申请量的42%,明显高于其他国家/地区。排名第二的目标国家为美国,申请数量占总申请量的19%。随后申请量较多的国家/地区依次是日本、欧洲专利局、印度、澳大利亚、韩国、俄罗斯和中国香港。
通过对进入中国的专利来源地域进行分析发现,约80%的专利源自国内申请人,约20%的专利为国外来华申请专利。一方面说明中国相关创新主体越来越关注该领域的发展,国内申请人在该领域提出了数量可观的专利申请;另一方面,中国是一个人口大国,相关检测产品的市场需求量也较大,较多的国外申请人开始在中国进行专利布局,争抢市场份额。分析提交世界知识产权组织的相关专利,结果显示超过半数的专利(57%)来自美国,而中国申请人提交的专利数量仅占总数的6%左右,这也从侧面反映了美国在全球专利布局中的相对领先地位。
2.3 全球和中国重要申请人排名
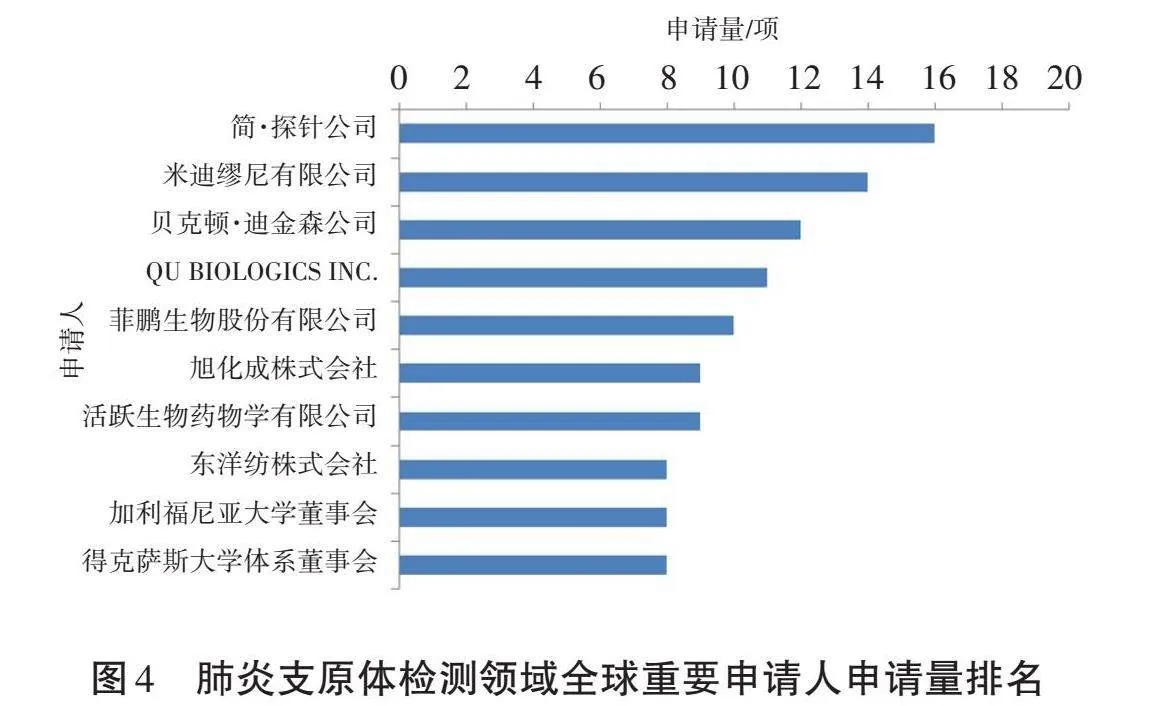
肺炎支原体检测领域全球重要申请人的专利申请量排名如图4所示。全球申请量排名前十的专利申请人(HimmPat标准化申请人)分别为:简·探针公司(美国)、米迪缪尼有限公司(美国)、贝克顿·迪金森公司(美国)、QU BIOLOGICS INC.(加拿大)、菲鹏生物股份有限公司(中国)、旭化成株式会社(日本)、活跃生物药物学有限公司(美国)、东洋纺株式会社(日本)、加利福尼亚大学董事会(美国)和得克萨斯大学体系董事会(美国)。
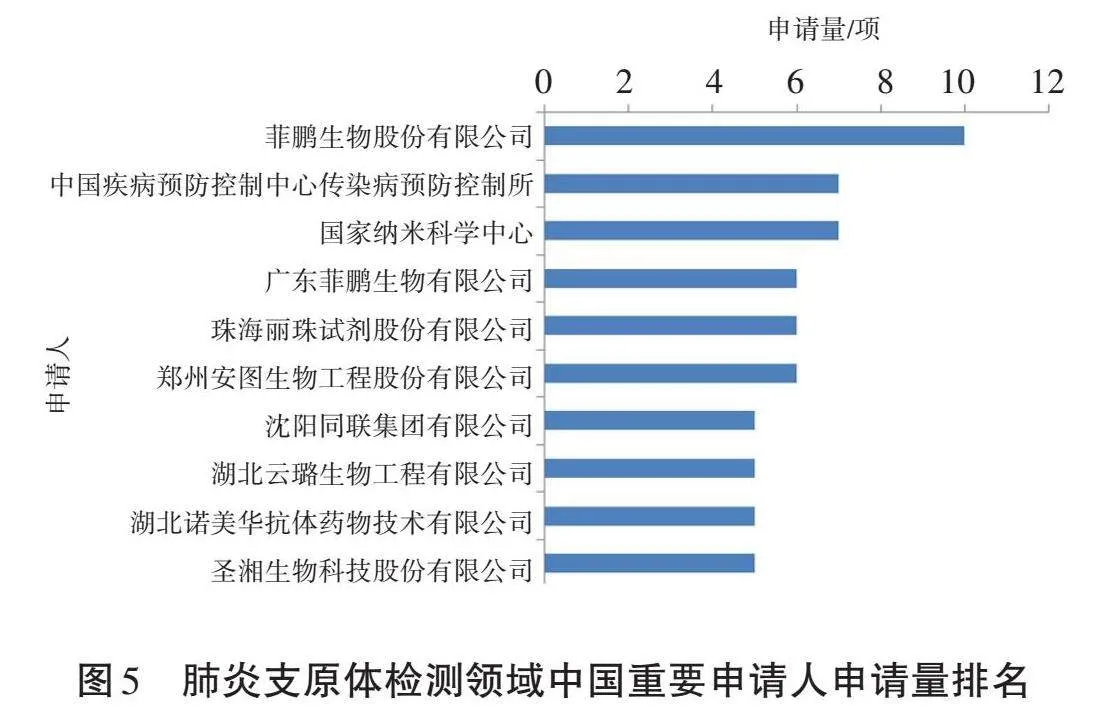
来自国内的重要申请人专利申请量排名情况如图5所示。其中,菲鹏生物股份有限公司排名第一,共有10件相关专利申请,也是唯一进入全球申请量排名且前十的中国申请人。中国疾病预防控制中心预防控制所和国家纳米科学中心并列第二,各提交了7件相关专利申请。紧随其后的重要国内申请人分别是广东菲鹏生物有限公司、珠海丽珠试剂股份有限公司、郑州安图生物工程股份有限公司、沈阳同联集团有限公司、湖北云璐生物工程有限公司、湖北诺美华抗体药物技术有限公司和圣湘生物科技股份有限公司。
2.4 重要申请人技术发展分析
通过对中国重要申请人的专利进行分析,可以更好地了解国内创新主体在相关领域的研发现状。为了明确重要申请人在肺炎支原体检测相关专利上的技术发展脉络及专利布局情况,本文选取了国内申请量最多的重点申请人菲鹏生物股份有限公司和注册上市产品最多的重点申请人珠海丽珠试剂股份有限公司做进一步分析。
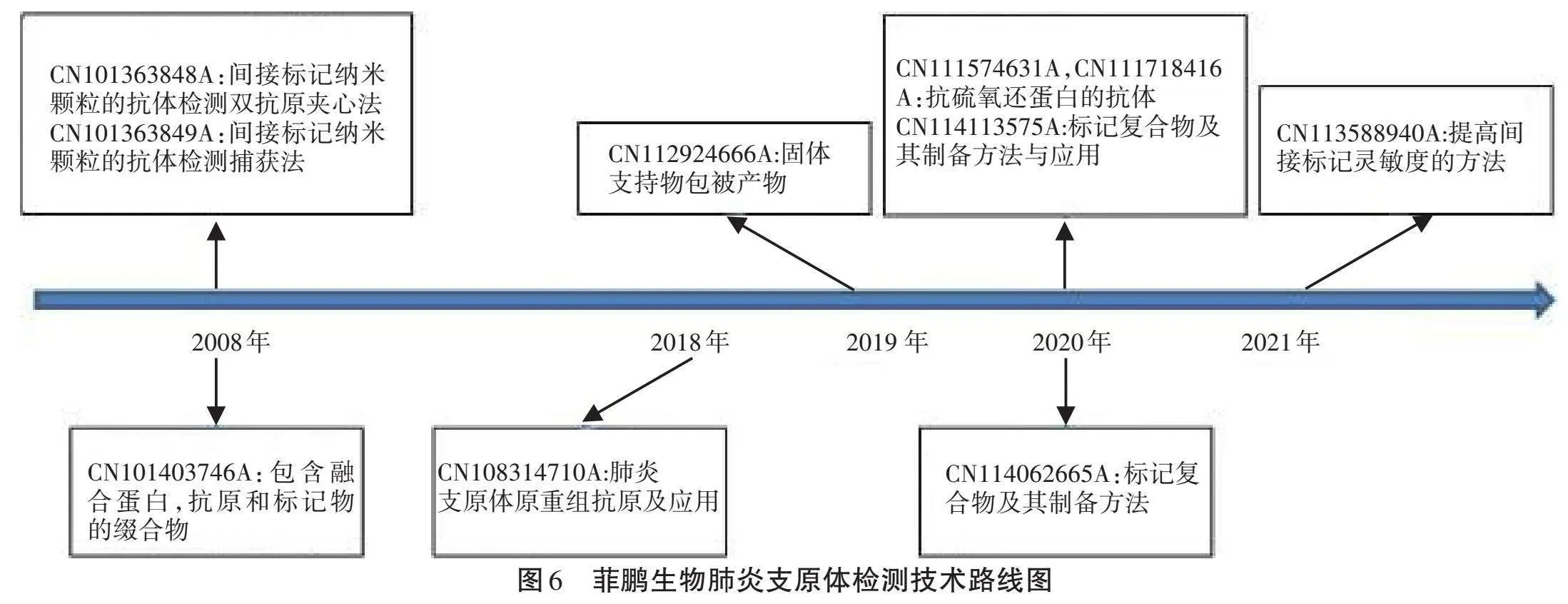
2.4.1 菲鹏生物股份有限公司。菲鹏生物股份有限公司(简称“菲鹏生物”)是行业领先的体外诊断平台型企业,为全球体外诊断企业提供具备出色性能表现的IVD试剂核心原料、试剂解决方案和开放仪器平台。该公司非常重视技术创新和知识产权保护,2022年,菲鹏生物体外诊断试剂生物活性蛋白关键技术获“广东省科技进步二等奖”。截至2024年01月05日,菲鹏生物专利总量近500件,其中发明专利占比80%以上。在肺炎支原体检测领域,菲鹏生物所提交的专利申请技术路线如图6所示。
菲鹏生物的相关专利主要围绕对检测抗原和间接标记法检测肺炎支原体的改进。在免疫检测领域,融合蛋白-抗原-标记物这一缀合物的活性对免疫检测的灵敏度有着决定性的影响。CN101403746A提供了一种用于免疫检测的缀合物,其包含融合蛋白、抗原和标记物。融合蛋白的亲水性较好,有利于蛋白表达在上清部分,从而使目的抗原的空间构象折叠得更加接近天然抗原,而且此融合蛋白分子量大小适中,不会因过大而对目的抗原的生物活性产生影响。以上特点使表达出来的抗原具有很高的活性,尤其是用在免疫检测中的酶标记缀合物或胶体标记缀合物时,灵敏度、特异性、稳定性等均显著优于目前常用的载体所表达的抗原。为了提高重组抗原纳米颗粒的抗体检测捕获法和双抗原夹心法的检测效果,CN101363848A和CN101363849A分别提供了间接标记纳米颗粒的抗体检测双抗原夹心法和捕获法。纳米颗粒类标记物与标记抗原之间的标记是通过抗原上的标签和标记在纳米颗粒标记物上的可特异性识别该标签的配体相结合来完成的间接标记,同时CN101363848A和CN101363849A均聚焦于IgM的检测。间接标记的方法保证了抗原与纳米标记的摩尔比例更接近1:1的最佳状态,同时避免了标记物对标记抗原的表位造成空间位阻、遮盖等不利影响,从而可实现比直接标记法更高的检测灵敏度。间接标记多了一步标签—配体的特异性识别。由于杂蛋白不会与配体结合且间接标记的抗原用量低于直接标记,降低了非特异性结合的可能性,因此间接标记法的检测特异性也较直接标记法更高。
同时,由于间接标记法是建立在配体(如特异性单抗)基础上,因此针对标签Trx的单克隆灵敏度、特异性以及亲和力会影响检测结果。为了提供结合和检测性能更高的单克隆抗体,CN11157631A和CN111718416A分别进一步公开了新的抗硫氧还蛋白的抗体及相关应用。在间接标记法实际应用过程中,纳米颗粒类标记物经标记配体、标记抗原的振荡过程,一部分标记抗原从配体脱落游离在标记体系中导致灵敏度下降。基于此,CN113588940A在间接标记检测方法基础上作出进一步改进,通过向标记体系中补充加入标记了配体的纳米颗粒类标记物以提高间接标记法的灵敏度。此外,在抗原包被方面,CN108314710A和CN112924666A分别提供了一种肺炎支原体重组抗原和包被产物及其制备方法,可克服现有技术中重组抗原表位少而导致的检出率低以及可提高有效偶联效率及包被产物的稳定性。
2.4.2 珠海丽珠试剂股份有限公司。珠海丽珠试剂股份有限公司(简称“丽珠试剂”)创立于1989年,是上市公司丽珠医药集团旗下第一家高科技子公司,专业从事体外诊断试剂及配套设备的研发、生产和销售。该公司已荣获“国家高新技术企业”“广东省创新型企业”“珠海市专精特新企业”等诸多殊荣。丽珠试剂共提交了6件涉及肺炎支原体检测的发明专利申请,并且有7件相关检测试剂盒已获国家药品监督管理局批准。
珠海丽珠的相关专利主要围绕抗原改进和提高抗原稳定性等方面。在抗原改进方面,CN111253478A以肺炎支原体P1蛋白第1 340-1 518位氨基酸残基(P1M抗原片段)为包被抗原,该抗原特异性强、敏感度高,检测效果优于全长P1抗原,从而可应用于制备化学发光法、ELISA或胶体金快速检测试剂盒。为了提供更多的抗原表位而提高检测灵敏度,CN111548423A在上述P1M抗原片段的基础上,将其通过短肽与P30抗原第170-182位氨基酸残基(P30A抗原片段)融合构建了新的融合抗原(P1M-P30A)。经免疫血清学检测IgM抗体验证,与现有的肺炎支原体抗原相比,其特异性更强、灵敏度更高。CN115015544A在肺炎支原体抗体检测试剂盒中使用了3种重组肺炎支原体抗原(P1M-linker-P30A、P1-LQ-P30B1和P116A-(EAAAK)2-P1A-(EAAAK)2-P30B1)作为与磁性微粒连接的抗原。由于含有多个抗原决定簇,3个抗原对抗体的检测存在互补关系,能够尽可能多地涵盖特异有效的抗原表位,从而可以实现更好的IgM抗体检测效果。在提高抗原稳定性方面,CN111157721A提供了用于提高肺炎衣原体抗原/支原体抗原在免疫层析试剂中稳定性的包被液及其制备方法。该包被液的第一组分有助于将抗原固定于硝酸纤维素膜上,稳定剂能够提高支原体抗原和衣原体抗原的稳定性,抗氧化剂能够防止支原体抗原和衣原体抗原氧化,各个组分互相协同保护了抗原在免疫层析试剂中的稳定性。CN114791489A提供的肺炎支原体抗体检测试剂盒中,融合抗原工作液中除了包含融合抗体P1M-P30A,还包含脂肪醇聚氧乙烯醚硫酸酯盐的磷酸盐缓冲液,为融合抗原提供了稳定良好的微环境,进一步提高了试剂盒抗原的热稳定性。此外,肺炎支原体血清学检测的靶抗原主要有灭活菌体抗原、糖脂抗原、膜蛋白抗原和重组抗原(P1、P30、P116等)。由于天然培养的肺炎支原体中提取的膜蛋白成分复杂,使肺炎支原体膜蛋白抗原包被磁珠的效率较低。CN111579773A提供了一种新的膜蛋白包被磁珠的方法,该方法包括先使用还原剂处理肺炎支原体膜蛋白抗原,再将肺炎支原体膜蛋白抗原与磁珠偶联,缓解了天然肺炎支原体膜蛋白抗原包被磁珠效率低的技术问题。
3 批准上市产品及主要注册公司
在药智数据库(db.yaozhi.com)查询已批准上市的肺炎支原体检测相关产品,共有235件医疗器械批准上市,包括210件国产器械和25件进口器械。已批准上市的产品试剂类型包括肺炎支原体IgM检测试剂(共98件,含两件IgM/IgG检测试剂)、肺炎支原体IgG检测试剂(共47件)、肺炎支原体核酸检测试剂(共29件)、肺炎支原体培养基(共60件)及肺炎支原体抗原检测试剂(共3件)。其中,进口器械均为抗体检测试剂,包含16件肺炎支原体IgM检测试剂和9件IgG检测试剂。肺炎支原体抗体检测试剂盒主要采用酶联免疫法(共57件)和胶体金法(共56件),核酸检测试剂盒主要采用PCR-荧光探针法,其中有5件涉及对包含肺炎支原体在内的多种病原菌的联合检测。
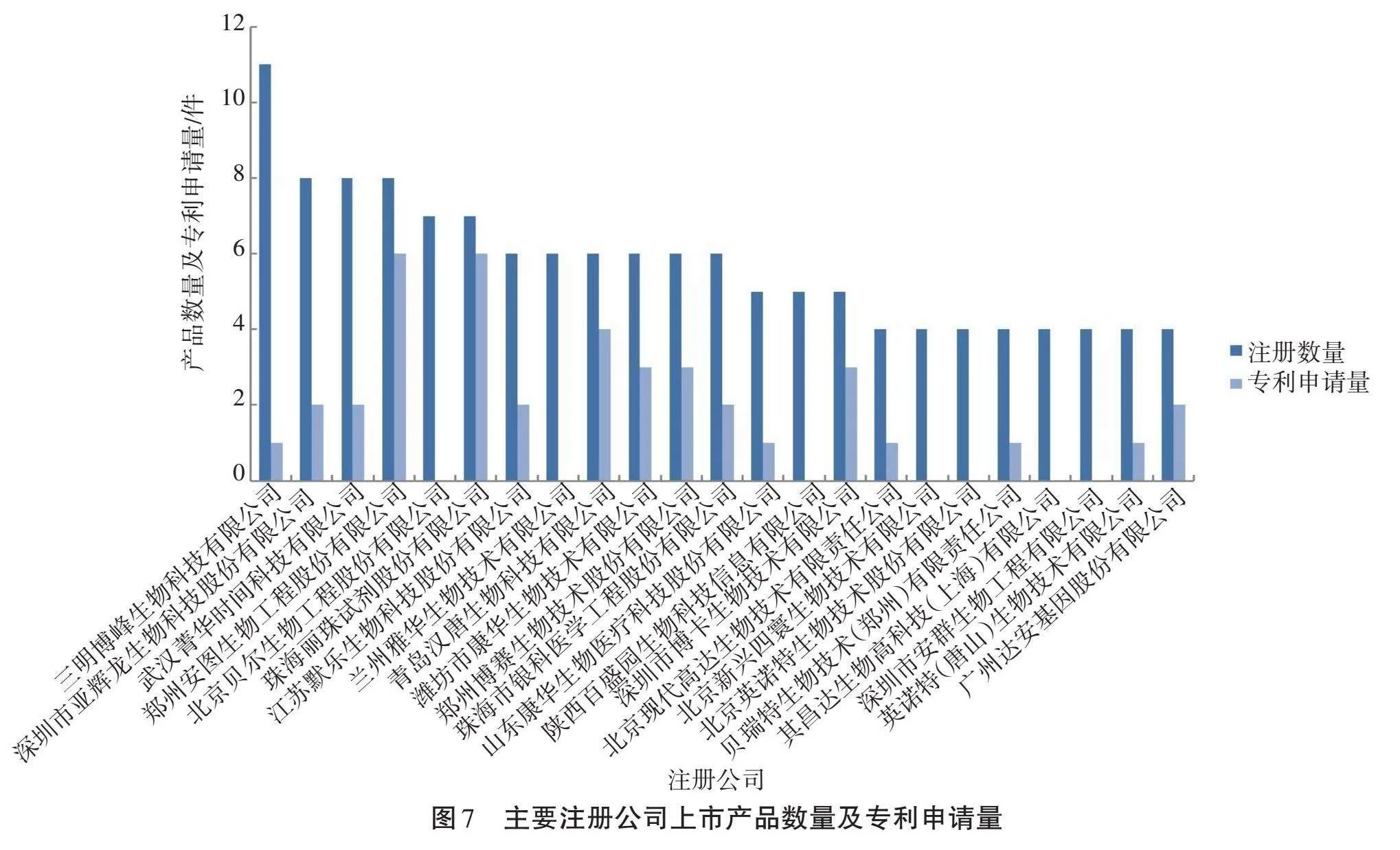
具有4件以上已批准上市产品的主要注册公司有23家,图7显示了主要注册公司上市产品数量及肺炎支原体检测相关专利的申请量。从图7可以看出,三明博峰生物科技有限公司拥有最多的批准上市产品(共11件)。该公司是专业从事体外诊断试剂研发、生产和销售的高新技术企业,具有胶体金试剂系列、酶联免疫试剂系列、微生物培养基系列、生化系列等多条产品线,是国内主要的诊断试剂生产企业之一。但通过分析该公司的专利申请状况,发现其仅申请1件涉及肺炎支原体抗体检测试剂盒的外观设计专利,说明该公司的知识产权保护及专利布局意识不强。值得注意的是,郑州安图生物工程股份有限公司和珠海丽珠公司虽然分别拥有8件和7件批准上市产品,但每家公司都提交了6件发明专利申请,一方面说明了这两家公司具有较强的研发能力,另一方面说明它们具有较强的知识产权保护意识。珠海丽珠公司的7件上市产品分别为肺炎支原体IgM抗体检测试剂(胶体金法)(2件)、肺炎支原体IgG抗体检测试剂(胶体金法)、肺炎支原体IgM抗体检测试剂盒(荧光免疫层析法)、肺炎支原体IgM抗体检测试剂盒(化学发光法)、肺炎支原体抗体检测试剂盒(被动凝集法)和肺炎支原体IgM抗体/肺炎衣原体IgM抗体检测试剂(胶体金法)。其中,肺炎支原体IgM抗体/肺炎衣原体IgM抗体检测试剂对应于其专利CN111157721A,均是对肺炎支原体/衣原体的检测,而其他6种检测试剂,由于在申报材料“主要组成部分”中并未明确采用的抗原具体类型,因此难以与该公司名下的专利明确对应起来。
进一步分析主要注册公司的上市产品类型,发现这些公司的产品以肺炎支原体IgM检测试剂盒为主,这与全部产品的总体情况一致。郑州安图生物工程股份有限公司的产品最丰富,4种不同类型的检测试剂均有涉及。大部分主要注册公司的产品类型涵盖两种以上,只有部分注册公司专注于通过培养法(江苏默乐生物科技股份有限公司、郑州博赛生物技术股份有限公司、陕西百盛园生物科技信息有限公司、贝瑞特生物技术(郑州)有限责任公司、其昌达生物高科技(上海)有限公司)或分子生物学方法(广州达安基因股份有限公司)检测肺炎支原体。
4 结语
快速、准确地诊断肺炎支原体对于患者的救治与预后具有重要的意义。本文对肺炎支原体检测相关专利申请趋势、技术来源国与目标国、全球和中国重要申请人、重要申请人的专利技术发展及已批准上市产品进行了统计分析。整体来看,肺炎支原体检测专利申请量近年来快速增长,虽然中国在该领域起步较晚,但近几年奋起直追,申请量已稳居世界第二。国内重要申请人与主要注册公司在相关专利申请量和已批准上市产品数量方面并不能完全对应。究其原因,一方面可能是由于一些重要申请人更注重产品上游核心原料的开发和销售,另一方面可能是由于免疫检测和核酸检测等相关领域技术的发展已较为成熟,技术壁垒少,从而导致技术方案的可替代性较高。从技术角度来看,IgM抗体相对于IgG抗体可在感染早期出现,通过检测IgM可实现对肺炎支原体的早期诊断,因此IgM检测试剂也是已批准上市产品中最多的类型。在专利上,重点企业也对该检测技术分支进行了专利布局。血清学检测试剂以产品酶联免疫法和胶体金法为主,酶联免疫法具有灵敏度高、特异性好、可定量检测等优势,已成为肺炎支原体临床检测的主要手段之一;胶体金法虽在灵敏度和特异性方面比ELISA差些,但其具有快捷、方便、操作简单、无须专业设备或专业人员操作、可实现家庭自检等优势,能对ELISA检测方法起到很好的补充作用,已经得到越来越广泛的应用。
参考文献:
[1]李亚娟,张佳佳,王宪灵,等. 学龄前儿童和老年人呼吸道感染患者病原体分布特征[J]. 河北医药,2023,45(18):2855-2857.
[2]贺凌煜,朱文勇,杨丽源,等. 肺炎支原体检测技术研究进展[J]. 生物技术通讯,2020,31(1):112-116.
[3]孙国磊,王一民. 肺炎支原体感染诊断方法的研究进展[J]. 医学综述,2021,27(10):1961-1965.
[4]国家卫生健康委员会. 儿童肺炎支原体肺炎诊疗指南(2023年版)[J]. 传染病信息,2023,36(4):291-297.
[5]李青曌,史文元,陈虹亮. 肺炎支原体的实验室检测技术研究进展[J]. 中国人兽共患病学报,2017,33(9):841-844.
[6]崔兆海,廖国阳. 肺炎支原体感染流行病学及耐药状况的研究进展[J]. 中国生物制品学杂志,2020,33(2):203-206.

