突破反应热的计算类试题

反应热是化学反应中能量的转移或转化形式之一,对于理解化学反应的本质以及预测和控制反应过程具有重要意义.与反应热相关的试题不仅是热力学知识的具体应用,更是对考生逻辑思维和计算能力的全面考查.要想在高考中轻松应对反应热的计算问题,不仅需要深入理解反应热的基本原理,还需要掌握一系列实用的计算方法.
1 掌握盖斯定律
盖斯定律被称为反应热的加法性原理,它告诉我们,一个化学反应无论是一步完成还是多步完成,其反应热效应总是相同的.这一原理不仅简化了复杂反应热的计算过程,还为我们提供了一种全新的视角来审视化学反应中的能量变化.
例1 (2023年全国乙卷,节选)硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁催化剂等.已知下列热化学方程式:
FeSO4·7H2O(s)=FeSO4(s)+7H2O(g) ΔH1=a kJ·mol-1, ①
FeSO4·xH2O(s)=FeSO4(s)+xH2O(g) ΔH2=bkJ·mol-1, ②
FeSO4·yH2O(s)=FeSO4(s)+yH2O(g) ΔH3=ckJ·mol-1, ③
则FeSO4 ·7H2O (s)+ FeSO4 ·yH2O (s)=2(FeSO4·xH2O)(s)的ΔH =____ kJ·mol-1.
解析
根据盖斯定律,由①+③-2×②可得目标反应FeSO4·7H2O(s)+FeSO4·yH2O(s)=2(FeSO4·xH2O)(s),所以ΔH = (a +c -2b )kJ·mol-1.
盖斯定律不仅是反应热计算中的一把利器,更是我们理解化学反应机理的重要工具.通过掌握盖斯定律,我们不仅可以更加准确地计算反应热,还能够深入理解化学反应中的能量变化.因此,我们应该深入学习并熟练掌握盖斯定律的相关内容,以便更好地应用它来解决实际问题.
2 利用反应物和生成物的能量计算
反应热等于生成物的总能量减去反应物的总能量.因此,如果知道反应物和生成物的能量,可以直接计算反应热,这是一种既直接又有效的方法.这种方法不仅能够帮助考生快速准确地解决问题,还能够培养考生的逻辑思维能力和问题解决能力.
例2 已知:在标准压强(100kPa)、298K 下,由最稳定的单质合成1mol物质B的反应焓变,叫作物质B的标准摩尔生成焓,用ΔH (kJ·mol-1)表示.有关物质的ΔH 有如图1所示关系.下列有关判断正确的是( ).
A.H2O(l)的ΔH >-241.8kJ·mol-1
B.NH3(g)比N2H4(l)稳定
C.N2H4(l)标准燃烧热为534.2kJ·mol-1
D.NO(g)的键能大于N2 (g)与O2 (g)的键能之和
解析
H2O(g)的能量高于H2O(l),则H2O(l)的ΔH < -241.8kJ·mol-1,选项A 错误.N2H4(l)的标准摩尔生成焓为+50.6kJ·mol-1,NH3(g)的标准摩尔生成焓为-45.9kJ·mol-1,由能量越低越稳定的原理可知,NH3 比N2H4(l)稳定,选项B 正确.N2H4 (l)的标准摩尔生成焓为+50.6kJ·mol-1,则N2(g)+2H2(g)⇌N2H4(l) ΔH =+50.6kJ·mol-1, ①H2O(g)的标准摩尔生成焓为-241.8kJ·mol-1,则2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1. ②
根据盖斯定律,由②-①可得反应N2H4 (l)+O2(g)=N2(g)+2H2O(g),但标准燃烧热是指生成液态水,无法根据题中数据计算,选项C错误.NO 的标准摩尔生成焓为+91.3kJ·mol-1,则N2 (g)+O2(g)=2NO(g)的ΔH >0,故NO(g)的键能小于N2(g)与O2(g)的键能之和,选项D错误.答案为B.
解答反应热相关问题时,需要考生对化学反应的基本概念和能量变化有深入的理解.利用反应物和生成物的能量进行计算.因此,在日常学习中,考生应该注重基础知识的积累和实践能力的提升,以便在高考中取得优异的成绩.
3 利用燃烧热计算
在化学反应中,燃烧热是一个特定的、重要的能量值,表示单位物质的量的物质完全燃烧时放出的热量.利用燃烧热计算反应热是一种非常实用的方法,尤其在处理涉及多个步骤的复杂反应时.当我们要计算一个复杂反应的反应热时,可以将这个反应拆分成若干个简单的反应,根据盖斯定律,通过各个步骤反应热的简单相加或相减得到整个复杂反应的反应热.
此外,利用燃烧热计算反应热时,还需要注意一些细节.例如,要确保所有物质都是在标准状态下进行反应的,因为非标准状态下的反应热可能会有所不同.另外,还要注意反应物和生成物的状态,因为固态、液态和气态的物质所放出的热量是不同的.
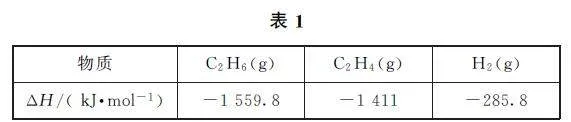
例3 (2023年海南卷)各相关物质的燃烧热数据如表1所示.下列热化学方程式正确的是( ).
A.C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH =-1411kJ·mol-1
B.C2H6(g)=C2H4(g)+H2(g) ΔH =-137kJ·mol-1
C.H2O(l)=O2(g)+H2(g) ΔH =+285.8kJ·mol-1
D.C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l) ΔH =-1559.8kJ·mol-1
解析
当1mol纯物质完全燃烧生成指定产物时,所放出的热量为燃烧热.在利用热化学方程式表示燃烧热时,方程式中的可燃物必须为1mol,产物为稳定产物.H2O 为气态时,不是稳定的氧化物,选项A 错误.由表1数据可得C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l) ΔH =-1559.8kJ·mol-1, ①C2H4(g)+3O2(g)=2CO2(g)+2H2O (l) ΔH =-1411kJ·mol-1, ②1/2O2(g)+H2(g)=H2O (l) ΔH =-285.8kJ·mol-1, ③依据盖斯定律,由①-②-③可得反应C2H6(g)=C2H4(g)+H2(g),ΔH =+137kJ·mol-1,选项B错误.由H2 的燃烧热为-285.8kJ·mol-1可得,1/2O2(g)+H2(g)=H2O(l)ΔH =-285.8kJ·mol-1,则H2O(l)=1/2O2(g)+H2(g)ΔH =+285.8kJ·mol-1,选项C错误.由C2H6 的燃烧热为-1559.8kJ·mol-1可得,C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l)的ΔH =-1559.8kJ·mol-1,选项D正确.答案为D.
利用燃烧热计算反应热是一种非常实用的方法.通过明确燃烧热的概念,将复杂反应拆分成简单的步骤,并利用盖斯定律进行计算,我们可以准确地得到整个反应的反应热.这种方法不仅简化了计算过程,还提高了计算的准确性,是高考化学中不可或缺的一部分.
综 上所述,高考中反应热的计算不仅要求考生具备扎实的理论基础,还需要灵活运用各种计算方法和策略.通过不断练习和总结经验,相信每位考生都可以在高考化学科目中展现出自己的实力,取得优异的成绩.
(完)

