基于转录组测序的乌桕叶色相关基因的挖掘
收稿日期:2023-10-11
基金项目:中央财政林业科技推广示范基金项目[苏(2021)TG12];江苏省苏北科技专项(SZ-LYG202142);连云港市财政局专项基金项目(QNJJ2205)
作者简介:王晓晓(1996-),女,山东济南人,硕士,研究实习员,主要从事观赏树种栽培及遗传育种研究。(E-mail)2402287168@qq.com
通讯作者:刘兴满,(E-mail)yyyy28@126.com
摘要: 乌桕(Triadica sebifera)耐盐碱能力强,叶色随季节变化显著,尤以秋季观赏性最佳,是园林绿化中常用的彩叶植物。为揭示乌桕叶片呈色的分子机制,本研究对自主选育的3个乌桕品种连桕1号、云台红桕、云台金桕转色前后的叶片进行转录组测序,共获得123.78 GB测序数据,70 815个高质量单一基因序列(Unigenes),其中48 367个Unigenes得到了功能注释。将3个乌桕品种转色前后的转录组数据进行两两对比,各比较组之间鉴定出共有的差异表达基因(DEG)2 674个。GO分析发现,DEG主要与细胞过程、细胞、结合等生物学功能相关。通过KEGG Pathway功能分析,筛选出53个与乌桕叶色相关的DEG,包括与花青素合成有关的基因14个,与卟啉和叶绿素代谢有关的基因22个,与类胡萝卜素生物合成有关的基因17个。其中花青素合成途径相关基因在乌桕转色后相对表达量上升,叶绿素、类胡萝卜素合成途径相关基因相对表达量下降,而叶绿素、类胡萝卜素降解途径相关基因相对表达量上升,该结果与叶片中色素含量的变化趋势一致。本研究结果可为探究乌桕叶片呈色机制提供理论依据。
关键词: 乌桕;叶色变化;转录组;基因挖掘;分子机制;呈色
中图分类号: S687.9 文献标识码: A 文章编号: 1000-4440(2024)08-1521-12
Mining of genes related to Triadica sebifera leaf color based on transcriptome sequencing
WANG Xiaoxiao, ZHENG Xu, ZHAO Wenjing, MIAO Meihua, LIU Xingman
(Lianyungang Academy of Agricultural Sciences, Lianyungang 222000, China)
Abstract: Triadica sebifera is a frequently-used color-leafed plant in landscaping because of its strong salt-tolerance and remarkable leaf color change with seasons, and it has the best ornamental properties in autumn. In order to reveal the molecular mechanism of leaf coloration of Triadica sebifera, the transcriptomes of leaves of three self-selected varieties of Triadica sebifera (Lianjiu No.1, Yuntaihongjiu and Yuntaijinjiu) were sequenced before and after leaf color changed. A total of 123.78 GB sequencing data were obtained, with 70 815 high-quality Unigenes, of which 48 367 were functionally annotated. A total of 2 674 shared differentially expressed genes (DEGs) of different comparison groups were identified from the transcriptome data of three Triadica sebifera varieties before and after color transformation, through pairwise comparison. Go analysis revealed that DEGs were mainly related to biological functions such as Cell process, Cell and Binding. Through functional analysis of KEGG Pathway, 53 DEGs related to leaf color were screened, including 14 genes related to anthocyanin synthesis, 22 genes related to porphyrin and chlorophyll metabolism and 17 genes related to biosynthesis of carotenoid. The relative expression levels of genes related to anthocyanin biosynthesis pathway were increased and those related to chlorophyll and carotenoid biosynthesis pathways were decreased, the relative expression levels of genes related to chlorophyll and carotenoid degradation pathways were increased, which results were consistent with the change trends of pigment content in leaves. The results of this study can provide a theoretical basis for exploring the mechanism of leaf coloration of Triadica sebifera.
Key words: Triadica sebifera;leaf color change;transcriptome;gene mining;molecular mechanism;coloration
乌桕(Triadica sebifera)隶属大戟科(Euphorbiaceae)乌桕属(Triadica),在中国栽培历史悠久,耐盐碱能力强,具有观赏、油用、药用等多种用途。乌桕树体高大,在秋季呈现绿、红、黄、紫等丰富的叶色,因此常用于道路绿化、公园造景,极具观赏价值[1]。目前对乌桕的研究主要集中在繁殖栽培[2]、油用品质[3]、种子性状[4]等方面。倪正[5]通过对比金黄4号、合红6号和滁紫1号不同发育期叶片色素含量和N元素含量,阐明了两者对叶色的影响。吴飞洋等[6]通过探究影响乌桕叶片转色的环境因素,发现山地红壤条件下的全光照处理更有利于秋季乌桕叶色的呈现。目前对乌桕叶片呈色机理的研究主要集中在生理特性和环境因子上,在分子水平上对乌桕呈色机制的研究还鲜有报道。
色素是植物叶片呈色的物质基础,叶绿素、类胡萝卜素、花色素苷是决定叶色的主要色素,其中由花青素和糖组成的糖苷是红叶植物的主要呈色物质[7]。当色素含量和比例发生变化时,叶色也会随之改变[8]。近年来,转录组测序(RNA-Seq)技术不断迭代升级,已成为研究彩叶植物呈色机制的重要工具。利用转录组测序技术,Dong等[9]发现,在热胁迫下鸡爪槭(Acer palmatum)中花青素和类胡萝卜的生物合成相关基因表达量显著上调,而叶绿素的生物合成相关基因表达量显著下调,色素合成相关基因表达量的变化是叶色由红变绿的直接分子机制。Liu等[10]对三色观赏甘蓝(Brassica oleracea L. var. acephala)转录组进行测序发现,甘蓝叶片从绿色转为白色是由于叶绿素生物合成过程受到抑制。
连桕1号、云台红桕及云台金桕均是从乌桕实生苗中选育出的新品种。其中,连桕1号叶片硕大,叶面积为普通乌桕的2倍,秋季叶片呈紫红色,最佳观叶期25 d。云台红桕早秋叶片呈亮红色,最佳观叶期比连桕1号提早1周。秋季云台金桕叶片呈金黄色,叶片转色早,观赏期长。此外,3个乌桕品种耐盐能力强,均可在含盐量5‰的沿海地区种植。本研究以上述品种转色前后的叶片(绿色叶、红色叶、黄色叶)为研究对象,探究色素合成相关基因的差异表达情况,以揭示乌桕叶片呈色机制,同时为调控乌桕叶色、延长观赏期提供理论依据。
1 材料与方法
1.1 试验材料
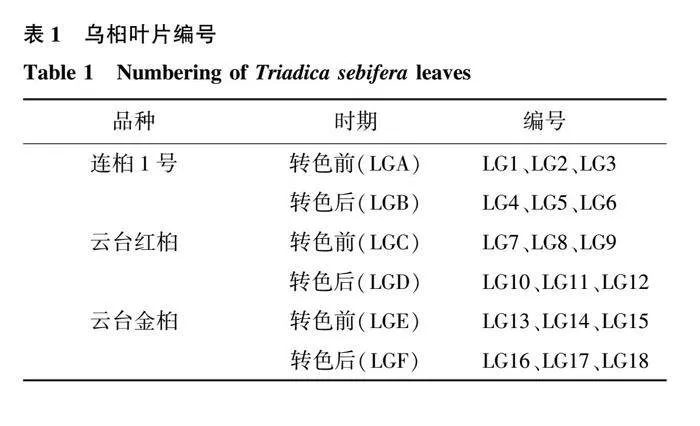
试验材料为连云港市农业科学院东辛试验基地自主选育的3个乌桕品种:连桕1号、云台红桕、云台金桕。于2021年9月至11月分别采集3个乌桕品种的转色前和转色后的叶片,3个乌桕品种的叶片转色前均为绿色,转色后分别为紫红色、红色和金黄色,每种叶片设置3次生物学重复,依次进行编号(表1)。
1.2 试验方法
1.2.1 色素含量的测定 花青素、叶绿素和类胡萝卜素含量分别参照植物原花青素试剂盒、植物叶绿素含量试剂盒、类胡萝卜素含量试剂盒(苏州科铭生物技术有限公司产品)说明书,使用分光光度法进行测定,均为鲜重含量。
1.2.2 总RNA的提取与质量检测 使用MiniBEST Plant RNA Extraction试剂盒(日本TaKaRa公司产品)提取总RNA,随后使用核酸蛋白质浓度测定仪(德国Eppendorf公司产品,产品型号为BioPhotometer Plus 6132)检测RNA的纯度、浓度和完整度,将RNA保存于-80 ℃冰箱中备用。
1.2.3 cDNA文库的构建及测序 用带有Oligo dT的磁珠特异性结合带有PolyA尾的mRNA,利用打断试剂使mRNA片段化,以打断后的mRNA为模板合成一链cDNA,随后利用二链合成反应体系合成二链cDNA。使用试剂盒纯化回收、末端修复并连接测序接头,然后对片段大小进行选择,最后进行PCR扩增。cDNA文库的测序在Illumina平台上进行。
1.2.4 测序数据的过滤与组装 对原始数据(Raw reads)进行过滤,得到高质量序列(Clean reads)。使用Trinity软件进行de novo组装,利用CD-HIT软件聚类得到非冗余序列(Unigenes)。使用eXpress软件计算Unigenes的表达水平,表达水平用FPKM值表示。
1.2.5 Unigenes功能注释 用7个功能数据库对组装得到的Unigenes进行注释。其中KEGG、GO、NR、eggNOG、SwissProt、KOG注释通过Diamond软件进行,Pfam注释通过HMMER软件进行。
1.2.6 差异表达基因(DEG)的筛选 首先筛选保留counts>2的基因,利用DESeq2软件对各样本基因的counts数目进行标准化处理,计算差异表达倍数(Fold change),将q<0.05且Fold change>2作为筛选条件,采用负二项分布检验的方式进行差异显著性检验,最终根据检验结果确定DEG。
1.2.7 DEGs的表达模式分析 使用TBtools软件可视化展示候选DEG的相对表达量。
2 结果与分析
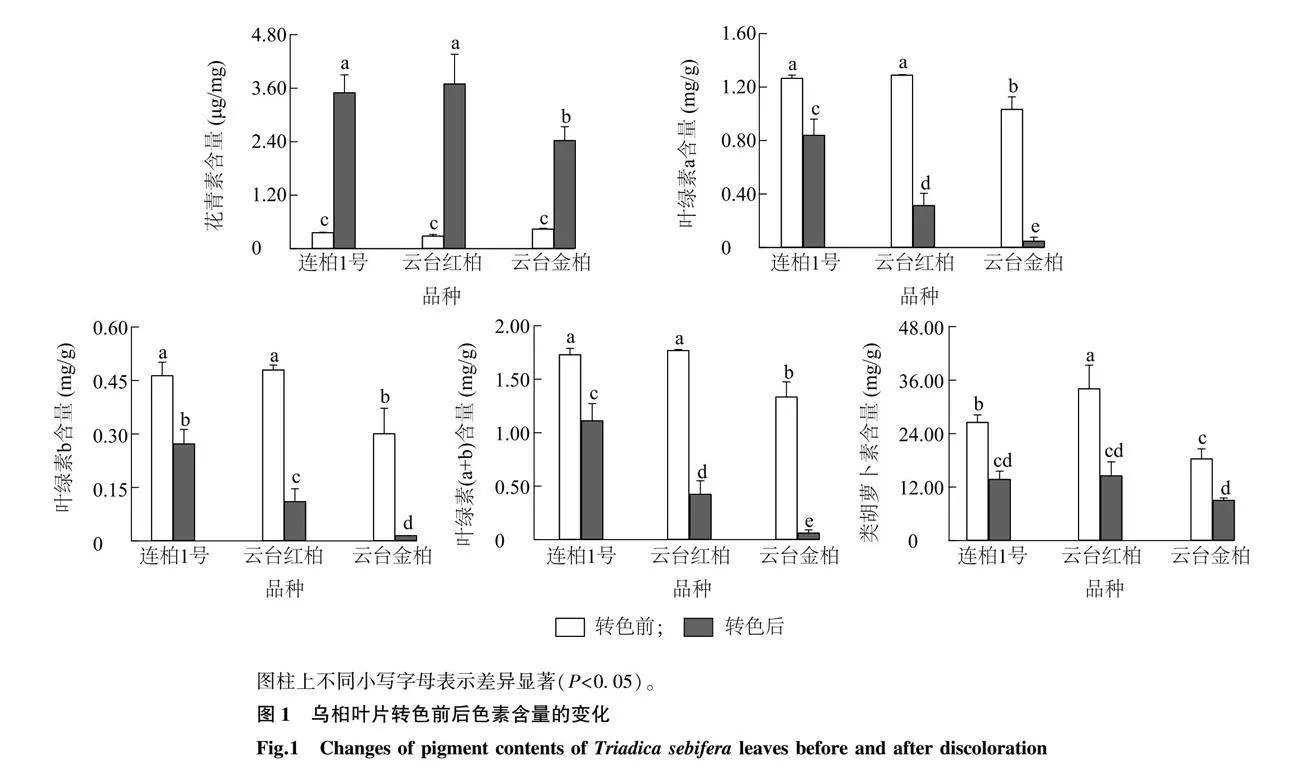
2.1 乌桕转色前后色素含量的变化
由图1可以看出,转色后连桕1号、云台红桕、云台金桕叶片的花青素含量显著高于转色前,而叶绿素a、叶绿素b和类胡萝卜素含量均显著低于转色前(P<0.05)。其中,连桕1号转色后的花青素含量是转色前的9.84倍,叶绿素(a+b)和类胡萝卜素含量分别为转色前的64.30%和51.70%;云台红桕转色后的花青素含量是转色前的13.20倍,叶绿素(a+b)和类胡萝卜素含量分别为转色前的23.94%和42.62%;云台金桕转色后的花青素含量是转色前的5.54倍,叶绿素(a+b)和类胡萝卜素含量分别为转色前的4.56%和49.18%。
2.2 转录组测序结果及质量评估
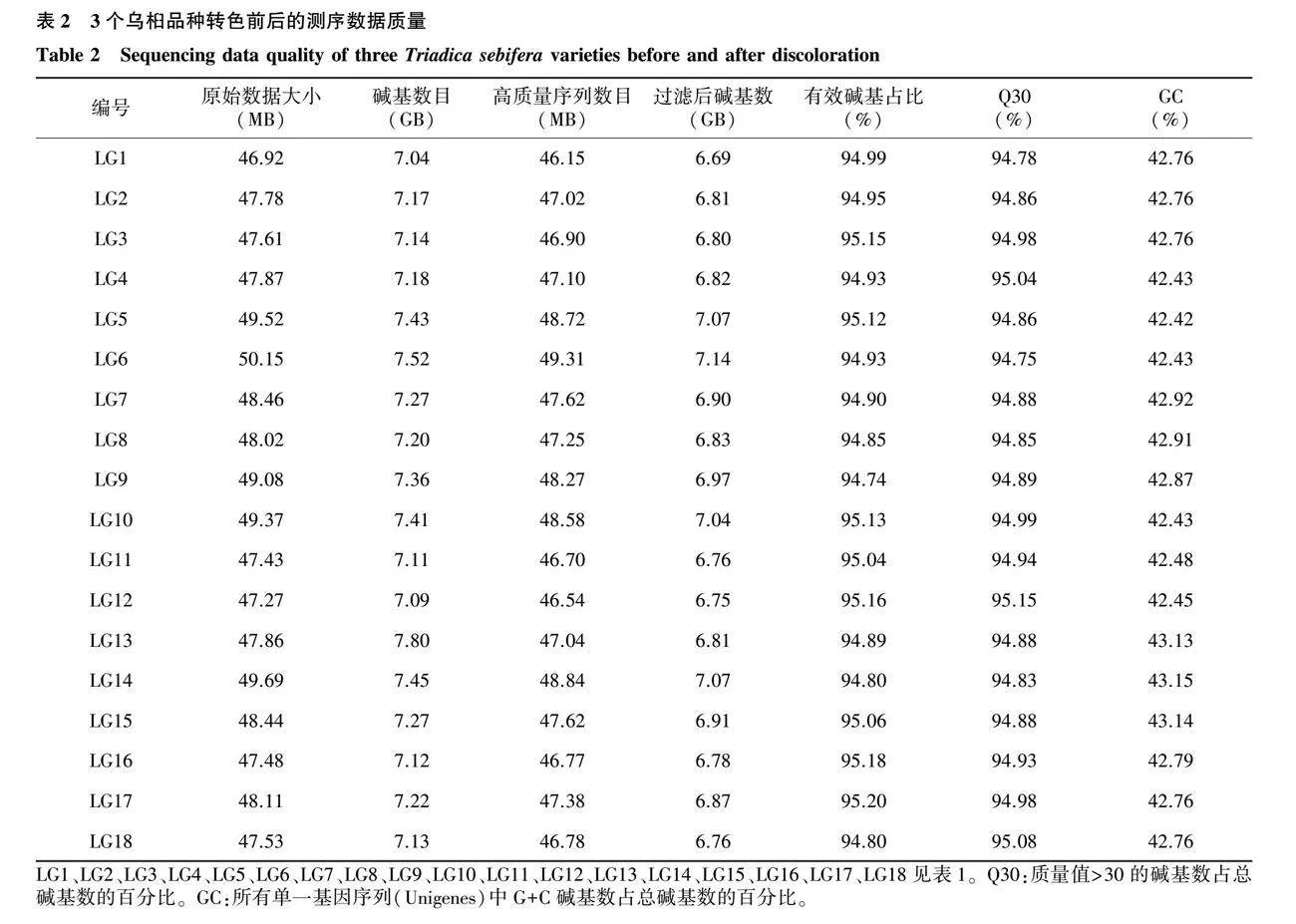
以3个乌桕品种转色前后的叶片为材料,构建18个cDNA文库,使用Illumina平台进行转录组测序,共获得123.78 GB序列数据,拼接出70 815个Unigenes。将Raw reads过滤后,平均每个文库的Clean reads为47.48 MB,有效数据量为6.69~7.14 GB,Q30碱基均不低于94.75%,平均GC含量为42.74%(表2)。以上研究结果表明,本次测序数据质量良好,可用于后续分析。
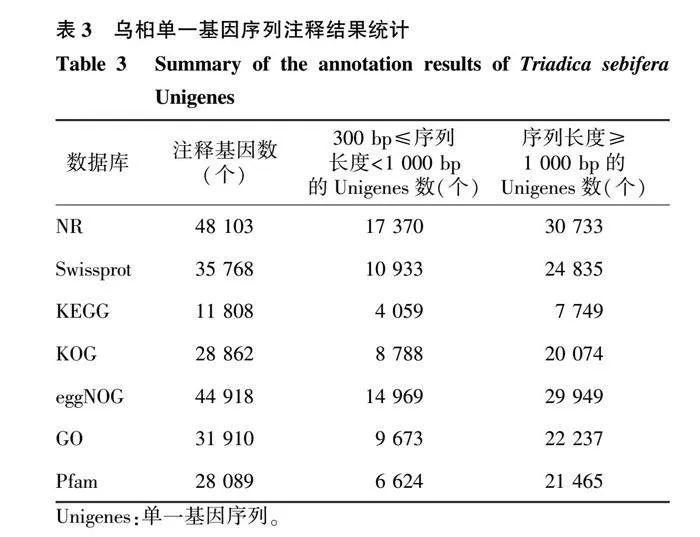
2.3 Unigenes功能注释
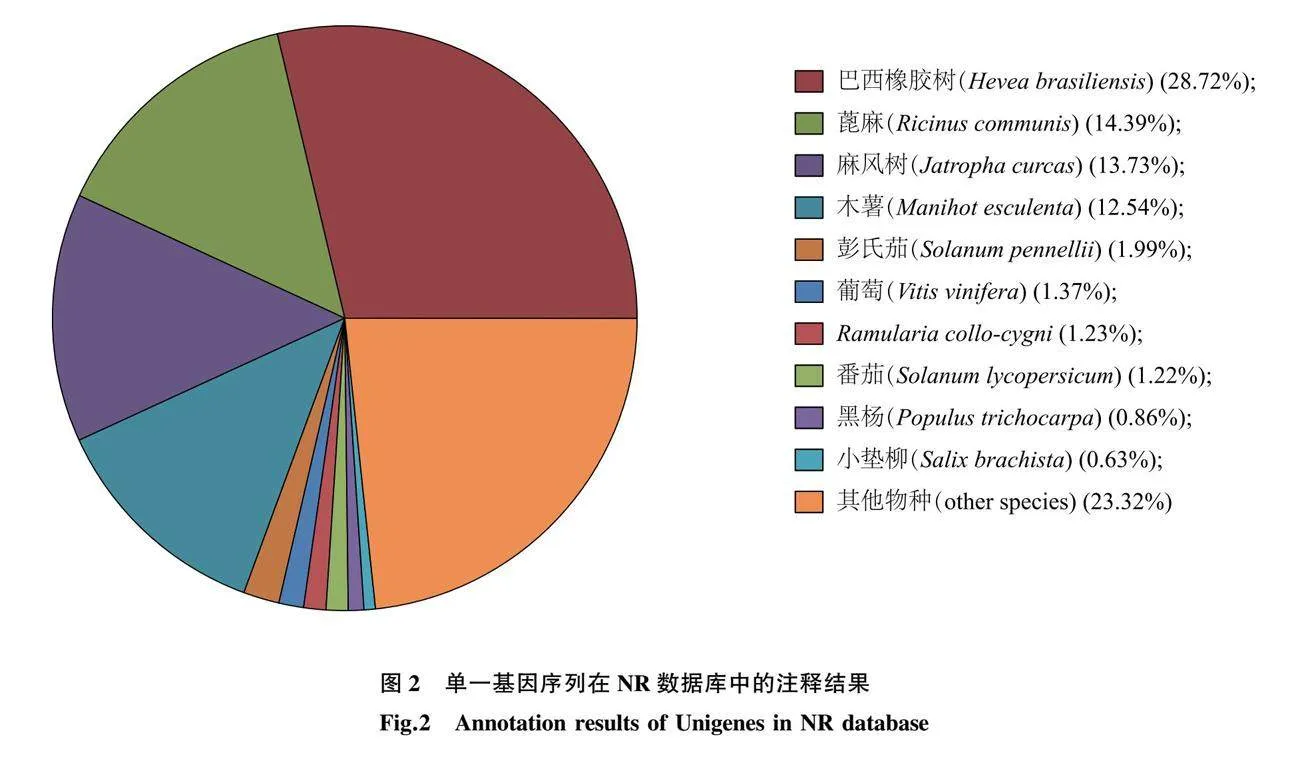
将得到的Unigenes在7个数据库(NR、SwissProt、KEGG、KOG、eggNOG、GO和Pfam)中进行功能注释的结果见表3。有6 633个Unigenes(9.37%)被7个数据库同时注释,有48 367个Unigenes(68.30%)被任一数据库注释。注释到Unigenes数量最多的为NR数据库,共有48 103个Unigenes与其显著相关,占总数的67.93%,其中,序列长度为300~<1 000 bp的Unigenes占24.53%,序列长度≥1 000 bp的占43.40%。
NR注释结果显示,与乌桕具有同源性的物种有10个,其中巴西橡胶树同源性较高,达28.72%,其次为蓖麻、麻风树、木薯,同源性均在12.54%及以上(图2)。
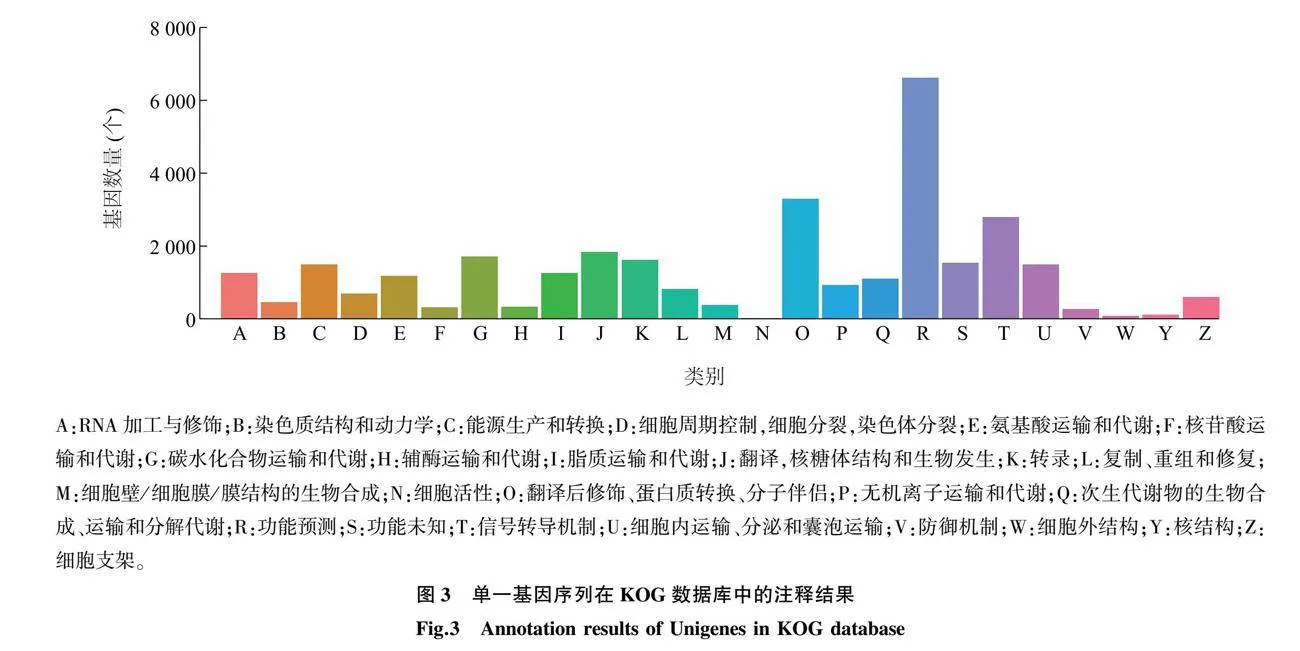
随后将乌桕Unigenes序列注释到KOG数据库,得到基因同源物的分类信息,结果如图3所示。32 164个Unigenes根据基因功能归纳为25个组,其中注释到功能预测(General function prediction only)类别的Unigenes数量最多,有6 635个,占注释总数的20.63%;其次是翻译后修饰(Posttranslational modification)、蛋白质转换(Protein turnover)、分子伴侣(Chaperones)类别,有3 295个Unigenes,占总数的10.24%,注释到信号转导机制(Signal transduction mechanisms)类别的Unigenes有2 799个,占总数的8.70%。
2.4 Unigenes的差异表达分析
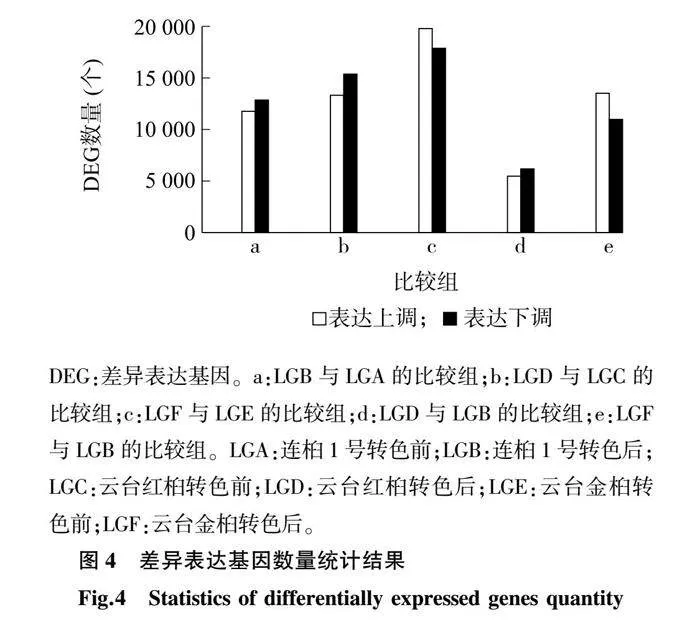
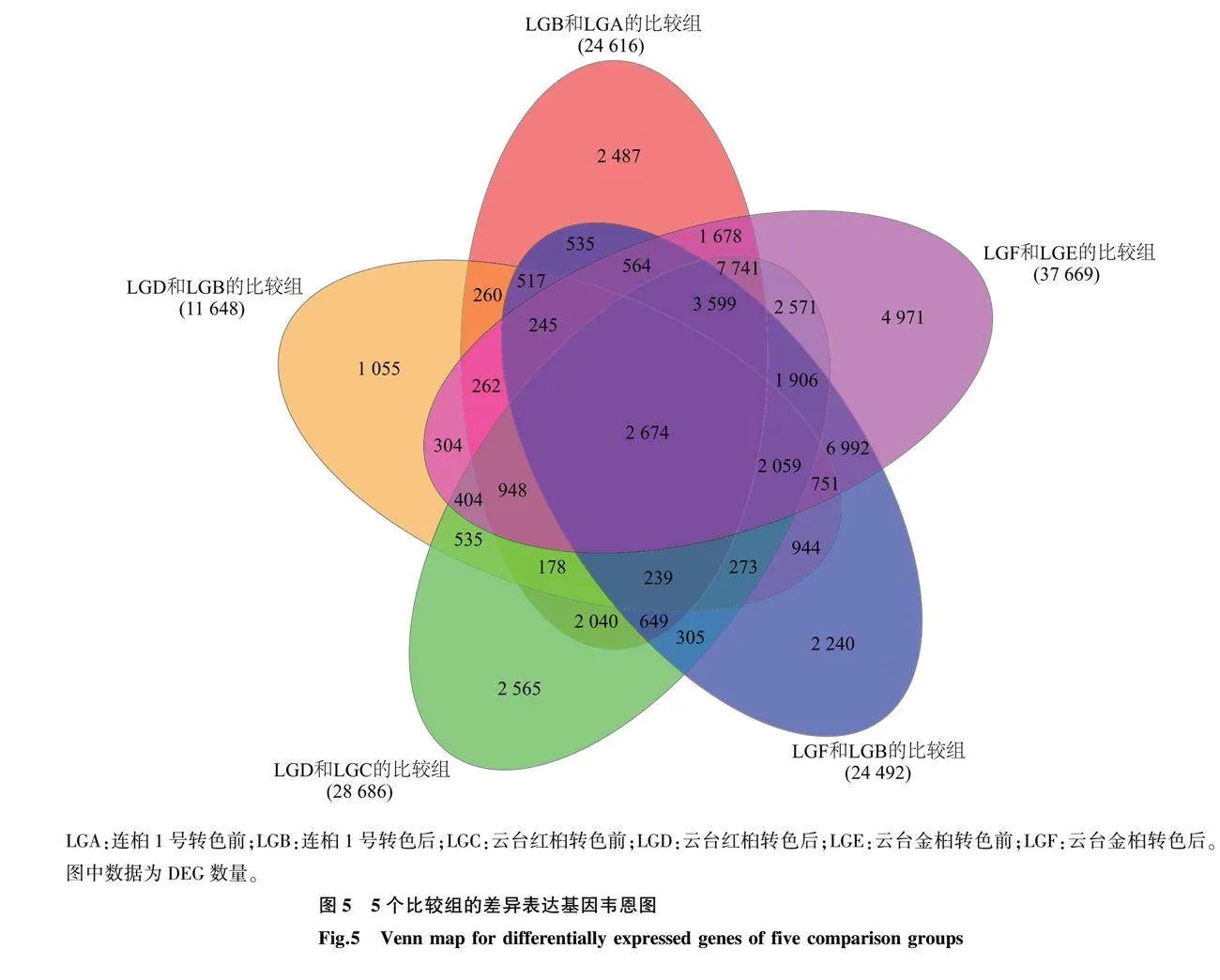
为获得乌桕叶色变化的相关基因,将连桕1号转色前(LGA)、连桕1号转色后(LGB)、云台红桕转色前(LGC)、云台红桕转色后(LGD)、云台金桕转色前(LGE)、云台金桕转色后(LGF)的转录组数据进行两两对比,分为LGB和LGA、LGD和LGC、LGF和LGE、LGD和LGB和LGF和LGB 5个比较组,并将q<0.05且Fold change>2作为筛选条件来筛选DEG,共鉴定出52 491个DEG,DEG数量统计结果如图4所示。LGB和LGA的比较组共有24 616个DEG,其中有11 765个DEG表达上调,12 851个表达下调;LGD和LGC的比较组共有28 686个DEG,其中有13 316个DEG表达上调,15 370个DEG表达下调;LGF和LGE的比较组共有37 669个DEG,其中有19 789个DEG表达上调,17 880个DEG表达下调;LGD和LGB的比较组共有11 648个DEG,其中有5 469个DEG表达上调,6 179个DEG表达下调;LGF和LGB的比较组共有24 492个DEG,其中有13 515个DEG表达上调,10 977个DEG表达下调。5个比较组共有的DEG有2 674个(图4、图5)。
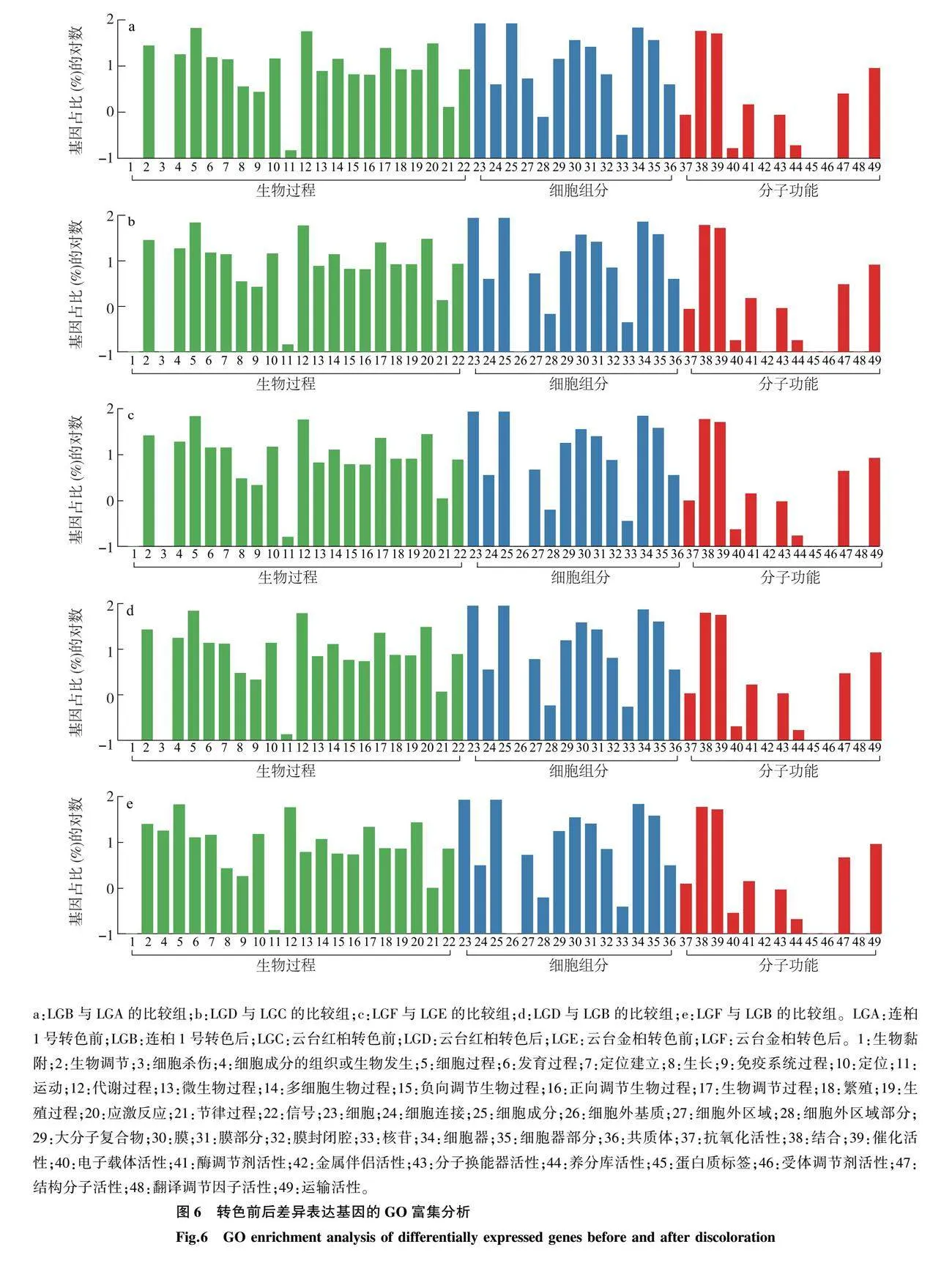
2.5 DEG的GO富集分析
对3个乌桕品种叶片转色前后的DEG进行GO富集分析发现,所有的DEG被富集在生物过程、细胞组分和分子功能三大类别。在生物过程类别中,DEG主要富集在细胞过程和代谢过程中,LGB 和LGA的比较组中的DEG数量分别为7 936个和6 746个,LGD和LGC的比较组中DEG数量分别为9 582个和8 224个,LGF和LGE的比较组中DEG数量分别为12 836个和10 923个,LGD和LGB的比较组中DEG数量分别为3 938个和3 450个,LGF和LGB的比较组中DEG数量分别为8 423个和7 296个。在细胞组分类别中,DEG主要富集在细胞和细胞成分中,LGB和LGA的比较组中的DEG数量分别为10 101个和10 090个,LGD和LGC的比较组中DEG数量分别为12 215个和12 197个,LGF和LGE的比较组中DEG数量分别为16 216个和16 191个,LGD和LGB的比较组中DEG数量分别为5 058个和5 051个,LGF和LGB的比较组中DEG数量分别为10 631个和10 613个;此外,在5个比较组中有大量DEG富集在分子功能类别中的结合和催化活性中(图6)。
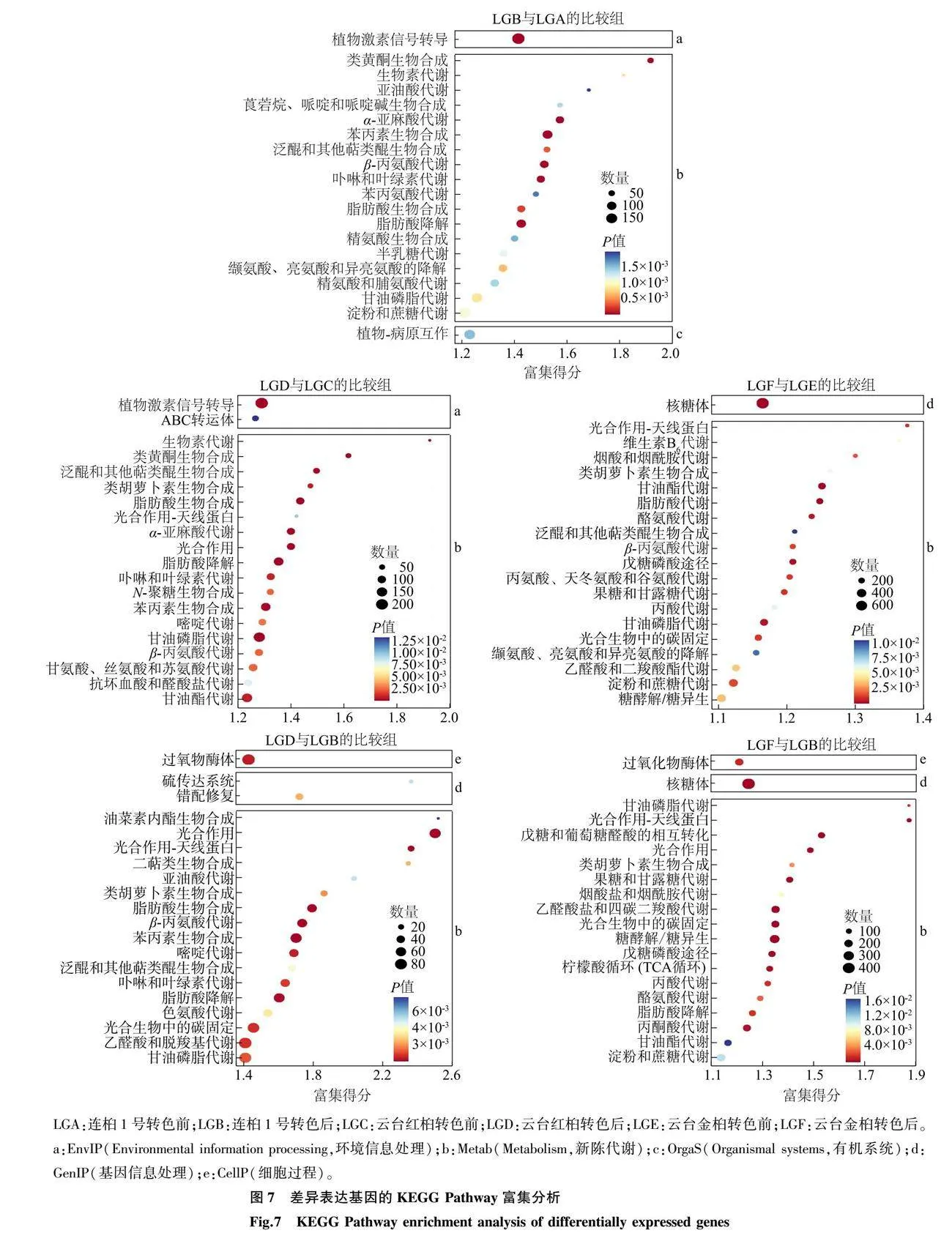
2.6 DEG的KEGG Pathway分析
KEGG Pathway注释分类对明确DEG的生物学功能起到重要作用[11]。LGB和LGA、LGD和LGC、LGF和LGE、LGD和LGB、LGF和LGB 5个比较组分别得到了126条、127条、127条、125条、126条富集代谢通路,富集的DEG分别为6 515个、7 765个、10 825个、3 378个、7 428个。5个比较组中DEG富集程度排名前20条的代谢通路如图7所示,可以看出,DEG在类黄酮生物合成、苯丙素生物合成、卟啉和叶绿素代谢、类胡萝卜素生物合成等通路中的富集程度较高,可能与乌桕叶色变化过程相关。
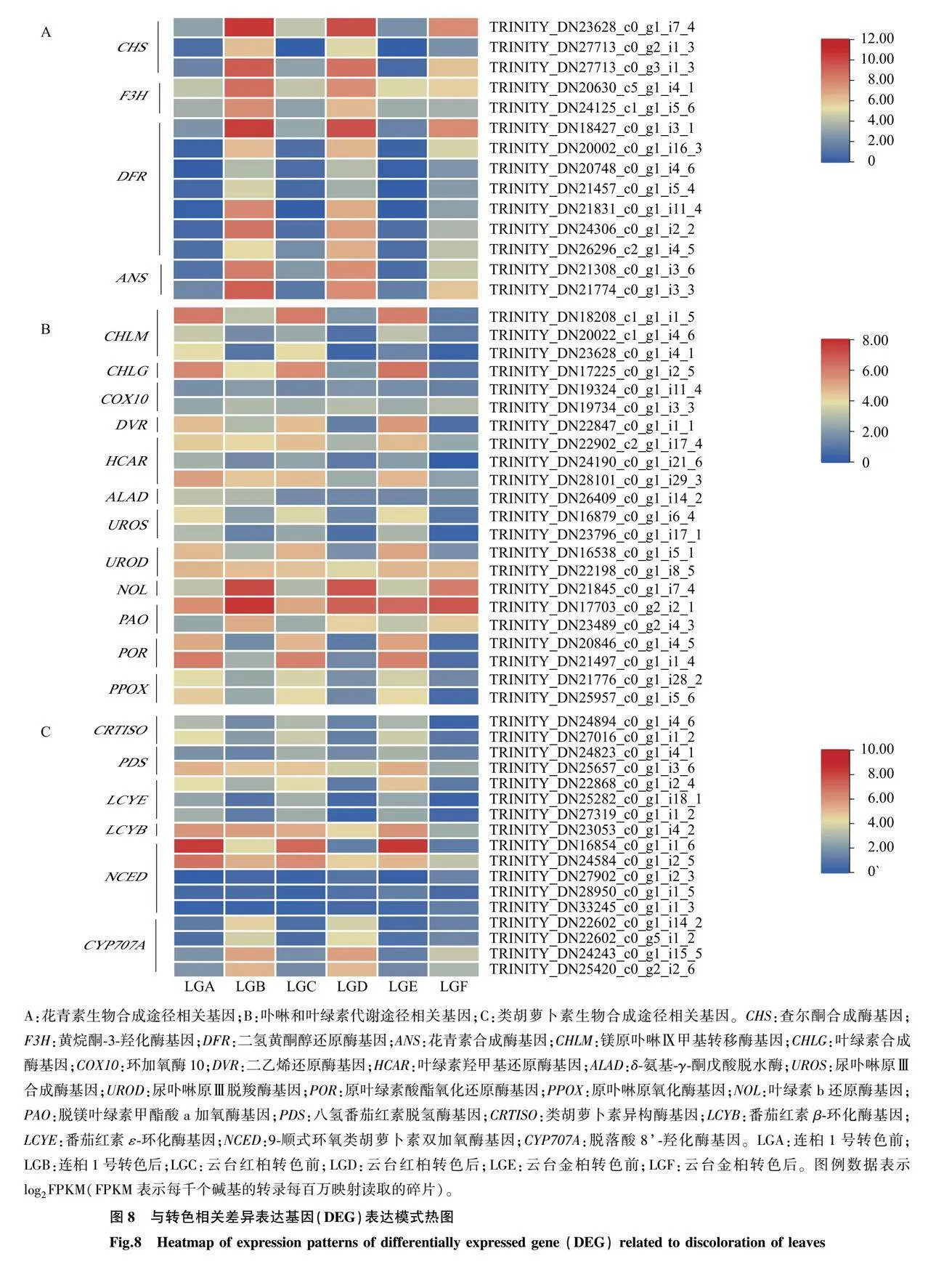
2.7 3种乌桕叶色相关基因的表达模式分析
基于KEGG富集结果,对花青素生物合成途径、卟啉和叶绿素代谢途径以及类胡萝卜素生物合成途径相关的53个DEG的相对表达量进行可视化展示。
本研究在6种不同叶色状态的乌桕叶片中,筛选出14个与花青素合成相关的DEG,包括查尔酮合成酶基因(CHS)、黄烷酮-3-羟化酶基因(F3H)、二氢黄酮醇还原酶基因(DFR)、花青素合成酶基因(ANS)(图8A)。随着连桕1号、云台红桕和云台金桕叶片在秋季转色,这些基因的表达水平均上调,且在连桕1号转色后查尔酮合成酶基因(CHS)、黄烷酮-3-羟化酶基因(F3H)、二氢黄酮醇还原酶基因(DFR)、花青素合成酶基因(ANS)表达水平的提升最为明显。在卟啉和叶绿素代谢途径中筛选出22个DEG,随着叶片发育,叶色转红、转黄,镁原卟啉Ⅸ甲基转移酶基因(CHLM)、叶绿素合成酶基因(CHLG)、二乙烯还原酶基因(DVR)、叶绿素羟甲基还原酶基因(HCAR)、δ-氨基酮戊酸脱水酶(ALAD)、尿卟啉原Ⅲ合成酶基因(UROS)、尿卟啉原Ⅲ脱羧酶基因(UROD)、原叶绿素酸酯氧化还原酶基因(POR)、原卟啉原氧化酶基因(PPOX)等与叶绿素合成相关的基因相对表达量下降;而叶绿素b还原酶基因(NOL)、脱镁叶绿素甲酯酸a加氧酶基因(PAO)等与叶绿素降解相关的基因相对表达量上升(图8B)。从类胡萝卜素生物合成途径中筛选出17个DEG。与转色前相比,乌桕转色后叶片中参与类胡萝卜素生物合成的多种关键酶基因相对表达量下降,如八氢番茄红素脱氢酶基因(PDS)、类胡萝卜素异构酶基因(CRTISO)、番茄红素环化酶基因(LCYE、LCYB)等,参与类胡萝卜素降解途径的部分9-顺式环氧化类胡萝卜素双加氧酶(NCED)基因表达量上升,且各个基因之间的表达量相差较大,CYP707A基因家族相关基因的表达量上升(图8C)。
3 讨论
Illumina Solexa测序技术是利用边合成边测序和可逆终止子原理的双端测序,具有较高的准确性及灵敏度,是研究植物生长发育的有力工具[12]。目前,人们已对许多彩叶植物进行了转录组测序,如文心兰(Oncidium hybridum)[13]、罗汉松(Podocarpus costalis)[14]、杜梨(Pyrus betulifolia Bunge)[15]、紫薇(Lagerstroemia indica)[16]等,为研究彩叶植物呈色机理奠定了基础。本研究对连桕1号、云台红桕、云台金桕转色前后的叶片进行转录组测序,共构建18个cDNA文库,获得123.78 GB数据,Q30碱基不低于94.75%,平均GC含量42.74%,表明本次测序质量较高,乌桕转录组数据满足后续分析要求。
本研究在NR、SwissProt、KEGG、KOG、eggNOG、GO和Pfam 7个数据库中共成功注释到48 367个Unigenes。随后通过差异表达分析共鉴定到124 437个DEG,其中5个比较组共有的DEG为2 674个。GO功能分类结果表明,乌桕叶色变化与细胞过程和代谢过程(生物过程)、细胞和细胞成分(细胞组分)、结合和催化活性(分子功能)等过程密切相关;KEGG富集分析结果显示,在类黄酮生物合成、苯丙素的生物合成、卟啉和叶绿素代谢、类胡萝卜素生物合成等通路中的DEG显著富集,这些代谢途径可能与乌桕的叶色变化有关。
花青素的生物合成受多种结构酶基因的控制,这些基因可分为早期生物合成基因(CHS、F3H)和晚期生物合成基因(DFR、ANS)[17-18]。其中CHS是启动花青素合成的端口基因,负责调控花青素等类黄酮物质的合成和积累[19]。F3H位于CHS下游,是控制二氢黄酮醇合成的关键基因,二氢黄酮醇在DFR的作用下,进一步生成无色的花青素,然后由ANS催化成有颜色的花青素,从而影响植物组织着色[20-22]。本研究中,相较于绿色叶,红色叶和黄色叶中CHS、F3H、DFR、ANS等基因相对表达量和花青素含量显著上升,这与前人关于鸡爪槭(Acer palmatum)[23]和彩叶桂(Osmanthus fragrans)[24]叶色的研究结果类似。由此推测,这些基因表达上升可能导致花青素的合成与积累量升高,从而促使乌桕红色和黄色叶片的形成。
叶绿素是植物光合色素的重要组成之一[25-32],呈绿色或蓝绿色。Zhou等[33]分别对绿色和白色花椰菜进行研究发现,绿色植株中参与叶绿素生物合成的相关基因表达水平更高。POR和CHLG均为叶绿素合成途径中的关键酶,前者能够催化原叶绿素酸酯向叶绿素的转化,其亚型PORB还具有平衡植物体内原叶绿素酸酯的作用;后者负责脱植基叶绿素酯化,完成叶绿素生物合成的最终步骤[34-35]。本研究发现乌桕转色后POR、CHLG基因相对表达量下降,且在云台金桕中最为明显,这可能导致叶绿素生物合成过程受阻,从而使乌桕叶片褪绿变黄。已有研究结果表明,在紫花槭中NOL基因表达量上升是造成叶绿素降解、叶片呈现红色的重要原因[36],本研究结果与之相似。同时,本研究测定的乌桕转色前后的叶绿素含量,其变化趋势与转录组分析结果一致。
类胡萝卜素的生物合成与叶绿素的生物合成相互协调,其含量会对叶色造成影响[37]。八氢番茄红素是植物体内率先合成的类胡萝卜素,经PDS和CRTISO等催化生成番茄红素,然后在LCYB、LCYE的作用下转化为α-胡萝卜素和β-胡萝卜素[38]。Chai等[39]研究水稻斑马叶突变体时发现,编码CRTISO的ZEBRA2基因突变,会导致保护性类胡萝卜素含量降低。银杏叶片转色后期,LCYB显著下调表达,同时伴随着类胡萝卜素含量下降[40]。9-顺式环氧化类胡萝卜素双加氧酶(NCED)是参与类胡萝卜素降解的重要酶之一,也是控制类胡萝卜素向脱落酸(ABA)转化的限速中枢[41]。CYP707A基因家族编码的脱落酸8’-羟基化酶对ABA含量变化起重要作用。本研究发现,乌桕在类胡萝卜素合成阶段,PDS、CRTISO、LCYB、LCYE等基因相对表达量下降,而在类胡萝卜素降解阶段NCED、CYP707A等基因相对表达量上升,且类胡萝卜素含量显著下降,这可能会导致乌桕叶片中ABA含量增多,从而加速叶片衰老,降低活性氧(ROS)的清除效率,因此光氧化损伤可能是造成突变体叶色变化的原因之一。
4 结论
本研究对3个乌桕品种连桕1号、云台红桕、云台金桕转色前后的叶片进行转录组测序及分析,共获得123.78 GB测序数据,70 815个高质量Unigenes;将全部Unigenes与7个数据库进行比对,有48 367个Unigenes得到功能注释。GO分析结果显示,DEG主要与细胞过程和代谢过程(生物过程)、细胞和细胞成分(细胞组分)、结合和催化活性(分子功能)等生物学功能相关。通过KEGG分析,筛选出与花青素、叶绿素、类胡萝卜素等相关的53个DEG,其中花青素合成途径相关基因在乌桕转色后相对表达量上升,叶绿素、类胡萝卜素合成途径相关基因相对表达量下降,而叶绿素、类胡萝卜素降解途径相关基因相对表达量上升。同时对3个乌桕品种转色前后的主要色素含量进行测定发现,花青素含量在转色后显著上升,叶绿素和类胡萝卜素含量在转色后显著下降。
参考文献:
[1] 陈百强,曹受金,沈 鑫,等. 观赏乌桕品种表型多样性分析及综合评价[J]. 分子植物育种,20(12):4108-4120.
[2] 张广涛,包厚天,黄卫和,等. 不同施氮处理对乌桕容器苗养分状况的影响[J]. 西北林学院学报,2023,38(1):80-87.
[3] 王文静,董泰玮. 超声波辅助提取乌桕籽油的工艺优化研究[J]. 中国油脂,2019,44(4):6-9.
[4] 向珊珊,杜洋文,程军勇,等. 长江流域乌桕优良种质资源种子品质性状评价[J]. 经济林研究,2023,41(2):30-37.
[5] 倪 正. 观叶乌桕优株选择及其叶片呈色生理生化分析[D]. 合肥:安徽农业大学,2023.
[6] 吴飞洋,柳新红,董峰平,等. 光照和土壤对乌桕秋季叶片色素及可溶性糖的影响[J]. 西南林业大学学报(自然科学),2019,39(6):41-48.
[7] 张 敏,钱 猛,倪竞德,等. 乌桕秋叶转色前后生理特性及超微结构的变化[J]. 东北林业大学学报,2012,40(1):20-24.
[8] 沈周高,谢应华,范晓娟,等. 叶色变异茶树生理生化特征及其变异机制的研究进展[J]. 安徽农业大学学报,2023,50(4):582-594.
[9] DONG H Y, XU B, JI K S. Comparative transcriptome analysis of genes involved in response to thermal stress and leaf colour change of Acer palmatum[J]. Scientia Horticulturae,2019,255:77-85.
[10]LIU X P, ZHANG B, WU J, et al. Pigment variation and transcriptional response of the pigment synthesis pathway in the S2309 triple-color ornamental kale (Brassica oleracea L. var. acephala) line[J]. Genomics,2020,112(3):2658-2665.
[11]王晓晓. 凤丹对高温胁迫的响应及缓解措施研究[D]. 扬州:扬州大学,2023.
[12]LIANG Y, CHEN S Y, LIU G S. Application of next generation sequencing techniques in plant transcriptome[J]. Hereditas,2011,33(12):1317-1326.
[13]SAKURABA Y, PARK S Y, PACK N C. The divergent roles of STAYGREEN (SGR) homologs in chlorophyll degradation[J]. Molecules and Cells,2015,38(5):390-395.
[14]范 美. 海岛罗汉松嫩叶叶色变化过程及分子机制研究[D]. 杭州:浙江农林大学,2023.
[15]陈 燕,郭 聪,王 莹,等. 杜梨叶片转录组分析[J]. 江苏农业科学,2022,50(3):58-67.
[16]王淑安,王 鹏,张振宇,等. 紫薇叶片转录组分析及叶绿素和类胡萝卜素等途径基因的鉴定[J]. 分子植物育种,2016,14(5):1059-1066.
[17]LIU Y, TIKUNOV Y, SCHOUTEN R E, et al. Anthocyanin biosynthesis and degradation mechanisms in solanaceous vegetables:a review[J]. Frontiers in Chemistry,2018,6:52.
[18]刘淑华,臧丹丹,孙 燕,等. 花青素生物合成途径及关键酶研究进展[J]. 土壤与作物,2022,11(3):336-346.
[19]LIM W S, and LI J R. Co-expression of onion chalcone isomerase in Del/Ros1-expressing tomato enhances anthocyanin and flavonol production[J]. Plant Cell Tissue Organ Culture,2017,128(1):113-124.
[20]BUER C S, MUDAY G K, DJORDJEVIC M A. Flavonoids are differentially taken up and transported long distances in Arabidopsis[J]. Plant Physiology,2007,145:478-490.
[21]李 莹,高振蕊,张 驰,等. 花青素合成途径中分子调控机制的研究进展[J]. 生态学杂志,2015,34(10):2937-2942.
[22]杜婷婷,宋治华,董碧莹,等. 木豆类黄酮代谢通路关键基因家族的鉴定与表达分析[J]. 农业生物技术学报,2021,29(12):2289-2303.
[23]ZHU L, WEN J, MA Q Y, et al. Transcriptome profiling provides insights into leaf color changes in two Acer palmatum genotypes[J]. Bmc Plant Biology,2022,22(1):589.
[24]黄均华,徐蕴晨,黄子洋,等. 彩叶桂(Osmanthus fragrans)品种‘虔南桂妃’叶片红色消退过程中的转录组分析[J]. 基因组学与应用生物学,2022,41(增刊1):1964-1972.
[25]李 硕,李美玄,刘英卉,等. 干旱-复水处理对吉林文冠果幼苗生理特性和光合参数的影响[J]. 江苏农业科学,2023,51(18):134-143.
[26]侬文莲,李秀芳,吴世清,等. 咸水灌溉下生物炭对玉米光合特性及产量的影响[J]. 排灌机械工程学报,2023,41(6):605-613.
[27]杨 洪,李旭毅,卿发红,等. 不同产量水平水稻群体光合特性和产量构成差异[J]. 江苏农业学报,2023,39(5):1089-1096.
[28]李金威,原慧芳,田耀华,等. 5个珠芽魔芋品种(系)的生长发育及其光合特性分析[J]. 南方农业学报,2023,54(4):1166-1174.
[29]王克晓,周 蕊,黄 祥,等. 油菜角果高光谱成熟指数构建[J]. 江苏农业学报,2023, 39(3):716-723.
[30]马 玲,杜明华,孟 露,等. 基于高光谱成像技术的番茄叶片叶绿素含量检测[J]. 江苏农业科学,2023,51(11):167-174.
[31]张雪芹,欧阳海波,谢志南,等. 不同品种油梨果实品质、光合特性比较及其相关分析[J]. 南方农业学报,2023,54(2):405-413.
[32]王声锋,徐亚泽,彭致功,等. 基于PROSAIL模型的夏玉米叶绿素含量垂直分层模拟[J]. 排灌机械工程学报,2022,40(6):603-610.
[33]ZHOU X J, FEI Z J, THANNHAUSER T W, et al. Transcriptome analysis of ectopic chloroplast development in green curd cauliflower (Brassica oleracea L. var. botrytis)[J]. BMC Plant Biology,2011,11 (1):169.
[34]REINBOTHE C, BAKKOURI M E, BUHR F, et al. Chlorophyll biosynthesis:spotlight on protochlorophyllide reduction[J]. Trends Plant Science,2010,15:614-624.
[35]田密霞,周福慧,姜爱丽,等. 芸薹属植物呈色机理研究进展[J]. 园艺学报,2023,50(9):1971-1986.
[36]翁 卓,高玉福,李佳霖,等. 基于转录组的紫花槭光合色素相关基因筛选与分析[J]. 分子植物育种,2024,22(6):1881-1891.
[37]郭 婷. 栾树彩叶突变体叶色变异机理的初步探究[D]. 北京:北京林业大学,2022.
[38]王紫璇,李佳佳,于旭东,等. 高等植物类胡萝卜素生物合成研究进展[J]. 分子植物育种,2021,19(8):2627-2637.
[39]CHAI C, FANG J, LIU Y, et al. ZEBRA2, encoding a carotenoid isomerase, is involved in photoprotection in rice[J]. Plant Molecular Biology,2011,75(3):211-221.
[40]何智冲. 银杏叶片衰老转色进程及调控研究[D]. 扬州:扬州大学,2020.
[41]JI K, KAI W B, ZHAO B, et al. SlNCED1 and SlCYP707A2:key genes involved in ABA metabolism during tomato fruit ripening[J]. Journal of Experimental Botany,2014,65:5243-5255.
(责任编辑:成纾寒)

