杨树水泡型溃疡病病原菌的分离鉴定及药剂抑菌分析




摘要采集发生水泡型溃疡病的杨树树皮病斑,在实验室内进行分离和分子鉴定,确定病原菌种类,并开展了百菌清对该病原菌的抑菌试验。结果表明:鉴定病原菌为杨树水泡型溃疡病病原菌,有性阶段为葡萄座腔菌(Botryosphaeria dothidea),无性阶段为小穴壳菌(Dothiorella gregaria);百菌清600倍稀释液对杨树水泡型溃疡病抑制率达到90%以上,百菌清对杨树水泡型溃疡病有较好的抑制效果。
关键词杨树;水泡型溃疡病;序列鉴定;百菌清;抑菌
中图分类号:S763.11文献标识码:Adoi:10.13601/j.issn.1005-5215.2024.05.007
Isolation and Identification of Pathogens of Poplar Vesicular Canker and Analysis of Fungicide Antibacterial
Wang Shitong
(Institute of Forest and Grassland Investigation and Planning,National Forestry and Grassland Administration,Beijing 100714,China)
AbstractPoplar bark lesions with vesicular canker were collected,isolated and molecularly identified in the laboratory to determine the pathogen species,and the antibacterial test of chlorothalonil against the pathogen was carried out. The results showed that the pathogen was identified as the pathogen of poplar vesicular canker. The sexual stage was Botryosphaeria dothidea,and the asexual stage was Dothiorella gregaria. The inhibition rate of chlorothalonil 600 times dilution on poplar vesicular canker reached more than 90%,and chlorothalonil had a good inhibitory effect on poplar vesicular canker.
Key wordspoplar;vesicular canker;sequence identification;chlorothalonil;antibacterial
杨树(Populus spp.)是世界中纬度平原地区栽培面积最大的速生用材林树种之一,具有生长快、成林早、产量高和易于更新等特点,因而被广泛用于集约栽培[1]。近年来,一些地区因没有做到适地适树、经营管理粗放等导致杨树病虫害发生严重,给林业生产造成巨大损失,威胁着杨树用材林和生态林的发展[2]。
杨树溃疡病是发生在枝干部、引起皮层局部溃疡性坏死等多种症状的重大病害。该病在我国东北、华北、西北、河南、江苏、安徽、山东等20多个省市和自治区发生[3],可危害青杨派、白杨派、黑杨派及欧美杨等在内的200多个杨树品种、杂交种和无性系,还可侵染多种其他树木,几乎遍及全球[4]。目前,杨树溃疡病在我国各杨树栽植区均有发生且危害严重,是阻碍杨树产业发展的重要因素之一[5]。因此,掌握杨树溃疡病发病规律,切实做好杨树溃疡病防治工作,对杨树产业发展具有重要意义。
1材料与方法
1.1 材料
1.1.1供试菌株
从辽宁省沈阳市国有新民市机械化林场5年生新林1号杨发病植株上采集树皮病斑,于实验室内进行分离纯化。
1.1.2供试培养基
PDA固体培养基。
1.1.3 试剂
DNA提取试剂盒:快捷性植物基因组DNA提取系统(天根生化科技有限公司);
PCR扩增试剂: 10×Ex Taqbuffer、dNTP、Ex Taq酶、ddH2O、Marker(DL2000)(TaKaRa生物工程有限公司);真菌通用引物:ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’),由上海生工生物工程有限公司合成;有效成分75%百菌清(利民化学有限责任公司)。
1.2方法
1.2.1病原菌分离
(1)培养基制备。
取新鲜马铃薯洗净去皮切成小块,用天平称取200 g,加适量水放置于电阻炉上加热至沸腾,持续加热25 min后用8层纱布过滤,弃滤渣,将滤液定容至1 L,加入20 g葡萄糖,再加入20 g琼脂,用玻璃棒搅拌至葡萄糖充分混匀并溶解,均匀分装于三角瓶中高压灭菌备用[6,7]。
(2)无菌病斑预处理。
将采集的病斑用无菌剪刀剪成约1 cm2的小块,用自来水进行病斑表面的冲洗, 75%的酒精清洗3次,1%氯化汞浸泡5 min,再用无菌水冲洗3次,即得到无菌病斑[8]。
(3)菌株分离、纯化。
将灭菌的PDA培养基趁热倒入无菌平皿中,待凝固后接种无菌病斑,封口,倒置于25 ℃恒温生化培养箱中培养。随时观察菌落变化,待菌落长到5 cm左右时,将菌落边缘菌丝转接至新固体PDA培养基中,获得进一步纯化后的纯菌株[9]。
1.2.2病原菌的分子鉴定
(1)DNA提取。
将纯菌株接种于新PDA培养基中,25 ℃恒温培养5 d,用无菌刀片刮取菌丝放于无菌研钵中,迅速加入液氮研磨成粉末,分装于1 mL离心管中,DNA提取过程见DNA提取试剂盒使用说明书[10]。
(2)DNA浓度测定和电泳检测。
用DHS NanoPro超微量紫外分光光度计进行测定,用1%琼脂糖凝胶进行电泳检测[11]。
(3)PCR扩增。
以提取DNA为模板,ITS1/ ITS4为引物进行PCR扩增[12]。
反应体系:10×PCR Buffer 2.5 μL、dNTP(2.5 mmol)2.0 μL、上游引物ITS1(10 mmol)0.5 μL、下游引物ITS4(10 mmol)0.5 μL、模板DNA 1.0 μL、Ex Taq酶 0.25 μL、ddH2O up to 25 μL。
反应条件:94 ℃预变性5 min,94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸45 s,72℃延伸10 min,反应30个循环,4 ℃终止反应。
电泳检测:
取5 μL反应产物用1%琼脂糖凝胶电泳检测[13]。
(4)序列Blast比对。
对电泳检测的PCR产物进行测序。测序结果在NCBI中进行Blsat比对,确定病原菌种类[13]。
1.2.3药剂抑菌试验
(1)带药培养基制备。
将不同浓度梯度的百菌清药剂(无菌水配置)依次加入到冷却40 ℃左右无菌PDA培养基中,混合均匀倒入平皿中,待培养基冷却后备用,使各培养基中百菌清的稀释倍数为400、600、800和1 000倍,以无菌水为对照,每组处理4次重复[14,15]。
(2)接种病害病原菌。
在无菌操作室用无菌打孔器(直径5 mm)在活化好的杨树病害病原菌边缘打孔,用接种铲挑取一片菌块,倒置接种至带药培养基中,封口膜封口,倒置于25 ℃生物培养箱中培养,待对照菌丝长至平皿边缘时终止生长[16,17]。
(3)计算与统计。
采用生长速率法测定菌丝生长抑菌率,并进行数据统计与分析[18-20]。
抑菌率=对照菌丝生长直径-处理菌丝生长直径对照菌丝生长直径×100%
2结果与分析
2.1杨树病害病原菌菌种分离
将采集的病原菌病斑接种至PDA平板培养基中,培养2 d后可见白色菌丝长出,转接纯化2次,获得纯种菌丝,将菌种命名为KY8090。生长情况如图1、图2。
2.2杨树病害病原菌分子鉴定结果
2.2.1DNA电泳检测
提取后的DNA经脂糖凝胶电泳检测,结果如图3。KY8090 DNA条带单一无杂质,无降解。
2.2.2DNA浓度检测
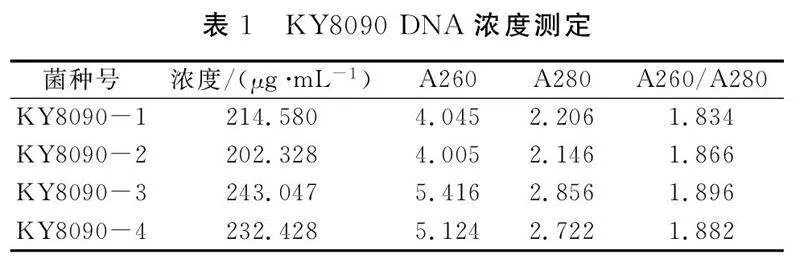
用DHS-NanoPro超微量紫外可见风光光度计对提取的KY8090 DNA样品进行浓度测定,结果见表1。提取的DNA浓度为200~250 μg·mL-1,A260/A280比值1.8~1.9,说明DNA较好,可以作为PCR反应模板。
2.2.3PCR扩增及电泳检测
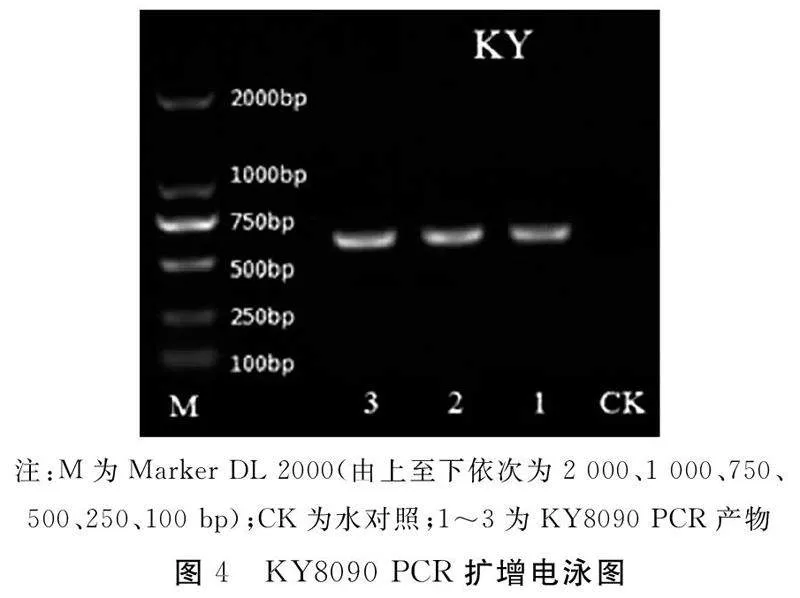
PCR反应结束后,取5 μL反应产物经1%琼脂糖凝胶电泳进行检测,电泳结果见图4。
扩增出来的目的片段处于同一位置,约600 bp的目的片段,条带单一,无杂带,无引物二聚体。
2.2.4PCR产物序列测定
经过生物公司序列测定,确定所测得的目的片段长度大小为550 bp,序列如下:
TTCCTCCCGGCCTTATTGATATGCTTAAGTTCAGCGGGTATCCCTACCTG
ATCCGAGGTCAACCTTGAGAAAAGTTCAGAAGGTTCGTCCGGCGGGCGAC
GCCCTGCGCTCCGAAGCGAGATGTATGTTCTACTACGCTTGAGGCAAGAC
GCCACCGCCGAGGTCTTTGAGGCGCGCCCGCAAAGGACGGTGCCCAATAC
CAAGCAGAGCTTGAGGGTTGTAATGACGCTCGAACAGGCATGCCCTTCGG
AATACCAAAGGGCGCAATGTGCGTTCAAAGATTCGATGATTCACTGAATT
CTGCAATTCACATTACTTATCGCATTTCGCTGCGTTCTTCATCGATGCCA
GAACCAAGAGATCCGTTGTTGAAAGTTTTAGTTTATTAAATGTTTTTCAG
ACTGCATCGTTTACTGACTGGAGTTTGATGGTCCTCTGGCGGGCGCTGGC
CACCCCCCCGGGGAGGGGGGCGGCCGCGGAGGACCGCGGCCCGCCAAAGC
AACAGAGGTAGGTACACAAAGGGTGGGAGGATCGGGCCGAGCCCGAATCA
2.2.5序列Blast比对结果
将测得目的序列在NCBI官网上进行Blast核酸比对,结果见图5。
KY8090与登记号为MN871641.1、MH393518.1、KC197771.1、EU520229.1、MG779570.1、KY393143.1、KY788305.1等菌株序列相似性较高。Query cover 均为100%,Ident均为99%,均为水泡型溃疡病病原菌,有性阶段为葡萄座腔菌(Botryosphaeria dothidea),属子囊菌亚门腔菌纲格孢腔菌目葡萄座腔菌属;无性阶段为小穴壳菌(Dothiorella gregaria),属半知菌亚门球壳孢目球壳孢科小穴壳属。确定KY8090为杨树水泡型溃疡病。
2.3药剂抑菌试验结果
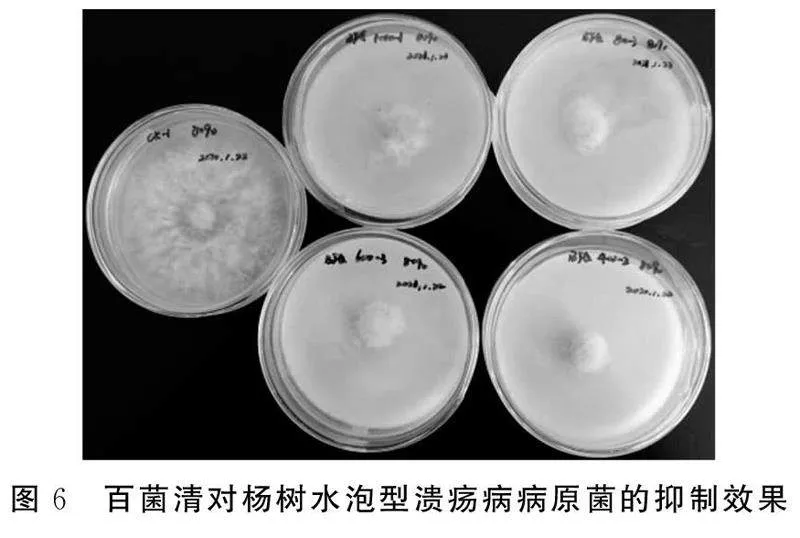
由表2和图6可见,对照培养基病原菌菌丝生长很快,带药培养基上病原菌菌丝生长缓慢。培养5 d左右,对照菌丝已延伸至平皿边缘,此时菌丝生长直径达85.27 mm,1 000倍稀释液的菌丝生长直径为13.86 mm,抑菌率为83.75%,而600倍稀释液的菌丝生长直径仅为7.38 mm,抑菌率为91.35%。各组间菌丝生长直径和抑菌率存在显著差异(P<0.05)。各组菌丝均为白色,对照菌丝向外延伸很长,而处理组菌丝向外几乎不延伸,各组均未产生孢子。
可见,随着百菌清稀释倍数减小(药剂浓度增大),抑制率逐渐增大,当达600倍稀释液时,抑菌率达90%以上。通过抑菌试验确定百菌清对杨树水泡型溃疡病有显著的抑菌作用,最适宜的抑菌浓度为600倍稀释液。
3结论与讨论
本研究对发病杨树的树皮病斑进行了病原菌分离,并进行分子鉴定,确定病原菌为杨树水泡型溃疡病病原菌,有性阶段为葡萄座腔菌,无性阶段为小穴壳菌。同时开展了保护型杀菌剂百菌清对杨树水泡型溃疡病抑菌作用试验,确定百菌清对杨树水泡型溃疡病有较好抑菌作用,最适宜的抑菌浓度为600倍稀释液,此时抑菌率达90%以上。
杨树是我国栽培广泛的一种重要树种,具有重要的经济效益、社会效益和生态效益。杨树病害及时准确的防治,可有效降低病害带来的巨大损失,提高木材产量和质量。百菌清是一种保护型杀菌剂,主要作用是使病原真菌细胞的新陈代谢受破坏而失去生命力。该药剂没有内吸传导作用,具有良好的黏附性、不易被雨水冲刷掉、药效期较长等特点。本研究仅开展了室内抑菌试验,还应进行林间病害防治试验来进一步分析百菌清对杨树病害的抑菌作用,以期为杨树水泡型溃疡病防治提供科学依据。
参考文献:
[1] 王胜东,杨志岩.辽宁杨树[M].北京:中国林业出版社,2006
[2] 刘巍,蔄胜军,纪纯阳,等.我国杨树枝干病害研究进展[J].林业科技开发,2013,27(1):1-4
[3] 陈海燕.杨树溃疡病病原菌营养体亲和性研究[D].杨凌:西北农林科技大学,2006
[4] 黄烈健,苏晓华.我国杨树溃疡病研究进展[J].世界林业研究,2003,16(4):49-53
[5] 陆燕君,李桂林,张秉新,等.山东杨树大斑溃疡病研究[J].山东农业大学学报,1990,21(3):23-30
[6] 杨倩,谭婷,吴娟娟,等.几种食用香辛料的抑菌活性研究[J].中国调味品,2019,44(4):23-26,34
[7] 冀瑞卿,李玉,宋瑞清,等.Amanita virrosa对杨树烂皮病的抑制效果及其抑菌机理初探[J].中国森林病虫,2010,29(6):14
[8] 赵世明,王美玲,律凤霞.水稻稻瘟病病原菌分离纯化及分子鉴定[J].湖北农业科学,2021,60(6):64-66
[9] 扶艳萍,漆艳香,谢艺贤,等.香蕉灰纹病的病原鉴定及其生物学特性[J].热带生物学报,2021,12(1):63-71
[10] 侯康,王帆,胡军华,等.石棉县黄果柑果实病斑致病菌的分离鉴定[J].中国南方果树,2018,47(2):46-49
[11] 张莞苓,薛雅蓉,郭雨,等.引起生姜块茎腐烂病原菌的分离与鉴定[J].山东农业科学,2020,52(12):79-85
[12] 苏文,文吴迪,韩振诚,等.贵州猕猴桃果实腐烂病病原菌鉴定及分析[J].河南农业科学,2021,50(3):97-102
[13] 高园园,张龙平,任艳云,等.山东省大蒜主产区根腐病病原菌分离与鉴定[J].江苏农业科学,2021,49(14):86-90
[14] 孙妍,赵红盈,宋小双,等.豚草提取物对杨树烂皮病菌的抑制作用[J].安徽农业科学,2014,42(34):12111-12112,12192
[15] 杨春杰,王云华.杨树烂皮病药剂筛选及防治技术[J].林业科技,2010,35(3):27-29
[16] 王春磊,王秀桂,于海伟.木霉菌对杨树烂皮病防治的研究[J].防护林科技,2007(5):16-17
[17] 孙冬梅,杨谦,宋金柱.黄绿木霉菌代谢产物对杨树烂皮病菌抑菌能力的研究[J].北京林业大学学报,2006,28(1):76-79
[18] 张欣倩,张国财,包颖,等.豚草提取物对小鼠肝脏CarE活性及蛋白质含量的影响[J].北京林业大学学报,2012,2(34):109-111
[19] 孙妍.走马芹等三种植物粗提物的杀虫(抑菌)活性研究[D].哈尔滨:东北林业大学,2010
[20] 崔永亮,郑晓琴,袁敏.等.猕猴桃溃疡病防治药剂室内筛选及田间防效[J].安徽农业科学,2016,44(36):177-178,187

