基于单路PPG信号的无袖带血压监测算法

摘 要:PPG信号描述了人体组织对外界光线反射量随脉搏变化的波形,其波形特征与血压值存在关联,现有的PPG信号估计血压算法存在模型复杂、通用性低等问题。本文利用轻量化的卷积神经网络提取单周期信号特征,在无需个人化校正的情况下,仅用单路PPG信号对收缩压与舒张压分别估计。针对PPG信号中存在的大量干扰,设计了一套基于周期间幅值关系的信号校正方法,并利用循环移位自相关函数值为判断依据,合理去除不适宜采用的数据段;同时采用了一种幅度频谱增强方法,强化了特征提取效果。测试结果表明,本模型能在大多数情况下将误差控制在合理区间,可在计算量较小的条件下为个人提供血压值参考。
关键词:PPG信号;深度学习;卷积神经网络;自相关函数;血压监测;信号处理
中图分类号:TP391.4;TH776 文献标识码:A 文章编号:2095-1302(2024)04-00-04
DOI:10.16667/j.issn.2095-1302.2024.04.007
0 引 言
光电容积描记法(PPG)传感器利用皮肤表面的LED光源和光敏元器件,通过测量皮下组织对光线的吸收、反射量,得到血管中血液容积随脉搏的变化量[1],进而可用于测量心率等健康参数。由于传统的袖带式血压(BP)测量方法无法全天候持续对患者血压进行监测,且会对血管造成压迫,而穿刺式血压测量方法会对患者身体造成较大损伤,为求得一种非侵入式、简单易行且能全天候工作的血压监测方法,人们很早就将目光投向了PPG信号,希望从PPG信号中提取出准确的血压信息。
近年来,深度学习方法在无创估计血压领域逐渐占据了主导地位。相比传统方法,深度神经网络可从PPG与心电信号(ECG)中提取更加丰富的特征,如Harfiya等人[2]利用长短期记忆网络(LSTM),通过迁移学习的方法实现从PPG信号到其对应动脉血压信号(ABP)的转换,此类方法使用单路PPG信号对血压进行预测,不借助ECG信号;而Baker等人[3]则同时利用ECG信号和PPG信号,通过卷积神经网络(CNN)及LSTM组成的混合网络对血压进行估计。显而易见的是,ECG+PPG模式更容易得到精确的血压值,但其泛用性较差,相比之下,采用单PPG信号监测方法更易移植到可穿戴设备上。同时,在测量前对模型进行个人化校正,也能提高估计准确度[4],但这种方法需要腕带式设备测得标准血压,一定程度上增加了使用复杂度。
本文基于单路单周期PPG信号,通过轻量化的CNN对血压进行预测,同时利用一种基于周期间幅值关系的干扰去除方法,对信号中的加性干扰与乘性干扰分别去除,大大提高了模型的训练质量;且模型无需个人数据校正、计算代价小、对外界干扰鲁棒性高。
1 模型框架
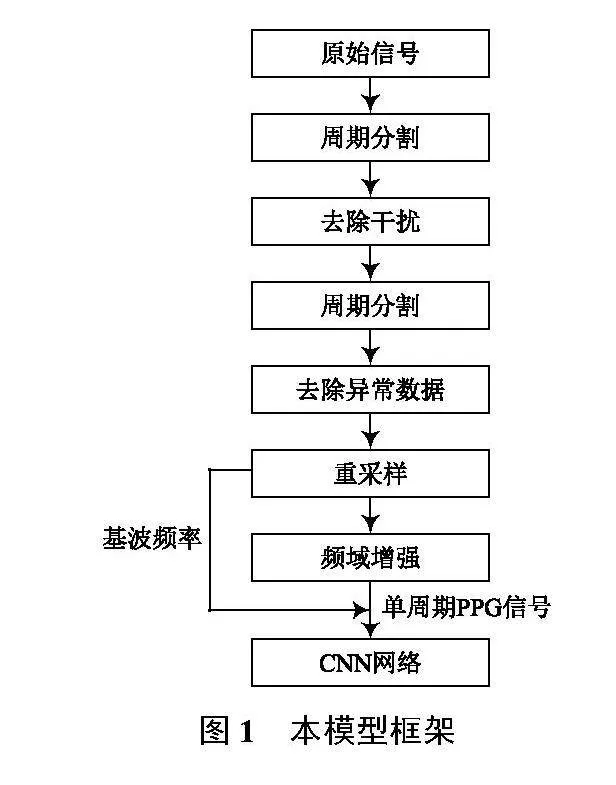
本文算法分为若干个数据处理模块与CNN网络模块,其流程结构如图1所示。
PPG信号在采集过程中由于存在接触面压力变化、肌肉组织活动、硬件基线漂移等因素,其波形往往存在较大的幅值波动,并伴有周期不稳定等问题;同时,为使得波形特征易于提取,需要将连续的PPG信号分割为多个单周期波形,并对高频分量适当增强,即需要一种鲁棒性较强的周期分割算法;对于一些受干扰较大无法正确判别基频的信号还应及时舍去。为解决以上问题,算法的数据处理过程分为4部分:周期分割、去除干扰、去除异常数据、频域增强,其中周期分割模块使用了2次。
而对于神经网络部分,本文采用了简单的CNN模型,包含6层卷积模块,数据来源为经过预处理的MIMIC II(UCI Repository)[5]数据集,该数据集虽然经过去除异常值、平滑等操作,但对于本模型而言,无法直接进行训练,需要进行数据处理。
2 数据处理
2.1 周期分割
在信号处理领域,自相关函数能在一定程度上表征信号移位后与原信号的相似度,可用于识别受到干扰较大的信号的基频。对于实信号而言,自相关函数即为移位后的信号与原信号的互相关,其自变量为位移量,由于自相关函数为偶函数,此位移量可表示超前时间也可表示滞后时间,如下式:
(1)
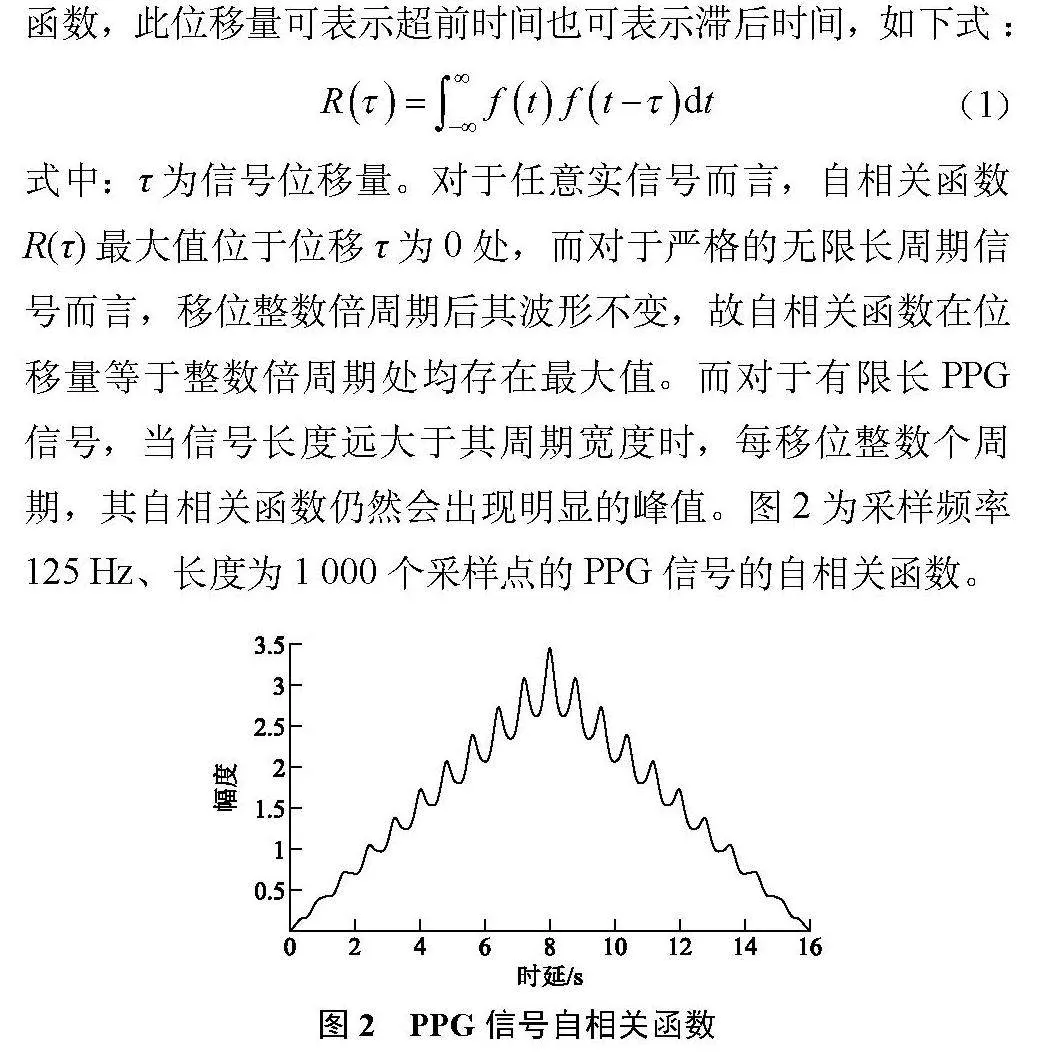
式中:τ为信号位移量。对于任意实信号而言,自相关函数R(τ)最大值位于位移τ为0处,而对于严格的无限长周期信号而言,移位整数倍周期后其波形不变,故自相关函数在位移量等于整数倍周期处均存在最大值。而对于有限长PPG信号,当信号长度远大于其周期宽度时,每移位整数个周期,其自相关函数仍然会出现明显的峰值。图2为采样频率
125 Hz、长度为1 000个采样点的PPG信号的自相关函数。
图2中的纵坐标并无特定物理意义,由于受到环境光等因素影响,原始PPG信号往往有较大的直流分量,故其有限长序列的自相关函数呈三角形。可以通过计算自相关函数峰值出现位置来判断有限长PPG信号周期。但由于部分PPG信号二次谐波较大,在位移为半个周期处自相关函数也会出现峰值。为提高算法鲁棒性,需要计算图2中心峰值某一侧前后2个峰值出现的位置,并计算其对应函数值。对于有限长周期信号,若位移τ=kT,其中k∈Z,那么当τ不超过信号总长度时,k的绝对值越大,则R(τ)越小,即峰值高度随位移长度呈递减趋势;若信号中存在较大幅度的二次谐波,其在半周期处形成的R(τ)峰值往往小于两侧整数倍周期处的峰值,可通过比较其对应函数值进行取舍。
2.2 去除干扰
PPG信号中存在的加性高斯噪声可以通过设置合适的低通滤波器加以去除,但信号中也存在大量无法简单滤波去除的干扰,这些干扰可分为2种:加性干扰与乘性干扰,其关系可由下式表示:
(2)
式中:f(t)为无干扰信号;fn(t)为含干扰信号;nm(t)为乘性干扰;na(t)为加性干扰。加性干扰视其独立于乘性干扰,故可通过信号相减首先去除。
除此之外,还有相位不统一等影响数据质量的因素,从不同受试者采集的PPG信号形态差异较大,本文规定每个周期内最小值为相位为0处,统一相位即为将每一组PPG信号都统一到第一个周期的最小值处开始,所有信号在进行处理前都需要利用周期分割的结果,划分出第一个周期,求取此周期内的最小值点并进行移位,从而实现相位的统一。
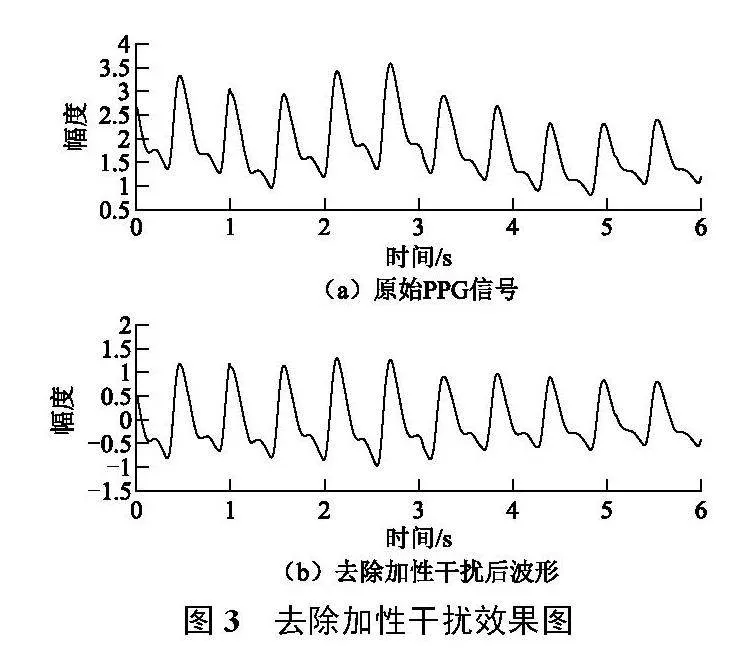
PPG信号的加性干扰表现为不同周期内信号均值的无规律波动,其通常由设备自身造成的基线漂移、人体组织的不规律运动等因素引起;由于往往频率较低,无法通过低通滤波器去除,常用的去除手段是经验模态分解(emd)[6],但PPG信号常常一个周期内包含多个极大或极小值,且幅值不确定,波形因人因时差异较大,故不适合简单应用emd。本文基于emd提出一种较为稳定的加性干扰去除方法。首先对PPG信号进行周期分割,并求取每个周期内的信号均值,然后以每个周期中点为横坐标,均值为纵坐标,进行3次样条插值,形成基准波形,最后在原信号中减去该基准波形,如图3所示。
图3所示加性干扰主要是基线漂移,本方法可将其有效去除,在不破坏波形大致特征的前提下,统一每个周期的直流分量。该方法假设信号中的加性干扰连续变化且最大频率不超过信号自身频率,关注周期间信号的涨落;然而,许多PPG信号中基准线的周期性波动也有可能表征了受试者特定的生理状况,该方法在去除加性干扰的同时忽略了这些因素,造成了信息的损失。
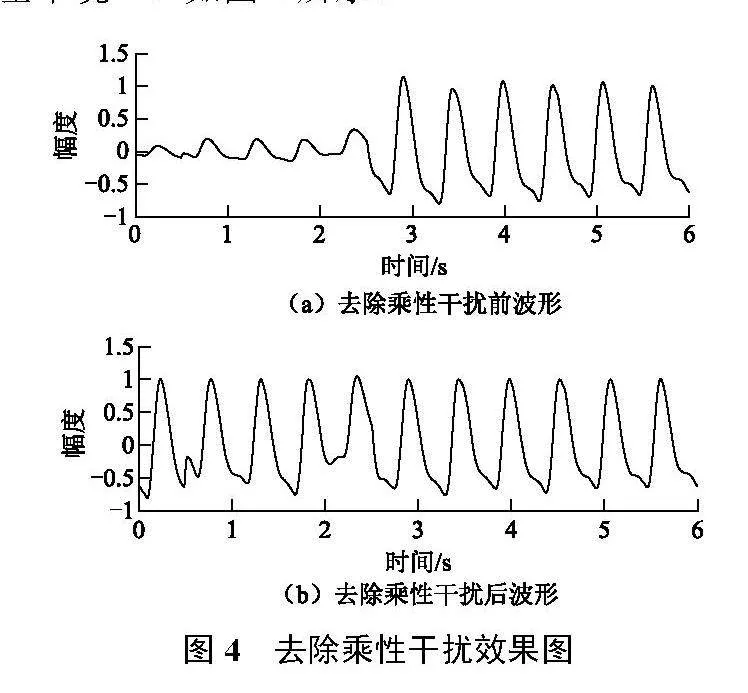
PPG信号的乘性干扰主要表现为不同周期间峰峰值的无规律变化,在去除加性干扰后,每个周期内信号均值被统一到0左右,故乘性干扰可表征为每个周期内最大值或最小值的涨落。PPG信号单个周期内可能存在多个极大值或极小值,且不同极小值之间差异较小,故每个周期内最小值所在位置可能差异较大,不适宜作为校正参考;但往往一个周期内信号只存在一个主峰,即最大值,且其余最大值与之相差较大。故以每个周期内最大值点作为参考点,进行3次样条插值形成幅值基准信号,原信号除以幅值基准信号,即可将每个周期内最大值幅度统一为1,并且每个周期中最大值以外的部分幅度基本统一,如图4所示。
图4中的波形首先已去除了加性干扰,信号均值接近于0,一部分信号受到严重干扰,出现了较大的幅度衰落,去除乘性干扰后,可以看到受到较大干扰的波形依然具有波形特征。本方法对于变化缓慢的乘性干扰有较好的效果,且一定程度上保留了信号自身的形态特征。对于以上2种分别用于消除加性干扰和乘性干扰的方法,因采用3次样条插值,在边界处缺乏有效约束,故容易造成首尾周期内波形出现较大失真,为保证信号质量,需要舍去首尾2个周期的波形。
2.3 去除异常数据
对于部分上述方法无法去除的较大干扰,或是传感器脱落等原因造成的无效信号,应予以剔除。本文采用自相关函数作为判据,判断信号移位整数倍周期后与原信号是否足够相似。理想情况下PPG信号每个周期波形应当完全一致,实际中波形相似度越低,亦即移位后自相关函数值越小,说明信号幅值受干扰越大,或是周期抖动越大。与前文将自相关函数用于提取周期不同,此处自相关函数的自变量位移代表循环位移量;这是因为首次周期分割时信号尚未消除干扰,且信号长度不为整数倍周期,循环移位后首尾难以相接,容易引起误判;而经过上一步处理后,信号足够规整,循环移位对于干扰去除效果较好的信号而言不会引入过多误差,而对于受到干扰较大无法去除的信号则能更好予以判别。
将去除干扰后的PPG信号重新提取周期,舍去末尾非完整周期;根据信号长度,进行若干个整数周期的循环移位,并与原信号作互相关,此处为求取两信号所有采样点乘积之和;然后计算原信号所有采样点的平方和,相当于原信号总能量;最后计算自相关结果与总能量之比,若此比值低于某一设定阈值,则应舍去该组数据。
由于开源数据集中PPG信号往往伴随连续ABP信号的采集,要读取PPG信号对应的收缩压(SBP)与舒张压(DBP),亦需要对ABP信号进行周期分割后提取最大最小值,故为保证PPG信号与ABP信号同时刻相对应,上述所有涉及相位改变、数据取舍的步骤均应对ABP信号进行相同操作。并且由于ABP信号中常出现异常值,循环移位自相关检验的步骤也应对ABP信号执行。需要注意的是,去除干扰步骤会去除信号的直流分量,不能用于ABP信号的处理,否则将无法提取具体血压数值。最后,将PPG信号分割为若干个单周期波形,对每个波形分别进行重采样,使其长度一致,并记录该波形的原始周期长度及其对应ABP信号中的最大、最小值分别作为SBP与DBP值。
2.4 频域增强
现有的PPG信号估计血压算法中,常以PPG信号的二阶导数(APG)作为特征波形[7],因为APG信号相较于PPG信号,包含更多的高频分量,更利于神经网络提取特征。考虑到APG信号本身也会损失一部分PPG信号的特征,为保证特征不丢失,则需要增大数据量,而这对于设备的性能提出了更高的要求。且卷积神经网络(CNN)、循环神经网络(RNN)等深度学习架构本身就有提取信号二阶导数的能力;例如对CNN而言,求取二阶导数仅仅相当于一次卷积模板运算。为了在保留原信号特征的同时,突出信号中的高频分量,本算法采取了对信号进行频域对数映射的方法。
将信号通过快速傅里叶变换(FFT)变换到频率域,再对幅度频谱进行对数映射,相位谱不变,如下式:
(3)
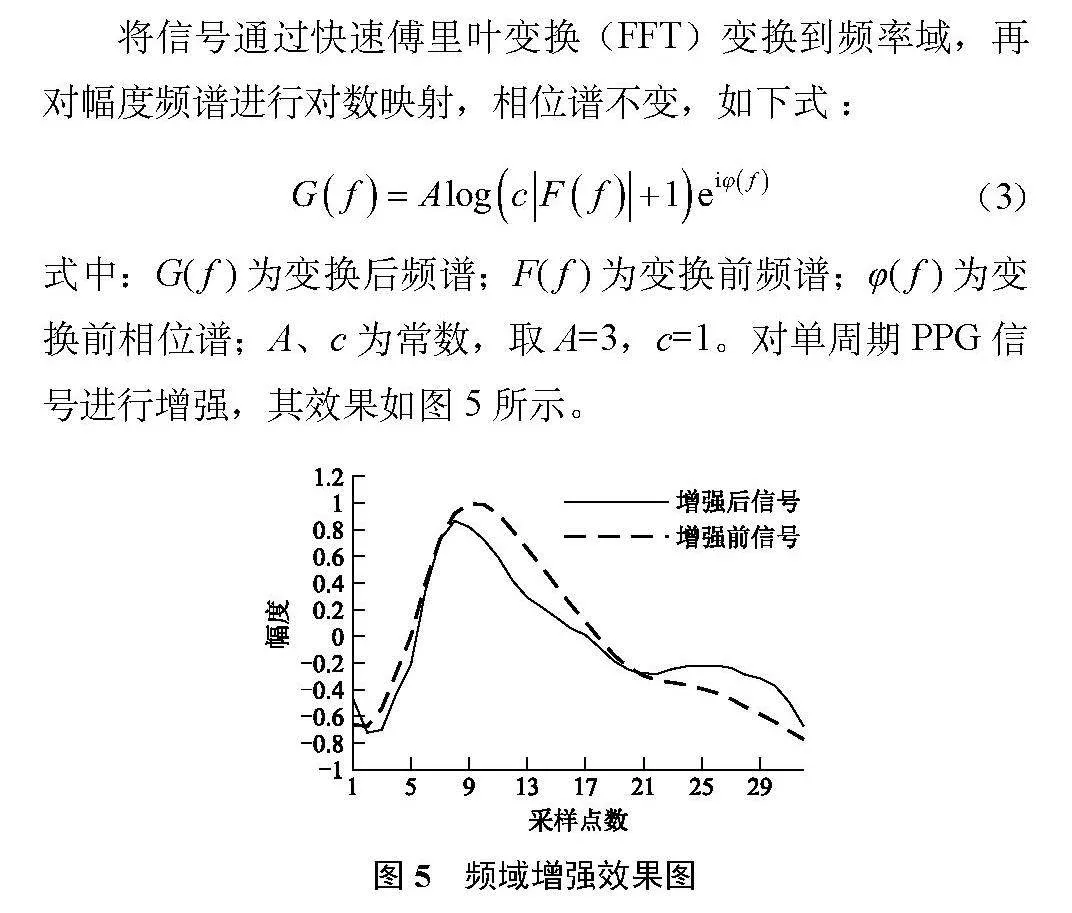
式中:G(f)为变换后频谱;F(f)为变换前频谱;φ(f)为变换前相位谱;A、c为常数,取A=3,c=1。对单周期PPG信号进行增强,其效果如图5所示。
由于PPG信号频谱中高频分量幅值较小,低频分量幅值较大,经过对数映射后幅值较小的高频分量幅度增大,而低频分量幅度得到压缩。经过快速傅里叶反变换(IFFT)到时域后,可以看到图5中增强后的波形具有更丰富曲折的细节,突出了原波形中不易提取的特征。
3 预测模型
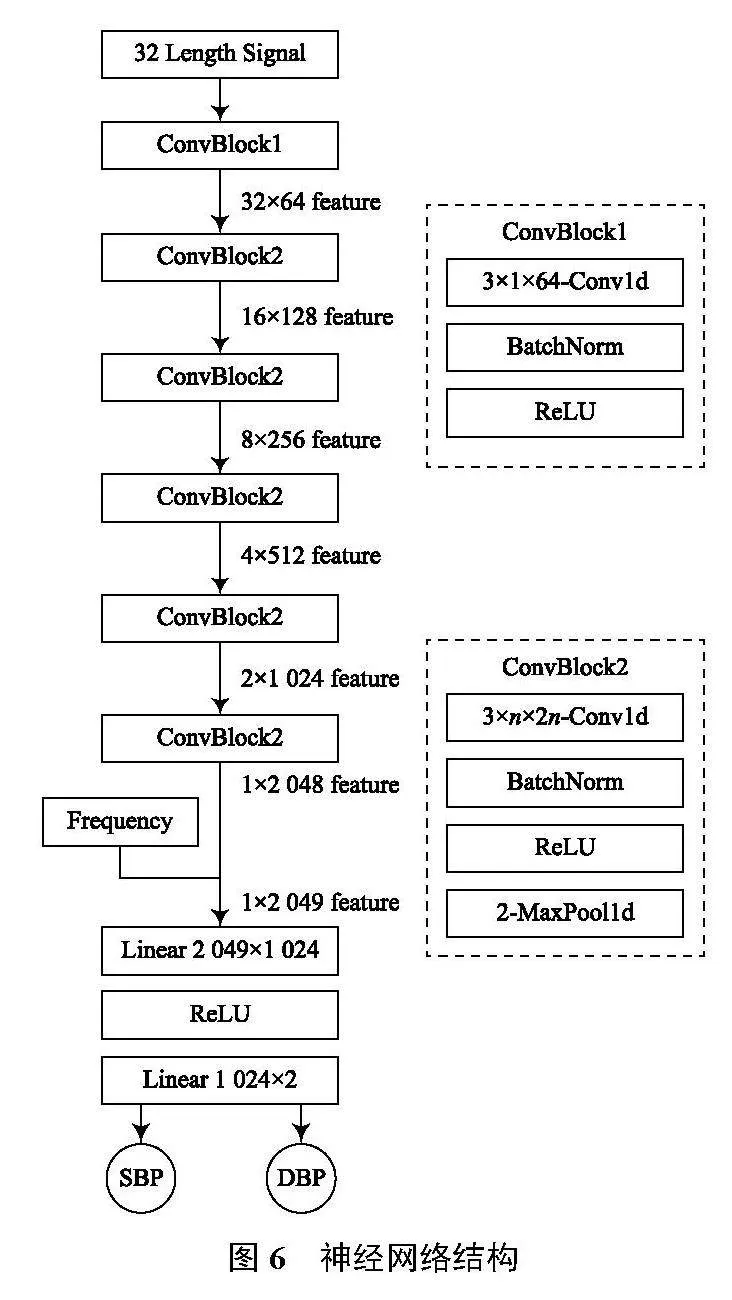
3.1 模型结构
本文采用CNN为血压预测模型,其结构如图6所示。网络输入为32点的单周期PPG信号,输出为SBP与DBP具体数值,单位为毫米汞柱(mmHg)。由于固定长度的单周期PPG信号无法反映其频率特征,在全连接层前需要向特征中拼接频率特征,此处以125 Hz采样频率下的周期点数代替。
本网络基本结构包括2种卷积模块,第一种卷积模块ConvBlock1用于在第一层提取输入信号特征,其使用长度为3的一维卷积核,边缘采用0填充,将单个一维信号扩充到64个特征图,模块中还包含批归一化、ReLU激活函数层;第二种卷积模块ConvBlock2用于后续5层,模块中依然采用长度为3的一维卷积核,边缘0填充,其特征图数目均为输入特征的2倍,而每个模块则包含1个窗口长度为2的池化层,实现单个特征图长度减半。
由于网络输入为单个周期PPG信号,许多特征若感受野太小则无法有效获取,故采用多层卷积-池化结构,卷积层将特征翻倍,池化层将特征减半,保持特征总数不变,减小计算代价。其次,由于频率与血压值可能存在较复杂的非线性关系,不能用一层线性连接表示,故采用两层全连接层结构,并添加了ReLU激活函数,使其具备非线性拟合能力。
3.2 模型测试评价
从连续PPG数据中分割出393 637条单周期PPG信号及其对应血压值为训练集,指定其损失函数为SmoothL1Loss[8],表达式如下:
(4)
式中:yc-y表示预测值与实际值的误差,该损失函数在误差大于1时相比L2损失函数具有较好的稳定性,而网络的输出为单位为mmHg的血压值,误差常常大于1,故使用该损失函数可避免下降过快,且在0附近可导。
使用Adam优化器,设置学习率为0.001 5,批大小为
2 048,训练20个epoch。利用1 598条连续6个周期的PPG信号作为测试集,每个周期分别进行频域增强,将6个周期的ABP最大值、最小值分别进行平均,作为本条数据的实际SBP与DBP值。将每个周期信号分别传入模型预测结果,将6个周期的结果取平均值作为预测SBP与DBP值。
测试得SBP平均绝对误差为11.105 2 mmHg,DBP平均绝对误差为5.969 2,随机取其中一部分结果作残差,如
图7所示。
由此可见,SBP预测误差相对于DBP更大,大部分误差值落在[-20,20]区间,而DBP大部分误差值落在[-10,10]区间。同时也可以看到,残差分布明显不均匀,血压偏高预测误差往往更倾向于负值,而血压越低预测误差更倾向于正值[9-10]。
4 结 语
本文所设计算法基于PPG信号对血压值进行预测,具有计算代价小、鲁棒性高等优点,不借助ECG等外部信号,无需进行个人化校正,结合可穿戴设备有较大的发展前景。本文所采用的数据处理方法具备较强的泛用性,可用于很大一部分非平稳信号的处理与分析。但模型预测精度尚达不到医用实用标准,未来可通过丰富数据集、改进网络结构、适当引入个人化校正等方法提高预测精度。
参考文献
[1] CASTANEDA D,ESPARZA A,GHAMARI M,et al. A review on wearable photoplethysmography sensors and their potential future applications in health care [J]. International journal of biosensors amp; bioelectronics,2018,4(4):195.
[2] HARFIYA L N,CHANG C C,LI Y H. Continuous blood pressure estimation using exclusively photopletysmography by LSTM-based signal-to-signal translation [J]. Sensors,2021,21(9):2952.
[3] BAKER S,XIANG W,ATKINSON I. A hybrid neural network for continuous and non-invasive estimation of blood pressure from raw electrocardiogram and photoplethysmogram waveforms [J]. Computer methods and programs in biomedicine,2021,207:106191.
[4] BAEK S,JANG J,YOON S. End-to-end blood pressure prediction via fully convolutional networks [J]. IEEE access,2019,7:185458-185468.
[5] KACHUEE M,KIANI M M,MOHAMMADZADE H,et al. Cuff-less high-accuracy calibration-free blood pressure estimation using pulse transit time [J]. IEEE international symposium on circuits and systems (ISCAS’15),2015.
[6] HUANG N E,SHEN Z,LONG S R,et al. The empirical mode decomposition and the Hilbert spectrum for nonlinear and non-stationary time series analysis [J]. Proceedings of the royal society of london. series A:mathematical,physical and engineering sciences,1998,454(1971):903-995.
[7] CAO Y,CHEN H,LI F,et al. Crisp-BP:Continuous wrist PPG-based blood pressure measurement [C]// Proceedings of the 27th Annual International Conference on Mobile Computing and Networking. 2021:378-391.
[8] GIRSHICK R. Fast r-cnn [C]// Proceedings of the IEEE international conference on computer vision,2015:1440-1448.
[9]沈瑾.便携式多参数监护仪在互联网+时代的使用设计[J].物联网技术,2018,8(6):92-93.
[10]郭丽华.基于PPG信号的无袖带连续性血压测量方法研究[D].杭州:浙江大学,2011.
收稿日期:2023-04-13 修回日期:2023-05-16

