探究性化学实验题的解题技巧






化学是一门以实验为基础的学科,其中探究性实验题不仅要求学生掌握扎实的理论知识,而且需要他们能够将这些知识应用于具体实验中,从而培养学生的科学探究能力和创新思维.本文探讨探究性化学实验题的解题技巧,帮助学生在实验设计、数据收集与处理、结果分析和结论提炼等方面提高效率和准确性.
1 探究性化学实验概述
探究性化学实验题的特点在于它们往往没有标准答案,鼓励学生运用科学的方法来探索未知,通过实验的方式来验证假设,提出并证实自己的理论.探究性实验题的类型多样,题目通常包括对已知化学现象的进一步探索,或是对陌生化合物和反应的实验研究,既可以是定量的,也可以是定性的,有时是开放式的问题,有时则是需要验证特定科学假设的实验.探究性化学实验基本模式如图1所示.
2 探究实验常见类型
2.1 探究反应原理
例1 小明同学在进行实验时,发现当铜和稀硝酸反应时,最终的溶液呈现蓝色.当将稀硝酸换成浓硝酸,再次进行反应时,溶液呈现绿色.为探究原因,请完成下列问题:
[猜想假设]
假设1: ______;
假设2:NO2 气体溶解在硝酸铜溶液中.
[实验操作及现象分析]
实验1:将硝酸铜晶体添加至蒸馏水中,不断增加晶体的添加量,最后配成饱和溶液.发现该溶液从始至终呈现蓝色,并没有绿色出现.
小明同学根据实验1的现象,分析出假设1并不成立,请回答假设1的内容.
实验2:小明同学在实验1的基础上,对假设2进行了验证,实验结果初步证明了其猜想成立,则具体的实验操作和实验现象为______.
小红同学在观看了小明同学的实验之后,认为假设2不严谨,并对实验2进行了进一步的探究.
实验3:向浓硝酸和铜反应后的混合溶液中通入氮气.产生大量红棕色气体,短时间内溶液会保持绿色,但经过较长时间后,溶液呈现蓝色.
根据实验3的操作和现象,小红同学认为假设2不严谨的原因是______.
小红同学经过查阅资料,发现以下知识:
① 铜与浓硝酸反应后溶液呈现绿色是由于HNO2(或NO- 2 )与铜离子作用的结果.
② 金属和浓硝酸的反应一旦发生后速率不断加快,原因是反应过程中有HNO2 生成.如Cu与浓硝酸反应,开始生成的NO2 溶于水形成HNO2,HNO2 再与Cu反应,反应速率就大大加快.
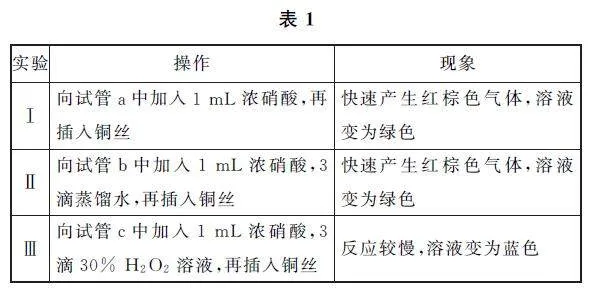
实验4:小红同学通过表1所述实验证实了反应过程中有HNO2 的生成.
请解释实验Ⅲ产生该现象的原因是______.
解析
结合实验1操作可知,实验探究的是硝酸铜溶液浓度对溶液颜色的影响,故假设1是硝酸铜溶液颜色与溶液浓度有关.假设2为硝酸铜溶液中溶解了NO2,且初步验证了假设2成立,则实验设计是加热硝酸铜溶液,温度升高,NO2 气体溶解度减小而逸出,放出红棕色气体,溶液颜色变为蓝色,说明颜色的变化与溶解了NO2 气体有关.实验3向混合溶液中通入氮气会将溶液中溶解的NO2 气体带出,而溶液仍保持一段时间绿色,说明绿色的产生不是溶解NO2 气体的原因,所以认为假设2不严谨.实验Ⅲ中反应较慢,溶液变为蓝色的原因是过氧化氢具有强氧化性,过氧化氢与亚硝酸反应生成硝酸,导致溶液中亚硝酸的浓度降低,反应速率减小,溶液变蓝.
2.2 探究物质性质
物质性质探究通常是对我们比较熟悉的物质进行性质验证,该类探究题的思维模型如图2所示.
例2 某学习小组设计了如图3所示装置用于制取SO2 并验证其性质.
(1)实验时装置E中反应的离子方程式为______.
(2)若装置B中溶液无明显现象,装置C中溶液红色褪去,则使品红的水溶液褪色的含硫微粒一定不是______(填化学式).
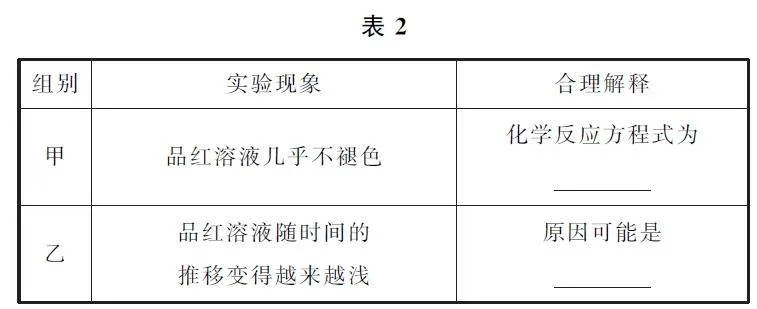
(3)该实验小组的甲、乙两位同学为进一步探究SO2 的漂白性,按如图4所示装置继续进行实验并记录相关现象.研究发现2种气体用量不同现象不同.
① 装置中浓硫酸除了干燥气体以外的作用为______.
② 根据表2中实验现象做出合理解释.
(4)装置D 中没有白色沉淀产生,但随着反应的进行,发现装置D 中产生了少量白色沉淀.为进一步探究产生沉淀的原因,丙同学分别用煮沸和未煮沸过的蒸馏水配制的Ba(NO3)2 和BaCl2 溶液,进行如图5所示实验.
实验中G、H、I烧杯中观察到的现象如表3所示.
① 据G中现象推测D中产生的白色沉淀的化学式是______.
② 据I中出现白色沉淀的速率比H 中快很多的现象,推测其根本原因可能是______.
解析
(1)装置E 中发生的反应为2Fe3+ +SO2+2H2O=SO24- +2Fe2+ +4H+,实验现象为溶液由棕黄色变为浅绿色.
(2)若装置B中溶液无明显现象,装置C中溶液红色褪去,说明使品红的水溶液褪色的含硫微粒是SO2 与 H2O反应生成的 H2SO3 或SO23- 或 HSO3-,一定不是SO2.
(3)① 由实验装置图可知,装置中浓硫酸的作用为通过观察集气瓶中气泡的多少,判断气体流速,从而控制2种气体的比例.② 由甲中品红溶液几乎不褪色可知,SO2 和Cl2 在品红溶液中恰好完全反应生成没有漂白性的盐酸和硫酸,反应的化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4.由乙中品红溶液的颜色随时间的推移变得越来越浅,说明某种气体流速过快,导致Cl2 或SO2 过量,使品红溶液漂白褪色.
(4)① 由G中无白色沉淀产生,pH 传感器测的溶液pH=53可知,D中SO2 与溶液中的氧气反应生成硫酸,硫酸与氯化钡溶液反应生成硫酸钡沉淀和氯化氢.② 由I中出现白色沉淀的速率比H 中快很多的现象可知,没有煮沸的蒸馏水中溶有的氧气与SO2 的反应速率比NO- 3 在酸性条件下与SO2 反应的速率快,说明在水溶液中O2 氧化SO2 比NO- 3 氧化SO2 活化能小,生成沉淀速率快.
3 解题技巧总结
解题的流程可以分为以下几个步骤.
1)细致审题:该步骤要求学生仔细阅读题目,识别题目中的关键信息,并将其与已有的化学知识联系起来.
2)逻辑推理:在明确了题目要求之后,学生需要运用逻辑思维和化学知识来推导出解题的途径.这个过程中,他们需要清晰地规划解题步骤,并快速找到解决问题的方法.
3)理解原理:深刻理解化学反应的基本原理对于解答探究题至关重要.学生需要根据题目条件,分析预期的化学反应和结果,教师应通过讲解和实验演示来帮助学生理解化学反应的本质,并鼓励他们通过实验来验证理论.
总之,解决化学探究题需要学生具备良好的审题能力、逻辑推理能力.教师的作用是通过各种教学方法和实践活动,引导学生掌握这些能力,从而提高他们解决问题的效率和准确性.
(完)

