高铁酸钾在考题中的呈现角度解析

高中化学必备知识是高考必考的内容与命题依据,是根据«普通高中化学课程标准(2017年版2020年修订)»及高校专业设置要求必须要掌握的内容.新高考试题要体现基础性、综合性、应用性与创新性,指向必备知识融合考查是高考命题的重要特征.本文多角度分析高考中高频考查的高铁酸钾,以期把握命题方向,探寻解题规律,提高备考效率.
1 融合考查高铁酸钾的制备
1.1 融合元素化合物知识,考查高铁酸钾的实验法制备
制备K2FeO4 一般有两种方法,一是融合铁、钠及其化合物的性质与应用的干法制备.先通过反应:2FeSO4+6Na2O2 =2Na2FeO4 +2Na2O+O2 ↑ +2Na2SO4制得Na2FeO4,然后在低温下,向Na2FeO4溶液中加入KOH 至饱和,可使K2FeO4 析出,过滤得粗品,用KOH 溶液溶解,蒸发浓缩,冷却结晶,再用苯和95% 乙醇溶液进行脱碱、乙醚洗涤,干燥制得K2FeO4.二是融合铁、氯及其化合物的性质与应用的湿法制备.是在KOH 碱性条件下,用Cl2 或ClO- 将Fe(OH)3 氧化生成K2FeO4,离子方程式为3Cl2 +2Fe(OH)3 +10OH- =2FeO24- +6Cl- +8H2O,2Fe(OH)3+3ClO- +4OH- =2FeO24- +3Cl- +5H2O.元素及其化合物知识是高考化学命题的重要考查内容,高铁酸钾的实验法制备融合铁、钠、氯等核心元素及其化合物性质及应用,因此在高考中经常出现,复习备考时要予以强化.
例1 高铁酸钾(K2FeO4)是一种绿色、高效的新型水处理剂,对病毒的去除率可达99.95%.某兴趣小组设计如下实验制备K2FeO4 并探究其性质.
已知:① K2FeO4 为紫色固体,微溶于KOH 溶液;② FeO24- 具有强氧化性,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定.
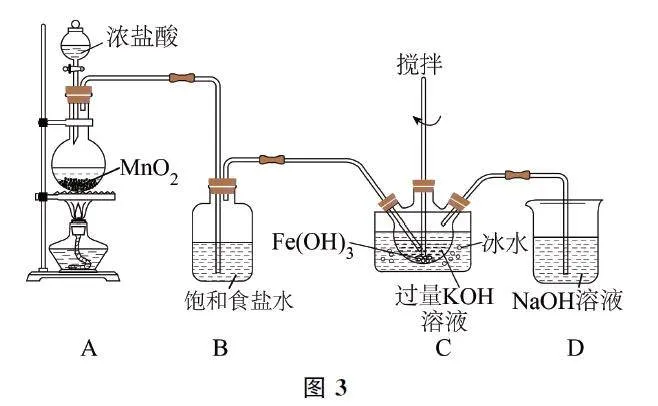
(1)如图1所示(夹持装置略),装置A 为氯气发生装置,橡胶管的作用是______.
(2)装置B的作用是______.
(3)装置C中的KOH 溶液需过量,目的是______.
(4)C 中得到紫色固体.则C 中发生反应生成K2FeO4 和KCl的离子方程式为______.
解析
本题是融合氯及其化合物、铁及其化合物性质的综合考查.
(1)装置A 用于制取Cl2,为了防止因反应过于剧烈,烧瓶内压强增大而使液体无法滴落,应通过橡胶管将分液漏斗与蒸馏烧瓶连通,目的是平衡体系的压强,确保浓盐酸能顺利流下.
(2)由于盐酸具有挥发性,所得Cl2 中混有HCl和H2O(g);HCl会消耗Fe(OH)3、KOH,因此要用饱和NaCl溶液除去HCl.
(3)由题目已知信息可知,K2FeO4 在酸性或中性环境下不稳定,在碱性环境中能稳定存在,因此,装置C需要确保碱性环境,即KOH 溶液要过量.
(4)装置C在碱性条件下用Cl2 将Fe(OH)3 氧化生成K2FeO4,反应的离子方程式为3Cl2 +2Fe(OH)3+10OH-=2FeO24-+6Cl-+8H2O.
1.2 融合电化学知识,考查高铁酸钾的电解法制备
电化学是制备物质的重要方法和手段.电解法制备高铁酸钾是以石墨和铁为电极材料,以浓KOH 溶液为电解质溶液,铁与电源的正极相连,作为阳极发生氧化反应,电极反应为Fe-6e- +8OH- =FeO24-+4H2O,闭合开关,通电一段时间后,可观察到阳极附近溶液变成紫红色,是电解生成的FeO24-在溶液中呈现的颜色,实现了电解法制备高铁酸钾.高铁酸钾也可以作为新型化学电池的正极材料,高铁酸钾电池体积小、质量小、能量密度大、寿命长且无污染.融合电化学原理制备及应用高铁酸钾,充分说明了高考化学注重知识点在生产、生活中的应用情境,是学以致用的重要体现.
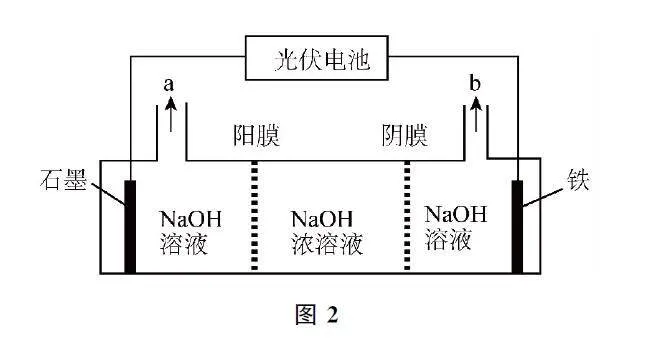
例2 (双选)高铁酸钾(K2FeO4)是环保型水处理剂,以光伏电池为电源先制备Na2FeO4,再将其转化为高铁酸钾,装置如图2所示.下列说法不正确的是( ).
A.石墨为阳极,铁电极发生还原反应
B.a含有H2,b为Na2FeO4 溶液
C.铁电极反应式为Fe-6e-+8OH-=FeO24-+4H2O
D.若电路中转移1 mol电子,则石墨电极区NaOH 溶液质量增加23g
解析
本题融合电解池的工作原理及应用,先利用电解法制备Na2FeO4,再转化为K2FeO4.铁电极发生氧化反应生成Na2FeO4,则铁为阳极,石墨为阴极,发生还原反应,选项A 说法错误.石墨电极的电极反应式为2H2O+2e- =2OH- +H2↑,a为H2、NaOH 溶液,b为Na2FeO4 溶液,选项B说法正确.铁电极发生氧化反应生成Na2FeO4,根据得失电子守恒和电荷守恒配平离子方程式为Fe-6e- +8OH- =FeO24-+4H2O,选项C说法正确.每转移1mol电子,浓NaOH 溶液中有1molNa+ 向左迁移,由2H2O+2e- =2OH- +H2↑可知,生成0.5molH2,石墨电极区的溶液质量净增1mol×23g·mol-1-0.5mol×2g·mol-1=22g,选项D说法错误.答案为A、D.
2 融合考查高铁酸钾的性质与应用
2.1 融合氧化还原知识,考查高铁酸钾的强氧化性
高铁酸钾为暗紫色或紫色固体,具有金属光泽,具有强氧化性,比Cl2、O2、ClO2、KMnO4 的氧化性强,微溶于KOH 溶液.干燥品在室温下稳定,在0~5℃碱性溶液中较稳定,随着pH 减小,稳定性下降,在酸性或中性溶液中与水快速反应产生O2.试题经常将高铁酸钾的性质与氧化还原反应及规律的探究考查有机融合,注重必备知识与关键能力的考查.
例3 探究K2FeO4 的性质.
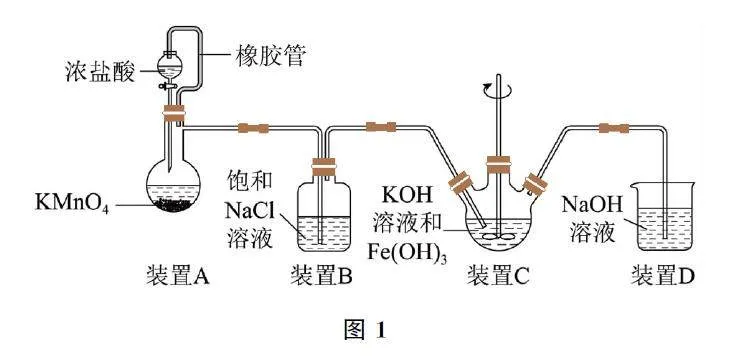
(1)取图3装置C 中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验,气体中含有Cl2.为证明是否是K2FeO4 氧化了Cl- 而产生Cl2,设计表1所示方案.
ⅰ.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4 将Cl- 氧化,还可能由反应产生______(用离子方程式表示).
ⅱ.方案Ⅱ可证明K2FeO4 氧化了Cl- .用KOH溶液洗涤的目的是______.
(2)根据K2FeO4 的制备实验得出,氧化性:Cl2______ FeO24-(填“>”或“<”),而方案Ⅱ实验表明,Cl2 和FeO24-的氧化性强弱关系相反,原因是______.
(3)资料表明,酸性溶液中的氧化性:FeO24- >MnO- 4 ,验证实验如下:将溶液b滴入MnSO4 和足量H2SO4 的混合溶液中,振荡后溶液呈浅紫色.该现象能否证明氧化性:FeO24->MnO4-.若能,请说明理由;若不能,进一步设计实验方案.理由或方案: ______.
解析
(1)溶液a中滴加KSCN 溶液至过量,溶液呈红色,说明溶液a中含有Fe3+ ,K2FeO4 在酸性溶液中快速产生O2 和Fe3+ ,产生的Fe3+ 干扰了实验检验,反应为4FeO24- +20H+ =3O2↑+4Fe3++10H2O.K2FeO4 在碱性溶液中较稳定,并且固体表面附有ClO- ,加入盐酸时ClO- 能与盐酸反应生成Cl2,所以用KOH 溶液洗涤的目的是使K2FeO4 稳定溶出,并除去K2FeO4 固体附着的ClO- ,防止ClO- 与Cl- 在酸性条件下反应生成Cl2,避免ClO- 干扰实验.
(2)制备K2FeO4 的反应为3Cl2+2Fe(OH)3+10KOH=2K2FeO4 +6KCl+8H2O,Cl2 是氧化剂,K2FeO4 是氧化产物,则氧化性:Cl2>K2FeO4,方案Ⅱ反应的氧化性:K2FeO4>Cl2,二者相反.对比两个反应的条件,制备K2FeO4 在碱性条件下,方案Ⅱ在酸性条件下,说明溶液的酸碱性不同会影响物质氧化性的强弱.
(3)将溶液b滴入MnSO4 和足量H2SO4 的混合溶液中,振荡后溶液呈浅紫色,说明生成了KMnO4,根据实验现象和氧化还原反应规律可知,能证明氧化性FeO24->MnO4-,因为 K2FeO4 在酸性溶液中快速生成O2 和Fe3+ ,使溶液呈黄色,振荡后溶液呈浅紫色,一定是KMnO4 的颜色.
2.2 融合盐类水解知识,考查高铁酸钾的应用
K2FeO4 易水解,保存时需防潮,是高效、安全、绿色无污染的水处理剂.主要用于饮用水的消毒净化、生产生活污水的处理与再生使用.K2FeO4 可增加水体的溶氧量,对水体中亚硝酸盐、氨氮等污染物具有良好的去除效果.K2FeO4 消毒是利用其强氧化性可迅速杀灭细菌,净化水是与水反应产生具有强吸附性的Fe(OH)3 胶体,可除去水中细微的悬浮物.
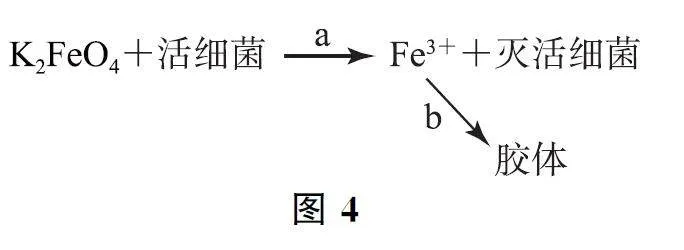
例4 高铁酸钾(K2FeO4)是高效、绿色的水处理剂,其原理如图4,下列说法不正确的是( ).
A.K2FeO4 中铁元素的化合价为+6价
B.在a过程中K2FeO4 被活细菌还原
C.在b过程中形成的Fe(OH)3 胶体能净水
D.在a过程中活细菌发生还原反应
解析
K2FeO4 中钾为+1价,O 为-2价,故铁元素的化合价为+6价,选项A 说法正确.在a过程中K2FeO4 中Fe元素由+6价降为+3价,被活细菌还原,选项B说法正确.在b过程中Fe3+ 水解形成的Fe(OH)3 胶体能净水,选项C说法正确.在a过程中活细菌被K2FeO4 氧化,发生氧化反应,选项D说法错误.答案为D.
综上,高铁酸钾的考查融合了元素化合物、氧化还原反应、电化学、盐类水解等必备知识,同时也融合了高中化学不同模块知识的考查,在复习过程中要多角度、全面认识高铁酸钾的性质,提高备考的针对性.
(完)

