以基本哲学观点命制的高中化学试题赏析
«普通高中化学课程标准(2017年版2020年修订)»中明确要求能从内因与外因、量变与质变等方面较全面地分析物质的化学变化;能从不同视角对纷繁复杂的化学变化进行分类研究,逐步揭示各类变化的特征和规律;能用对立统一、联系发展和动态平衡的观点考查化学反应等.学科思想是化学知识在更高层次上的抽象和概括,是构成学科体系的重要方面之一,哲学观点是学科思想的核心.高考化学结合哲学观点考查是未来命题的重要趋势,应引起重视.
1 以对立统一的哲学观点命制的试题
例1 (2023年湖北卷)下列化学事实不符合“事物的双方既相互对立又相互统一”的哲学观点的是( ).
A.石灰乳中存在沉淀溶解平衡
B.氯气与强碱反应时既是氧化剂又是还原剂
C.铜锌原电池工作时,正极和负极同时发生反应
D.Li、Na、K的金属性随其核外电子层数增多而增强
解析
电解质的沉淀和溶解是对立的,当电解质的沉淀速率和溶解速率相等时,电解质建立了沉淀溶解平衡.石灰乳中存在沉淀溶解平衡,这个化学事实符合“事物的双方既相互对立又相互统一”的哲学观点,选项A 不符合题意.氯气与强碱反应时,有部分氯气发生氧化反应,同时也有部分氯气发生还原反应,因此,氯气既是氧化剂又是还原剂,氯气的这两种作用统一在同一反应中,这个化学事实符合“事物的双方既相互对立又相互统一”的哲学观点,选项B不符合题意.铜锌原电池工作时,正极和负极同时发生反应,正极上发生还原反应,负极上发生氧化反应,氧化反应和还原反应是对立的,但是这两个反应又同时发生,统一在原电池反应中,因此,这个化学事实符合“事物的双方既相互对立又相互统一”的哲学观点,选项C不符合题意.Li、Na、K均为第ⅠA 族的金属元素,其核外电子层数依次增多,原子核对最外层电子的吸引力逐渐减小,失电子能力依次增强,因此,其金属性随其核外电子层数增多而增强,这个化学事实不符合“事物的双方既相互对立又相互统一”的哲学观点,选项D符合题意.
答案 D.
内容解读 对立统一体现的是同一问题相互对立的依从关系,是哲学的重要内容,运用对立统一思想对化学知识的理解应用意义深远.例如,化合价的正负、原电池正负极、电解池的阴阳极、元素的金属性和非金属性、化学反应中的吸热与放热、断键与成键等都蕴含对立统一思想.
2 以普遍性与特殊性的哲学观点命制的试题
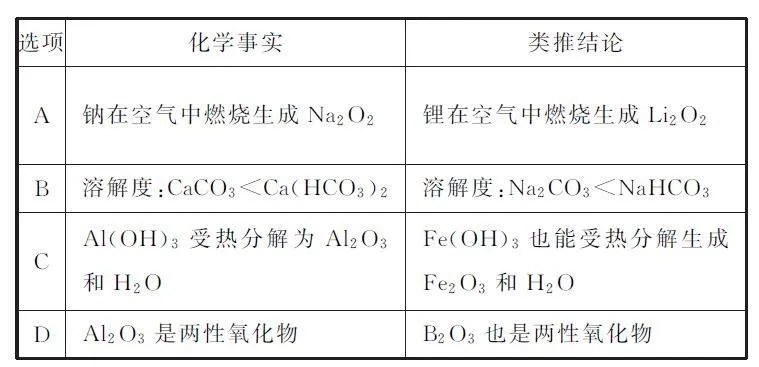
例2 类推时要注意物质的相似性和特殊性,下列类推结论正确的是( ).
解析
锂在空气中燃烧应该生成Li2O,类推不正确,选项A 不符合题意.碱金属的碳酸盐溶解度大于碳酸氢盐,故溶解度:Na2CO3>NaHCO3,类推不正确,选项B不符合题意.难溶性的碱受热分解,生成对应的氧化物和水,所以Al(OH)3、Fe(OH)3加热分解生成相应的金属氧化物和水,类推正确,选项C 符合题意.B2O3 只是酸性氧化物,不yaHh7e4tCPbLah1CmQ9+MQ==是两性氧化物,选项D不符合题意.
答案 C.
内容解读 哲学观点认为普遍性寓于特殊性之中,即任何事物既有个性,又有共性,既要考查它的一般性,又要考查其特殊性.元素周期律中同主族元素性质的相似性是普遍规律,但在普遍规律中也有很多的特殊性.如氟元素在卤素中的非金属性最强;没有最高正化合价;单质F2 与H2O 反应剧烈,生成O2,其他卤素与H2O 反应的通式为X2 + H2O⇌ HX+HXO.碳族元素中+4价化合物性质稳定是普遍性规律,特殊性是铅的+2价化合物性质稳定,+4价化合物很活泼;对于组成与结构相似的分子,一般来说,相对分子质量越大,分子间作用力越大,熔沸点越高,但NH3、H2O、HF等分子间存在氢键,使熔沸点呈特殊性,比其他同主族元素的氢化物的熔沸点要高.普遍性是事物发展的一般规律,而特殊性使化学学科内容多姿多彩,在学习过程中,学生既要把握规律的一般性,也要格外留意其特殊性.
变式1 类比法是化学研究的重要方法之一.下列类比合理的是( ).
A.AgCl难溶于水,则AgF也难溶于水
B.Na与H2O 反应生成NaOH 和H2,则Fe与H2O 反应生成Fe(OH)3 和H2
C.工业上通过电解熔融的NaCl冶炼Na,则可以通过电解熔融的MgCl2 冶炼Mg
D.NaClO 溶液与CO2 反应生成NaHCO3 和HClO,则NaClO 溶液与SO2 反应生成NaHSO3和HClO
答案 C.
3 量变引起质变的哲学观点
例3 下列变化不遵循“量变引起质变”哲学思想的是( ).
A.向酚酞溶液中加入漂粉精粉末,溶液先变红,后迅速褪色
B.向CuSO4溶液中滴加浓氨水,先产生蓝色沉淀,后沉淀溶解,溶液变成深蓝色
C.向NaOH 溶液中滴加AlCl3溶液,起始时无明显现象,后产生白色絮状沉淀
D.向含甲基橙的纯碱溶液中滴加盐酸,溶液由黄色变为橙色,最终变为红色
解析
漂白粉有效成分Ca(ClO)2属于强碱弱酸盐,由于ClO- 的水解使NaClO 溶液呈碱性,使酚酞溶液先变红色,水解生成的HClO 具有强氧化性,后观察到迅速褪色,与量的多少无关,选项A 符合题意.向CuSO4溶液中滴加浓氨水,刚开始发生反应:Cu2+ +2NH3·H2O=Cu(OH)2↑+2NH4+,即先产生蓝色沉淀,当氨水过量时,发生反应:Cu(OH)2 +4NH3·H2O=[Cu(NH3)4]2+ +4H2O+2OH- ,然后沉淀溶解,溶液变成深蓝色,与量的多少有关,选项B不符合题意.向NaOH 溶液中滴加AlCl3溶液,起始时没有明显现象,发生反应:Al3+ +4OH- =[Al(OH)4]- ,后产生白色絮状沉淀,是由于发生反应:3[Al(OH)4]- +Al3+ =4Al(OH)3 ↓,与量的多少有关,选项C 不符合题意.Na2CO3 属于强碱弱酸盐,由于CO23- 的水解使纯碱溶液呈碱性,使甲基橙溶液呈黄色,滴入 HCl溶液,首先发生反应:CO23-+H+=HCO- 3 ,溶液的碱性逐渐减弱,继续滴加HCl发生反应:HCO- 3 +H+ =H2O+CO2↑,最终溶液呈酸性,故溶液由黄色变为橙色,最终变为红色,与量的多少有关,选项D不符合题意.
答案 A.
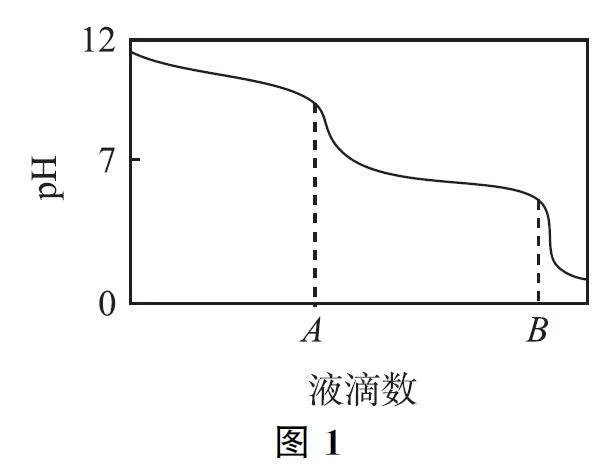
变式2 为探究Na2CO3 与盐酸反应的原理,某同学设计如下实验:
① 用一定浓度的稀盐酸与一定浓度的稀Na2CO3 溶液通过滴加的方式逐步反应.
② 用pH 传感器和滴数传感器测定和记录反应过程的变化.
实验过程记录如图1 所示,请回答下列问题:
(1)本实验是______溶液向______溶液中逐滴加入.
(2)用“量变引起质变”的观点分析图1.
①0A 段反应的离子方程式: ______.
②AB 段反应的离子方程式: ______.
③0A 与AB 两段所记录的滴数______(填标号).
a.基本相同 b.明显不等 c.无法判断
答案 (1)盐酸;碳酸钠.
(2)① CO23-+H+=HCO3-.
② HCO- 3 +H+ =CO2↑+H2O.
③a
高中化学试题中哲学观念的引入,明确了物质变化是有条件的,物质结构决定性质,性质存在一般性与特殊性,对学生形成正确的化学学科思想,树立科学的人生观、世界观、方法论,从而促进化学与社会的和谐发展.
(完)

