聚吡咯导电水凝胶的制备及在生物医学领域中的应用进展



关键词聚吡咯;水凝胶;导电;组织修复;柔性传感;评述
水凝胶是一种由亲水性高分子链形成的三维聚合物网络体系,具有良好的生物相容性、生物降解性[1]以及类细胞外基质等特性,广泛应用于生物医学领域。通常,水凝胶是由分散在水介质中的聚合物链通过多种机制交联而成[2],可分为物理交联型和化学交联型[3]。化学交联型水凝胶是在光[4]、热[5]、机械力[6]和pH[7]的作用下由单体聚合实现凝胶化[8-9],而物理交联型水凝胶是通过静电相互作用[10]、离子相互作用[11]、氢键[12]和链的缠结[13]等物理作用力形成的水凝胶。目前,大多数生物医用水凝胶几乎不导电,因此很难将电信号引入到典型的生物医用水凝胶中[14],这限制了水凝胶在生物医学领域中的应用。将电信号引入水凝胶,使其在水凝胶中产生传导和检测电信号,有助于皮肤损伤修复、神经修复、心肌修复以及柔性传感等生物医学领域的发展。
自1994年首次报道导电水凝胶以来,通过在传统水凝胶中引入导电成分制备的导电水凝胶得到了广泛的研究,聚吡咯(PPy)[15]、聚苯胺[16]、聚噻吩及其衍生物[17]等导电聚合物以及碳纳米管[18]、石墨烯[19]等导电纳米材料通常被用于合成导电水凝胶。其中,PPy是一种具有优异的导电性[20]、良好的生物相容性[21-22]、出色的氧化还原性能[23]以及环境稳定性[24]的导电聚合物,在生物医学领域具有极大的应用潜力。PPy可调节细胞的迁移、增殖和分化,适合与水凝胶复合形成性能稳定的PPy导电水凝胶,其中的PPy导电成分通常可以促进细胞黏附和生长[25]、改善水凝胶的机械性能、增强其机械强度[26]。PPy导电水凝胶对电信号的刺激具有响应性,使其能够通过传递电信号刺激电敏感细胞(皮肤细胞、神经细胞和肌肉等)响应电信号,促进上述细胞的增殖与分化[27],从而促进组织损伤修复,并且这种特性可用于柔性传感器,佩戴在人体表面[28]用于人体运动监测以及无线通信[29]等。
近年来,基于PPy导电水凝胶的研究和应用取得了巨大进展。本文介绍了PPy导电水凝胶的设计和制备方法,以及PPy导电水凝胶在皮肤损伤修复、神经修复、心肌修复以及柔性传感等生物医学领域的应用研究进展。
1PPy导电水凝胶的设计与制备
PPy导电水凝胶制备简单、电学性能优异、生物相容性良好,是研究最多的一类导电水凝胶。根据PPy与水凝胶基质结合的交联机理,PPy导电水凝胶主要分为两类:非共价交联型PPy导电水凝胶和共价交联型PPy导电水凝胶,其中较常见的是非共价交联型PPy导电水凝胶。
1.1非共价交联型PPy导电水凝胶
非共价交联型PPy导电水凝胶通常采用原位聚合法和一锅法,通过非共价相互作用将电活性成分PPy和非导电成分聚合而成。原位聚合法是将吡咯单体引入到水凝胶基质中,并在该水凝胶基质中聚合形成PPy导电水凝胶。一锅法是将吡咯单体与非导电聚合物的单体混合在一起,加入引发剂后同时聚合,反应完成后得到不同基质的PPy导电水凝胶。
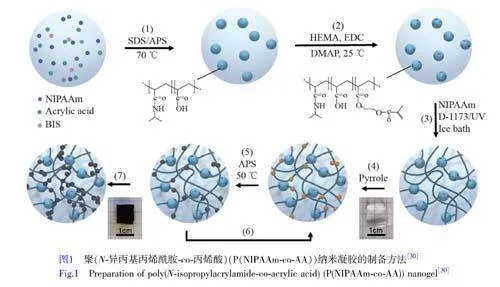
原位聚合制备PPy导电水凝胶的方法可使PPy均匀分散在水凝胶基质中,从而提供良好且稳定的导电性能,此方法通常先将吡咯单体分散在水凝胶基质中,而后将其浸泡在引发剂溶液中,使吡咯发生聚合反应形成PPy。Lo等[30]提出了一种在具有纳米结构的可伸缩、快速热响应的聚(N-异丙基丙烯酰胺)(PNIPAAm)水凝胶基质中原位聚合PPy的方法,制备了一种自传感致动器。由纳米结构的热响应材料PNIPAAm和具有吸光性的导电聚合物PPy聚合而成的P(NIPAAm-co-AA)纳米凝胶具有互穿双网络结构。如图1所示,首先构筑透明无色的PNIPAAm水凝胶基质,将其浸泡在吡咯溶液中,使吡咯单体附着在PNIPAAm水凝胶基质中,然后在50℃条件下将其浸泡在过硫酸铵(APS)溶液中,使吡咯在PNIPAAm水凝胶基质上原位聚合形成PPy导电水凝胶,此时由于引入了黑色的PPy导电聚合物,水凝胶由透明变为黑色。这种设计使水凝胶材料同时具备光、热和压阻响应性,实现了远程触发致动和局部应变传感。
Chen等[31]以聚乙烯醇(PVA)为基底,在PPy和聚丙烯酰胺(PAAM)聚合、交联的基础上进行凝胶化,制得PPy导电水凝胶。他们首先将吡咯单体加入到PVA基质中,再加入APS引发剂,通过原位聚合的方法使吡咯单体在PVA基质中聚合形成PPy,此时材料并未凝胶化,再向其中加入丙烯酰胺,最终形成聚乙烯醇-聚丙烯酰胺-PPy(PVA-PAAM-PPy)导电水凝胶。通过PVA、PPy和聚丙烯酰胺互穿网络之间的多重氢键,使导电水凝胶具有优异的力学性能,拉伸强度在500%时达到0.2MPa,压缩强度在90%时达到1.5MPa,同时电导率达到0.3S/m。因此,此水凝胶可作为柔性可穿戴电子设备中的应变传感器进行信号检测。
受贻贝结构启发,本研究组采用邻苯二酚衍生物多巴胺(DA)作为掺杂剂和介体,在双网络水凝胶基质中原位聚合PPy,得到PPy导电水凝胶[32]。首先,通过光交联的方式制备了双网络甲基丙烯酰化明胶-聚丙烯酰胺(GelMA-PAM)水凝胶(GP水凝胶),聚合过程条件温和,能够很好地保持水凝胶的微观结构[33]。然后,将GP水凝胶浸泡在含有DA的吡咯溶液中,吡咯能够附着在GP水凝胶的网络上,在掺杂剂DA的作用下,吡咯单体通过水凝胶链上的氨基和羟基与吡咯环上的碳氧键之间以非共价相互作用结合,使其在GP水凝胶上均匀分散。最后,缓慢加入引发剂APS,在低温下搅拌反应,吡咯单体发生缓慢的氧化聚合得到DA-PPy-GP水凝胶。在吡咯聚合的同时DA形成了低聚物,增加了PPy链的亲水性,进一步增强了PPy链与水凝胶主链之间的强氢键和相互作用[34]。采用常规方法制备的导电水凝胶通常会存在导电聚合物分散不均匀的情况。但采用DA作为掺杂剂和介体制备的导电PPy网络在水凝胶中分散非常均匀,促进了电子在导电水凝胶中的快速传递,表现出良好的力学性能、生物相容性以及灵敏的应变响应能力,适用于植入式应变传感。
原位聚合法通常是将氧化剂加入含有吡咯单体的水凝胶基质中,由于水凝胶的孔径通常小于吡咯单体,吡咯单体无法在水凝胶基质中充分渗透,导致PPy聚集在水凝胶的表面而非内部[35],吡咯单体无法在水凝胶基质中均匀聚合,这将影响PPy导电水凝胶的电学性能和机械性能[36]。Wang等[37]在PVA水凝胶中原位聚合PPy得到PVA/PPy复合水凝胶,由于吡咯无法均匀分散在PVA水凝胶基质中,很难得到电学性能较好的复合水凝胶。PPy原位聚合的不均匀性并非在任何情况下都是缺点,Kim等[38]在聚(N-异丙基丙烯酰胺)(PNIPAm)基质上原位聚合导电PPy,合成了一种具有热变形性与热响应性的PPy导电水凝胶薄膜,如果PPy渗入到PNIPAM内部,可能会失去热变形性。由于一锅法是将所有单体同时聚合,制备方法简单,可以有效解决吡咯在整个水凝胶中分布不均匀的问题。
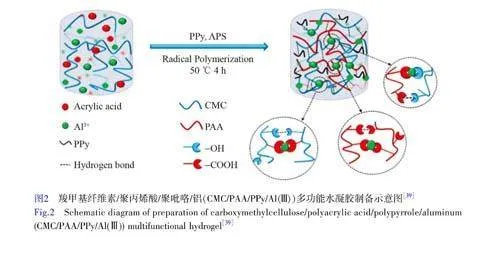
一锅法制备PPy导电水凝胶的过程操作简单,通常是将需要聚合的所有单体与引发剂同时加入容器中进行反应。Wang等[39]采用一锅法制备了一种新型多功能水凝胶(图2),将羧甲基纤维素、丙烯酸(AA)、吡咯和Al3+同时加入到容器中,再加入引发剂APS进行聚合形成复合羧甲基纤维素/聚丙烯酸/PPy/Al(Ⅲ)(CMC/PAA/Ppy/Al(Ⅲ))水凝胶,羧甲基纤维素和Al3+与聚丙烯酸中羧基之间的多重动态配位作用,以及PPy与羧甲基纤维素中的羟基以及聚丙烯酸中羧基之间的氢键作用使其具有良好的力学性能及可自愈合性能。PPy纳米粒子、自由离子以及PPy纳米粒子与自由离子之间的协同作用赋予水凝胶良好的导电性。
非共价交联型PPy导电水凝胶合成方法简单,但是由于PPy与水凝胶基质通过非共价键结合,其结合能力相对较弱,在实际应用过程中可能会造成PPy脱落。例如,当非共价交联型PPy导电水凝胶作为组织损伤修复材料时,使用环境通常位于体内或比较潮湿,或作为柔性可穿戴传感材料在水下或汗液过多的环境中使用,由于水凝胶具有溶胀特性,在生理条件下PPy可能会从水凝胶中脱落渗出,导致导电性降低,并存在潜在的毒性[40],影响其使用效果。因此,非共价交联型PPy导电水凝胶在制备时需要结合实际应用进行设计,使其稳定性、耐化学性以及机械性能可以满足实际应用需求。
1.2共价交联型PPy导电水凝胶
共价交联型PPy导电水凝胶是通过共价键使PPy与水凝胶基质结合而成。共价交联型PPy导电水凝胶组分之间的共价键使水凝胶能够保持稳定的状态,具有良好的化学耐受性和稳定的机械性能[41],与通过聚合物链之间较弱的相互作用进行交联得到的非共价交联型PPy导电水凝胶相比具有优势。
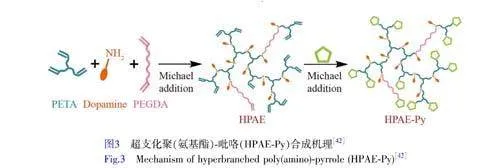
如图3所示,Liang等[42]设计了一种可涂装的导电水凝胶贴片,将吡咯基团封端到含有多巴胺的超支化聚合物上,吡咯和DA通过Fe3+的氧化同时在原位聚合。此导电水凝胶贴片具有良好的湿粘附性与导电性能,自聚合的DA和多巴胺-Fe3+的络合作用赋予水凝胶粘附特性,而原位形成的导电PPy纳米颗粒既作为交联点保持网络稳定性,又赋予水凝胶导电性能。通过两步迈克尔加成反应,顺序引入DA和吡咯基团,合成超支化聚(氨基酯)-吡咯(HPAE-Py),加入明胶与纯化的HPAE-Py聚合物形成前驱体溶液,使用Fe3+引发HPAE-Py末端吡咯基团的聚合。此外Fe3+还可作为固化剂,与DA形成儿茶酚-Fe3+络合物,通过化学键连接到水溶性超支化大分子上的吡咯基团可以减少吡咯单体的毒性和泄漏,并且在不引入有机溶剂或小分子的情况下在水溶液中聚合,PPy在水凝胶中分布均匀,可以直接体内给药。
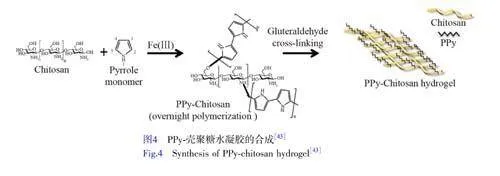
Mihic等[43]首先使用3/100和3/10两种浓度比例的PPy/壳聚糖分别制备了两种PPy-壳聚糖聚合物,然后通过戊二醛交联形成PPy-壳聚糖水凝胶(图4)。不同浓度的PPy-壳聚糖聚合物制备的水凝胶具有相似的拉伸弹性,用作心脏跳动环境中的生物医学材料时可能具有相似的特性。采用循环伏安法评估电导率,两种PPy-壳聚糖都形成了与其氧化/还原状态相对应的滞后环,而未接枝的壳聚糖则表现出一致的线性关系,这表明PPy-壳聚糖水凝胶不同于纯壳聚糖,具有半导体性质。
共价交联型PPy导电水凝胶中的共价键进一步增加了修饰主链和侧基与官能团连接的可能性,从而增大了PPy导电水凝胶的化学活性。共价交联PPy导电水凝胶通常需要改性单体,而不是直接使用单体原料制备水凝胶,对特殊改性单体的要求可能会限制共价交联型PPy导电水凝胶的应用。通常,非共价交联型PPy导电水凝胶的制备过程简单,但由于非共价交联的作用相对较弱,其电化学和力学性能比较有限。与非共价交联型PPy导电水凝胶相比,共价交联型PPy导电水凝胶组分之间共价键的存在使其结构状态稳定,并具有较好的电化学和力学性能[14],但因共价交联型PPy导电水凝胶通常需要通过有机合成的方法改性单体,制备过程比较复杂,难以控制。因此,在设计与制备PPy导电水凝胶时,需要考虑其实际应用所需的性能,进行有目的性的设计。
2PPy导电水凝胶的应用
水凝胶具有良好的生物相容性、三维多孔结构、高含水率以及类细胞外基质等特性,可与PPy导电聚合物优异的电学性能相结合,在生物医学工程中展示出巨大的应用潜力,可用于皮肤损伤修复、神经修复、心肌修复和柔性传感等。
2.1皮肤损伤修复
皮肤组织是覆盖人体表面并与外界直接接触的人体组织,具有感受外界刺激、调节体温和保护人体免受外界伤害等作用[44],虽然大部分皮肤损伤后可以恢复原本的样子,但是大多数皮肤损伤都无法完全恢复其功能[45-46]。传统的伤口敷料(如纱布、绷带或海绵)功能单一,只起到物理屏障以及吸收渗出液的功能,不能达到促进伤口愈合的作用。此外,纱布、绷带等敷料在使用过程中,当纤维或碎片与伤口部位交织在一起会引起炎症,可能造成二次损伤[47]。由于水凝胶具有高含水率、良好的溶胀性、适当的弹性和类细胞外基质等特性,可以满足伤口愈合的环境要求,是伤口敷料的极佳候选材料[48]。导电水凝胶材料可以通过传递电信号刺激皮肤细胞,促进其响应电信号,有利于其增殖与分化,进而促进皮肤伤口愈合。
Feng等[49]设计了一种具有近红外(NIR)触发的可调粘附、自变形和细菌清除功能的非对称PPy导电水凝胶。以吡咯和DA为原料,引入N-异丙基丙烯酰胺(N-异丙基丙烯酰胺)和AA制备了PPy-PDA非对称水凝胶。如图5所示,PPy-PDA非对称水凝胶集成了近红外触发的可调粘附、自我变形和细菌清除等多种功能,内部的水传递使其具有自变形和可调的粘附性,作为创面敷料时,通过近红外光照可以较容易去除PPy-PDA非对称胶水凝胶,从而实现无痛和按需更换敷料。该研究构建了大鼠皮肤感染伤口的模型,采用PPy-PDA非对称水凝胶进行了促进伤口愈合实验,分为空白组、商用3MTM薄膜组、水凝胶组和水凝胶+近红外光照组,在0、3、7、16d观察伤口大小,结果表明,只有水凝胶+近红外光照组在16d后伤口创面完全愈合。此外,通过Masson染色评估了16d后伤口部位胶原沉积的情况,染色结果表明,水凝胶组与水凝胶+近红外光组均出现均匀的胶原束沉积,而空白组与商用3MTM薄膜组创面边缘清晰、胶原沉积,这表明近红外光照组材料具有良好的促进伤口愈合效果。因此,这种多功能水凝胶不仅在感染伤口敷料方面具有潜在的应用价值,而且为设计智能非对称水凝胶提供了一种新方法。Wang等[50]制备了一种同样具有近红外响应性的PPy导电水凝胶,通过光热和光动力抗菌治疗的协同作用,水凝胶在体外抗菌实验表现出良好的抗菌活性。体内实验结果表明,该水凝胶能有效控制感染,促进创面愈合。由于PPy是一种黑色聚合物,因此含有PPy的水凝胶多为黑色,而深色物质可以吸收近红外激光将其转化为热量,通过升高温度进行光热治疗,杀死细菌,促进伤口愈合,所以PPy导电水凝胶在处理细菌感染伤口方面具有极大的应用潜力。
慢性的皮肤伤口通常会为患者带来更大的危害,电刺激与水凝胶结合治疗的方法有望成为解决慢性伤口的一种可行的解决方法。Zhang等[51]设计了一种简便易行的方法制备具有自主自愈能力的高度可伸缩的PPy导电水凝胶,以PVA和官能化的硫酸软骨素(CS)为原料,设计制备了价格低廉、制备简单的PCPZ水凝胶。将PCPZ水凝胶作为导电水凝胶敷料,采用电刺激治疗(ES)糖尿病大鼠的慢性创面模型,实验分为4组:对照组、水剂敷料组、PCPZ水凝胶组和PCPZ+ES治疗组,结果表明,单独使用市售水剂敷料并不能加速创面愈合,PCPZ水凝胶组可在一定程度上促进创面愈合,但通过导电的PCPZ水凝胶以3V电压刺激伤口,可以维持或增强皮肤创面电流,显著促进伤口闭合,这说明通过PCPZ水凝胶应用ES进行愈合的效果优于单独使用水凝胶。但是,该研究仅对纯水凝胶组与水凝胶+ES组进行了对比,并未讨论不同电压刺激下慢性伤口愈合的情况。因此,不同电压刺激是否会影响慢性伤口的治疗效果,可能是导电水凝胶与ES结合治疗方法未来的研究方向。导电水凝胶除了可以促进皮肤细胞的信号响应使其增殖分化,还可以使用电刺激进行治疗,这也是PPy导电水凝胶不同于传统水凝胶的优势。
2.2神经修复
神经系统的自我修复能力有限[52],因此神经再生目前仍然是生物医学工程中的一大挑战。神经再生受到许多生物因素影响,电信号可以控制电敏感细胞的黏附、代谢、增殖、迁移和分化[53],神经细胞属于电敏感细胞[54]。导电水凝胶在神经组织工程中显示出很大的应用潜力。导电水凝胶通常通过水凝胶基质与导电聚合物材料结合得到[55],PPy是典型的导电聚合物[56],具有高导电性、环境稳定性和低细胞毒性[57],能够很好地满足神经再生的要求。
Xu等[58]开发了一种用于修复神经的可注射PPy导电水凝胶(图6)。此材料具有高吸水率和良好的自愈合性,可促进神经干细胞(NSCs)的附着、增殖和分化,在斑马鱼脑损伤模型中,在脑内注射含有神经干细胞的CDD水凝胶,斑马鱼在6d后的存活率高达80%,单独CDD水凝胶组中斑马鱼的存活率约为40%,而空白对照组中斑马鱼存活率仅有30%。斑马鱼恢复运动功能测试结果表明,在4和6d后,神经干细胞CDD水凝胶组斑马鱼运动能力分别恢复了66%和80%,CDD水凝胶组斑马鱼分别恢复了47%与53%的运动能力,对照组斑马鱼运动能力在6d后仅恢复了21%。综上可知,此材料可以修复神经,促进神经再生,在神经修复和运动感知领域具有极大的应用潜力。本研究组设计了一种具有多孔、高导电性、柔性以及粘附性的生物相容性PPy导电水凝胶[59]。这种薄膜状的水凝胶敷料可以很容易地附着在神经纤维上,并自动形成管状结构,简化了糖尿病患者周围神经损伤(PNI)治疗过程中繁琐的安装过程。PPy导电水凝胶的这些特性除了具有体外促进轴突伸展的功能外,还可以促进Schwann细胞附着和迁移,体内实验证明此水凝胶能促进糖尿病大鼠轴突和髓鞘的再生。此外,水凝胶还可以促进神经冲动传递和肌肉感受性,从而防止肌肉失神经萎缩,促进肌肉功能恢复。
天然神经组织是由多个排列的神经束组成,基质电导率有利于细胞之间电信号的传递,或有效地向细胞传递外部电信号。Wu等[60]采用针对神经元细胞外基质的仿生设计,首次合成了具有亲水性的导电PPy纳米粒子,以改善其在胶原水凝胶中的均匀性,然后通过微流控芯片制备了具有高度取向微结构的载细胞-PPy-胶原水凝胶微纤维。水凝胶微纤维具有天然的细胞粘附性、定向纤维结构和导电性,为神经元提供了一个仿生三维微环境,定向的纤维微结构增强了神经元样细胞与纤维轴突的排列;基质传导性促进了细胞伸展,上调了神经元相关基因的表达;此外,外部电刺激进一步促进了神经元功能的表达。研究者采用逆转录聚合酶链式反应(RT-PCR)方法检测电刺激对PC12细胞神经发生相关基因表达的影响。在没有电刺激的情况下,各组的微管蛋白-β3(一种与神经发生相关的特定蛋白质标志物)基因表达均略有增加,表明单独使用水凝胶为纤维对神经发生具有一定促进作用。经3次电刺激后,微管蛋白-β3在Ⅰ型胶原蛋白含量最多的水凝胶组中的表达增加了2.2倍,表明电刺激与水凝胶微纤维结合治疗的方法可以有效促进神经发生。这种方法在构建神经发生的仿生微环境和促进神经修复方面具有良好的应用潜能。PPy导电水凝胶由于具有良好的生物相容性及高导电性,在促进神经损伤的神经再生方面具有良好的应用前景。
2.3心肌修复
心肌梗死是目前世界上最常见的死亡原因之一,针对心肌梗死治疗的技术与材料相继被开发出来,例如通过注射生物材料和心脏补片重建梗死心肌的正常功能[61]。但是,不论是腔内、补片缝合还是经导管注射,都可能对虚弱的心肌组织造成二次损害[62],因此,需要开发出更适用于临床应用的良性材料。相比于腔内、补片缝合以及经导管注射等方式,PPy导电水凝胶不会对心肌造成二次损伤,并且其导电特性可以更好地促进心肌修复。
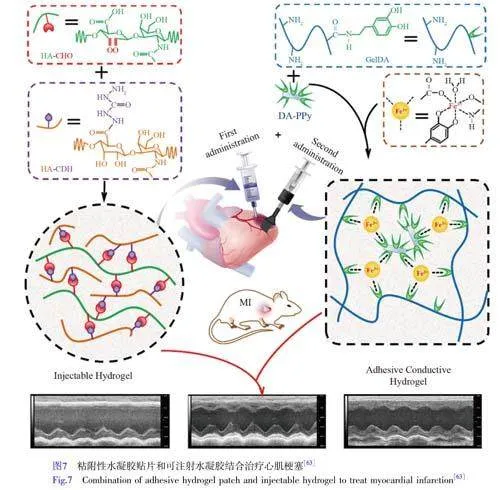
Wu等[63]提出了一种在梗塞心肌内同时应用导电水凝胶贴片和可注射水凝胶的联合治疗方法。如图7所示,首先通过Fe3+诱导多巴胺-明胶(GELDA)与多巴胺功能化PPy(DA-PPy)的离子配位作用形成均一的网络结构,制备了具有自粘性的导电水凝胶贴片,然后通过氧化型透明质酸(HA-CHO)和酰肼基玻尿酸(HHA)之间的席夫碱反应原位形成可注射可裂解的水凝胶。与使用单一材料相比,在心肌内注射HACHO/HHA水凝胶,然后在心脏表面涂抹导电的GELDA/DA-PPy水凝胶贴片,超声心动图、组织学和血管生成方面的实验结果显示,心肌功能得到了显著改善。
Parchehbaf-Kashani等[64]成功研制出以模仿心脏细胞外基质和PPy为导电成分的PPy-心凝胶(CGPPy)导电心脏支架,并采用交联剂提升支架的力学性能。PPy-心凝胶导电心脏支架可以提供一个生物相容的微环境,在细胞种植后,可在14d内增强心肌祖细胞(CPC)的活性、黏附与迁移。研究结果表明,CPC包埋的交联型CG-PPy对心肌梗死大鼠的心功能恢复具有积极作用,在材料植入4周后仍然具有较高的促进细胞增殖和分化能力,增加了α-平滑肌肌动蛋白(α-SMA)血管样圆形结构的数量,减少了CD68+细胞的数量。因此,该支架在临床处理梗死后的心肌恢复方面具备巨大的应潜力。
心肌损伤与心肌疾病通常会造成心肌信号传导异常,但心肌细胞的再生能力有限,若不治疗会产生永久性瘢痕组织。PPy导电水凝胶可以提供生物相容的微环境,增强心肌信号传导,促进心肌细胞增殖与分化,在心肌修复领域具有极大的应用潜力。但是,用于心肌修复的PPy导电水凝胶通常是由可降解的亲水性聚合物与PPy结合而成,在人体内使用时,随着亲水性聚合反应的发生,不可降解的PPy[65]直接暴露在人体内,长期留存可能会产生炎症反应[14]。PPy长期留存体内所引发的安全性问题是研究人员未来需要重点解决的问题。
2.4柔性传感
柔性可穿戴传感器因其可以方便地实现运动监测[66]、健康监测[67]和人机交互[68],因而受到广泛关注[69-70]。应变传感器附着在可形变的衬底表面,与衬底表面完全接触,当衬底发生形变时,传感器同时发生形变,使形变的机械信号转化为电压和电阻等电信号变化[71]。在不同类型的传感材料中,PPy导电水凝胶兼具传统导电材料的特性和水凝胶的物理特性,因此在柔性传感设计中显示出很大的优势。
Han等[72]通过在聚合物网络中原位形成PDA掺杂的PPy纳米纤维,制备了具有导电性、可伸展性和粘附性的透明水凝胶(图8)。PDA-PPy纳米纤维在具有亲水性的聚合物聚丙烯酰胺中原位形成,并且结合良好,形成了水凝胶网络,进而形成了完整的导电路径,PDA-PPy纳米纤维中的邻苯二酚基团为水凝胶提供了良好的粘附性,PDA-PPy纳米纤维含量增加使水凝胶变得更坚韧,可拉伸性能更好。该研究提出的原位形成导电纳米纤维的策略简单且智能,将不可溶且疏水的导电聚合物引入了水凝胶,制备的多功能PDA-PPy水凝胶具有广阔的应用前景,如传感器、透明电子皮肤和用于透明身体附着信号检测的生物电极。Li等[73]使用海藻酸钠和多巴胺官能化的PPy与硼砂设计了一种多功能PPy导电水凝胶,其电导率高达(1.33±0.012)S/m,作为应变传感器具有高达10.23的高测量因子,以及稳定、可重复的响应信号,可以超灵敏地大规模监测人体关节运动和微妙的肌肉运动。
基于导电水凝胶的可穿戴应变传感器在人体运动和健康监测等领域具有巨大的应用潜力,其应用需求也越来越多。但是,水分子会削弱或消除水凝胶的某些性质,因此设计适用于水下或潮湿环境并具有生物安全性的可穿戴传感器仍然具有挑战性。Zheng等[74]通过原位聚合将丝素蛋白(SF)和单宁酸(TA)复合的导电聚合物PPy引入到同一个水凝胶网络中,成功构建了SF/TA@PPy导电水凝胶。SF/TA@PPy导电水凝胶具有良好的延伸性、皮肤顺应性、抗菌性和生物相容性,在空气与水环境中均具备良好的自愈合能力。此外,在潮湿环境下SF/TA@PPy对各种材料仍能表现出良好的粘附性,并且这种材料的工作范围宽、应变灵敏度高、电阻响应快,在多次拉伸循环后仍具有稳定的电性能。作为一种可穿戴的应变传感器,无论在空气还是水环境中,SF/TA@PPy水凝胶都可在不借助外部器件的情况下直接附着在人体表面,并且可以快速感知手指、手腕、肘和膝关节等大应变的身体运动,也能准确表达微笑、皱眉、咳嗽和呼吸等小应变的生理信号变化。基于稳定的电学性质,SF/TA@PPy可通过控制身体运动变化表达摩斯密码,从而有效实现水下信息传输。应用了PPy导电水凝胶的可穿戴应变传感器在空气或水环境中均表现出良好的信号传输能力,PPy导电水凝胶具有良好的生物相容性与抗菌性,不会因为长期与人体接触而引起过敏,这种材料为水下运动的生理信号检测提供了新的思路与解决方式。
3结论
PPy导电水凝胶是一类独特的材料,结合了水凝胶和有机导体的优点,PPy结构为电子传输相(电极)和离子传输相(电解液)之间提供了良好的界面,显著提高了电子或离子传导性以及对外部刺激的响应。由聚合物网络组成的复合型PPy导电水凝胶具有较好的完整性、强度、弹性和力学性能,在皮肤损伤修复、神经修复、心肌修复和柔性传感等生物医学领域具有广阔的应用前景。但是,PPy导电水凝胶的发展目前面临以下挑战:(1)PPy的生物相容性通常是通过体外细胞培养评估,表现出良好的生物相容性,但PPy的体内和体外生物相容性实验结果不同,在体内使用时,由于PPy导电水凝胶中的亲水性聚合物成分逐渐降解,使得PPy直接与人体接触,由于PPy不可降解,长期留存体内可能产生不良反应;(2)用于组织时是否会产生炎症反应;(3)用于柔性传感时其导电性能是否可以保持长期稳定性。因此,还需对现有的品质优良的PPy导电水凝胶材料进行相关研究,探索PPy导电水凝胶在生物医学应用中的安全性与稳定性,这将是PPy导电水凝胶研究今后的发展目标与必经之路。

