sFlt-1/PlGF比值联合D-二聚体评估子痫前期妊娠结局的临床价值


[摘 要]目的 探讨可溶性fms样酪氨酸激酶1(sFlt-1)/胎盘生长因子(PlGF)比值联合D-二聚体(D-D)评估子痫前期(PE)妊娠结局的临床价值。方法 回顾性选取2021年12月至2023年1月收治的102例PE患者作为子痫前期组,另选取同期在我院进行产前检查的正常孕妇60例作为对照组,比较两组28至32周时血清sFlt-1、PlGF、sFlt-1/PlGF比值、D-D水平,采用受试者工作特征(ROC)曲线分析sFlt-1/PlGF比值联合D-D对妊娠结局的预测价值。结果 子痫组血清sFlt-1、sFlt-1/PlGF比值、D-D水平高于对照组,PlGF水平低于对照组(t值分别为10.855、20.310、17.002和15.365,P<0.05);Logistic分析显示,高体质量指数(BMI)、妊娠期糖尿病或肾病、既往子痫前期史、sFlt-1/PlGF比值、D-D均为影响孕妇发生子痫前期的独立危险因素,其OR值及95%CI分别为18.171(6.493~50.849)、4.259(1.096~16.547)、11.367(1.226~105.391)、7.939(2.514~25.068)和1.567(1.330~1.845),P<0.05。不良妊娠结局组血清sFlt-1、sFlt-1/PlGF比值、D-D水平高于非不良妊娠结局组,PlGF水平低于非不良妊娠结局组(t值分别为4.759、5.646、5.331和3.135,P<0.05)。ROC曲线显示,sFlt-1/PlGF比值联合D-D预测妊娠结局的曲线下面积(AUC)为0.843,灵敏度和特异度分别为79.41%和75.00%。结论 子痫前期患者血清sFlt-1/PlGF比值、D-D水平升高,二者可用于评估子痫前期妊娠结局。
[关键词] 子痫前期;妊娠结局;可溶性fms样酪氨酸激酶1;胎盘生长因子;D-二聚体
Doi:10.3969/j.issn.1673-5293.2024.07.013
[中图分类号]R173[文献标识码]A
[文章编号]1673-5293(2024)07-0079-06
The clinical value of sFlt-1/PlGF ratio combined with D-D
in assessing the pregnancy outcomes of preeclampsia
[Abstract] Objective To explore the clinical value of the soluble fms-like tyrosine kinase-1 (sFlt-1)/placental growth factor (PlGF) ratio combined with D-dimer (D-D) in assessing the pregnancy outcomes of preeclampsia (PE). Methods Retrospectively,102 cases of PE patients admitted from December 2021 to January 2023 were selected as the PE group,while 60 normal pregnant women undergoing prenatal examinations in our hospital during the same period were selected as the control group.The serum sFlt-1,PlGF,sFlt-1/PlGF ratio and D-D at 28 to 32 weeks were compared between the two groups.Receiver operating characteristic (ROC) curve was used to analyze the predictive value of sFlt-1/PlGF ratio combined with D-D for pregnancy outcome. Results Serum levels of sFlt-1,sFlt-1/PlGF ratio and D-D in PE group were higher than those in control group,while PlGF level in the PE group was lower than those in control group (t=10.855,20.310,17.002,and 15.365,P<0.05).Logistic analysis showed that high body mass index (BMI),gestational diabetes mellitus or kidney disease,history of PE,sFlt-1/PlGF ratio and D-D were independent risk factors for PE in pregnant women,with OR values and 95%CI of 18.171(6.493-50.849),4.259(1.096-16.547),11.367(1.226-105.391),7.939(2.514-25.068),and 1.567(1.330-1.845),respectively,P<0.05.Serum levels of sFlt-1,sFlt-1/PlGF ratio and D-D in adverse pregnancy outcome group were higher than those in good pregnancy outcome group,while PlGF level was lower than those in non-adverse pregnancy outcome group,while PlGF levels in adverse pregnancy outcome group were lower than in the non-adverse pregnancy outcome group (t=4.759,5.646,5.331,and 3.135,P<0.05).ROC curves analysis showed that sFlt-1/PlGF ratio combined with D-D had an area under the curve (AUC) of 0.843 for predicting pregnancy outcomes,with sensitivity and specificity of 79.41% and 75.00%,respectively. Conclusion PE patients have elevated serum sFlt-1/PlGF ratio and D-D levels,both of which can be used to assess the pregnancy outcome of PE.
[Key words] preeclampsia;pregnancy outcomes;soluble fms-like tyrosine kinase-1;placental growth factor;D-dimer
子痫前期是一种多系统进展性疾病,其发病率达2%~5%[1]。这类疾病目前尚无有效的治疗方法,研究指出,子痫前期严重可累及肝脏、肾脏等多系统,导致胎儿生长受限、羊水过少、宫内胎儿死亡、神经发育障碍,甚至不可逆的脑损伤(脑瘫)等[2-3]。近年来,子痫前期的发病率在世界范围内不断增加,但其病理生理机制仍然知之甚少,目前用于子痫前期诊断的有效标志物仍然不多。相关研究表明,子痫前期与血小板、凝血酶以及纤溶因子等指标异常密切相关[4]。可溶性fms样酪氨酸激酶1(soluble fms-like tyrosine kinase-1,sFlt-1)和胎盘生长因子(placental growth factor,PlGF)均为循环血管生成因子,sFlt-1/PlGF比值作为判断胎盘功能障碍的指标在过去十年得到了广泛的研究[5-6]。D-二聚体(D-dimer,D-D)是一种特异性降解产物,可反映机体纤溶系统活性及血液高凝状态[7]。基于此,本研究旨在分析sFlt-1/PlGF比值联合D-D评估子痫前期妊娠结局的临床价值。
1资料与方法
1.1一般资料
回顾性选取2021年12月至2023年1月收治的102例子痫前期患者作为子痫前期组,纳入标准:①符合子痫前期诊断标准[8];②年龄20~40岁;③孕周28~39周;④单胎妊娠者;⑤患者本人及家属知晓并同意,本人自愿签署知情同意书。排除标准:①多胎妊娠;②孕期服用致畸药物者;③合并感染性疾病;④血液系统疾病者;⑤存在胎盘早剥、胎盘前置者;⑥严重心、肺、肾部疾病。另选取同期在我院进行产前检查的正常孕妇60例作为对照组,排除标准:①多胎妊娠;②年龄<20岁或>40岁;③孕期服用致畸药物者;④存在胎盘早剥、胎盘前置者;⑤严重心、肺、肾部疾病。本研究符合相应伦理原则和规范,已得到我院的伦理委员会批准。
1.2方法
收集产妇28~32周时清晨空腹静脉血5mL,放入普通不抗凝试管中保存。自然凝固30min后,3 000r/min离心15min分离上清,采用酶联免疫吸附法检测sFlt-1、PlGF、D-D水平,并计算sFlt-1/PlGF比值。收集所有孕妇年龄、体质量指数(body mass index,BMI)、孕周、受孕方式、孕次、高血压、妊娠期糖尿病或肾病、子痫前期史、自然流产史等资料。
1.3观察指标
1.3.1血清sFlt-1、PlGF、sFlt-1/PlGF比值、D-D水平
患者空腹静脉血液标本5mL,酶联吸附法检测sFlt-1、PlGF、D-D水平,同时计算sFlt-1/PlGF比值。
1.3.2研究对象临床资料
孕妇年龄、BMI、孕周、受孕方式、孕次、高血压、妊娠期糖尿病或肾病、子痫前期史、自然流产史等资料。
1.4统计学处理
采用SPSS 20.0进行数据分析,计量资料以例数n表示,组间比较进行χ2检验。符合正态分布的计量资料采用平均值±标准差(x-±s)表示,组间比较采用独立样本t检验。采用多因素Logistic回归分析sFlt-1/PlGF比值联合D-D在评估子痫前期风险的获益情况,绘制受试者工作特征曲线(receiver operating characteristic,ROC)分析sFlt-1/PlGF比值联合D-D对妊娠结局的预测价值。P<0.05为差异有统计学意义。
2结果
2.1子痫前期组和对照组血清sFlt-1、PlGF、sFlt-1/PlGF比值、D-D水平比较
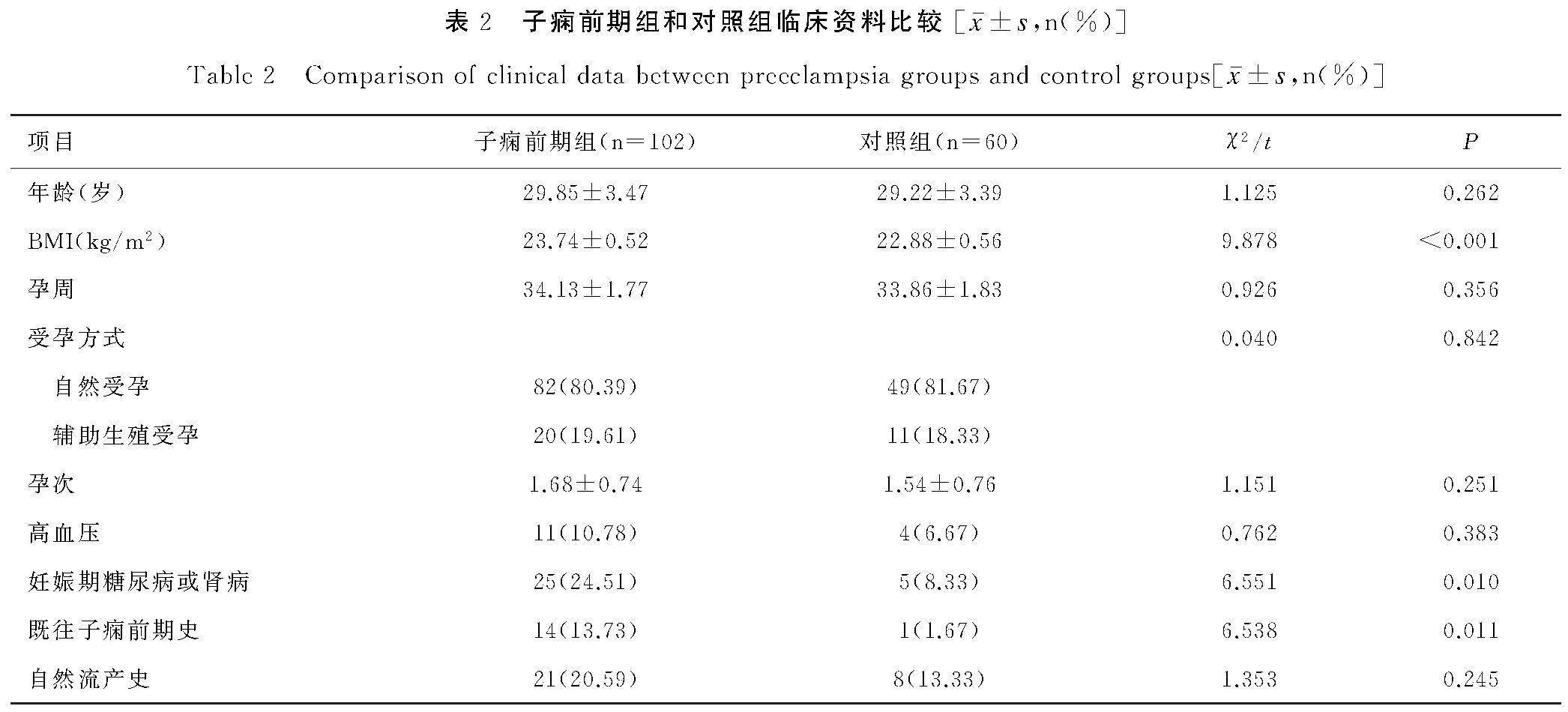
子痫前期组血清sFlt-1、sFlt-1/PlGF比值、D-D水平高于对照组,PlGF水平低于对照组,差异有统计学意义。(t值分别为10.855、20.310、17.002和15.365,P<0.05),见表1。
2.2子痫前期组和对照组临床资料比较
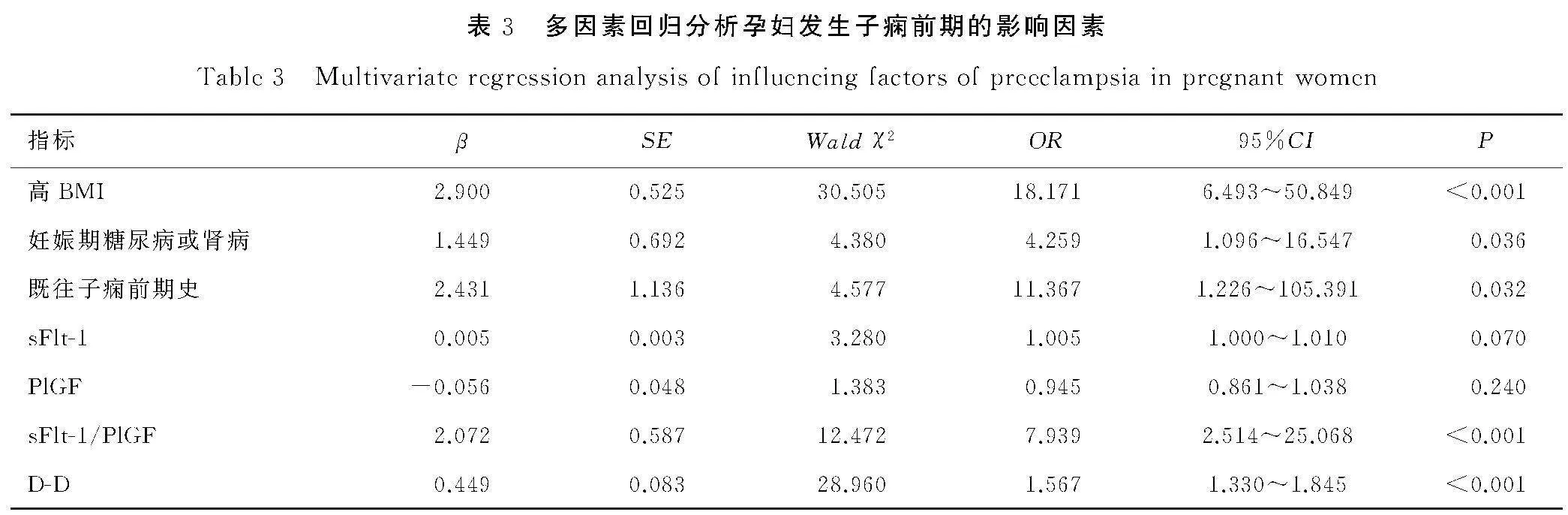
子痫前期组和对照组在BMI、妊娠期糖尿病或肾病、既往子痫前期史方面差异具有统计学意义(χ2/t值分别为9.878、6.551和6.538,P<0.05),见表2。
2.3多因素回归分析孕妇发生子痫前期的影响因素
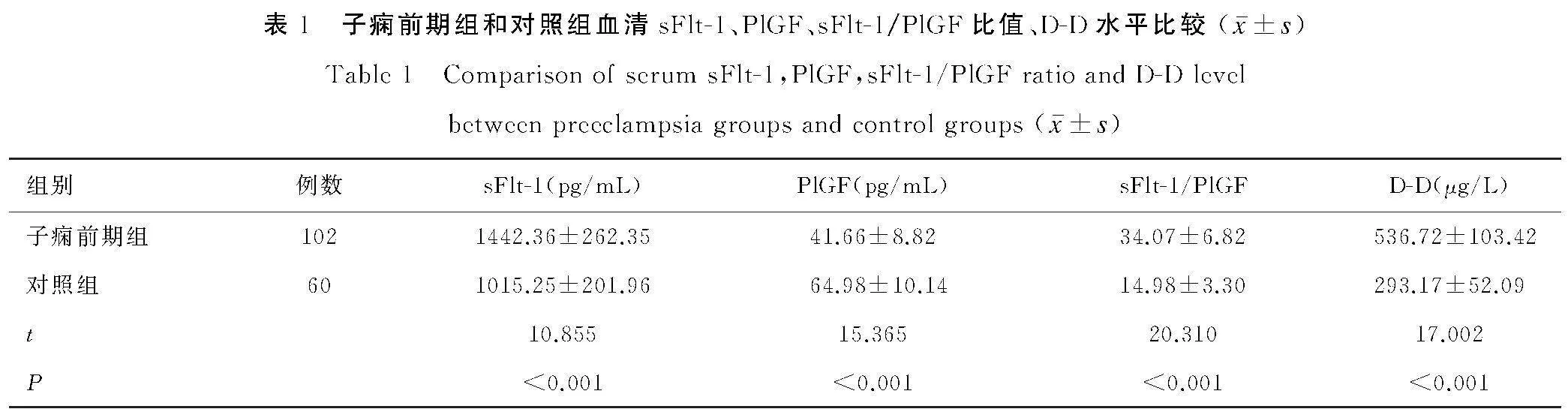
将表1和表2中具有统计学意义的变量纳入Logistic分析,结果显示,高BMI、妊娠期糖尿病或肾病、既往子痫前期史、sFlt-1/PlGF比值、D-D均为影响孕妇发生子痫前期的独立危险因素(P<0.05),见表3。
2.4不同妊娠结局孕妇血清sFlt-1、PlGF、sFlt-1/PlGF比值、D-D水平比较
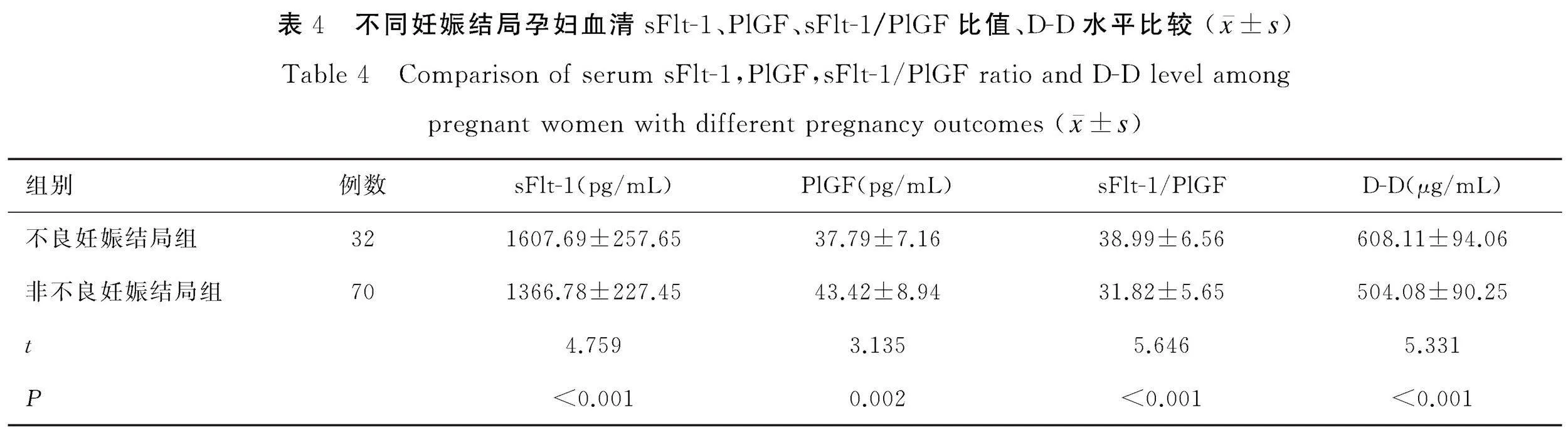
不良妊娠结局组血清sFlt-1、sFlt-1/PlGF比值、D-D水平高于非不良妊娠结局组,PlGF水平低于非不良妊娠结局组(t值分别为4.759、5.646、5.331和3.135, P<0.05),见表4。
2.5 sFlt-1/PlGF比值联合D-D对妊娠结局的预测价值
ROC曲线显示,sFlt-1/PlGF比值联合D-D预测妊娠结局的曲线下面积(area under the curve,AUC)为0.843,高于sFlt-1/PlGF的0.767、D-D的0.781,见表5,图1。
3讨论
子痫前期是一种动态性疾病,病情可持续发展,可表现为轻度子痫前期(仅高血压伴蛋白尿)或迅速发展为重度子痫前期(多器官和系统功能受损的子痫前期)、子痫(基于子痫前期发生且不明原因的癫痫发作)或HELLP(hemolysis,elevated liver enzymes,and low platelet count)综合征(溶血、肝酶升高和血小板降低),导致胎儿和孕产妇死亡率较高[9-10]。因此,提高对子痫前期的临床诊断对改善母婴预后具有重要意义。
3.1血清sFlt-1、PlGF及sFlt-1/PlGF比值与子痫前期妊娠结局的关系
以往研究显示,sFlt-1、PlGF与子痫前期的发展密切相关,但由于仅采用两项指标进行子痫前期的预测存在敏感度和特异度较低的问题[11]。本研究中,子痫组血清sFlt-1、sFlt-1/PlGF比值水平高于对照组,PlGF水平低于对照组,这与以往的研究结果一致[12]。sFlt-1作为酪氨酸家族成员之一,其可与PlGF或血管内皮生长因子(vascular endothelial growth factor,VEGF)结合,进而调控新生血管生成、重塑、再植,胎盘螺旋动脉重塑以及促绒毛细胞增殖,进而在子痫前期中发挥作用。进一步分析显示,sFlt-1/PlGF比值均为孕妇发生子痫前期的高危因素,提示临床可基于sFlt-1/PlGF比值评估子痫前期的发生风险。sFlt-1、PlGF表达异常可引起内皮功能障碍以及氧化应激,进而激活下游调亡信号通路介导胎盘滋养层细胞凋亡,造成胎盘滋养不足,这也是子痫前期发生和发展的主要病理学基础[13]。本研究中,不良妊娠结局组血清sFlt-1、sFlt-1/PlGF比值水平高于非不良妊娠结局组,PlGF水平低于非不良妊娠结局组,提示sFlt-1、PlGF水平与子痫前期妊娠结局密切相关。动物实验证实,PlGF可通过增强70kD核糖体蛋白激酶Ⅰ、细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)和蛋白激酶B(protein kinase B,AKT)磷酸化,进而改善或逆转因哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)磷酸化带来的滋养细胞侵袭力的减弱,PLGF水平降低可引起滋养细胞侵袭力减弱,进而导致胎儿生长受限[14]。另有研究显示,根据sFlt-1/PlGF比值将患者进行风险分层,结果显示高风险人群与更轻体重、更长住院时间相关[15]。
3.2血清D-D水子痫前期妊娠结局的关系
D-D是纤维蛋白溶解形成的一小部分蛋白质,是诊断非妊娠人群静脉血栓栓塞性疾病的重要标志物[9]。研究表明,D-D在妇女怀孕期间显著增加,且与胎龄呈正比,妊娠早期D-D值高于正常人的15%,妊娠中期为71%,妊娠晚期为96%[16]。本研究中子痫组血清D-D水平高于对照组,提示D-D与子痫前期密切相关。研究证实,炎症细胞因子和凝血途径的激活在子痫前期的发生和发展中发挥着重要作用[17-18]。在子痫前期中,内皮功能障碍导致组织纤溶酶原激活剂(tissue plasminogen activator,tPA)和纤溶酶原激活剂抑制剂(plasminogen activator inhibitor,PAI)1型PAI-1增加,PAI-2减少,进而导致血液高凝状态和纤维蛋白溶解。Logistic回归分析显示,D-D为影响孕妇发生子痫前期的高危因素,提示临床可基于D-D评估子痫前期的发生风险。不良妊娠结局组血清D-D水平高于非不良妊娠结局组,提示D-D水平与子痫前期妊娠结局密切相关。研究指出,在重度子痫前期中,较低浓度的PAI-2可上调纤溶系统,导致循环D-D水平升高,而微血栓的形成和D-D的过度沉积可影响到多个母体器官以及胎盘,进而引发胎盘功能障碍[19]。ROC曲线显示,sFlt-1/PlGF比值联合D-D预测妊娠结局的AUC高于单一指标,提示sFlt-1/PlGF比值联合D-D预测子痫前期妊娠结局的预测效能较高。
3.3影响孕妇发生子痫前期的高危因素
本研究中,BMI为影响孕妇发生子痫前期的高危因素,这与以往的研究结果一致[20]。这一结果的主要原因为:肥胖可导致胰岛素抵抗、糖脂代谢异常,进而引发滋养层细胞障碍和胎盘缺血。妊娠期糖尿病或肾病由于存在血管内皮功能损害,其可通过影响胎盘血液循环,进而增加子痫前期的发生风险[21]。既往子痫前期史是子痫前期的独立危险因素已经得到了充分的研究[22]。
综上所述,子痫前期患者血清sFlt-1/PlGF比值、D-D水平升高,二者可用于评估子痫前期妊娠结局。
[参考文献]
[1]Shi P,Zhao L,Yu S,et al.Differences in epidemiology of patients with preeclampsia between China and the US(review)[J].Exp Ther Med,2021,22(3):1012.
[2]Yang Y,Le Ray I,Zhu J,et al.Preeclampsia prevalence,risk factors,and pregnancy outcomes in Sweden and China[J].JAMA Netw Open,2021,4(5):e218401-e218401.
[3]Wainstock T,Sergienko R,Sheiner E.Who is at risk for preeclampsia?Risk factors for developing initial preeclampsia in a subsequent pregnancy[J].J Clin Med,2020,9(4):1103.
[4]于静,刘丹,王静远.子痫前期孕妇血清25-羟维生素D,凝血功能及生化指标等检测对其妊娠结局的预测价值[J].临床和实验医学杂志,2021,20(7):753-756.
[5]Chiril C N,Mrginean C,Chiril P M,et al.The current role of the sflt-1/plgf ratio and the uterine-umbilical-cerebral doppler ultrasound in predicting and monitoring hypertensive disorders of pregnancy:an update with a review of the literature[J].Children(Basel),2023,10(9):1430.
[6]Ohkuchi A,Saito S,Yamamoto T,et al.Short-term prediction of preeclampsia using the sFlt-1/PlGF ratio:a subanalysis of pregnant Japanese women from the PROGNOSIS Asia study[J].Hypertens Res,2021,44(7):813-821.
[7]Rodríguez-Pea Y,Ibáez-Pinilla M.Elevated levels of D-dimer tested by immunoturbidimetry are associated with the extent of severity of pre-eclampsia[J].Int J Gynaecol Obstet,2020,150(2):241-247.
[8]谢幸,孔北华,段涛.妇产科学(第9版)[M].北京:人民卫生出版社,2018:84.
[9]Shao H,Gao S,Dai D,et al.The association of antenatal D-dimer and fibrinogen with postpartum hemorrhage and intrauterine growth restriction in preeclampsia[J].BMC Pregnancy Childbirth,2021,21(1):605.
[10]Dathan-Stumpf A,Rieger A,Verlohren S,et al.sFlt-1/PlGF ratio for prediction of preeclampsia in clinical routine:a pragmatic real-world analysis of healthcare resource utilisation[J].Plos one,2022,17(2):e0263443.
[11]Stepan H,Hund M,Andraczek T.Combining biomarkers to predict pregnancy complications and redefine preeclampsia:the angiogenic-placental syndrome[J].Hypertension,2020,75(4):918-926.
[12]罗鸿,张晓菊,唐乾坤.血清ADMA水平、sFlt-1/PlGF比值与子痫前期患者胎盘血流动力学参数的相关性分析[J].中国妇幼健康研究,2022,33(9):70-74.
[13]Zuo Q,Zou Y,Huang S,et al.Aspirin reduces sFlt-1-mediated apoptosis of trophoblast cells in preeclampsia[J].Mol Hum Reprod,2021,27(1):gaaa089.
[14]李辞妹,杨颖,毕晶晶,等.mTOR和PLGF在胎儿宫内生长受限中的作用机制[J].基因组学与应用生物学,2020,39(1):326-331.
[15]Jeon H R,Jeong D H,Lee J Y,et al.sFlt-1/PlGF ratio as a predictive and prognostic marker for preeclampsia[J].J Obstet Gynaecol Res,2021,47(7):2318-2323.
[16]Baboolall U,Zha Y,Gong X,et al.Variations of plasma D-dimer level at various points of normal pregnancy and its trends in complicated pregnancies:a retrospective observational cohort study[J].Medicine(Baltimore),2019,98(23):e15903.
[17]林少玲,陈彤华.CTRP9和A-FABP与子痫前期患者脂代谢及炎症因子的关系[J].中国妇幼健康研究,2021,32(12):1757-1761.
[18]黄文英.血小板及凝血功能参数与子痫前期病情严重程度的关系[J].大医生,2023,8(20):130-133.
[19]段炼,何国琳.妊娠期D-二聚体升高带来的临床困惑[J].四川大学学报(医学版),2022,53(3):543-548.
[20]Ren Q W,Yang F F,Han T B,et al.Relationship between the pre-pregnancy BMI,gestational weight gain,and risk of preeclampsia and its subtypes[J].Zhonghua Liu Xing Bing Xue Za Zhi,2021,42(11):2037-2043.
[21]Pankiewicz K,Szczerba E,Fijakowska A,et al.The impact of coexisting gestational diabetes mellitus on the course of preeclampsia[J].J Clin Med,2022,11(21):6390.
[22]Usselman C W,Adler T E,Coovadia Y,et al.A recent history of preeclampsia is associated with elevated central pulse wave velocity and muscle sympathetic outflow[J].Am J Physiol Heart Circ Physiol,2020,318(3):H581-H589.

