锂氧电池有机电解液的研究进展




摘要:随着消费类电子产品和新能源汽车产业的迅速发展,传统的锂离子电池已经不能满足日益增长的能源需求。为了应对这一挑战,许多高比能电池被提出和研发。其中,锂氧电池以其超高的能量密度引起了广泛的关注,但其可逆性较差问题严重限制了锂氧电池的进一步发展。在锂氧电池中,电解液是一个重要的组成部分,其组分和配比对电池的放电容量、倍率性能和负极稳定性等方面具有至关重要的影响。本文以电解液的组分为线索,对锂氧电池有机电解液的发展历程以及最新研究成果进行了梳理和总结。同时,对于降低过电势和抑制电解液分解的展望,也为锂氧电池的未来发展指明了方向。
关键词:锂氧电池;有机电解液;溶剂;锂盐;添加剂
中图分类号:O646
1 引言
2020年9月,我国明确提出“双碳”目标,在2030年实现“碳达峰”,在2060年实现“碳中和”。众所周知,燃油车是碳排放的一大来源。因此,采用新能源汽车代替燃油车已成为实现“双碳”目标的重要手段。在这一背景下,近几年电动汽车发展迅猛,动力电池产业蓬勃发展。当前电动汽车使用的动力电池主要是锂离子电池,但其能量密度已接近理论极限。为了进一步提升电动汽车的续航里程,具有更高能量密度的电池体系亟待开发。锂金属电池1、锂硫电池2和锂氧电池3等体系相比于现有的锂离子电池具有更高的能量密度,因此受到了研究者们的广泛关注。其中,锂氧电池凭借其3500 Whꞏkg−1的超高理论能量密度4,被视为二次电池领域的圣杯,同时,其也是下一代储能装置的有力候选者。
典型的锂氧电池由正极、锂金属负极和有机电解液三部分组成(图1) 5。锂氧电池在充放电过程中,负极侧发生锂金属的沉积和溶解反应,正极侧则伴随着放电产物过氧化锂的分解和产生。这意味着,放电时,正极发生氧还原反应(ORR),氧气得电子后结合锂离子生成过氧化锂。充电时正极发生氧析出反应(OER),过氧化锂分解生成氧气和锂离子。随着对锂氧电池研究的不断深入,锂氧电池的放电产物也变得多元化,包括过氧化锂6、氢氧化锂7、超氧化锂8和氧化锂9。目前为止,关于锂氧电池的研究主要集中在以过氧化锂为放电产物的电池体系。因此,本文之后的介绍也将围绕以过氧化锂为放电产物的锂氧电池体系展开。
锂氧电池在拥有极高能量密度的同时也面临着诸多挑战10。首先,当前锂氧电池的可逆性较差,OER/ORR很少能超过90% 11。这主要是因为锂氧电池的放电产物过氧化锂为导电性较差的半导体,在充电过程中需要较大的过电势才可完全分解。这会使得一些高压稳定性较差的溶剂在高充电电压下分解,发生副反应,进而降低电池的可逆性。另外,充放电过程产生的超氧根、单线态氧等氧活性物质易攻击电解液发生化学反应,并会造成碳正极的腐蚀12。如何解决这些问题,提高锂氧电池的可逆性是锂氧电池研究中的重要课题。其次,受限于离子传导和氧气传质等问题,锂氧电池的正极载量通常较低,使得电池可提供的实际能量密度难以发挥锂氧电池的优势。再次,为锂氧电池提供氧气的存储装置会增加锂氧电池的使用成本并降低其整体的能量密度。所以,要想充分发挥锂氧电池的高能量密度优势,其需要在空气中运行以去掉不必要的氧气存储装置,但电池的性能会受到空气中其他组分的影响。比如,空气中的二氧化碳和水蒸气等会与过氧化锂反应,生成氢氧化锂和碳酸锂等更难分解的副产物,并且这些气体会扩散到负极,腐蚀锂金属。此外,与高纯氧气相比,空气中的氧气含量较低,对氧气的传质提出了更高的要求。其他空气组分在锂氧电池中的作用还需要进一步研究和探索,以便研究者们开发出有效的应对方案。最后,作为以锂金属为负极的电池,锂氧电池面临着严峻的负极腐蚀问题。目前,实验室中组装的锂氧电池所用的锂金属负极一般是严重过量的,这使得负极的问题并不突出,但这种做法并不能满足实际应用的需求。锂氧电池中复杂的组分和中间体使得其负极保护面临比一般的以锂金属为负极的电池更加严峻的挑战。氧气、超氧根等反应中间体均有机会扩散到负极,腐蚀锂金属。此外,电解液分解产生的水也会对负极造成持续的腐蚀。在开发负极保护策略时,我们既要关注锂金属负极的固有问题,也要考虑锂氧电池体系特有的氧气、中间体和水等对锂负极的腐蚀。
电解质作为锂氧电池的重要组成部分对锂氧电池的性能发挥有着至关重要的影响,其开发和研究也是解决上述问题的关键之一13。近年来,固态电解质在锂氧电池中展现出了巨大的潜力14,但相关研究数量较少,且有较多问题需要探究,在本文中不做介绍。本文将从锂氧电池性能提升对电解液的要求出发,按照电解液的组分梳理其发展历程及最新研究成果,并对锂氧电池电解液未来的发展提出了设想和展望。
2 锂氧电池有机电解液的要求
明确而客观的评价体系对于指导锂氧电池有机电解液的开发十分重要。本节将首先讨论评价锂氧电池性能的常用指标及其与电解液的关系,并以此为依据进一步分析锂氧电池电解液的要求。
对锂氧电池而言,可逆性、放电容量、循环圈数、过电势、倍率性能和安全性等都是评价其性能的重要指标。其中放电容量、循环圈数和过电势更是重点关注的对象。以实际应用为目标,锂氧电池需要较大的放电容量以实现高能量密度,需要长期稳定地循环以保证其使用寿命,需要较低的过电势以提高电池的能量效率。而这些目标的实现依赖于电池良好的可逆性和快速的反应动力学。
锂氧电池的放电容量一般由放电反应路径和正极容纳放电产物的能力决定,并受离子输运和氧气传质等多种因素的影响。放电反应路径一般分为溶液反应路径和表面反应路径。当电解液对放电产物或反应中间体具有较大的溶解度时,放电产物可以在远离电极表面的地方沉积,这种方式一般被称为溶液反应路径。该种反应路径一般会生成较大的放电产物,提高锂氧电池的放电容量。反之,由于过氧化锂的导电性较差,若放电产物和中间体在电解液中溶解度较低,则放电产物仅能紧密沉积在电极表面。这种反应机理被称为表面反应路径。该种反应路径的放电产物一般以薄膜的形式存在,遵循这一反应路径的锂氧电池一般放电容量较低。给体数(DN)较高的溶剂和与锂离子结合能力较强的阴离子可以提高电解液对超氧化锂等中间体的溶解度,有利于锂氧电池遵循溶液反应路径。放电氧化还原介体(RM)等添加剂的使用也可以调整锂氧电池放电反应的路径和机理,从而提升锂氧电池的放电容量。
锂氧电池的循环圈数是当前衡量锂氧电池性能的重要指标之一,对于这一指标的深入理解和客观分析十分重要。在锂氧电池研发初期,碳酸酯类电解液表现出了优于醚类和酰胺类电解液的循环性能。但后续研究发现,碳酸酯类电解液循环过程中正极侧发生的反应主要是电解液的分解,并非过氧化锂的沉积和溶解。因此,锂氧电池的循环性能需要谨慎地验证,特别要注意关注循环过程中实际的电化学反应是否是目标放电产物的沉积与分解。锂氧电池中任一组成部分的失效都可能会导致电池整体的失效,如电极表面被难以分解的放电产物或副产物覆盖、锂负极耗尽以及电解液的挥发和分解耗尽等。所以,锂氧电池电解液的挥发性,电解液对锂负极、放电产物以及中间体的稳定性和对正极反应的调控作用等均会对锂氧电池的循环性能产生重要影响。
锂氧电池的过电势直接决定着电池的能量效率。此外,高的充电过电势易导致电解液的电化学分解以及攻击性的单线态氧产生,对锂氧电池的可逆性以及循环性能造成十分严重的负面影响。锂氧电池的充电过电势通常可达到1 V以上。缓慢的过氧化锂分解动力学过程,副产物的生成等都是锂氧电池充电过电势高的原因。同循环性能类似,评价锂氧电池的过电势时也应关注电池的可逆性。当电解液中含有电化学稳定性较差的组分时,其在充电过程中的分解有时会导致电池表现出较低的过电势。因此,在评价锂氧电池及其电解液的性能时,对可逆性的关注是十分必要的。
为了充分发挥锂氧电池的电化学性能,其电解液需要满足以下要求。第一,电解液需要保证电池反应所需的电荷输运以及氧气传输。这要求锂盐在溶剂中有较大的解离度,且电解液粘度较低,有较高的氧气溶解度以及氧气扩散系数。第二,作为以锂金属为负极的电池体系,锂氧电池的电解液需要在负极表面形成稳定的保护层,防止其受到电池中其他组分、中间产物和副产物的侵蚀15。第三,锂氧电池是一个半开放体系,电解液应不易挥发16。电解液的挥发一方面会带来安全隐患,另一方面也会降低电池的使用寿命。第四,电解液需要具有良好的电化学稳定性以及对超氧根等氧活性物质的化学稳定性17。此外,电解液的合理设计也有助于增大锂氧电池的放电容量18并降低充放电的过电势19。
高的锂离子电导率和对锂金属的稳定性是以锂金属为负极的电池体系对电解液的共性要求,氧气溶解度等其他条件则对锂氧电池体系更具针对性。其中,如何得到稳定的电解液从而提高锂氧电池的可逆性和循环寿命是最受关注的研究课题之一20。McCloskey等21认为,锂氧电池电解液的电化学稳定性和化学稳定性之间存在矛盾关系,某种溶剂很难在耐高电压的同时对超氧根保持稳定。其原因在于,亲电子的溶剂在高的氧化电位下比较稳定,但是这样的溶剂易被超氧根亲核攻击。因此,似乎很难找到同时满足化学稳定性和电化学稳定性要求的溶剂。但是值得注意的是,不同于使用高压正极的锂金属电池,锂氧电池的平衡电位只有2.96 V (vs. Li+/Li)。其较高的充电电压主要是由过电势引起的,而如此高的过电势对于锂氧电池的实际应用而言是必须要避免的。如果能降低锂氧电池的充电过电势,对于锂氧电池电解液电化学窗口的要求便可有所缓和。同时,随着锂氧电池中单线态氧的发现22以及对锂氧电池反应机理的深入认识23,电解液化学稳定性问题的解决也出现了新的思路。单线态氧被认为是引发锂氧电池副反应的重要因素之一。虽然其在充放电阶段均会生成,但大部分单线态氧生成于电压高于3.5V (vs. Li+/Li)的充电阶段24。也就是说,锂氧电池中电解液的化学分解也与高的过电势有着密切的联系。综上所述,锂氧电池电解液的电化学稳定性和化学稳定性问题均与高过电势相关,而高的过电势又是锂氧电池实际应用道路上所必须要解决的难题。那么,解决电解液稳定性问题的思路就不局限在如何提高电解液的稳定性,而是可以从降低电池过电势的角度进行突破。
3 电解液的组成
锂氧电池的电解液主要包含溶剂、锂盐和添加剂三种组分,各个组分均发挥着关键的作用。组分的选择和配比会对电解液乃至电池的性能产生影响。本节将从溶剂、锂盐和添加剂三个方向总结锂氧电池电解液的发展历程及最新成果。
3.1 溶剂
溶剂的开发一直是锂氧电池电解液研究所重点关注的问题之一。溶剂的选择不仅会影响电解液的离子输运、氧气传质及负极稳定性,还会影响锂氧电池的反应路径,进而影响电池的放电容量。下面,本文将对锂氧电池中不同种类的溶剂进行介绍,阐述其优缺点,并介绍相应的改性策略。
碳酸酯类溶剂是锂氧电池研究之初常用的溶剂,其是从锂离子电池的电解液中借鉴而来的25。碳酸酯类溶剂一般具有较强的极性,可充分解离锂盐,表现出较高的离子电导率26。2006年,Ogasawara等27首次使用碳酸丙烯酯(PC)电解液实现了锂氧电池50圈的充放电循环,证明了锂氧电池的可充性。2010年,Mizuno等28发现使用碳酸酯类电解液的锂氧电池其主要放电产物不是过氧化锂,而是碳酸锂和有机锂盐。2011年,Freunberger等29提出碳酸酯类电解液潜在的分解机理,认为锂氧电池充放电过程的中间产物超氧根会进攻羰基形成过氧化物自由基,并使得溶剂分子最终分解为水、二氧化碳和碳酸锂等。随后,越来越多的研究通过不同的表征方法探测到了碳酸酯类电解液在锂氧电池中的分解产物30,进一步证明了其不稳定性。这之后,碳酸酯几乎不再作为锂氧电池电解液的溶剂出现。然而,2022年,Chen等31发现二氧化碳能够和超氧根形成中间体,从而抑制碳酸酯类电解液的分解(图2a)。这一发现也许会使碳酸酯电解液再次受到关注。
在意识到碳酸酯类溶剂在锂氧电池中的不稳定性后,研究者们对众多商业化溶剂进行了筛选21。其中,一些溶剂,比如四乙二醇二甲醚、N,N-二甲基乙酰胺等,凭借其较宽的电化学窗口,对超氧根等氧活性物质的稳定性等优势受到了广泛的关注。锂氧电池的可逆性和循环寿命也在这一过程中得到了显著的提升。二甲基亚砜(DMSO)是一种极性较强的溶剂分子,拥有较高的DN值,能够溶解一定量的超氧根离子,从而使锂氧电池拥有较大的放电容量和较低的过电势。2012年,Peng等32使用纳米多孔金正极,在LiClO4/DMSO电解液中实现了锂氧电池的可逆循环。在循环100圈后,电池容量保持率依然可达95% (图2b,c),且可检测到的放电产物中过氧化锂的含量大于99%。然而,有研究者在严格除去电解液中水的情况下, 在使用碳正极和DMSO基电解液的锂氧电池放电产物中发现氢氧化锂的存在33。此后,Mozhzhukhina等34在锂氧电池中探测到了多种DMSO电解液的分解产物。与碳酸酯类电解液类似,DMSO也容易受到超氧根的亲核攻击。这些证据表明DMSO作为锂氧电池电解液的溶剂难以在长循环中保持其稳定性。2019年,Feng等35设计了没有活性α-H的砜类溶剂分子,该分子砜基的两端分别连接三氟甲基和二甲基胺,表现出良好的化学稳定性。以其为电解液溶剂的锂氧电池在充电过程中产生的氧气远多于DMSO基电解液。但是,氟原子的存在一方面降低分子的介电常数,使得电池的放电容量有所下降;另一方面降低分子间的作用力,提高溶剂的挥发性36。为解决这一问题,Nishioka等36用乙基替换了上述分子中的三氟甲基,实现了锂氧电池在大容量下的多次循环。此外,DMSO电解液还存在对锂负极不稳定37、挥发性相对较高38、易吸湿等问题39。
醚类溶剂一般亲电子能力较弱,不易受到超氧根的亲核攻击,被认为是当前稳定性最高的一类溶剂5。早在2005年,Read等40就将1,3-二氧五环(DOL)和乙二醇二甲醚(DME)混合作为锂氧电池电解液的溶剂使用。2012年,Jung等41使用四乙二醇二甲醚(TEGDME)作为溶剂,三氟甲磺酸锂(LiOTf)作为锂盐,在1000 mAh∙g−1的放电容量下实现了100圈的稳定循环,且对放电产物的表征也没有发现明显的副产物生成。此后,TEGDME被作为一种经典的锂氧电池电解液溶剂而广泛使用。之后,研究者们也对醚类溶剂链长的影响进行了研究。链长较短的醚类溶剂具有更小的粘度,较高的氧气溶解度和扩散系数,可以实现较高的离子电导率和快速的氧气传质42。其中,短链醚DME对锂金属的稳定性也要高于长链的TEGDME。Sharon等43发现使用二乙二醇二甲醚(DEGDME)的锂氧电池具有比TEGDME基锂氧电池更优的循环性能。他们发现为失效的锂氧电池更换电解液能够使电池容量恢复,认为电解液的分解是限制该电池体系循环寿命提升的主要因素,进而说明了链长较短的醚类在锂氧电池中具有更高的稳定性。但是短链醚挥发性较强,以其为溶剂的锂氧电池容易因电解液干涸而失效,这一问题影响了短链醚类电解液在锂氧电池中的应用。关于醚类电解液的稳定性,有研究者发现醚类电解液的β-H原子容易和氧气以及过氧化锂等反应44,这一分解机理被称为自氧化。为了解决这一问题,Adams等45采用稳定的基团来代替醚类分子上易被攻击的活性氢原子,从而实现增强电解液化学稳定性的目的(图2d)。TEGDME电解液的一个显著缺点在于其DN值较低,使得锂氧电池的放电容量较小,电池过电势较大。使用RM 46或者将TEGDME与DN值较高的溶剂混用47可以缓解这一问题。
酰胺类电解液凭借其高氧化电位而受到了广泛地关注。此外,氮原子的给电子能力要强于氧原子,这使得酰胺类羰基中碳原子的亲电性弱于碳酸酯类溶剂,不易被超氧根亲核进攻,从而增强了酰胺类电解液对超氧根的稳定性48。2013年,Walker等49以N,N-二甲基乙酰胺(DMA)为溶剂,硝酸锂为锂盐,实现了锂氧电池在较大面容量(1 mAh∙cm−2)下的稳定循环。通过电化学微分质谱(DEMS)的气体释放曲线可以看出,DMA基电解液在循环80圈后的充电阶段仍以释放氧气为主,表现出良好的可逆性(图2e)。硝酸锂的引入有助于在负极表面形成稳定的固态电解质界面膜(SEI),缓解酰胺类电解液对锂负极不稳定的问题。2020年,Yu等50在DMA电解液中同时使用LiTFSI和硝酸锂,在负极表面构筑了均匀稳定的SEI,从而在中等浓度下实现了优于高浓度电解液的负极保护效果(图2f)。
离子液体具有较宽的电化学窗口,不易挥发和燃烧,且部分离子液体具有疏水的特性。从这一角度而言,离子液体可以称得上是锂氧电池的理想电解液体系。2005年,离子液体首次被用在一次锂氧电池中,由于其不易挥发以及疏水的特性,电池实现了长达56天的放电时长51。除了上述优势外,研究人员还发现离子液体能够显著降低锂氧电池的充电过电势。2014年,PYR14TFSI/LiTFSI电解液体系被用于锂氧电池中,实现了0.5–0.6 V的低充电过电势52。2015年,Xie等53发现在DME中加入离子液体能够降低锂氧电池的充电过电势,降幅随着离子液体占比的增大而增加,在完全使用离子液体时达到最大。他们认为离子液体能够稳定充电过程中产生的超氧根离子从而实现单电子的充电反应路径。但是离子液体也存在明显的不足。从对电池性能的影响而言,离子液体的不足在于粘度大、氧气溶解度低,这会影响电池的倍率性能。将离子液体与有机溶剂混合使用可以降低电解液粘度并可增加氧气的溶解度和扩散速率。2023年,Cai等54将离子液体与溶剂化能力较弱的苯甲醚混合作为锂氧电池的电解液溶剂。锂氧电池在较大的电流密度(1 A∙g−1)下实现了120圈的稳定循环。从商业应用角度而言,离子液体由于制作难度较大,价格昂贵,且制备过程会使用大量溶剂,污染环境55,不利于实际应用。深共晶电解液由于其组分间独特的相互作用,有着和离子液体类似的性质,被称作离子液体类似物。近年来,其在电池领域有着广泛的应用56。深共晶溶剂制备工艺简单,一般通过混合加热即可获得,且制备过程不需要其他溶剂,原子利用率可以达到百分之百。2022年,Li等57首次将深共晶电解液应用到锂氧电池中,其优异的热稳定性使得以其为电解液的锂氧电池可在60 °C下循环280圈。低过电势是锂氧电池实际应用的必要条件,也是解决电解液稳定性问题的思路之一,离子液体和深共晶电解液在锂氧电池中的应用值得进一步研究。
腈类溶剂和砜类溶剂也凭借其在高电位下的稳定性而受到关注58。但它们的一些不足使得对其的相关研究较少。腈类电解液会严重腐蚀锂负极,且分子量较小的腈类,如乙腈,具有很强的挥发性,不适用于半开放体系的锂氧电池。环丁砜等砜类溶剂一般具有较高的熔点,虽然与锂盐混合之后,体系的熔点有所下降,但依然对其使用有较大限制59。
对溶剂的探索是锂氧电池发展的一个极其重要的过程,并已取得了较多的研究进展。但到目前为止,尚没有一种溶剂能够很好地满足锂氧电池所需的全部条件。溶剂的探索与开发依然是锂氧电池研究的重要组成部分,新的溶剂体系也在不断地被开发,并取得了良好的效果。2022年,Sun等19将1,1,3,3-四甲基脲作为锂氧电池电解液的溶剂,在不使用催化剂的情况下实现了低至0.5 V的过电势(图2g),并实现了超越TEGDME的循环性能(图2h)。四甲基脲较高的DN值赋予其较强的锂离子溶剂化能力,提高了对超氧化锂的溶解度,使得充电的氧气释放过程可以通过歧化反应进行,降低了电池的充电过电势。此外,该分子不存在相对活泼的α-H,不容易被超氧根进攻,具有良好的化学稳定性。
综合来说,锂氧电池有机电解液溶剂的选择可对锂氧电池的放电容量、过电势、循环性能以及可逆性等产生重要的影响。开发对放电产物以及中间体稳定的溶剂体系是锂氧电池有机电解液设计必须要攻克的课题。在锂氧电池有机溶剂设计过程中,溶剂结构所发挥的作用应得到更多的关注,不同的官能团会对电池性能产生何种影响以及这种影响如何产生都值得进一步清晰明确。
3.2 锂盐
锂盐在溶剂中解离后释放出能够在电解液中自由移动的阴阳离子,赋予了电解液传导离子的能力。锂盐的选择十分重要,因为其阴离子与溶剂一样可显著影响锂氧电池的性能。
阴离子的电荷离域程度和尺寸决定了锂盐被溶剂解离的难易程度60。电荷比较分散、尺寸较大、空间位阻效应较强的阴离子易被解离,从而使电解液具有较高的离子电导率。硝酸锂等较难解离的盐一般需要搭配DN值较大的溶剂,而LiTFSI等容易解离的盐则适用于更多的溶剂体系。
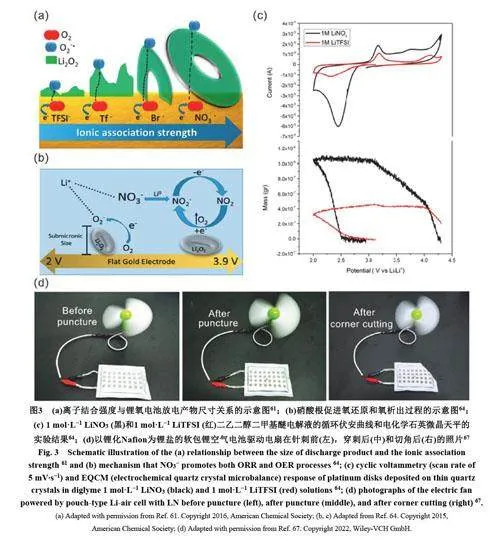
在锂氧电池中,阴离子的DN值同样会对电池的反应路径产生影响。2016年,Sharon等61测试了一系列锂盐对锂氧电池放电容量的影响,发现硝酸锂可大幅提升电池的放电容量,而使用LiTFSI的电池放电容量则较小(图3a)。值得注意的是,阴离子对放电容量的影响和溶剂对放电容量的影响是不能相互叠加的。高DN值的阴离子可以提高低DN值溶剂体系的放电容量,但对高DN值的溶剂体系却没有明显的影响62。这从侧面佐证了阴离子和溶剂影响反应路径的方式是相似的。此外,一些阴离子会在锂氧电池的充放电过程中对放电产物的生成和分解起到催化作用,如硝酸根离子。
不同于溶剂分子的多样性,锂盐的选择较为有限。早期研究中,锂盐的选择主要借鉴锂离子电池体系, 包括LiPF6 、LiBF4 和二草酸硼酸锂(LiBOB)。LiPF6和LiBF4会发生水解反应,生成氢氟酸26,而锂氧电池中溶剂分解产生的痕量水足以促成这一反应的发生。因此,这两种锂盐目前很少在锂氧电池中使用。卤化锂中的氟化锂和氯化锂在有机溶剂中的溶解度较低,很少在锂氧电池中作为锂盐使用。溴化锂和碘化锂在锂氧电池工作的电压范围内会发生氧化还原反应,常被作为RM使用,很少单独作为电解液的锂盐。LiBOB和LiClO4会与放电产物过氧化锂发生反应,目前也较少单独在锂氧电池中使用63。锂氧电池中常用的锂盐包括LiTFSI、LiOTF和硝酸锂。前两种锂盐的阴离子DN值较低,在有机溶剂中有较高的溶解度,还可在锂负极表面分解生成LiF以增加SEI膜的强度15。对于硝酸锂而言,其能够在负极表面生成稳定的SEI,保护金属锂负极49,还能促进OER过程64 (图3b,c),并在碳正极表面生成保护膜65。
除了上述常见的锂盐,研究者们还开发出一些新型锂盐。2018年,Tong等66将Li[(CF3SO2)(n-C4F9SO2)N]引入锂氧电池,其在抑制电池副反应的同时还实现了对锂负极的保护。2022年,Xiong等67将锂化Nafion (LN)作为可溶性锂盐加入到了DMSO中,用作锂氧电池的电解液。使用LN的电解液表现出高的离子电导率(2.5 mS∙cm−1)和锂离子迁移数(0.84)。此外,LN的引入可在负极表面形成富含LiF的SEI膜并赋予了电解液一定的阻燃效果,提升了锂氧电池的循环寿命和安全性(图3d)。
相比于溶剂,锂盐的选择虽然范围相对有限,但其对电解液的性质有着重要的影响。因此,新型锂盐的开发以及电解液中锂盐的选择和配比依然值得进一步探究。
3.3 添加剂
为了调控锂氧电池的性能,研究者们通常还会在电解液中引入具有不同功能的添加剂。添加剂的使用能够实现的效果包括增大放电容量、降低充放电过电势、提高电解液的稳定性、保护锂负极等。本文重点介绍锂氧电池中极为重要又比较特殊的两种添加剂:RM和单线态氧淬灭剂。
RM是锂氧电池中常用的添加剂,在提高锂氧电池放电容量和降低锂氧电池过电势方面表现出巨大的潜力68。在锂氧电池中,RM也被称为可溶性催化剂,其可被溶解在电解液中,基本作用是将电荷从正极表面带到反应所需的地方。锂氧电池的放电产物过氧化锂具有较低的电导率,这使得充电过程中离电极表面较远的放电产物不易被分解,导致较大的充电过电势。充电时,RM可以在电极表面被氧化,然后扩散到放电产物处,氧化放电产物使其释放锂离子和氧气,与此同时,RM也被还原成初始态。这一过程解决了远离电极表面放电产物难以分解的问题,可显著降低电池的充电过电势。研究者们在设计用于充电阶段RM的同时,也设计了放电阶段发挥作用的RM。放电RM可以实现放电产物遵循溶液路径生长,使锂氧电池的放电反应发生在离电极表面较远的地方,进而增大电池的放电容量。此外,一些RM可以同时结合锂离子和氧气,直接生成过氧化锂,从而避免超氧根的生成,减少了副反应的发生。
2013年,Chen等18将四硫富瓦烯(TTF)作为充电RM使用,实现了在较低充电电压(~3.5 V vs.Li+/Li)下100圈的稳定循环,这是RM在锂氧电池中的首次使用。2014年,Bergner等69将2,2,6,6-四甲基哌啶氧化物(TEMPO)加入电解液,有效促进了放电产物的分解,降低了充电过程的过电势。图4a为TEMPO在充电过程促进过氧化锂分解的机理示意图。从图4b,c中可以看出,TEMPO的引入有效降低了锂氧电池的充电过电势,且充电过程中释放的气体主要为氧气,表明发生的反应为过氧化锂的分解反应。此后,TEMPO也被作为一种经典的充电RM被广泛使用。2016年,Gao等46将2,5-二叔丁基-1,4-苯醌(DBBQ)作为放电RM使用。在使用DN值较低的溶剂TEGDME时,DBBQ的加入可使电池发生溶液路径的放电反应,大幅提高了锂氧电池的放电容量。此外,放电过程中,得到电子的DBBQ会和锂离子以及氧气结合,避免超氧化锂的产生,减少了其对电解液的进攻。2017年,Gao等70在锂氧电池中同时使用TEMPO和DBBQ,电池以较低的过电势(lt; 1 V vs. Li+/Li)在大放电容量(2mAhꞏcm−2)下实现了50圈的稳定循环。此后,多种RM被提出并应用于锂氧电池中。RM的设计与使用也成为了锂氧电池研究中的重要课题之一71。
LiI和LiBr是锂氧电池中十分重要且被广泛研究的一类RM,由于其无机物的特性,其对锂氧电池中的氧活性物质比较稳定71。2014年,Lim等72首次使用LiI作为RM,结合纳米管阵列正极,在较低的过电势(~0.25 V vs. Li+/Li)下实现了900圈的稳定循环(图4d)。这样的循环稳定性即使在今天也依然十分出色。I−在充电过程中会被氧化成I3−和I2,I3−和I2会与过氧化锂反应生成Li+和氧气并被还原成I−。将过氧化锂加入溶解有I2的TEGDME中,可以检测到氧气的释放。值得注意的是,得到这一数据的电池的正极活性物质载量较小,且整篇文章没有提供电池全放电(放电至截止电压2.0 V vs. Li+/Li)容量的数据。2015年,Liu等7发现在少量水存在的情况下,以LiI为RM的锂氧电池能够生成以氢氧化锂为主的放电产物,且充电过程中氢氧化锂可以分解。同年,Kwak等73发现在没有水存在的情况下,一定浓度LiI的存在也会导致放电过程中氢氧化锂的生成。他们认为LiI能够与溶剂的分解产物LiOOH反应,从而对电解液的分解起促进作用,这一过程会产生氢氧化锂。这一发现使得LiI与副反应的关系受到关注。2016年,Burke等74发现氢氧化锂的生成与分解和电解液中水的含量密切相关。在放电阶段,生成的过氧化锂会和水反应生成氢氧化锂,当水耗尽后,过氧化锂开始累积。在充电阶段,I−首先被氧化成I3−分解过氧化锂,之后,I−会被进一步氧化成I2,分解氢氧化锂并生成水。值得注意的是,这一过程中LiOH虽然可以分解,但不会释放氧气,并非放电反应的逆过程。此后,Tułodziecki等75和Liu等76分别认为LiI对水解离氢离子能力的增强以及导致C―H键的伸长是LiI引发副反应的主要原因。2023年,Wang等77结合实验和计算结果,通过比较LiI和LiBr,认为氢氧化锂的产生是IO3−对溶剂分子的亲核进攻所导致的,并非由于电解液酸性的改变所引起的。LiI在锂氧电池中是一种极具争议的RM。相比于LiI而言,LiBr具有更高的氧化电位,并且在使用过程中不会诱导放电产物向LiOH的转变,具有更好的稳定性。
总结来说,RM的设计一般需要基于如下三方面的考虑78。首先,RM需要具有合适的氧化还原电位。以充电RM为例,其氧化还原电位需要高于锂氧电池的平衡电位2.96 V (vs. Li+/Li),这样其才有能力在失去电子后氧化过氧化锂。这一条件是RM发挥作用所必须满足的。在此基础上,相对较低的氧化还原电位有利于获得较低的充电过电势。其次,RM应该对电池中的各组分稳定,特别是其自身要对超氧根和单线态氧等充放电中间体和产物稳定。这一要求相对较难满足,也是RM在锂氧电池应用中所面临的主要难题。另外,一些RM还会和溶剂发生反应,这一问题可以通过调控RM的最高占据分子轨道(HOMO)和最低未占据分子轨道(LUMO)能级来进行避免。Kwak等79发现RM会受到单线态氧的进攻,并在电解液中添加了单线态氧淬灭剂来增强RM的稳定性。此外,RM会穿梭到负极与锂金属反应,引起电池的自放电。第三,RM的设计需要考虑RM与过氧化锂的反应动力学。RM的氧化还原电位以及稳定性目前可以通过计算RM的HOMO、LUMO、SOMO以及电荷分布来设计和优化,但RM与过氧化锂的反应动力学目前还在探究阶段,缺少明确的反应模型。2018年,Chen等80探索了RM氧化过氧化锂的表观速率常数与RM均相电子传输速率常数、RM平衡电位之间的关系,发现RM氧化过氧化锂的速率与RM在电极处得失电子的速率以及其平衡电位都没有明显的相关关系。此外,他们还发现RM氧化过氧化锂的表观速率常数比RM在电极上得失电子的速率常数低一个数量级,认为RM作用过程的决速步骤是RM与过氧化锂间的反应,而非RM在电极处被氧化的过程。2021年,Petit等23进一步探究了RM氧化过氧化锂的反应机理。他们认为RM会首先与过氧化锂发生单电子反应,生成超氧化锂。之后,部分超氧化锂会再次与RM发生单电子反应生成氧气,另一部分超氧化锂则会通过歧化反应生成氧气。两者的比例取决于RM与超氧化锂的反应相较于超氧化锂歧化反应速率的快慢,且大部分RM的反应速率是慢于歧化反应的。2022年,Cao等81发现RM与过氧化锂的快速反应存在阈值电位,当充电电压高于3.56 V和3.74 V两个阈值电位时,反应速率会提升数倍。通过理论计算,他们发现阈值电位的存在是因为过氧化锂不同的晶面释放锂离子和电子所需的过电势不同。2023年,Ahn等82则认为不存在RM与超氧化锂反应的单电子过程。综合而言,RM的氧化还原电位和稳定性相对容易设计,但设计能使锂氧电池在较低的过电势下实现良好倍率性能的RM还需要对RM与过氧化锂反应的机制以及影响因素进行更加深入的研究。
锂氧电池中另一种重要的添加剂是单线态氧淬灭剂。氧气的基态是三线态。单线态氧是一种处于激发态的氧气,具有比三线态氧更高的能量和化学活性83。在相当长的一段时间里,反应中间体超氧根被认为是锂氧电池中副反应的根源,这一物质也是研究者们在设计稳定电解液时所主要针对的5。锂氧电池中单线态氧的发现及相关研究的展开让锂氧电池电解液的设计有了新的思考方向。
早在2011年,就有研究者认为单线态氧可能是锂氧电池的充电产物之一,但没有实验上的证据能支持该观点84。2016年,Wandt等22通过捕获剂2,2,6,6-四甲基哌啶酮(4-Oxo-TEMP)首次在锂氧电池中探测到了单线态氧的存在(图5a),他们发现充电电压高于3.5 V时即有单线态氧产生。2017年,Mahne等24发现单线态氧是造成电解液分解的主要因素,且单线态氧在电池放电和充电的全过程中均会产生,特别是在高电压充电阶段产生最多。他们发现在电解液中添加单线态氧淬灭剂1,4-二氮杂二环[2.2.2]辛烷(DABCO)可以显著抑制电解液的分解。此外,他们还发现水的存在也会促进单线态氧的产生。至此,单线态氧在锂氧电池中的存在以及其可促进电解液的分解已经基本确定,但是单线态氧产生的机理还尚不明确。2018年,Mahne等85发现碳酸锂的电化学分解会释放单线态氧,这在一定程度上解释了充电电压高时单线态氧产生较多的现象。2019年,Mourad等86发现超氧根的歧化反应会导致单线态氧产生,路易斯酸性越强的阳离子越容易促进歧化反应的发生,这也是锂氧电池中单线态氧问题较钠氧和钾氧电池更严重的原因。2022年,Dong等87通过同位素标记法进一步证明了放电过程中的歧化反应也会发生氧氧键的断裂并产生单线态氧,氧氧键断裂产生的单线态氧可占整个歧化反应产生单线态氧的40%。
因此,开发有效的单线态氧抑制剂对提高电池稳定性是十分重要的。单线态氧捕获剂和淬灭剂均可与单线态氧相结合,但前者的结合是不可逆的,后者则可以将单线态氧转化成三线态氧释放并再次结合新的单线态氧。因此单线态氧捕获剂一般被用于锂氧电池中单线态氧的检测,而单线态氧淬灭剂则被用作增强电解液稳定性的添加剂。为了抑制单线态氧对电池组分的破坏,研究者们开发了一系列单线态氧淬灭剂来消除电解液中的单线态氧。Mahne等24提出的DABCO是锂氧电池中最早应用的单线态氧淬灭剂,但其电化学窗口只能稳定到3.6 V (vs. Li+/Li),难以满足锂氧电池的实际需要。为了解决这一问题,Petit等88对DABCO的结构进行了设计,将其电化学稳定窗口拓展到了4.2 V (vs. Li+/Li),提高了其电化学稳定性(图5b)。Kwak等79则提出了对这一问题的另一种解决思路,让RM和单线态氧淬灭剂DABCO协同作用。充电时,RM可以有效降低充电电压,但其容易受到单线态氧的攻击而失活78。DABCO能够减少电解液中的单线态氧,但却在高电压下不稳定。Kwak等79将RM和DABCO同时添加到电解液中,在降低充电电压的同时还减少了单线态氧的产生,使得RM和DABCO均可以稳定工作(图5c)。2020年,Liang等89发现,TEMPO作为一种常用的RM可减少单线态氧的产生,增加三线态氧的生成,从而减少了锂氧电池中的副反应发生。他们认为RM可以将单线态的中间体转化成三线态的中间体,进而减少单线态氧的产生。这一现象在LiI等RM上也能观察到,并且RM抑制单线态氧产生的能力甚至强于当前已知的单线态氧淬灭剂。2022年,Jiang等90将三苯胺作为单线态氧淬灭剂应用于锂氧电池中,因三苯胺具有优异的稳定性和单线态氧淬灭效率,其可使锂氧电池实现超过300圈的循环寿命(图5d)。
对添加剂的理解及其合理地使用对于锂氧电池性能的提升有着至关重要的意义。虽然RM和单线态氧淬灭剂在锂氧电池中已有应用,但其作用机理和设计原则仍需进一步明确。此外,电解液并不是各组分的简单加和,组分间的相互作用对各组分能否充分发挥其功能乃至电解液整体的性能都有着重要的影响。
4 展望
为满足人们对电动汽车高续航里程的需求,具有超高能量密度的锂氧电池受到了广泛的关注。近年来,通过溶剂与锂盐的筛选、添加剂的使用、电解液组分的调控等策略,锂氧电池电解液的性能得到了显著的提升。此外,单线态氧的发现与探索也增进了对于电解液不稳定原因的理解。然而,当前锂氧电池的电解液依然存在稳定性较差,电荷传导和物质输运能力不足,难以与负极形成稳定的界面等问题。
电解液较差的化学稳定性和电化学稳定性是限制锂氧电池性能发挥和实际应用的重要原因,也是研究者们非常关注的问题。虽然溶剂对于超氧根的稳定性和对于高氧化电位的稳定性难以兼顾,但是我们可以通过选择合适的溶剂和锂盐、开发高效的RM或正极催化剂等手段来降低电池的过电势,同时减少单线态氧的产生,从而减少电解液分解反应的发生,开发出满足锂氧电池需求的电解液。
溶剂化结构是当前电解液设计的一个重要方向,衍生出了高浓度电解液91、局域高浓度电解液等一系列新型电解液体系和弱溶剂、软溶剂等一系列溶剂选择标准。这些策略和思路在锂氧电池电解液的开发上已有应用92。阐明电解液组分的基本参数、电解液组分间的相互作用、溶剂和离子在电极界面上的分布与电池性能的相关关系对于锂氧电池电解液的开发和性能的提升具有重要的意义。
锂氧电池的电解液有着巨大的研发空间,也有许多关键科学需要探索和解决。未来,随着对电解液理解地加深,势必会开发出更适合于锂氧电池的电解液体系,最终推动锂氧电池的产业化发展。
References
(1) Wu, F.; Maier, J.; Yu, Y. Chem. Soc. Rev. 2020, 49, 1569.
doi: 10.1039/c7cs00863e
(2) Manthiram, A.; Fu, Y.; Chung, S. H.; Zu, C.; Su, Y. S. Chem. Rev.
2014, 114, 11751. doi: 10.1021/cr500062v
(3) Lu, J.; Li, L.; Park, J. B.; Sun, Y. K.; Wu, F.; Amine, K. Chem. Rev.
2014, 114, 5611. doi: 10.1021/cr400573b
(4) Chen, K.; Yang, D. Y.; Huang, G.; Zhang, X. B. Acc. Chem. Res.
2021, 54, 632. doi: 10.1021/acs.accounts.0c00772
(5) Kwak, W. J.; Rosy; Sharon, D.; Xia, C.; Kim, H.; Johnson, L. R.;
Bruce, P. G.; Nazar, L. F.; Sun, Y. K.; Frimer, A. A.; et al. Chem. Rev.
2020, 120, 6626. doi: 10.1021/acs.chemrev.9b00609
(6) Freunberger, S. A.; Chen, Y.; Drewett, N. E.; Hardwick, L. J.; Barde,
F.; Bruce, P. G. Angew. Chem. Int. Ed. 2011, 50, 8609.
doi: 10.1002/anie.201102357
(7) Liu, T.; Leskes, M.; Yu, W.; Moore, A. J.; Zhou, L.; Bayley, P. M.;
Kim, G.; Grey, C. P. Science 2015, 350, 530.
doi: 10.1126/science.aac7730
(8) Lu, J.; Lee, Y. J.; Luo, X.; Lau, K. C.; Asadi, M.; Wang, H. H.;
Brombosz, S.; Wen, J.; Zhai, D.; Chen, Z.; et al. Nature 2016, 529,
377. doi: 10.1038/nature16484
(9) Xia, C.; Kwok, C. Y.; Nazar, L. F. Science 2018, 361, 777.
doi: 10.1126/science.aas9343
(10) Chen, Y.; Xu, J.; He, P.; Qiao, Y.; Guo, S.; Yang, H.; Zhou, H. Sci.
Bull. 2022, 67, 2449. doi: 10.1016/j.scib.2022.11.027
(11) Luntz, A. C.; McCloskey, B. D. Nat. Energy 2017, 2, 17056.
doi: 10.1038/nenergy.2017.56
(12) Zhang, P.; Ding, M.; Li, X.; Li, C.; Li, Z.; Yin, L. Adv. Energy Mater.
2020, 10, 2001789. doi: 10.1002/aenm.202001789
(13) Li, Y.; Wang, X.; Dong, S.; Chen, X.; Cui, G. Adv. Energy Mater.
2016, 6, 1600751. doi: 10.1002/aenm.201600751
(14) Chi, X.; Li, M.; Di, J.; Bai, P.; Song, L.; Wang, X.; Li, F.; Liang, S.;
Xu, J.; Yu, J. Nature 2021, 592, 551.
doi: 10.1038/s41586-021-03410-9
(15) Wu, X.; Li, Z.; Song, C.; Chen, L.; Dai, P.; Zhang, P.; Qiao, Y.;
Huang, L.; Sun, S.-G. ACS Mater. Lett. 2022, 4, 682.
doi: 10.1021/acsmaterialslett.1c00756
(16) Liang, Z. J.; Wang, W. W.; Lu, Y.-C. Joule 2022, 6, 2458.
doi: 10.1016/j.joule.2022.10.008
(17) Yao, X.; Dong, Q.; Cheng, Q.; Wang, D. Angew. Chem. Int. Ed. 2016,
55, 11344. doi: 10.1002/anie.201601783
(18) Chen, Y.; Freunberger, S. A.; Peng, Z.; Fontaine, O.; Bruce, P. G. Nat.
Chem. 2013, 5, 489. doi: 10.1038/nchem.1646
(19) Sun, Z.; Lin, X.; Wang, C.; Hu, A.; Hou, Q.; Tan, Y.; Dou, W.; Yuan,
R.; Zheng, M.; Dong, Q. Angew. Chem. Int. Ed. 2022, 61,
e202207570. doi: 10.1002/anie.202207570
(20) Guo, H.; Luo, W.; Chen, J.; Chou, S.; Liu, H.; Wang, J. Adv. Sustain.
Syst. 2018, 2, 1700183 doi: 10.1002/adsu.201700183
(21) McCloskey, B. D.; Bethune, D. S.; Shelby, R. M.; Mori, T.; Scheffler,
R.; Speidel, A.; Sherwood, M.; Luntz, A. C. J. Phys. Chem. Lett.
2012, 3, 3043. doi: 10.1021/jz301359t
(22) Wandt, J.; Jakes, P.; Granwehr, J.; Gasteiger, H. A.; Eichel, R. A.
Angew. Chem. Int. Ed. 2016, 55, 6892. doi: 10.1002/anie.201602142
(23) Petit, Y. K.; Mourad, E.; Prehal, C.; Leypold, C.; Windischbacher, A.;
Mijailovic, D.; Slugovc, C.; Borisov, S. M.; Zojer, E.; Brutti, S.; et al.
Nat. Chem. 2021, 13, 465. doi: 10.1038/s41557-021-00643-z
(24) Mahne, N.; Schafzahl, B.; Leypold, C.; Leypold, M.; Grumm, S.;
Leitgeb, A.; Strohmeier, G. A.; Wilkening, M.; Fontaine, O.; Kramer,
D.; et al. Nat. Energy 2017, 2, 17036. doi: 10.1038/nenergy.2017.36
(25) McCloskey, B. D.; Bethune, D. S.; Shelby, R. M.; Girishkumar, G.;
Luntz, A. C. J. Phys. Chem. Lett. 2011, 2, 1161.
doi: 10.1021/jz200352v
(26) Xu, K. Chem. Rev. 2004, 104, 4303. doi: 10.1021/cr030203g
(27) Ogasawara, T.; Debart, A.; Holzapfel, M.; Novak, P.; Bruce, P. G.
J. Am. Chem. Soc. 2006, 128, 1390. doi: 10.1021/ja056811q
(28) Mizuno, F.; Nakanishi, S.; Kotani, Y.; Yokoishi, S.; Iba, H.
Electrochemistry 2010, 78, 403. doi: 10.5796/electrochemistry.78.403
(29) Freunberger, S. A.; Chen, Y.; Peng, Z.; Griffin, J. M.; Hardwick, L. J.;
Barde, F.; Novak, P.; Bruce, P. G. J. Am. Chem. Soc. 2011, 133, 8040.
doi: 10.1021/ja2021747
(30) Veith, G. M.; Dudney, N. J.; Howe, J.; Nanda, J. J. Phys. Chem. C
2011, 115, 14325. doi: 10.1021/jp2043015
(31) Chen, K.; Du, J. Y.; Wang, J.; Yang, D. Y.; Chu, J. W.; Chen, H.;
Zhang, H. R.; Huang, G.; Zhang, X. B. Chin. J. Chem. 2022, 41, 314.
doi: 10.1002/cjoc.202200498
(32) Peng, Z.; Freunberger, S. A.; Chen, Y.; Bruce, P. G. Science 2012,
337, 563. doi: 10.1126/science.1223985
(33) Xu, D.; Wang, Z. L.; Xu, J. J.; Zhang, L. L.; Zhang, X. B. Chem.
Commun. 2012, 48, 6948. doi: 10.1039/c2cc32844e
(34) Mozhzhukhina, N.; Méndez De Leo, L. P.; Calvo, E. J. J. Phys.
Chem. C 2013, 117, 18375. doi: 10.1021/jp407221c
(35) Feng, S.; Huang, M.; Lamb, J. R.; Zhang, W.; Tatara, R.; Zhang, Y.;
Zhu, Y. G.; Perkinson, C. F.; Johnson, J. A.; Shao-Horn, Y. Chem
2019, 5, 2630. doi: 10.1016/j.chempr.2019.07.003
(36) Nishioka, K.; Saito, M.; Ono, M.; Matsuda, S.; Nakanishi, S. ACS
Appl. Energy Mater. 2022, 5, 4404. doi: 10.1021/acsaem.1c03999
(37) Lee, H.; Lee, D. J.; Lee, J.-N.; Song, J.; Lee, Y.; Ryou, M.-H.; Park,
J.-K.; Lee, Y. M. Electrochim. Acta 2014, 123, 419.
doi: 10.1016/j.electacta.2014.01.042
(38) Lai, J.; Xing, Y.; Chen, N.; Li, L.; Wu, F.; Chen, R. Angew. Chem. Int.
Ed. 2020, 59, 2974. doi: 10.1002/anie.201903459
(39) Wu, Z.; Tian, Y.; Chen, H.; Wang, L.; Qian, S.; Wu, T.; Zhang, S.; Lu,
J. Chem. Soc. Rev. 2022, 51, 8045. doi: 10.1039/d2cs00003b
(40) Read, J. J. Electrochem. Soc. 2006, 153, A96.
doi: 10.1149/1.2131827
(41) Jung, H. G.; Hassoun, J.; Park, J. B.; Sun, Y. K.; Scrosati, B. Nat.
Chem. 2012, 4, 579. doi: 10.1038/nchem.1376
(42) Qiao, L.; Judez, X.; Rojo, T.; Armand, M.; Zhang, H. J. Electrochem.
Soc. 2020, 167, 070534. doi: 10.1149/1945-7111/ab7aa0
(43) Sharon, D.; Hirshberg, D.; Afri, M.; Frimer, A. A.; Aurbach, D.
Chem. Commun. 2017, 53, 3269. doi: 10.1039/c6cc09086a
(44) Bryantsev, V. S.; Faglioni, F. J. Phys. Chem. A 2012, 116, 7128.
doi: 10.1021/jp301537w
(45) Adams, B. D.; Black, R.; Williams, Z.; Fernandes, R.; Cuisinier, M.;
Berg, E. J.; Novak, P.; Murphy, G. K.; Nazar, L. F. Adv. Energy
Mater. 2015, 5, 1400867. doi: 10.1002/aenm.201400867
(46) Gao, X.; Chen, Y.; Johnson, L.; Bruce, P. G. Nat. Mater. 2016, 15,
882. doi: 10.1038/nmat4629
(47) Lai, J.; Liu, H.; Xing, Y.; Zhao, L.; Shang, Y.; Huang, Y.; Chen, N.;
Li, L.; Wu, F.; Chen, R. Adv. Funct. Mater. 2021, 31, 2101831.
doi: 10.1002/adfm.202101831
(48) Bryantsev, V. S.; Giordani, V.; Walker, W.; Blanco, M.; Zecevic, S.;
Sasaki, K.; Uddin, J.; Addison, D.; Chase, G. V. J. Phys. Chem. A
2011, 115, 12399. doi: 10.1021/jp2073914
(49) Walker, W.; Giordani, V.; Uddin, J.; Bryantsev, V. S.; Chase, G. V.;
Addison, D. J. Am. Chem. Soc. 2013, 135, 2076.
doi: 10.1021/ja311518s
(50) Yu, Y.; Huang, G.; Du, J.-Y.; Wang, J.-Z.; Wang, Y.; Wu, Z.-J.; Zhang,
X.-B. Energy Environ. Sci. 2020, 13, 3075. doi: 10.1039/d0ee01897j
(51) Kuboki, T.; Okuyama, T.; Ohsaki, T.; Takami, N. J. Power Sources
2005, 146, 766. doi: 10.1016/j.jpowsour.2005.03.082
(52) Elia, G. A.; Hassoun, J.; Kwak, W. J.; Sun, Y. K.; Scrosati, B.;
Mueller, F.; Bresser, D.; Passerini, S.; Oberhumer, P.; Tsiouvaras, N.;
et al. Nano Lett. 2014, 14, 6572. doi: 10.1021/nl5031985
(53) Xie, J.; Dong, Q.; Madden, I.; Yao, X.; Cheng, Q.; Dornath, P.; Fan,
W.; Wang, D. Nano Lett. 2015, 15, 8371.
doi: 10.1021/acs.nanolett.5b04097
(54) Cai, Y.; Hou, Y.; Lu, Y.; Zhang, Q.; Yan, Z.; Chen, J. Angew. Chem.
Int. Ed. 2023, e202218014. doi: 10.1002/anie.202218014
(55) Hansen, B. B.; Spittle, S.; Chen, B.; Poe, D.; Zhang, Y.; Klein, J. M.;
Horton, A.; Adhikari, L.; Zelovich, T.; Doherty, B. W.; et al. Chem.
Rev. 2021, 121, 1232. doi: 10.1021/acs.chemrev.0c00385
(56) Geng, L.; Wang, X.; Han, K.; Hu, P.; Zhou, L.; Zhao, Y.; Luo, W.;
Mai, L. ACS Energy Lett. 2021, 7, 247.
doi: 10.1021/acsenergylett.1c02088
(57) Li, C. L.; Huang, G.; Yu, Y.; Xiong, Q.; Yan, J. M.; Zhang, X. B.
J. Am. Chem. Soc. 2022, 144, 5827. doi: 10.1021/jacs.1c11711
(58) Laoire, C. O.; Mukerjee, S.; Abraham, K. M.; Plichta, E. J.;
Hendrickson, M. A. J. Phys. Chem. C 2010, 114, 9178.
doi: 10.1021/jp102019y
(59) Xu, D.; Wang, Z. L.; Xu, J. J.; Zhang, L. L.; Wang, L. M.; Zhang, X.
B. Chem. Commun. 2012, 48, 11674. doi: 10.1039/c2cc36815c
(60) Boisset, A.; Menne, S.; Jacquemin, J.; Balducci, A.; Anouti, M. Phys.
Chem. Chem. Phys. 2013, 15, 20054. doi: 10.1039/c3cp53406e
(61) Sharon, D.; Hirsberg, D.; Salama, M.; Afri, M.; Frimer, A. A.; Noked,
M.; Kwak, W.; Sun, Y. K.; Aurbach, D. ACS Appl. Mater. Interfaces
2016, 8, 5300. doi: 10.1021/acsami.5b11483
(62) Burke, C. M.; Pande, V.; Khetan, A.; Viswanathan, V.; McCloskey, B.
D. Proc. Natl. Acad. Sci. U. S. A. 2015, 112, 9293.
doi: 10.1073/pnas.1505728112
(63) Oswald, S.; Mikhailova, D.; Scheiba, F.; Reichel, P.; Fiedler, A.;
Ehrenberg, H. Anal. Bioanal. Chem. 2011, 400, 691.
doi: 10.1007/s00216-010-4646-z
(64) Sharon, D.; Hirsberg, D.; Afri, M.; Chesneau, F.; Lavi, R.; Frimer, A.
A.; Sun, Y. K.; Aurbach, D. ACS Appl. Mater. Interfaces 2015, 7,
16590. doi: 10.1021/acsami.5b04145
(65) Rosy; Akabayov, S.; Leskes, M.; Noked, M. ACS Appl. Mater.
Interfaces 2018, 10, 29622. doi: 10.1021/acsami.8b10054
(66) Tong, B.; Huang, J.; Zhou, Z.; Peng, Z. Adv. Mater. 2018, 30,
1704841. doi: 10.1002/adma.201704841
(67) Xiong, Q.; Huang, G.; Yu, Y.; Li, C. L.; Li, J. C.; Yan, J. M.; Zhang,
X. B. Angew. Chem. Int. Ed. 2022, 61, e202116635.
doi: 10.1002/anie.202116635
(68) Dou, Y.; Xie, Z.; Wei, Y.; Peng, Z.; Zhou, Z. Natl. Sci. Rev. 2022, 9,
nwac040. doi: 10.1093/nsr/nwac040
(69) Bergner, B. J.; Schurmann, A.; Peppler, K.; Garsuch, A.; Janek, J.
J. Am. Chem. Soc. 2014, 136, 15054. doi: 10.1021/ja508400m
(70) Gao, X.; Chen, Y.; Johnson, L. R.; Jovanov, Z. P.; Bruce, P. G. Nat.
Energy 2017, 2, 17118. doi: 10.1038/nenergy.2017.118
(71) Zhang, C.; Dandu, N.; Rastegar, S.; Misal, S. N.; Hemmat, Z.; Ngo,
A. T.; Curtiss, L. A.; Salehi-Khojin, A. Adv. Energy Mater. 2020, 10,
2000201. doi: 10.1002/aenm.202000201
(72) Lim, H. D.; Song, H.; Kim, J.; Gwon, H.; Bae, Y.; Park, K. Y.; Hong,
J.; Kim, H.; Kim, T.; Kim, Y. H.; et al. Angew. Chem. Int. Ed. 2014,
53, 3926. doi: 10.1002/anie.201400711
(73) Kwak, W. J.; Hirshberg, D.; Sharon, D.; Shin, H. J.; Afri, M.; Park, J.
B.; Garsuch, A.; Chesneau, F. F.; Frimer, A. A.; Aurbach, D.; et al.
J. Mater. Chem. A 2015, 3, 8855. doi: 10.1039/c5ta01399b
(74) Burke, C. M.; Black, R.; Kochetkov, I. R.; Giordani, V.; Addison, D.;
Nazar, L. F.; McCloskey, B. D. ACS Energy Lett. 2016, 1, 747.
doi: 10.1021/acsenergylett.6b00328
(75) Tułodziecki, M.; Leverick, G. M.; Amanchukwu, C. V.; Katayama,
Y.; Kwabi, D. G.; Bardé, F.; Hammond, P. T.; Shao-Horn, Y. Energy
Environ. Sci. 2017, 10, 1828. doi: 10.1039/c7ee00954b
(76) Liu, T.; Kim, G.; Jónsson, E.; Castillo-Martinez, E.; Temprano, I.;
Shao, Y.; Carretero-González, J.; Kerber, R. N.; Grey, C. P. ACS
Catal. 2018, 9, 66. doi: 10.1021/acscatal.8b02783
(77) Wang, A.; Wu, X.; Zou, Z.; Qiao, Y.; Wang, D.; Xing, L.; Chen, Y.;
Lin, Y.; Avdeev, M.; Shi, S. Angew. Chem. Int. Ed. 2023,
e202217354. doi: 10.1002/anie.202217354
(78) Kwak, W. J.; Kim, H.; Petit, Y. K.; Leypold, C.; Nguyen, T. T.;
Mahne, N.; Redfern, P.; Curtiss, L. A.; Jung, H. G.; Borisov, S. M.; et
al. Nat. Commun. 2019, 10, 1380. doi: 10.1038/s41467-019-09399-0
(79) Kwak, W.-J.; Freunberger, S. A.; Kim, H.; Park, J.; Nguyen, T. T.;
Jung, H.-G.; Byon, H. R.; Sun, Y.-K. ACS Catal. 2019, 9, 9914.
doi: 10.1021/acscatal.9b01337
(80) Chen, Y.; Gao, X.; Johnson, L. R.; Bruce, P. G. Nat. Commun. 2018,
9, 767. doi: 10.1038/s41467-018-03204-0
(81) Cao, D.; Shen, X.; Wang, A.; Yu, F.; Wu, Y.; Shi, S.; Freunberger, S.
A.; Chen, Y. Nat. Catal. 2022, 5, 193.
doi: 10.1038/s41929-022-00752-z
(82) Ahn, S.; Zor, C.; Yang, S.; Lagnoni, M.; Dewar, D.; Nimmo, T.;
Chau, C.; Jenkins, M.; Kibler, A. J.; Pateman, A.; et al. Nat. Chem.
2023, 15, 1022. doi: 10.1038/s41557-023-01203-3
(83) Schurmann, A.; Luerssen, B.; Mollenhauer, D.; Janek, J.; Schroder,
D. Chem. Rev. 2021, 121, 12445. doi: 10.1021/acs.chemrev.1c00139
(84) Hassoun, J.; Croce, F.; Armand, M.; Scrosati, B. Angew. Chem. 2011,
123, 3055. doi: 10.1002/ange.201006264
(85) Mahne, N.; Renfrew, S. E.; McCloskey, B. D.; Freunberger, S. A.
Angew. Chem. Int. Ed. 2018, 57, 5529. doi: 10.1002/anie.201802277
(86) Mourad, E.; Petit, Y. K.; Spezia, R.; Samojlov, A.; Summa, F. F.;
Prehal, C.; Leypold, C.; Mahne, N.; Slugovc, C.; Fontaine, O.; et al.
Energy Environ. Sci. 2019, 12, 2559. doi: 10.1039/c9ee01453e
(87) Dong, S.; Yang, S.; Chen, Y.; Kuss, C.; Cui, G.; Johnson, L. R.; Gao,
X.; Bruce, P. G. Joule 2022, 6, 185. doi: 10.1016/j.joule.2021.12.012
(88) Petit, Y. K.; Leypold, C.; Mahne, N.; Mourad, E.; Schafzahl, L.;
Slugovc, C.; Borisov, S. M.; Freunberger, S. A. Angew. Chem. Int. Ed.
2019, 58, 6535. doi: 10.1002/anie.201901869
(89) Liang, Z.; Zou, Q.; Xie, J.; Lu, Y.-C. Energy Environ. Sci. 2020, 13,
2870. doi: 10.1039/d0ee01114b
(90) Jiang, Z.; Huang, Y.; Zhu, Z.; Gao, S.; Lv, Q.; Li, F. Proc. Natl.
Acad. Sci. U. S. A. 2022, 119, e2202835119.
doi: 10.1073/pnas.2202835119
(91) Wu, C.; Zhou, Y.; Zhu, X.; Zhan, M.; Yang, H.; Qian, J. Acta
Phys. -Chim. Sin. 2021, 37, 2008044. [吴晨, 周颖, 朱晓龙,
詹忞之, 杨汉西, 钱江锋. 物理化学学报, 2021, 37, 2008044.]
doi: 10.3866/PKU.WHXB202008044
(92) Kwak, W.-J.; Chae, S.; Feng, R.; Gao, P.; Read, J.; Engelhard,
M. H.; Zhong, L.; Xu, W.; Zhang, J.-G. ACS Energy Lett.
2020, 5, 2182. doi: 10.1021/acsenergylett.0c00809

