不同浓度下二元弱酸酸式盐中微粒浓度的大小比较




摘要: 在二元弱酸的酸式盐溶液中,存在多个可逆过程。通常状况下,平衡常数大的反应主宰了体系的主要性质,因为HA-质子自递反应平衡常数最大,所以可以主宰整个体系的性质,但随着盐溶液浓度的降低,HA-离子浓度的迅速降低,HA-质子自递反应对体系的影响会逐渐降到HA-的水解或电离、甚至是水的电离相同的程度或之下,从而造成了在各个阶段,二元弱酸的酸式盐溶液中微粒浓度的大小排序的不同。通过对各可逆过程平衡常数的分析,结合守恒关系,定量分析出各阶段分界线的标志性浓度。
关键词: 二元弱酸酸式盐溶液; HA-质子自递反应; 多平衡竞争; 溶液浓度; 微粒浓度大小
文章编号: 1005-6629(2024)06-0093-05 中图分类号: G633.8 文献标识码: B
关于二元弱酸的酸式盐中,各微粒的浓度大小比较问题,已有不少著作加以论述,均提到不能忽略HA-的质子自递反应;HCO-3+HCO-3
H2CO3+CO2-3 K=Ka2/Ka1=1.04×10-4。否则,会对酸式盐中各微粒的浓度大小产生误判[1]。
但在这些文章中,并没有对酸式盐溶液中存在的平衡过程以及平衡常数进行系统分析,没有确定在稀释过程中各平衡过程对体系的贡献程度会出现怎样的改变,以及为什么会出现这样的改变。
本文以碳酸氢钠与亚硫酸氢钠为代表,全面分析二元弱酸酸式盐溶液中存在的各种平衡过程和这些过程的平衡常数,分析各平衡过程在不同浓度范围内对体系造成的不同影响,进而对各微粒浓度的大小以及大小排序的变化情况进行科学的分析,得出有科学依据的答案。
1 碳酸氢钠溶液中各离子浓度大小的探究
1.1 碳酸氢钠溶液中存在的平衡过程以及对体系的影响
我们发现,在四个可逆过程中,正向进行程度最大的是碳酸氢根的质子自递反应,然后是碳酸氢根的水解过程,第三为碳酸氢根的电离过程,最后是水的电离过程。
众所周知,平衡常数最大的那个反应的产物就是这个体系中量最大的物质,而碳酸氢根的质子自递反应,在所有的平衡过程中具有最大的平衡常数,其量级几乎是排第二位的碳酸氢根水解反应的5000倍。所以,可以肯定地说,在浓度不算太低的情况下,体系中的H2CO3与CO2-3是优势产物。
碳酸氢钠溶液在浓度逐渐降低过程中各微粒浓度的大小排序不同恰恰是因为在不同浓度下,碳酸氢根的质子自递反应在整个反应体系中所占的比重不断降低,也是在浓度降低过程中,剩余的三个平衡过程对体系的影响程度逐渐趋同所共同造就的结果(见图1)。
1.2 碳酸氢钠稀释过程对溶液中的四大平衡过程会造成不同的影响
在温度不变的条件下,四个反应的平衡常数不变,那么体系中的总平衡常数也应该不变,由于碳酸氢根初始浓度的不同,导致其余的四种微粒的平衡浓度也会
发生相应的改变,从而保证平衡常数不发生变化。通过对四个反应的平衡常数表达式与平衡常数的大小研究可知,K碳酸氢根质子自递=c(H2CO3)·c(CO2-3)c2(HCO-3),此平衡常数最大,在公式中,要对碳酸氢根的浓度值取平方,所以,随着碳酸氢根在溶液中的初始浓度的逐渐降低,此反应的产物在整个体系中的占比将会显著降低,质子自递反应对整个体系的贡献会逐渐降到碳酸氢根的水解反应、电离反应之后。
而碳酸氢根的水解与电离反应,由于一个是与水的反应,一个是单分子反应,碳酸氢根浓度的降低不会造成像其质子自递反应那么严重的影响,但随着其浓度的降低,两者对整个体系的贡献程度会逐渐接近,甚至有趋同的可能性。当然,此时的碳酸氢根浓度也将降低到可忽略不计的地步,失去了讨论的实际意义。
1.3 碳酸氢钠稀释过程中的五个阶段以及各阶段的分界线
从平衡常数可以看出,碳酸氢根的质子自递反应的平衡常数最大,对于整个体系的各物质浓度起到决定性的作用,由此反应产生的H2CO3与CO2-3占据绝对的优势地位,结合碳酸氢根的水解大于电离的情况,才会出现以下排序:c(HCO-3)>c(H2CO3)>c(CO2-3)>c(OH-)>c(H+)。
但随着碳酸氢根浓度的逐渐降低,碳酸氢根质子自递反应的产物会越来越少。因为水的浓度基本不变,所以碳酸氢根水解的产物占据的比重会越来越高,在这个转化过程中,存在一个两个平衡对体系的影响各占约50%的点,标志是c(CO2-3)=c(OH-)。我们为什么说“约”呢?因为,碳酸氢根的电离产生的CO2-3应该大于水电离时产生的OH-,但由于两电离的平衡常数太小,此阶段,可以忽略这两个电离过程的影响。故此时,溶液中各微粒的浓度排序为:c(HCO-3)>c(H2CO3)>c(OH-)=c(CO2-3)>c(H+)。
但碳酸氢钠的水解过程占据主导地位后(依然忽略碳酸氢根与水的电离),c(OH-)>c(CO2-3),此时碳酸氢根的质子自递过程与水解过程都产生碳酸,所以碳酸浓度依然大于氢氧根,溶液中各微粒的浓度排序为:c(HCO-3)>c(H2CO3)>c(OH-)>c(CO2-3)>c(H+)。
因为碳酸氢根的电离平衡常数大于水的电离平衡常数,所以,碳酸氢根的质子自递反应对整个系统的影响会先降到与碳酸氢根电离相同的程度,也就是说,碳酸氢根的电离与碳酸氢根的质子自递各贡献了50%的CO2-3。碳酸氢根的水解,因平衡常数大,居于主导地位,此过程的产物也占优势。此时,溶液中各微粒的浓度排序依然为:c(HCO-3)>c(H2CO3)>c(OH-)>c(CO2-3)>c(H+)。
当进一步降低碳酸氢钠溶液的浓度后,碳酸氢根的水解与电离逐渐居于主导地位,此时,碳酸氢根的质子自递反应对整个系统的影响逐渐降低到与水的电离过程相同的程度。由水电离产生的H+与碳酸氢根质子自递反应产生的CO2-3浓度相等,此时,溶液中的c(H+)=c(CO2-3),根据质子守恒,可得
当碳酸氢钠溶液的浓度极稀后,碳酸氢根的水解过程与电离过程对体系的影响会逐渐趋同,由于水解平衡常数大于电离平衡常数,所以水解过程始终大于电离过程;但碳酸氢根的电离结合水的电离,两个弱过程产生的粒子数目会等于一个强过程产生的粒子数,导致出现c(H2CO3)=c(H+)的情况,此时,溶液中各微粒的浓度排序为:c(HCO-3)>c(OH-)>c(H2CO3)=c(H+)>c(CO2-3)。
若浓度继续降低,各平衡对体系的影响逐渐趋同,使水电离造成的结果的比重在体系中进一步增大,就会出现碳酸氢根与水的电离共同造成的结果大于碳酸氢根的水解过程造成的结果,那么,此时,溶液中各微粒的浓度排序为:c(HCO-3)>c(OH-)>c(H+)>c(H2CO3)>c(CO2-3)。而在这个排序的最后两项为H2CO3与CO2-3,这已然说明碳酸氢根对体系的影响弱于水的电离过程。
1.4 碳酸氢钠溶液稀释过程中五个阶段的四个分界线与三个临界点的关系
1.5 各临界点、各阶段碳酸氢钠溶液中各微粒浓度的计算方法
根据NaHA酸式盐的质子守恒可得出以下公式:
c(H+)=Ka1(Ka2c(HA-)+Kw)Ka1+c(HA-),结合c(HA-)=Ka1·c(H2A)c(H+)与c(A2-)=Ka2·c(HA-)c(H+),参考伍强等根据此三个公式,结合临界点的条件得出的公式,可以推导出水解呈碱性的二元弱酸的酸式盐三个临界点各微粒的浓度与常数的关系[3],如表1所示。
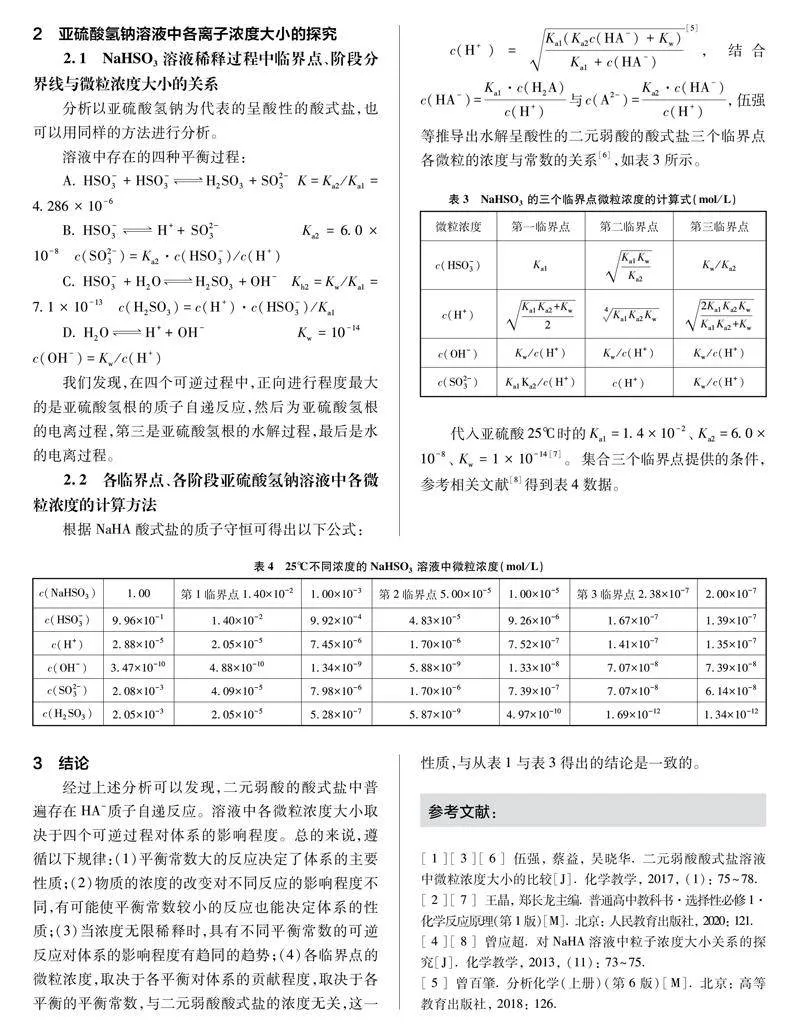
2 亚硫酸氢钠溶液中各离子浓度大小的探究
2.1 NaHSO3溶液稀释过程中临界点、阶段分界线与微粒浓度大小的关系
分析以亚硫酸氢钠为代表的呈酸性的酸式盐,也可以用同样的方法进行分析。
我们发现,在四个可逆过程中,正向进行程度最大的是亚硫酸氢根的质子自递反应,然后为亚硫酸氢根的电离过程,第三是亚硫酸氢根的水解过程,最后是水的电离过程。
2.2 各临界点、各阶段亚硫酸氢钠溶液中各微粒浓度的计算方法
3 结论
经过上述分析可以发现,二元弱酸的酸式盐中普遍存在HA-质子自递反应。溶液中各微粒浓度大小取决于四个可逆过程对体系的影响程度。总的来说,遵循以下规律:(1)平衡常数大的反应决定了体系的主要性质;
(2)物质的浓度的改变对不同反应的影响程度不同,有可能使平衡常数较小的反应也能决定体系的性质;
(3)当浓度无限稀释时,具有不同平衡常数的可逆反应对体系的影响程度有趋同的趋势;
(4)各临界点的微粒浓度,取决于各平衡对体系的贡献程度,取决于各平衡的平衡常数,与二元弱酸酸式盐的浓度无关,这一性质,与从表1与表3得出的结论是一致的。
参考文献:
[1][3][6]伍强, 蔡益, 吴晓华. 二元弱酸酸式盐溶液中微粒浓度大小的比较[J]. 化学教学, 2017, (1): 75~78.
[2][7]王晶, 郑长龙主编. 普通高中教科书·选择性必修1·化学反应原理(第1版)[M]. 北京: 人民教育出版社, 2020: 121.
[4][8]曾应超. 对NaHA溶液中粒子浓度大小关系的探究[J]. 化学教学, 2013, (11): 73~75.
[5]曾百肇. 分析化学(上册)(第6版)[M]. 北京: 高等教育出版社, 2018: 126.

