羌塘盆地索瓦组碳酸盐岩红层成因和环境意义
刘牧 季长军 黄元耕 丁一 陈荣庆 陈明思 杨钹 陈代钊

摘 要 【目的】海相红层分布在地质历史时期各个阶段,被解读为特殊环境的产物,并引起广泛关注。【方法】西藏双湖县毕洛错出露的侏罗系索瓦组表现为红色碳酸盐岩,围绕其致色成因与沉积意义,综合采用沉积学、矿物学和地球化学方法展开探讨。【结果】通过对索瓦组野外沉积学和镜下薄片鉴定,发现岩石以鲕粒—球粒支撑灰岩为主,富含头足、双壳、苔藓虫、腹足及其他底栖生物碎屑,鲕核以生物碎屑和陆源石英碎屑为主,呈现高能滩相沉积特征;光谱学研究和扫描电镜显示,致红色原因主要为亚微米级—微米级半自形—他形晶的赤铁矿,致色矿物集中在鲕粒圈层结构中,胶结物基本不含致色矿物,说明同沉积过程与早期成岩时期,尤其是鲕粒和球粒形成时期表面微需氧嗜铁微生物,对致色铁的氧化起到了重要作用。另外,碳酸盐矿物的地球化学分析结果显示,岩石的红色度与陆源碎屑输入的通量具有正相关性,且呈现正Ce/Ce*异常、富中稀土式配分曲线的特征,代表了铁氧化物经历了还原性溶解后的重结晶作用。【结论】据此,研究重建了索瓦组红层致色过程:陆源含铁矿物输入为致红色提供了物质基础,在动荡水体的同沉积过程中,鲕粒表层开始以胶体形式附着Fe(III)。随后在早成岩过程中,还原性流体促使含铁矿物溶解,为嗜铁微生物提供游离状态的铁离子,使其重结晶,通过化学成因或生物成因最终形成羟基铁并致红色。
关键词 海相红层;羌塘盆地;索瓦组;碳酸盐岩;赤铁矿;稀土元素;成岩作用
第一作者简介 刘牧,男,1990年出生,博士,副研究员,沉积地球化学,E-mail: liumu@mail.iggcas.ac.cn
中图分类号 P512.2 文献标志码 A
0 引言
“红层”一词通常用于描述具有红色色调的沉积岩[1?2],并在地质记录中广泛分布。最常见的红层是在陆相环境中形成的,称为陆相碎屑红层,它们的颜色通常是由于在含氧大气条件下形成铁锰氧化物所导致。相比之下,海洋红层的岩性则更加多变,包括砂岩、灰岩、砾岩和泥岩等。自从白垩纪海洋红层系统研究以来[3],海相红层受到越来越多的关注。基于水深和沉积相,海相红层可以大致可分为三类:(1)远洋红层,例如大多数白垩纪海洋红层[3?4];(2)风暴浪基面以上的浅海红层,例如波罗的海地区下奥陶统—中奥陶统的一些浅海灰岩[5];(3)风暴浪基面以下的深海红层,例如华南志留系特列奇阶深海灰岩和硅质岩红层[6?7],以及中国南方和塔里木地块中上奥陶统紫红色灰岩[8?10]。其中,同沉积和/或早期成岩成因的海相红层被认为与底部水体化学成分密切相关,因此吸引了沉积学家的广泛关注。在大多数情况下,分散的亚微米级赤铁矿颗粒被认为是主要的着色机制,但赤铁矿的来源仍然存在很大的争议。除了来自大陆风化碎屑的陆源性赤铁矿外[7,11?12],这些着色赤铁矿形成模式主要由两种,分别是早期成岩作用通过改变含铁矿物的过程自生形成[13],另一种则为同沉积模式,通过稳定存在的溶解态铁离子和氧化剂(主要是O2)的过程形成[14]。因此,海相红层常常被认为是底层水氧化、通气作用的产物,并与相对低的初级生产力关系密切[3,15?16]。
然而,在百万年的时间尺度上,形成红色均匀且广泛的红层需要大量且稳定的赤铁矿贡献。通常,沉积物中的碎屑赤铁矿颗粒分布高度不均匀,大多数为毫米级的碎屑赤铁矿,它们比更细的自生矿物的着色效果差很多[17]。如果碎屑赤铁矿不是直接原因,则水中的铁离子存在以及电子受体是自生赤铁矿形成的前提条件。然而,溶解态Fe(II)的转化为高度不溶性Fe(III)速度很快,因此如果没有提供持续的供应,溶解态Fe(II)储库会被迅速耗尽。另一方面,Fe(II)只能在相对还原的环境中稳定存在。热力学模型表明,海水中实际需要形成红层的Fe(II)浓度可能高于4 nM且低于50 μM[18],远高于现代海洋的平均浓度(0.1~1.0 nM)。从这个角度来看,海相红层中赤铁矿对海水或孔隙水中铁元素循环以及相应的古环境意义可能比以前想象的更为复杂。本研究选取位于羌塘盆地毕洛错地区的侏罗系飞来峰沉积序列,采用野外沉积学宏观描述和微观组构特征描述,结合碳酸盐矿物微量元素和扫描电镜(含能谱)分析,重点研究索瓦组海相红色碳酸盐岩地层的致色机制和古环境意义,旨在为解释海相红层的成因提供新的思路。
1 地质背景及剖面特征
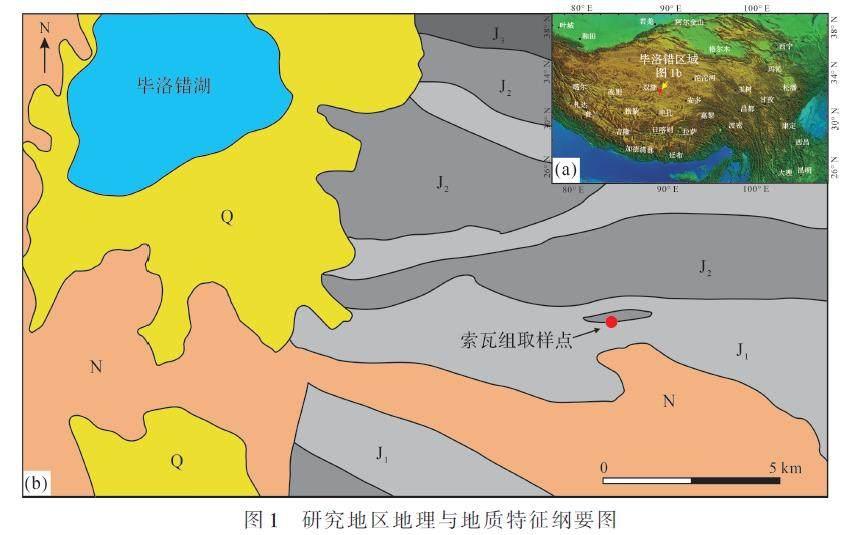
在晚侏罗世—早白垩世时期,由于班公湖—怒江洋盆的闭合作用,羌塘盆地经历了大规模的海退,在北羌塘地区形成了一个相对封闭的巨大海湾,其向北西方向开口[19],并在本地区沉积了雪山组、扎窝茸组、索瓦组上段和白龙冰河组等地层,这些地层可能是同时期但不同相的沉积产物。其中,上侏罗统索瓦组为一套的海陆过渡相细碎屑岩和碳酸盐岩组合地层,也是区域内重要的石油系统组成单元,一直以来广受关注[20]。其中在毕洛错地区出露的索瓦组碳酸盐岩红层,其红色的来源以及沉积学和古海洋学意义尚未有定论,结合引言对红层成因提出的疑问,羌塘地区出露的索瓦组碳酸盐岩是研究海相红层的典型代表和良好的研究对象(图1a,b)。
索瓦组整合于夏里组之上,其与上覆下白垩统雪山组接触关系尚有争议,野外观察多认为二者为整合接触,而菊石生物地层带则显示二者存在不整合关系[21]。索瓦组地层厚度变化较大,从北部到南部逐渐变厚。原索瓦组由青海省区调大队创名,该组相当于原雁石坪群的上灰岩段,原型剖面位于羌塘盆地东部的雀莫错,将其时代对比为晚侏罗世。早期基于双壳类生物研究研究认为羌塘地区索瓦组属于上侏罗统牛津阶—基默里奇阶[22],而Re-Os同位素年龄将索瓦组上段年龄定为早白垩世[20]。随着研究的深入,尤其是对确定时代、层位意义最大的菊石类化石的研究,将羌塘地区索瓦组的地层时代约束在中侏罗世巴通期至卡洛夫期[21]。索瓦组下段主要为碳酸盐岩、膏盐岩沉积组合,碳酸盐岩中发育粒屑和鲕粒,索瓦组上段出现细碎屑沉积,部分地区如北羌塘胜利河、长蛇山地区分布砂岩、泥晶灰岩及页岩组合,呈现海陆交互相沉积特征,在雀莫错地区以东分布了三角洲相泥岩和砂岩的沉积[20]。对索瓦组上段部分黑色页岩的元素地球化学研究显示,中侏罗世晚期随着海平面上升,本区域海水呈现由次氧向缺氧转化的环境,盐度逐渐升高,海水分层特征逐渐显著,整体沉积环境为潮坪—潟湖环境[23?24]。
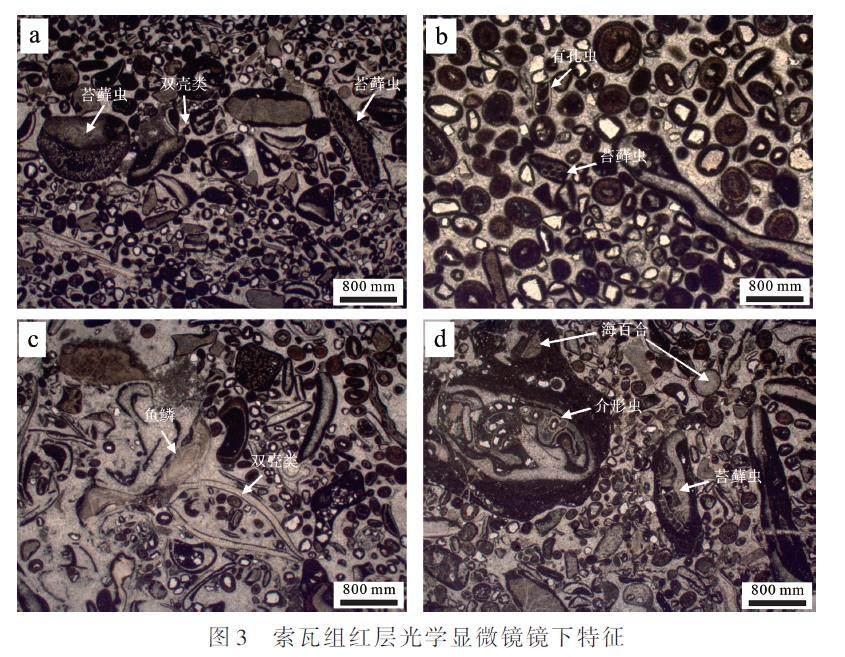
索瓦组下段中出现了碳酸盐岩红层的分布,然而由于羌塘盆地第四系沉积物覆盖较广,索瓦组红层出露较少且多不连续。位于毕洛错地区的飞来峰构造展示了厚约15 m的连续的索瓦组海相碳酸盐岩红层剖面(图2a),为研究本时期内红层成因和环境意义提供了重要的研究窗口。本地区出露索瓦组呈现扁豆状至瘤状灰岩结构并富泥质组分(图2b,c),以颗粒支撑灰岩为主,颗粒组成以内碎屑为主,如鲕粒以及生物碎屑等,伴随少量陆源碎屑(图2d)。后期裂隙或孔洞中出现较多的溶蚀作用析出的砖红色含铁物质(图2e),说明本地区红层的形成与铁氧化物可能关系密切。对岩石进行光学显微镜鉴定观察发现(图3),灰岩组构特征基本与野外观察结论一致,碎屑组分以内碎屑为主,常见鲕粒发育,环带多呈现同心圆特征,鲕核多为生物碎屑,亦可能来自陆源风化的石英碎屑的鲕核,指示沉积环境主要为水动力较强的高能滩相环境,生物组成包括双壳类、苔藓虫、海百合以及少量的介形虫。这些颗粒灰岩的基质或胶结物多呈现亮晶特征,并没有显著的富含铁质的光学特点,而颗粒物则多呈现消光至半消光特征,说明铁质物质可能集中在颗粒物中。
2 实验分析方法
2.1 红色色度定量分析
由于在野外观测时诸多不确定因素,使得肉眼所辨别出来的红色有可能并不准确,所以本次研究中使用定量测试标准分析岩石色度。在测量颜色之前,取约1.5 g样品在40 ℃状态下干燥并磨碎至200目,然后使用手持Minolta-CM2002色度计测量岩石颜色。颜色测量标准单位采用L*a*b*CIE颜色球形标尺[25]。本颜色球形标尺由French Commission internationale de l'éclairage 开发并使用,因此也成为(CIE)标准。L*轴(从-100~+100)代表了亮度从无光至全白光,a*轴则代表从-100(绿色)~+100(红色),b*轴则代表从-100(蓝色)~+100(黄色)。本研究将此标准应用至羌塘地区索瓦组相关样品的颜色评价工作中来。
2.2 紫外线—可见光漫反射光谱分析
紫外线—可见光波段漫反射光谱分析(ultra violetvisible-near infrared diffuse reflectance spectroscopy,UV-VIS-NIR-DRS)对于铁氧化物的探测和分析十分敏感,占全岩总含量约0.01%的铁氧化物都可以在DRS上有明显响应,使得DRS在白垩纪大洋红层致色矿物研究中发挥了重要作用[3]。进行DRS分析前,首先将待测样品磨碎至200目并平铺至Cary5000分光计的待测台上,白色标准物质采用纯硫酸钡粉末。扫描速率为300 nm/min(按从波长300~2 600 nm计),并按照每0.5 nm扫描一次的频率进行。所得到的DRS数据使用K-M(Kubelka-Munk)回归函数[F(R)=(1-R)2/2R,R为反射率]进行运算,使用Scheinost etal.[26]和Torrent et al.[27]的计算方法分别再对F(R)进行一次求导。
2.3 碳酸盐岩微量及稀土元素分析
为避免陆源成分的污染,我们采用“碳酸盐矿物选择性溶解”方法确保溶解碳酸盐组分以分析微量元素及稀土元素(Rare Earth Element,REE)。每个样品等分试样(~50 mg)在去离子(DI)水中超声处理2h,然后离心以去除潜在的污染物,使其与0.25 mL稀醋酸(0.86 M)进行反应,并溶解约20%(约10 mg)的样品,将样品在4 000 rpm转速下离心5 min。随后使用去离子水润洗两次沉淀的不溶物并烘干,采用与先前类似的溶解法,将约40%(约20 mg)的样品在0.5 mL的稀醋酸(0.86 M)进行溶解,并再次收集上清液。汇总两次溶解的上清液后加入2 mL HNO3(0.80M),并在120 ℃蒸发所有的酸。后续分析在中国科学院地质与地球物理研究所Agilent 7700e电感耦合等离子体质谱仪(ICP-MS)开展。通过一致性标准重复分析确定的分析精度优于5%RSD(1σ)。
2.4 扫描电镜观察与能谱分析
样品扫描电镜观察与能谱分析采用中国地质大学(武汉)的场发射环境扫描电镜(Hitachi SU8010)+电子背散射衍射仪(EBSD)一体化设备,电子加速电压为20 kV,并且装配有工作距离约15 nm的二次电子图像探测器用来观察样品形态特征,和用来分析样品化学组成的AsB探测器以及用于半定量分析样品中元素含量的X射线能谱仪。在进行观察和分析前,样品被加工至探针薄片标准,并在之上镀约10 nm厚的铂以增强导电作用。能谱工作射线直径约2 μm,半定量分析参考标准物质为MINM25-53,重复测量含量值的误差不超过1%。
3 结果与讨论
3.1 光学研究与红层致色原因
通常情况下,海相红层的致色矿物多为以赤铁矿、镜铁矿等为代表的铁氧化物[27],这些铁氧化物即使在岩石中含量极少时(低至0.1%),亦可以使岩石宏观颜色变红。另外,少数情况下菱锰矿等矿物的大量富集,也可能使海相沉积物变成红色[3]。由于本研究中样品光谱没有显示明显的含锰矿物的富集,所以基本可以排除含锰矿物为研究区海相红层主要的致色矿物。
沉积岩中铁的氧化物主要来源有三种:碎屑物质来源[28]、自生或成岩作用形成的[18,29]、生物成因的赤铁矿等[30?31]。索瓦组剖面为一处出露范围约0.3 km2的飞来峰构造,其红层沉积颜色分布较为均匀和稳定(图2),并在较远地区也有显示。在海相红层单层中,红色的表现较为均匀,说明红色的形成很可能为同沉积或早期成岩作用,因为后期抬升遭受的风化作用和雨水渗滤作用难以在同一层沉积岩中形成均匀的颜色表现。在偏光显微镜下,致红色矿物多呈半消光—全消光特征,而在索瓦组岩石光片鉴定中,未见全消光矿物的选择性不均匀区域分布,部分碎屑来源的鲕核为石英碎屑(图3b),几乎未发现碎屑来源赤铁矿,说明碎屑来源赤铁矿不是导致红色的直接因素。光学显微镜下观察显示,半消光—全消光矿物多集中在鲕粒或其他内碎屑的包壳上,碳酸盐岩基质多为较纯的透光方解石,说明致色矿物很可能是在同沉积时期至早期成岩时期形成。
索瓦组岩石粉碎至200目后仍均呈不同程度的红色特征,红色度a*均大于1。在DRS上反射波长的一阶导数曲线中,本研究中海相红层样品的最低点均在560 nm附近,对应赤铁矿矿物的反射光特征。样品的红色度(a*)越高,反射光波长(R%)一阶导数在560 nm波峰处响应越强,波峰越高,表明赤铁矿的致色因素贡献越大(图4)。560 nm处的反射波长一阶导数接近并比标准赤铁矿矿物反射波长(R%)一阶导数曲线波谷(565~575 nm)处稍低[32],此现象原因应为样品中亚微米级别的赤铁矿晶型较差(多为半自形到他形)。由于陆源碎屑赤铁矿颗粒较粗,且在沉积物中的分布不均一性较强,因此微米—亚微米级别的赤铁矿矿物颗粒相比陆源碎屑的毫米级赤铁矿染色能力更强[17]。同时,其他现象也证明了此推论,如含沉积成因的微米—亚微米级的赤铁矿的样品在使用研磨钵碎样的过程中,更易在研磨钵和杵上染色,同时容器难以洗净[32?33],这符合索瓦组样品处理时所观察到的现象,再次印证了索瓦组海相碳酸盐岩红层的致色矿物主要为半自形—他形晶体的微米级赤铁矿颗粒。
3.2 地球化学特征对沉积环境的指示
碳酸盐岩中的碳酸盐矿物原生组分,在一定程度上可以反映沉积时期或早期成岩作用时期海水与流体的化学性质。根据对索瓦组红层的野外观察和薄片光学研究(图2,3),并无显著的重结晶或显著的成岩改造作用(如喀斯特或溶蚀孔洞)的现象。
大多数地球表面水系统(如海水、孔隙水、河口水、热液水和陆地水)中稀土元素的浓度是欠饱和的,且各自具有较为典型的特征。溶解的稀土元素可以通过取代碳酸盐晶格中的Ca2+被沉积物中碳酸盐矿物组分捕获,因此原生碳酸盐岩是追踪不同时期流体化学性质的重要载体和工具[34]。现代海洋碳酸盐岩中的碳酸盐矿物真实地记录了海水REE特征,大多数未受显著后期改造的古代碳酸盐岩也是如此[35?36]。因此,碳酸盐中REE的变化模式可能反映了同沉积和早成岩时期流体来源、深时环境和沉积过程。稀土元素系列可根据其原子序数分为轻稀土元素(LREE,从La到Nd),中稀土元素(MREE,从Sm到Dy)和重稀土元素(HREE,从Ho到Lu)。海相自生碳酸盐岩REE的标准化配分模式与现代海水类似,具有富集重稀土元素(HREE),铈元素(Ce)正异常,高Y/Ho比值(44~74)等特点[37?38]。
值得注意的是,陆源碎屑组分和底部流的影响可能导致碳酸盐岩的地球化学信号偏离海水值[39?40]。由于在早期成岩作用过程中,沉积物—水界面附近的有机物与铁、锰羟化物的还原作用,以及碎屑或黏土颗粒的溶解作用,使得碳酸盐组分可能记录了海水以外的化学信号。陆源碎屑组分相对于碳酸盐组分,往往具有更高的总REE浓度[41],尽管实验处理中已采用稀醋酸溶解法,碎屑来源物质相对含量的增加,也可以在REE浓度的提高方面体现。红色色度最低的样品MLS-1,REE标准化图显示整体浓度相应最弱(图5),这说明致色的铁元素很可能主要来自于陆源碎屑,陆地风化物质输入与致红色关系密切。
Y与Ho在地球岩石圈层循环中化学性质类似,而在海水中Y与Ho化学络合方式有所差异:在海水中,Ho元素由浅及深的沉降速率是Y的2倍,使得海水中Y/Ho高于淡水,因而Y/Ho可以用来指示不同水体类型进而在海相碳酸盐岩中推测沉积区域与河流输入源的距离[42]。通常情况下,开放大洋会出现较强的Y异常(Y/Ho介于40~80),近岸或特定背景下Y异常程度较低(Y/Ho介于33~40)[43]。本研究中六个不同色度的索瓦组样品的Y/Ho介于37~44,说明沉积环境主要为开放海洋环境。其中色度最低的样品MLS-1的Y/Ho最高,可能说明该样品代表了距离陆源更远、碎屑输入量相对较少的沉积环境,这与该样品较低REE浓度相吻合,说明了陆源输入在红层致色过程中扮演了重要角色,然而这似乎与赤铁矿特征的光学与色度学研究有所不符(3.1节)。
索瓦组红色碳酸盐岩样品的REE 标准化曲线显示了MREE相对富集的“凸起型”模式(图5)。有研究显示,铁氧化物的还原性溶解作用释放的稀土元素可以导致碳酸盐矿物中MREE的相对富集[44]。Ce异常的角度也表现出了类似的结论:海水中REE系列的Ce异常(表示为Ce/Ce*=Ce×Nd/Pr2),在以碳酸盐为主的海相沉积物中提供了一个潜在的氧化还原指标[45]。在氧化条件下,Ce更易被锰氧化物和羟基化合物从海水中富集为Ce(IV),导致海水中沉淀的矿物出现负异常(Ce/Ce*<1)。相反,在次氧或缺氧环境下,负的Ce/Ce*异常较弱或不存在,反映在化变层下锰和铁氧化物的还原溶解,因此Ce/Ce*值会更偏正值[46]。索瓦组红层样品Ce/Ce*均大于1,介于1.1~1.3。MREE凸起模式和Ce/Ce*正异常均代表了这些红层形成时期经历过铁锰氧化物的还原性溶解作用,而岩石中丰富的底栖生物说明底部水体依然是含氧的。因此,在早期成岩过程中,应是水岩界面之下的还原性流体对铁氧化物的作用重塑了样品REE配分曲线的特征。这样看来,很可能早期陆地来源的含铁矿物提供了致色物质基础,而后期孔隙还原性流体对含铁矿物的溶解和赤铁矿重结晶等作用,将原本难以致红色的毫米级碎屑含铁矿物,改造成更易于致红色的亚微米—纳米级赤铁矿颗粒。
3.3 致色矿物微观尺度的分布和意义
为了进一步观察致色矿物微观分布特征,采用扫描电镜和元素能谱分析进行研究。可以发现,致色矿物赤铁矿颗粒多为微米—亚微米级,并且集中分布在鲕粒的环带上(图6a、图7a),碳酸盐矿物基质和胶结物上较少。元素能谱面扫描显示,岩石样品基本由碳酸钙组成,仅有少量陆源碎屑为硅质成分(图6b、图7b),鲕粒的内核多为生物碎屑和以硅质为主的陆源物质等,外层圈带结构无明显矿物成分的差异(图6c、图7c)。值得注意的是,在较为富硅质的区域,铁含量也有所显示(图6d、图7d),说明陆源的输入不仅与硅质关系密切,很可能输入了相当可观的含铁矿物。
与光学研究结论类似,在电镜下发现致色能力强的微米—亚微米级的赤铁矿在鲕粒圈层中富集,说明赤铁矿与鲕粒外层基本同时形成,应为同沉积至早期成岩时期。其中鲕粒外环部分中出现的赤铁矿可能是在动荡的水体中形成,组成了同沉积部分的赤铁矿,这些赤铁矿与碎屑物质较为均匀地散布在鲕粒外环和胶结物中,说明陆源物质对赤铁矿的分布有一定程度的贡献。另外在光学显微镜观察中,发现丰富的底栖生物化石,说明底部水体应是含氧的。在富游离氧的海水水体中,Fe(II)不能稳定存在,难以在百万年尺度形成稳定沉积的巨厚的均匀分布的碳酸盐岩红层[18]。因此,部分赤铁矿可能形成于早期成岩时期,并且位于水岩界面之下,此时海水对其化学成分影响十分有限。一些同沉积时期形成的赤铁矿可能先以三价铁胶体形式附着在鲕粒表面,并在随后的成岩过程中发生还原性溶解主导的重结晶作用,并均匀分布在鲕粒外层以及胶结物中。孔隙水环境下的还原性流体,可以使得Fe(II)长期保持相对稳定,并缓慢地输入通过化学沉淀形成致色的微米级赤铁矿。除了直接的化学沉淀,微生物参与也可以形成大规模的致色赤铁矿。鲕粒圈层中出现铁质矿物,常被解释为微生物密切参与的现象,如本溪组中铁质鲕粒等[47]。针对现代环境下研究发现,微生物介导的铁的氧化过程主要包括:微需氧细菌氧化Fe(II)、生物矿化、光化学过程以及利用硝酸盐的氧化等[48]。其中生物矿化作用产物主要为磁铁矿,底部沉积物中光难以投射,大部分硝酸盐还原菌氧化Fe(II)需要利用乙酸为底物[49],这些均与本例中索瓦组红层沉积与环境特征均不相符。因此,仅微需氧细菌活动可能性较大。微需氧的无机营养菌通过微生物细胞外膜上的Fe(II)氧化蛋白,形成难溶解的氢氧化物形式的Fe(Ⅲ)[50]。观察未发现索瓦组中具有典型的菌丝或其他菌类聚合物的结构特征,这与样品整体较低含量的赤铁矿特征也吻合,对参与铁氧化作用的微生物总体量要求较低。综上所述,电镜照片显示微米和亚微米级赤铁矿的形成,由化学沉淀过程及微生物作用共同控制。
4 结论
(1) 位于毕洛错地区的索瓦组红层为一套高能滩相鲕粒—球粒支撑的颗粒灰岩,致色原因为微米—亚微米级别的半自形—他形的赤铁矿晶体颗粒,主要分布在鲕粒或球粒外层圈带或包壳中。
(2) 陆地风化物质中的含铁矿物,在水岩界面以下的孔隙中经历了还原性流体的再溶解—重结晶的过程,为赤铁矿的形成提供了铁离子。
(3) 化学沉淀作用与微需氧的嗜铁微生物共同促成了索瓦组红层中致色赤铁矿微粒的形成和广泛分布。
(4) 碳酸盐岩红层的形成并不必然代表底部海水的氧化,而是与更加复杂的物源输入—生物过程—成岩作用等一系列过程密切相关。该研究为海相红层的研究提供了新的思路,展示了早期成岩过程中致色矿物形成的新证据。
致谢 衷心感谢编辑老师与审稿专家对论文提出的宝贵意见。在野外工作中,得到了中国地质科学院吴珍汉研究员的悉心指导,以及西藏自治区自然资源系统同仁的协助与支持,在此一并表示感谢!
参考文献(References)
[1] Tucker M E. Sedimentary petrology: An introduction to the originof sedimentary rocks[M]. 2nd ed. Oxford: Blackwell, 1991:31.
[2] 王成善,胡修棉. 白垩纪世界与大洋红层[J]. 地学前缘,2005,12(2):11-21.[Wang Chengshan, Hu Xiumian. Cretaceous worldand oceanic red beds[J]. Earth Science Frontiers, 2005, 12(2):11-21.]
[3] Hu X M, Scott R W, Cai Y F, et al. Cretaceous oceanic red beds(CORBs): Different time scales and models of origin[J]. Earth-Science Reviews, 2012, 115(4): 217-248.
[4] 吕璇,刘志飞. 大洋红层的分布、组成及其科学研究意义综述[J]. 地球科学进展,2017,32(12):1307-1318.[Lü Xuan, LiuZhifei. Distribution, compositions and significance of oceanic redbeds[J]. Advances in Earth Science, 2017, 32(12): 1307-1318.]
[5] Lindskog A. Early–Middle Ordovician biotic and sedimentary dynamicsin the baltoscandian paleobasin[D]. Lund: Lund University,2017: 1-115.
[6] Liu J B, Wang Y, Zhang X L, et al. Early Telychian (Silurian) marinesiliciclastic red beds in the eastern Yangtze Platform, SouthChina: Distribution pattern and controlling factors[J]. CanadianJournal of Earth Sciences, 2016, 53(7): 712-718.
[7] Rong J Y, Wang Y, Zhang X L. Tracking shallow marine red bedsthrough geological time as exemplified by the Lower Telychian(Silurian) in the Upper Yangtze region, South China[J]. ScienceChina Earth Sciences, 2012, 55(5): 699-713.
[8] Liu M, Chen D Z, Zhou X Q, et al. Upper Ordovician marine redlimestones, Tarim Basin, NW China: A product of an oxygenated deep ocean and changing climate? [J]. Global and PlanetaryChange, 2019, 183: 103032.
[9] Liu X C, Hou M C, Chang X L, et al. Formation of LateOrdovician marine red beds: A case study of Sandbian deposits inthe Tarim Basin, northwest China[J]. Global and PlanetaryChange, 2021, 207: 103669.
[10] Luan X C, Brett C E, Zhan R B, et al. Middle-Late Ordovicianiron-rich nodules on Yangtze Platform, South China, and theirpalaeoenvironmental implications[J]. Lethaia, 2018, 51(4):523-537.
[11] Luan X C, Zhang X L, Wu R C, et al. Environmental changes revealedby Lower-Middle Ordovician deeper-water marine redbeds from the marginal Yangtze Platform, South China: Linksto biodiversification[J]. Palaeogeography, Palaeoclimatology,Palaeoecology, 2021, 562: 110116.
[12] 林宝玉,任纪舜,李明,等. 中国主要块体奥陶纪达瑞威尔期(Darriwilian)晚期—凯迪期(Katian)早期海相红层及其构造意义[J]. 地质学报,2018,92(10):2002-2017.[Lin Baoyu, Ren Jishun,Li Ming, et al. Late Darriwilian to Early Katian (Ordovician)marine red beds from the main blocks in China and theirtectonic significance[J]. Acta Geologica Sinica, 2018, 92(10):2002-2017.]
[13] Turner P. Diagenetic origin of Cambrian marine red beds: CaerfaiBay shales, Dyfed, Wales[J]. Sedimentary Geology, 1979, 24(3/4): 269-281.
[14] Elorza J, Gómez-Alday J J, Jiménez Berrocoso ?. Syndepositionalprocesses in the pigmentation of oceanic red beds: Evidencefrom the Basque-Cantabrian Basin (northern Spain) [J].Geological Magazine, 2021, 158(9): 1683-1703.
[15] Chen X, Wang C S, Kuhnt W, et al. Lithofacies, microfacies anddepositional environments of Upper Cretaceous oceanic red beds(Chuangde Formation) in southern Tibet[J]. SedimentaryGeology, 2011, 235(1/2): 100-110.
[16] Wang C S, Hu X M, Huang Y J, et al. Cretaceous oceanic redbeds as possible consequence of oceanic anoxic events[J]. SedimentaryGeology, 2011, 235(1/2): 27-37.
[17] Li X, Cai Y F. Constraining the colouration mechanisms of cretaceousoceanic red beds using diffuse reflectance spectroscopy[J]. Cretaceous Research, 2013, 46: 257-266.
[18] Song H J, Jiang G Q, Poulton S W, et al. The onset of widespreadmarine red beds and the evolution of ferruginous oceans[J]. Nature Communications, 2017, 8(1): 399.
[19] 伊海生,林金辉,赵兵,等. 藏北羌塘地区地层新资料[J]. 地质论评,2003,49(1):59-65.[Yi Haisheng, Lin Jinhui, Zhao Bing,et al. New biostratigraphic data of the Qiangtang area in thenorthern Tibetan Plateau[J]. Geological Review, 2003, 49(1):59-65.]
[20] 曾胜强,王剑,陈明,等. 北羌塘盆地索瓦组上段的时代、古气候及石油地质特征[J]. 现代地质,2012,26(1):10-21.[ZengShengqiang, Wang Jian, Chen Ming, et al. Geological age,paleoclimate and petroleum geological characteristics of theupper part of the Suowa Formation in the north Qiangtang Basin[J]. Geoscience, 2012, 26(1): 10-21.]
[21] Yin J R. Bathonian – Callovian (Middle Jurassic) ammonitesfrom northwestern Qiangtang Block, Tibet, and the revised ageof the Suowa Formation[J]. Proceedings of the Geologists' Association,2016, 127(2): 247-265.
[22] 赵兵,陈海霞. 西藏双湖托拉木地区侏罗系索瓦组地层古生物[J]. 成都理工大学学报(自然科学版),2009,36(2):177-181.[Zhao Bing, Chen Haixia. Stratigraphy and palaeontologyof the Jurassic Suowa Formation in Tuolamu of Shuanghu, Tibet,China[J]. Journal of Chengdu University of Technology(Science & Technology Edition), 2009, 36(2): 177-181.]
[23] Yang R F, Cao J, Hu G, et al. Marine to brackish depositionalenvironments of the Jurassic – Cretaceous Suowa Formation,Qiangtang Basin (Tibet), China[J]. Palaeogeography, Palaeoclimatology,Palaeoecology, 2017, 473: 41-56.
[24] Liu M, Ji C J, Hu H W, et al. Variations in microbial ecologyduring the Toarcian Oceanic Anoxic Event (Early Jurassic) in theQiangtang Basin, Tibet: Evidence from biomarker and carbonisotopes[J]. Palaeogeography, Palaeoclimatology, Palaeoecology,2021, 580: 110626.
[25] Yang S L, Ding Z L. Color reflectance of Chinese loess and itsimplications for climate gradient changes during the last twoglacial-interglacial cycles[J]. Geophysical Research Letters,2003, 30(20): 2058.
[26] Scheinost A C, Chavernas A, Barrón V, et al. Use and limitationsof second-derivative diffuse reflectance spectroscopy in thevisible to near-infrared range to identify and quantify Fe oxideminerals in soils[J]. Clays and Clay Minerals, 1998, 46(5):528-536.
[27] Torrent J, Liu Q S, Bloemendal J, et al. Magnetic enhancementand iron oxides in the upper Luochuan loess-paleosol sequence,Chinese Loess Plateau[J]. Soil Science Society of America Journal,2007, 71(5): 1570-1578.
[28] Zhang X L, Wang Y, Rong J Y, et al. Pigmentation of the EarlySilurian shallow marine red beds in South China as exemplifiedby the Rongxi Formation of Xiushan, southeastern Chongqing,central China[J]. Palaeoworld, 2014, 23(3/4): 240-251.
[29] Hu X M, Zhao K D, Yilmaz I O, et al. Stratigraphic transitionand palaeoenvironmental changes from the Aptian oceanic anoxicevent 1a (OAE1a) to the oceanic red bed 1 (ORB1) in the Yenicesihlarsection, central Turkey[J]. Cretaceous Research, 2012, 38:40-51.
[30] Mamet B, Préat A. Iron-bacterial mediation in Phanerozoic redlimestones: State of the art[J]. Sedimentary Geology, 2006, 185(3/4): 147-157.
[31] Préat A R, de Jong J T M, Mamet B L, et al. Stable iron isotopesand microbial mediation in red pigmentation of the Rosso Ammonitico(mid-Late Jurassic, Verona area, Italy) [J]. Astrobiolo‐gy, 2008, 8(4): 841-857.
[32] Cai Y F, Li X, Hu X M, et al. Paleoclimatic approach to the originof the coloring of Turonian pelagic limestones from the VispiQuarry section (Cretaceous, central Italy) [J]. Cretaceous Research,2009, 30(5): 1205-1216.
[33] 蔡元峰,李响,潘宇观,等. Mn2+和Fe3+的致色作用:来自意大利白垩纪远洋红色灰岩的启示[J]. 地质学报,2008,82(1):133-138.[Cai Y F, Li X, Pan Y G, et al. The color-causingmechanism of Mn2+ and Fe3+ : Evidence from the Italian Cretaceouspelagic red limestones[J]. Acta Geologica Sinica, 2008, 82(1): 133-138.]
[34] Nothdurft L D, Webb G E, Kamber B S. Rare earth element geochemistryof Late Devonian reefal carbonates, Canning Basin,western Australia: Confirmation of a seawater REE proxy inancient limestones[J]. Geochimica et Cosmochimica Acta, 2004,68(2): 263-283.
[35] Liu M, Chen D Z, Jiang L, et al. Oceanic anoxia and extinctionin the latest Ordovician[J]. Earth and Planetary Science Letters,2022, 588: 117553.
[36] Zhao Y Y, Wei W, Li S Z, et al. Rare earth element geochemistryof carbonates as a proxy for deep-time environmental reconstruction[J]. Palaeogeography, Palaeoclimatology, Palaeoecology,2021, 574: 110443.
[37] Bau M, Koschinsky A, Dulski P, et al. Comparison of the partitioningbehaviours of yttrium, rare earth elements, and titaniumbetween hydrogenetic marine ferromanganese crusts and seawater[J]. Geochimica et Cosmochimica Acta, 1996, 60(10): 1709-1725.
[38] Shields G A, Webb G E. Has the REE composition of seawaterchanged over geological time?[J]. Chemical Geology, 2004, 204(1/2): 103-107.
[39] Kim J H, Torres M E, Haley B A, et al. The effect of diagenesisand fluid migration on rare earth element distribution in porefluids of the northern Cascadia accretionary margin[J]. ChemicalGeology, 2012, 291: 152-165.
[40] Wang Z, Guo W, Nie T, et al. Is seawater geochemical compositionrecorded in marine carbonate? Evidence from iron andmanganese contents in Late Devonian carbonate rocks[J]. ActaGeochimica, 2019, 38(2): 173-189.
[41] Webb G E, Kamber B S. Rare earth elements in Holocene reefalmicrobialites: A new shallow seawater proxy[J]. Geochimica etCosmochimica Acta, 2000, 64(9): 1557-1565.
[42] Nozaki Y, Zhang J, Amakawa H. The fractionation between Yand Ho in the marine environment[J]. Earth and PlanetaryScience Letters, 1997, 148(1/2): 329-340.
[43] de Baar H J W, Bacon M P, Brewer P G, et al. Rare earthelements in the Pacific and Atlantic Oceans[J]. Geochimica etCosmochimica Acta, 1985, 49(9): 1943-1959.
[44] Haley B A, Klinkhammer G P, McManus J. Rare earth elementsin pore waters of marine sediments[J]. Geochimica et CosmochimicaActa, 2004, 68(6): 1265-1279.
[45] Lawrence M G, Greig A, Collerson K D, et al. Rare earth elementand yttrium variability in south east Queensland waterways[J]. Aquatic Geochemistry, 2006, 12(1): 39-72.
[46] Wallace M W, Hood A V, Shuster A, et al. Oxygenation historyof the Neoproterozoic to Early Phanerozoic and the rise of landplants[J]. Earth and Planetary Science Letters, 2017, 466: 12-19.
[47] 李朋威,周川闽,金廷福,等. 太原西山七里沟剖面本溪组铁质鲕粒成因探讨[J]. 沉积学报,2013,31(3):396-403.[LiPengwei, Zhou Chuanmin, Jin Tingfu, et al. Origin of theferriferous ooids in the Benxi Formation at the Qiligou section,Taiyuan Xishan[J]. Acta Sedimentologica Sinica, 2013, 31(3):396-403.]
[48] 陈蕾,张洪霞,李莹,等. 微生物在地球化学铁循环过程中的作用[J]. 中国科学:生命科学,2016,46(9):1069-1078.[ChenLei, Zhang Hongxia, Li Ying, et al. The role of microorganismsin the geochemical iron cycle[J]. Scientia Sinica Vitae, 2016, 46(9): 1069-1078.]
[49] Melton E D, Swanner E D, Behrens S, et al. The interplay ofmicrobially mediated and abiotic reactions in the biogeochemicalFe cycle[J]. Nature Reviews Microbiology, 2014, 12(12):797-808.
[50] Sobolev D, Roden E E. Suboxic deposition of ferric iron bybacteria in opposing gradients of Fe(II) and oxygen atcircumneutral pH[J]. Applied and Environmental Microbiology,2001, 67(3): 1328-1334.
基金项目:国家自然科学基金项目(42102123)[Foundation: National Natural Science Foundation of China, No. 42102123]

