不同种植区库尔勒香梨树腐烂病菌Cytospora pyri营养体亲和性研究
彭莎莎 王喆 沙帅帅 张怡雯 闫成才 王兰

摘要 [目的]使用Nit突变体体系,探索来自新疆香梨种植区不同地理来源的腐烂病菌遗传多样性。[方法]首次使用Nit突变株技术(抗氯酸盐的硝酸盐利用缺陷突变体)对来自南疆3个不同种植区的13株库尔勒香梨树腐烂病菌Cytospora pyri的营养体亲和性进行了研究。[结果]13个菌株在含氯酸盐培养基(KPS)培养出115个Nit突变体,其中41个没有发生突变。在突变体稳定性鉴定中,鉴定出33个稳定的Nit突变体,82个不稳定的Nit突变体。产生的Nit突变体的表型85%被鉴定为NitD,15%被鉴定为NitB。[结论]获得2个Nit突变体,说明C.pyri的氮同化途径可能发生了2种突变。所有被检测的分离株都能够利用次黄嘌呤,使用次黄嘌呤的能力排除了钼辅助因子位点被阻断的可能性。
关键词 香梨树腐烂病菌;Cytospora pyri;Nit突变体
中图分类号 S 436.612.1 文献标识码 A 文章编号 0517-6611(2024)12-0136-03
doi:10.3969/j.issn.0517-6611.2024.12.029
Study on Vegetative Compatibility of Cytospora pyri from Korla Fragrant Pear in Different Planting Areas
PENG Sha-sha1,WANG Zhe1,SHA Shuai-shuai2 et al
(1.Agricultural College,Tarim University/Key Laboratory of Southern Xinjiang Agricultural Pest Control Corps/National and Local Joint Engineering Laboratory of High-Efficiency and High-Quality Cultivation and Deep Processing Technology of Characteristic Fruit Trees in Southern Xinjiang, Alar,Xinjiang 843300; 2. College of Modern Agriculture, Kashgar University, Kashgar,Xinjiang 844006)
Abstract [Objective] To use Nit mutant system to explore the genetic diversity of fragrant pear from different geographical sources in Xinjiang. [Method] In this study, Nit mutant technology (nitrate-resistant defective mutant) was used for the first time to study the nutritional affinity of Cytospora pyri, 13 strains of Korla pear tree rot from three different growing areas in southern Xinjiang. [Result] 115 Nit mutants were cultured in chlorate medium (KPS) from 13 strains, and 41 of them did not mutate. In the identification of mutant stability, 33 stable Nit mutants and 82 unstable Nit mutants were identified. The phenotype of the resulting Nit mutants was identified as NitD 85% and NitB 15%. [Conclusion] In this study, two Nit mutants were obtained, indicating that there may be two mutations in the nitrogen assimilation pathway of C. pyri. All isolates tested were able to utilize hypoxanthine, and the ability to use hypoxanthine ruled out the possibility that molybdenum cofactor sites were blocked.
Key words Pear Valsa Canker;Cytospora pyri;Nit mutant
基金项目 国家自然基金-新疆联合基金重点支持项目(U1903206);旱区作物逆境生物学国家重点实验室开放课题项目(CSBAA2020009);自治区研究生科研与创新项目(XJ2021G293)。
作者简介 彭莎莎(1999—),女,陕西汉中人,硕士研究生,研究方向:植物保护。*通信作者,教授,博士,从事植物病理学研究。
收稿日期 2023-10-27
库尔勒香梨(Pyrus sinkiangensis Yü)是国家地理标志产品之一,主要种植区有巴音郭楞蒙古自治州(简称巴州)、 阿克苏地区、喀什地区等地,是新疆地区农业经济发展的重要产业。香梨树腐烂病(Pear Valsa Canker)严重危害库尔勒香梨树,近年来新疆库尔勒香梨树腐烂病病株率普遍在50%~100%,在南疆平均病株率高达85%[1-3]。腐烂病(Cytospora pyri)是由Valsa属真菌引起。无性态为Cytospora属,相近属为Leucostoma,在世界范围内导致产量损失,特别是对东亚、中国、意大利许多地区的梨果生产构成重大威胁,经常导致整个果园的树木减产或死亡[4-6]。
自1976 年Cove[7]首次发现不能利用硝酸盐的突变体[Nitrate Non-utilizing Mutants]而获得构巢曲霉(Aspergillus nidulans)以来,国内外学者先后在多种真菌中使用诱导 Nit 突变体的方法进行研究。通过对半知菌亚门、子囊菌门等真菌的研究证实,硝酸盐利用缺陷型突变体(简称Nit 突变体)的方法常用于研究真菌营养体亲和性等方面[8-9]。1985 年 Puhalla[10]在进行互补试验测定营养体亲和性时,开辟了利用硝酸盐营养缺陷型(Nit)突变体的方法,为分析病原菌的遗传分析、亲和群与转化性、生理小种的相关性,以及病害生物防治等方面的研究提供了新的方向[11]。
笔者首次对库尔勒香梨树不同种植区的13株腐烂病菌C.pyri进行了营养体亲和性测定,建立并使用Nit突变体体系,以探索来自新疆香梨种植区不同地理来源的遗传多样性。
1 材料与方法
1.1 试验材料
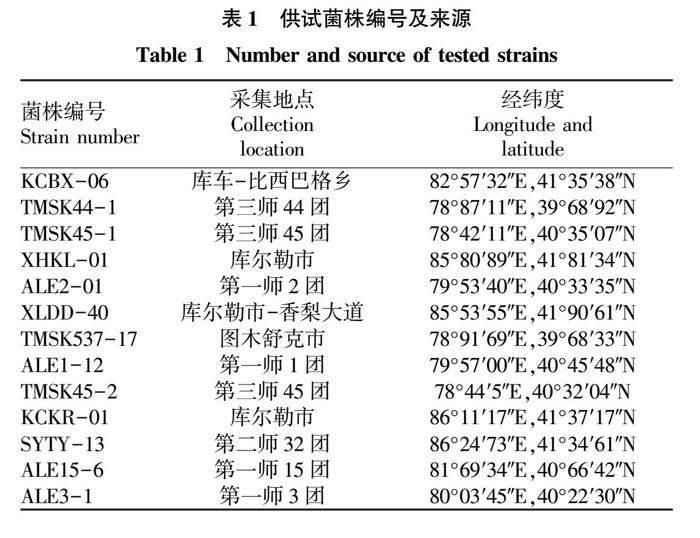
13个香梨树腐烂病菌株(Cytospora pyri)于2019年分别采自新疆的巴州、阿克苏和喀什等库尔勒香梨主产区,经单孢分离鉴定后获得(表1)。
马铃薯琼脂培养基(PDA):去皮马铃薯200 g,琼脂20 g,葡萄糖20 g;含氯酸盐培养基(KPS):去皮马铃薯200 g,琼脂20 g,氯酸钾粉末50 g,蔗糖20 g,蒸馏水1 000 mL;基本培养基(BM):琼脂20.00 g,KH2PO4 1.00 g,FeSO4·7H2O 0.01 g,KCl 0.50 g,MgSO4·7H2O 0.50 g,蔗糖30.00 g,微量元素液0.2 mL,蒸馏水1 000 mL。微量元素液(TES):蒸馏水95 mL,硫酸铜250 mg,硫酸锰50 mg,柠檬酸5 g,硫酸亚铁铵1 g。含硝酸钠培养基(MM):在1 000 mL的基本培养基中加入2.0 g 硝酸钠。含亚硝酸钠培养基(NM):在1 000 mL的基本培养基中加入0.5 g 亚硝酸钠。含次黄嘌呤培养基(HM):在1 000 mL的基本培养基中加入0.2 g次黄嘌呤[12]。
1.2 Nit突变体诱导与分离
先将供试菌株接种在PDA上于27 ℃黑暗培养4 d,之后接种于含5%的氯酸盐(KPS)培养基中诱导突变。菌株生长后在不规则突变区边缘挑取菌丝,接种于MM培养基中培养。在MM培养基中,出现菌丝稀薄、匍匐生长或不产生气生菌丝的菌落,则说明其形成抗硝酸盐利用缺陷型突变体,即Nit突变体,用甘油保存于-80 ℃冰箱中[13]。
1.3 Nit突变体稳定性鉴定
初次筛选的突变体可能因突变不稳定导致其返回原生状态,即回复突变,需要鉴定其稳定性。将筛选的Nit突变体接种至PDA中27 ℃黑暗培养4 d,再接种到MM培养基中。若产生气生菌丝或呈野生型生长,则说明突变体可能因突变不稳定返回原生状态,应丢弃;若菌落很稀薄或仍不产生气生菌丝,则说明形成稳定的Nit突变体,用甘油保存于-80 ℃冰箱中。
1.4 突变体表型鉴定
将筛选出的 Nit突变体接种于唯一氮源分别是硝酸盐、亚硝酸盐和次黄嘌呤的基本培养基(BM)上进行培养,通过突变体在3种培养基上的生长情况,判断突变体对2种氮源的利用情况,确定Nit突变体的生理表现类型(表2)。
2 结果与分析
2.1 Nit突变体的诱导与分离
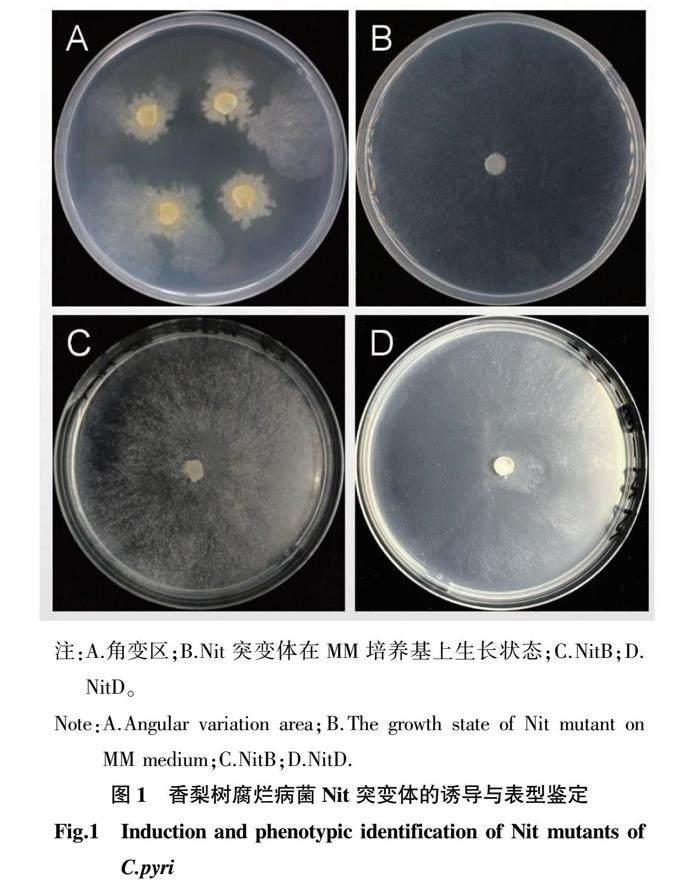
菌丝接种于KPS培养基后的 2~3 d,菌落几乎不生长,整体生长状态受到严重抑制。在7~11 d 后,部分菌落一侧开始出现气生菌丝,后逐渐发展成茂盛的扇形菌落(角变区),此为抗氯酸盐突变体。突变体在含有硝酸钠的培养基上生长较缓慢,菌丝呈无色透明胶质状,无气生菌丝产生,且只有很稀疏的菌丝匍匐于培养基表面生长,初步确定其为可选用的Nit突变体(图1A)。
单个菌株取12个重复于KPS培养基中诱导突变,共156个突变点位,在KPS培养基上均有不规则菌落(扇形菌落)生长,取边缘菌丝接种于MM培养基中进行稳定性筛选,有115个位点未产生气生菌丝或菌落很稀薄,说明形成了硝酸盐利用缺陷型突变体,即Nit突变体。
2.2 Nit突变体稳定性鉴定
将筛选的115个Nit突变体接种于PDA培养基中培养,再接种到MM培养基中培养,观察记录其生长情况。结果表明,有33个菌株不产生气生菌丝或菌落很稀薄(图1B),说明形成了稳定的Nit突变体,保留其菌株。
2.3 Nit突变体的筛选与鉴定
在含硝酸钠、亚硝酸钠、次黄嘌呤3种不同氮源的培养基上生长,鉴定Nit突变体表型。结果表明,所有在不同氮源差异培养基上的培养突变体在含次黄嘌呤和硝酸盐培养基上生长无气生菌丝,在亚硝酸盐上生长较差,部分有气生菌丝。从13个菌株中获得的33个突变体,根据突变体在不同氮源培养基的生长特征鉴别出NitB(图1C)与NitD(图1D)2种类型,不同菌株产生的各种突变类型差异较小。根据含有不同氮源的差异培养基上的生长,未检测到其他类型的Nit突变体,NitA、NitB、NitC和NitD表型频率分别为0、15%、0和85%(表3)。
3 讨论
硝酸盐利用缺陷型Nit突变体已被广泛用于区分VCGs和研究许多丝状真菌种内及种间的种群遗传多样性[14]。该研究首次利用Nit突变体研究C.pyri的营养亲和性。结果表明,通过在不同氮源培养基上进行Nit突变体表型鉴定,Nit突变体在含次黄嘌呤和硝酸盐培养基上生长无气生菌丝,在亚硝酸盐上抑制生长,仅有少数有气生菌丝产生,被鉴定为NitB、NitD突变体,说明C.pyri的氮同化途径可能发生了2种突变。C.pyri在亚硝酸盐上抑制生长,可能是一种无功能的硝酸盐还原酶起作用,而这是氮同化途径的必需酶。所有被检测的分离株都能够利用次黄嘌呤,使用次黄嘌呤的能力排除了钼辅助因子位点被阻断的可能性[15]。
研究表明,对不同种类的菌株诱导产生Nit突变体的条件不同[16]。尽管所研究的菌株具有地理多样性,但该试验只获得2种类型的Nit突变体。原因可能在于C.pyri的繁殖阶段中无性繁殖占主导地位,这直接导致了占据特定寄主或特定生态区域的C.pyri种内的基因流动,在氮同化方面,基因流导致了不同种植区香梨树腐烂病菌C.pyri的同质化,因此,推测大多数C.pyri菌株对氮的利用具有相同的模式。
利用Nit突变体的方法能够使研究者对壳囊孢属真菌在世界范围内的营养体亲和性进行比较,为这种普遍发生的植物病害的遗传多样性提供有价值的信息。后期可以在不同氯酸盐改良培养基上筛选更多的分离株,甚至在硒酸钠改良的培养基上产生其他种类的硫酸盐突变体,如硫酸盐非利用突变体(sul),可能有助于更好地了解C.pyri分离株的营养亲和性。
参考文献
[1] 刘江红,杨玉琼,刘翠兰.库尔勒香梨腐烂病、优斑螟防治新措施[J].北方果树,2005(5):33.
[2] 杜琴,孔利,赵思峰,等.新疆库尔勒香梨腐烂病病原鉴定[J].新疆农业科学,2013,50(12):2258-2265.
[3] 郭开发,杜琴,赵思峰,等.库尔勒香梨腐烂病发生的影响因素及药剂防效[J].中国植保导刊,2016,36(1):71-72,62.
[4] ABE K,KOTODA N,KATO H,et al.Resistance sources to Valsa canker(Valsa ceratosperma)in a germplasm collection of diverse Malus species[J].Plant breeding,2007,126(4):449-453.
[5] LI Z P,YIN Z Y,FAN Y Y,et al.Candidate effector proteins of the necrotrophic apple canker pathogen Valsa mali can suppress BAX-induced PCD[J].Frontiers in plant science,2015,6:1-9.
[6] WANG C X,GUAN X N,WANG H Y,et al.Agrobacterium tumefaciens-mediated transformation of Valsa mali:An efficient tool for random insertion mutagenesis[J].The scientific world journal,2013,2013:1-12.
[7] COVE D J.Chlorate toxicity in Aspergillus nidulans[J].Molecular and general genetics,1976,146(2):147-159.
[8] 高俊明,刘慧平,王建明,等.灰葡萄孢菌nit突变体的诱导及其在营养体亲和性测定中的应用初探[J].植物病理学报,2003,33(3):233-236.
[9] NITZAN N,HAZANOVSKY M,TAL M,et al.Vegetative compatibility groups in Colletotrichum coccodes,the causal agent of black dot on potato[J].Phytopathology,2002,92(8):827-832.
[10] PUHALLA J E.Classification of strains of Fusarium oxysporum on the basis of vegetative compatibility[J].Canadian journal of botany,1985,63(2):179-183.
[11] 梁宗琦.真菌的营养亲和性及亲和群[J].西南农业学报,1995,8(4):98-108.
[12] 潘月敏,营金凤,高智谋.棉花红腐病菌nit突变体筛选及营养亲和群测定[J].棉花学报,2009,21(1):17-22.
[13] COVE D J.Cholorate toxicity in Aspergillus nidulans:The selection and characterisation of chlorate resistant mutants[J].Heredity,1976,36(2):191-203.
[14] LESLIE J F.Fungal vegetative compatibility[J].Annual review of phytopathology,1993,31:127-150.
[15] PATEMAN J A,COVE D J,REVER B M,et al.A common co-factor for nitrate reductase and xanthine dehydrogenase which also regulates the synthesis of nitrate reductase[J].Nature,1964,201:58-60.
[16] 郭强.甘蔗梢腐病病原菌的营养体亲和性研究[D].南宁:广西大学,2016.

