耐高温异养硝化-好氧反硝化菌的分离鉴定及其脱氮特性研究
毕思远 罗傲 廖建珍 房志家 羊世成 李新红 赵聪

摘要 经过16S rDNA以及各项菌株生理生化特性研究试验,寻找一种耐热性较好的异养硝化-好氧反硝化菌(HN-AD)菌株,并将菌株接种至模拟污水环境的硝酸盐氮培养基中,研究其在不充足碳源及充足碳源的情况下菌株的脱氮效率及硝酸盐氮去除率。结果表明,在温泉中筛选出一种可使污水的pH更适合自身反硝化作用的HN-AD菌株,经鉴定所筛选出的HN-AD菌为斯氏假单胞菌。该菌株在模拟污水环境下反硝化最适pH为8.0,在充足碳源的情况下,其硝酸盐氮去除率能到达93%以上。菌株不仅拥有着较为高效的脱氮效率以及较高的硝酸盐氮去除率,而且拥有着自我调节环境pH的能力,能在充足碳源的情况下调节至最佳氮降解的pH。
关键词 污水处理;耐高温异养硝化-好氧反硝化菌;分离鉴定;脱氮特性
中图分类号 X 703 文献标识码 A 文章编号 0517-6611(2024)12-0007-06
doi:10.3969/j.issn.0517-6611.2024.12.002
Isolation, Identification and Denitrification Characteristics of High-temperature Tolerant Heterotrophic Nitrification and Aerobic Denitrification
BI Si-yuan1,2,3,LUO Ao2,LIAO Jian-zhen2 et al
(1.College of Materials and Chemical Engineering, Hezhou University, Hezhou, Guangxi 542899;2.College of Food Science and Technology, Guangdong Ocean University, Zhanjiang, Guangdong 524088;3.Shenzhen Jinyue Testing Technology Co., Ltd., Shenzhen, Guangdong 518100)
Abstract Through the study of 16S rDNA and physiological and biochemical characteristics of various strains, a heterotrophic nitrification and aerobic denitrification bacteria (HN-AD) strain with good heat resistance was found. The strain was inoculated into a nitrate nitrogen culture medium simulating sewage environment to study its denitrification efficiency and nitrate nitrogen removal rate under insufficient and sufficient carbon sources.The results showed that HN-AD strain that could make the pH of wastewater more suitable for its own denitrification was screened in hot springs, and the identified HN-AD strain was Pseudomonas stutzeri.The optimal pH for denitrification of this strain in a simulated wastewater environment was 8.0,with sufficient carbon source, its nitrate nitrogen removal rate could reach over 93%.The strain not only had a relatively efficient denitrification efficiency and a high nitrate nitrogen removal rate, but also had the ability to self regulate the environmental pH, which could be adjusted to the optimal pH for nitrogen degradation under sufficient carbon sources.
Key words Sewage treatment; High temperature tolerant heterotrophic nitrification and aerobic denitrification bacteria(HN-AD);Isolation and identification;Denitrification characteristics
基金项目 广西博士后专项经费资助项目(202320);湛江市科技计划项目(2022A01014);国家自然科学基金青年科学基金项目(62205221)。
作者简介 毕思远(1983—),男,山东济南人,副研究员,博士,从事食品安全工程研究。*通信作者,副教授,博士,博士生导师,从事食品质量安全研究。
收稿日期 2023-08-17
随着社会发展,污水排放等环境问题逐渐受到重视。城市污水、工业污水、厨余污水等未经处理直接排放到自然中,其中的含氮化合物蓄积并导致水体富营养化,藻类生长过于旺盛,致使水体中含氧量下降,水生动植物大面积死亡,人类摄入严重超标含氮化合物饮用水会致癌[1]。目前处理污水中含氮化合物的最有效的方法为生物法,利用微生物的硝化及反硝化过程对污水进行脱氮处理。但传统的微生物处理有一定局限性,因其将完整脱氮处理流程分为好氧硝化和厌氧反硝化两部分,说明传统微生物脱氮法具有启动时间长、处理场地大等缺陷[2]。针对这一局限提出了一种新型的微生物脱氮方法,即异养硝化-好氧反硝化(heterotrophic nitrification and aerobic denitrification,HN-AD),其克服了传统微生物脱氨法的局限,寻找出能同时进行异养硝化-好氧反硝化的菌株,并让其在好氧条件下不但可完成硝化过程,还能进行反硝化过程[3]。未经处理的污水一般环境都不适合普通微生物生长,如污水内的pH过酸或过碱、温度偏高等,而一般的硝化反硝化微生物也只能在温度和pH适合时才能保持高效的脱氮反应[4]。尽管此前已有许多研究者发现有些HN-AD菌能在较高温度中进行异养硝化-好氧反硝化脱氮功能,但其活跃温度仍在40 ℃,且对污水的pH具有严格要求,致使需要在污水进行异养硝化-好氧反硝化脱氮前对污水进行降温以及调节pH以便能让HN-AD菌能保持最大活性进行脱氮作业[5]。而在污水的各种含氮化合物中,又以硝酸盐氮最难去除,所以该试验目的在于寻找一种能够耐高温的HN-AD菌,并研究其在不同温度和pH中对硝酸盐氮的去除效率。
1 材料与方法
1.1 试验材料
1.1.1 筛菌样品。
为得到耐热性好的HN-AD菌,该研究采集了湛江市霞山区天然火山温泉进行后续的筛菌样品。
1.1.2 试验试剂与培养基。
氯化钠、浓盐酸、硝酸钠、无水乙醇、琼脂粉、硝酸钾标准溶液、丁二酸钠、氢氧化钠、磷酸氢二钾、七水硫酸镁、七水硫酸亚铁、七水硫酸锰、磺胺、可溶性淀粉、碘、过氧化氢、无水葡萄糖、溴百里酚蓝、甲基红均为国产分析纯。
反硝化培养基:用于前期筛选能利用硝基盐氮作为氮源的培养基,其配方为KNO3 2.00 g、丁二酸钠5.00 g、K2HPO4 1.00 g、MgSO4·7H2O 0.02 g、K2HPO4 1.00 g、蒸馏水1 000 mL。
反硝化鉴别细菌培养基:用于鉴别筛选出的菌株是否具有反硝化功能,其配方为丁二酸钠5.00 g、KNO3 2.00 g、Na2HPO4 1.00 g、MgSO4·7H2O 0.02 g、K2HPO4 1.00 g、1%溴百里酚蓝3 mL、蒸馏水1 000 mL。
维氏盐溶液:用于提供微生物生长活动所需的各项微量元素,其配方为NaCl 2.50 g、MnSO4·4H2O 0.05 g、K2HPO4 6.50 g、MgSO4·7H2O 2.50 g、FeSO4·7H2O 0.05 g、蒸馏水1 000 mL。
硝酸盐氮培养基:用于检测菌株的反硝化效率,其配方为NaNO3 0.51 g、丁二酸钠8.50 g、维氏盐溶液50 mL、蒸馏水1 000 mL。
营养肉汤培养基:用于菌株增殖以及活化,其配方为蛋白胨10 g、牛肉膏3 g、NaCl 5 g、蒸馏水1 000 mL。
营养琼脂培养基:用于观察菌株生长形态和后续镜检使用,其配方为蛋白胨10 g、琼脂17 g、牛肉膏3 g、NaCl 5 g、蒸馏水1 000 mL。
甲基红培养基:用于检测菌株甲基红试验,其配方为蛋白胨7 g、NaCl 5 g、葡萄糖5 g、蒸馏水1 000 mL,pH 7.0~7.2。
淀粉酶培养基:用于检测菌株淀粉酶试验,其配方为NaCl 5 g、牛肉膏3 g、胰蛋白胨10 g、可溶性淀粉20 g、蒸馏水1 000 mL,pH 7.0~7.2。
1.1.3 试验仪器。
高速离心机,H1650-W,湘潭湘仪仪器有限公司;超净工作台,SW-CJ-1G,上海沪净医疗器械有限公司;紫外可见光分光光度计,TU-1901,北京普析通用仪器有限公司;高压蒸汽灭菌锅,ZY-50F,浙江新丰仪器有限公司;pH计,PHS-3C,上海仪电科学仪器有限公司;恒温振荡培养箱,BSD-YX3200,北京博讯科技有限公司;电子显微镜,BM-500T,南京南派科技有限公司;生化培养箱,BSD-YX2400,上海一恒仪器有限公司;电子精密天平,Ar224CN,奥豪斯仪器有限公司;恒温水浴锅,HWS-26,上海五相仪器仪表有限公司;多功能酶标仪,Varioskan LUK,赛默科技仪器有限公司。
1.2 试验方法
1.2.1 HN-AD菌分离与筛选。
1.2.1.1 涂布。取2 mL温泉水,80 ℃水浴10 min,采用梯度稀释法稀释样品后,取0.1 mL样品涂布至反硝化鉴别培养基固体平板中,置于37 ℃恒温培养箱中培养。将样品涂布至反硝化鉴定培养基中,观察培养基中的颜色变化。
1.2.1.2 划线纯化。将涂布培养出培养基附近蓝色的单菌落用接种环挑取少许在反硝化鉴别细菌培养基固体平板中进行划线纯化,置于37 ℃恒温培养箱中培养。
1.2.1.3 保菌。划线后反硝化培养基固体平板有明显菌落长出时,随机挑选单菌落转移至5 mL营养肉汤培养基中,放入37 ℃,150 r/min恒温振荡摇床中培养2 d。混匀菌液后于离心管中,8 000 r/min离心1 min,弃去上清液,剩余菌液与甘油以1∶1的比例混匀后,置于-80 ℃冰箱中进行菌株保存。
1.2.2 菌株生理生化特征鉴定试验。
1.2.2.1 菌落观察。将筛选出的菌株通过平板划线的方法接种至营养琼脂培养基中,置于37 ℃的恒温培养箱中培养,待培养基上菌株清晰可见且生长状况良好时,对培养基上的菌株进行形态特征观察,如菌落色彩、形状、透明度等。
1.2.2.2 基因测序。
对菌株的16S rDNA基因测序,测序结果于NCBI和EzBioCloud的基因数据库(16S-based)比对分析,利用Mega 5软件中neighbor-joining法构建系统发育树,通过系统发育树大致确定菌株的属名。
1.2.2.3
革兰氏染色。取少量菌株于反硝化培养基进行平板划线,有明显单菌落时,取单菌落进行革兰氏染色。
1.2.2.4
甲基红试验。接种菌株至甲基红培养基中培养2 d,培养条件为37 ℃、150 r/min,在试管中滴入1滴甲基红试剂。
1.2.2.5
淀粉酶试验。将菌株活化后涂布至淀粉酶试验培养基中,置于 37 ℃恒温培养箱中培养3 d,将碘液滴加至淀粉酶培养基。
1.2.2.6
接触酶试验。用接种环取已活化好的菌株涂抹在载玻片上,滴加2~3滴过氧化氢溶液。
1.2.3 不同环境因子对菌株反硝化效率的影响。
设置7个梯度pH(4.0、5.0、6.0、7.0、8.0、9.0、10.0),6个梯度温度(30、40、50、60、70、80 ℃),每个单独梯度设置3个平行。将硝酸盐氮培养基升温至设定的温度后,将OD600为0.2的菌株接入至培养基中,模拟菌株直接接入高温污水,待培养基降至室温后放入37 ℃、150 r/min恒温振荡培养箱中培养,每12 h取出部分培养基进行硝酸根含量检测,探究菌株在不同环境因子下对硝酸盐氮的利用效率。
1.2.4 培养基中硝酸根含量检测。采用紫外分光光度法检测培养基中硝酸根含量,即取1 mL的1 g/L硝酸钾标准溶液于100 mL容量瓶中定容,制成10 mg/L的硝酸钾工作液;分别取0、0.5、1.0、1.5、2.0、2.5、3.0 mL于10 mL比色管中定容后分别测量其A220、A275,通过差值A=A220-A275计算硝酸根含量(C)并绘制标准曲线,得出线性方程为A=4.646 8C-0.089 2(R2=0.993 1)。
取1.5 mL培养基放入2 mL离心管中进行8 000 r/min离心1 min,取1 mL上清液于25 mL比色管中进行定容后分别测量其 A220、A275,并结合硝酸根标准曲线方程计算出培养基中硝酸根含量[6]。
2 结果与分析
2.1 耐热 HN-AD 菌的分离筛选结果
观察培养基中的颜色变化,培养基附近蓝色的单菌落有4株,如图1所示。
2.1.1 耐热HN-AD菌效率筛选。
利用HN-AD菌将无机氮转换为气态氮过程中会产碱,使培养基中的pH升高。将目标菌单独接种至反硝化鉴别细菌培养基中,观察培养基中的颜色变化程度,选择反硝化效率最高的菌株,反硝化鉴别细菌培养基前后对比如图2所示。
2.1.2 耐热 HN-AD 菌形态特征观察。
通过观察图3,菌株形态为圆形,白色有稍黄,菌株表面光滑圆润,有光泽,边缘有稍微皱褶。
2.1.3 耐热HN-AD菌16S rDNA鉴定。
对目标菌株的16S rDNA进行测序,该测序结果经BLAST比对分析表明,目的
菌株与Pseudomonas stutzeri ATCC 17588(T)菌株的相似性最高,根据16S rDNA基因的系统发育分析(图4)以及生理生化特性,确定该细菌为斯氏假单胞菌(Paenibacillus swuensis),并命名为S2-51。
2.1.4 革兰氏染色。
菌株革兰氏染色结果为红色杆状菌,革兰氏染色阴性,镜检结果如图5所示。
2.1.5 甲基红试验。
菌株甲基红试验结果为阴性,接菌培养基滴加甲基红试剂后变黄,如图6所示。
2.1.6 淀粉酶试验。
菌株淀粉酶试验结果为阳性,菌株附近培养基接触碘液变蓝,如图7所示。
2.1.7 接触酶试验。
微生物接触到过氧化氢后产生了大量气泡,接触酶试验结果为阳性,如图8所示。
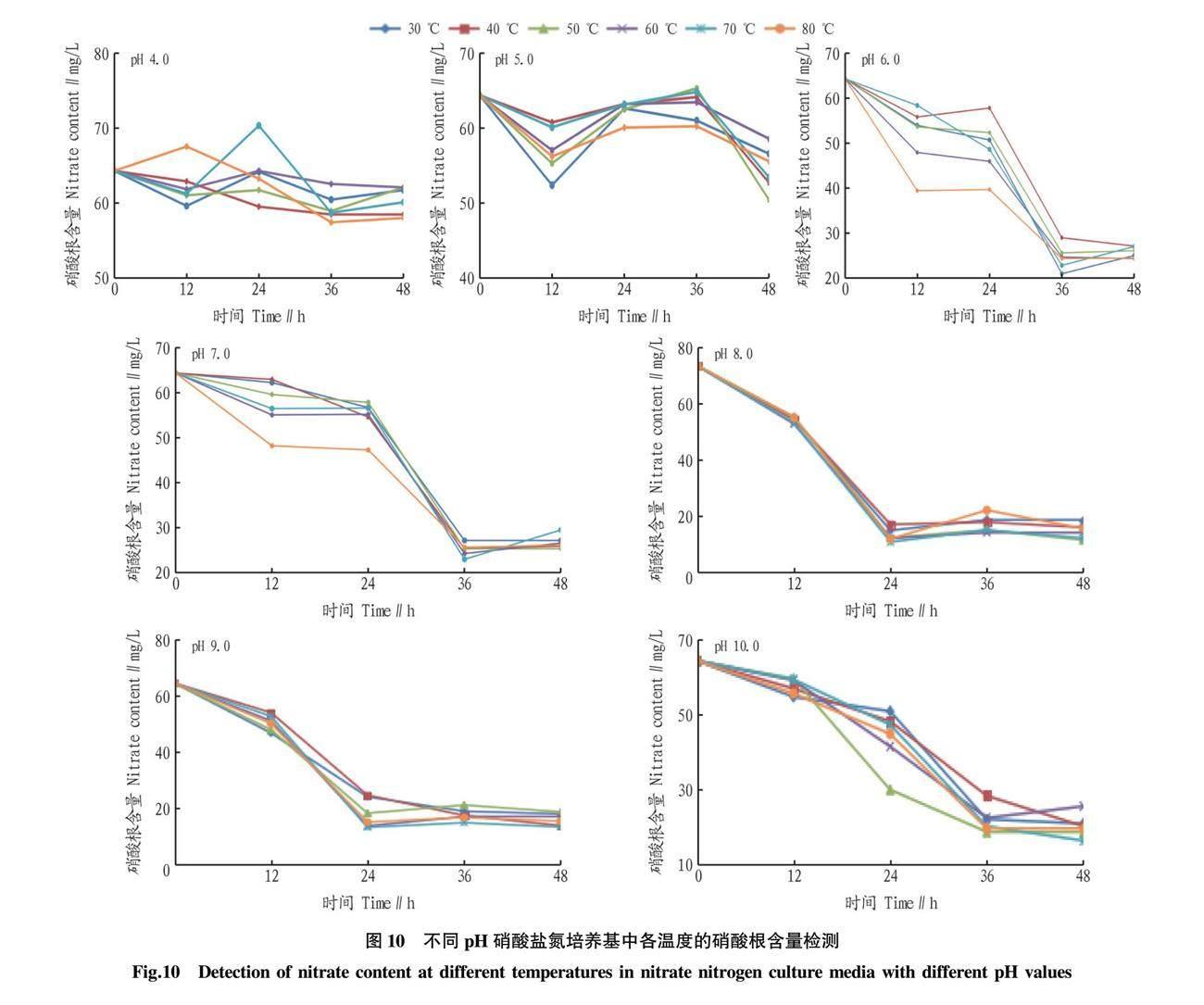
2.2 不同pH对耐热HN-AD菌反硝化效率的影响
pH对微生物生长繁殖和脱氮功能有很大的影响,具体表现为不同pH条件下菌株内的酶活性不同,或会影响菌株生物膜上的电荷变化,严重会导致菌株细胞内电荷失衡而造成膜破裂甚至死亡。一般耐热HN-AD菌在硝化作用下生成H+,以及反硝化作用下消耗H+,所处环境的pH对其脱氮效率影响较大,因此探寻其最适pH加快其脱氮速度十分有必要[7-9]。
将硝酸盐氮反硝化培养基加热到设定温度后,将OD600为0.2的耐热HN-AD菌接种至培养基中,并等待其冷却到室温后放入至恒温振荡培养箱中培养。每12 h取出部分培养基进行硝酸根含量检测,以鉴定菌株在硝酸盐氮中的脱氮效率和去除率。各温度下pH 4.0、5.0、6.0、7.0、8.0、9.0、10.0的硝酸盐氮去除率平均值分别为7.0%、14.7%、59.8%、59.0%、78.9%、76.4%和68.3%。由此得知,在pH 8.0时,硝酸盐氮的去除率最高,而pH 9.0次之。此外根据图9可知,在不同温度处理下pH 8.0的组别中硝酸盐氮脱氮效率最快。分析数据得知,在pH 4.0和5.0的情况下,其脱氮效率及硝酸盐氮去除率较低,若将菌株用于异养硝化-好氧反硝化脱氮工艺中,需提前将污水的pH调至碱性以加快菌株的脱氮效率。而在pH 8.0和9.0的情况之外,其硝酸盐氮的去除率并不明显,但通过数据分析,菌株在生长繁殖以及脱氮过程中会自行改变环境的pH至最适合反硝化脱氮工艺的pH,硝酸盐氮培养基经48 h培养后,原pH由4.13、5.09、6.01、7.07、8.17、9.12、10.03分别变化为4.47、7.89、8.21、8.32、8.43、8.42、8.16。综上所得污水原始pH在5~10,只要向污水中投入足够的碳源菌株会自行改变其中的pH至8.0附近,这节省了大量人力去定时调整污水中的pH以让耐热HN-AD菌一直保持着最佳效率。
2.3 不同温度对耐热HN-AD菌反硝化效率的影响
微生物的生长繁殖以及生命活动都与所处环境的温度息息相关,具体表现为温度会影响着微生物体内的酶活性以及微生物细胞内的各类蛋白质物质。过低的温度会抑制微生物体内的蛋白酶活性,导致微生物体内的各项反应变慢进而影响到微生物的生长繁殖以及生命活动;而过高的温度会对微生物体内的蛋白酶及其蛋白质等活性物质造成不可逆损伤,使微生物体内的蛋白酶及其蛋白质等活性物质变性,进而导致微生物的死亡[6,10-11]。该研究目的是找寻出能在高温污水中耐高温的HN-AD菌,因此将所寻找到的菌株进行高温检测并记录其数据探讨其耐热性是否符合要求是十分有必要的。将硝酸盐氮反硝化培养基加热到设定温度后,将OD600值为0.2的耐热HN-AD菌接种至培养基中,并等待其冷却到室温后放入至恒温振荡培养箱中培养。每12 h取出部分培养基进行硝酸根含量检测,以鉴定菌株在硝酸盐氮中的去除率。从图10可以看出,S2-51菌株在不同的pH硝酸盐氮培养基中各温度去除率相差不大,在投入指定温度的硝酸盐氮培养基后其脱氮率并没有过多减弱,其脱氮速度也只是前期与室温处理菌株稍落后,后期其速度与室温处理硝酸盐氮几乎没有差别。
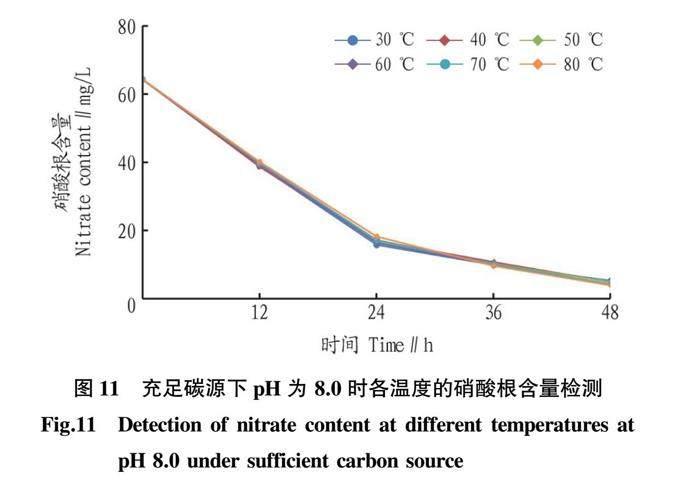
2.4 充足碳源下 HN-AD 菌硝酸盐氮去除率
通过试验探寻出菌株反硝化的最佳pH为8.0,将pH 8.0的硝酸盐氮培养基中丁二酸钠从原培养基的8.5 g提升至17.0 g,模拟向污水中投入充足碳源的情况下研究S2-51菌株的硝酸盐氮去
除率及其脱氮效率。将菌株分别接种至已升温到30、40、50、60、70、80 ℃的培养基中,待其冷却放入恒温培养箱中培养,每12 h测一次培养基中的硝酸根含量。如图11所示,30、40、50、60、70、80 ℃的硝酸盐氮去除率分别为95%、95%、93%、93%、93%和93%,表明在碳源充足的情况下,菌株经过短暂的高温后,硝酸盐氮去除率有所下降,但其下降程度并不明显,且仍能保持较高除氮效率。
3 结论与讨论
该研究成功寻找到耐热性较好的 HN-AD 菌株,经过 16S rDNA 以及各项菌株生理生化特性研究试验,鉴定所筛选出的 HN-AD 菌为斯氏假单胞菌,后续将菌株接种至模拟污水环境的硝酸盐氮培养基中,研究其在不充足碳源及充足碳源的情况下菌株的脱氮效率及硝酸盐氮去除率。菌株不仅拥有着较为高效的脱氮效率以及较高的硝酸盐氮去除率,还拥有着自我调节环境pH的能力,能在充足碳源的情况下调节至最佳氮降解的pH。
HN-AD 菌拥有着生长发育速度快、对极端环境耐受性强、数量种群庞大等优点,但现今研究因 HN-AD 菌的多
样性仍未真正地探寻出硝化/反硝化的本质机理。目前大多数的 HN-AD 菌在试验中有着较高的脱氮效果,在实际应用中却因各种特殊情况表现欠佳。因此今后的研究重点可以集中在以下3个方面:①在各种环境中继续分离出更多具有异养硝化-好氧反硝化功能的菌株,并研究其在不同环境中的生长发育和脱氮特性,加深异养硝化-好氧反硝化菌株耐受极端环境的特性;②利用更多的研究手段去探寻检测 HN-AD 菌的氮代谢途径,补充对 HN-AD 菌氮代谢机理并探索其本质氮代谢理论;③增加在实验室设定环境中对 HN-AD 菌的污水脱氮处理的研究,探寻其对污水的脱氮特性,并将其尝试至实际应用中记录其数据,为日后规模化投入至污水处理应用提供理论支持。
参考文献
[1] 陈云增,李天奇,马建华,等.沙颍河流域典型癌病高发区水体硝态氮污染及健康风险[J].环境科学学报,2019,39(5):1698-1707.
[2] SUN Z Y,LV Y K,LIU Y X, et al.Removal of nitrogen by heterotrophic nitrification-aerobic denitrification of a novel metal resistant bacterium Cupriavidus sp.S1[J].Bioresource technology,2016,220:142-150.
[3] CHEN J,HAO H H,CHEN J M.Characteristics and metabolic pathway of Alcaligenes sp TB for simultaneous heterotrophic nitrification-aerobic denitrification[J].Applied microbiology and biotechnology,2016,100:9787-9794.
[4] 袁建华,赵天涛,彭绪亚.极端条件下异养硝化-好氧反硝化菌脱氮的研究进展[J].生物工程学报,2019,35(6):942-955.
[5] 潘章磊.基于异养硝化—好氧反硝化的餐厨垃圾发酵废水脱氮技术研究[D].重庆:重庆大学,2020.
[6] 曹秀云,谢茜.如何利用紫外分光光度法测定水中硝酸根离子[J].硅谷,2014,7(5):72-73.
[7] 宋佳强,李军,陈光辉,等.pH 值对包埋固定化技术反硝化脱氮的影响[J].中国给水排水,2019,35(3):78-82.
[8] 王伟东.工业废水处理工艺的研究与应用[J].化工管理,2019(29):199.
[9] 吴玉清,王永会,李祥,等.染料厂遗址土壤中微生物的筛选鉴定及理化性质分析[J].农业与技术,2021,41(15):41-46.
[10] 郭宗昊.模拟气候变化对小麦根际土壤硝化和反硝化细菌群落结构的影响[D].淮北:淮北师范大学,2022.
[11] 黄智刚,张璐雅,汪斯丹,等.基于模拟实验探讨 2018 年高考全国Ⅰ卷理综第 37 题[J].生物学教学,2019,44(5):61-62.

