根瘤菌对茎瘤芥的促生作用研究
毛仲玉 常黎洁 王殿东

摘要 [目的]研究田菁茎瘤固氮根瘤菌侵染茎瘤芥的情况以及对植株促生作用的影响。[方法]分析根瘤菌对不同品种茎瘤芥的促生作用差异、不同浓度根瘤菌对茎瘤芥栽培品种“涪杂2号”的影响、不同诱导剂对结瘤的影响。[结果]田菁茎瘤固氮根瘤菌侵染的6个茎瘤芥品种中,“涪杂2号”根长和株高增加显著,促生作用明显。以不同浓度田菁茎瘤固氮根瘤菌侵染“涪杂2号”幼苗结果表明,在1.0×108个/mL浓度下,茎瘤芥的根长和株高增加最为显著,同时利用荧光显微镜观察到根瘤菌在“涪杂2号”健康幼苗根部组织的定殖情况,在处理茎瘤芥3 d后,根瘤菌可侵入茎瘤芥根部并定殖,在接菌15 d后,在茎瘤芥根系局部组织发展成很高的群体密度。横向比较3种诱导剂诱导茎瘤芥结瘤效率差异表明,使用2,4-D、氯磺隆、豆科威后,3种诱导剂均可在30 d后于茎瘤芥根部形成类根瘤,60 d后类根瘤数量明显增多,其中,2,4-D结瘤效率最好,高达93%,显著高于其他2种诱导剂结瘤效率。[结论]该研究为更好地利用根瘤菌促进茎瘤芥生长的共生体系打下基础。
关键词 茎瘤芥;田菁茎瘤固氮根瘤菌;诱导结瘤;促生作用
中图分类号 S-3 文献标识码 A
文章编号 0517-6611(2024)12-0001-06
doi:10.3969/j.issn.0517-6611.2024.12.001
Study on the Growth-promoting Effect of Rhizobia on Tumorous Stem Mustard
MAO Zhong-yu1,CHANG Li-jie2,WANG Dian-dong2
(1.College of Biology and Food Enginerring,Chongqing Three Gorges University,Chongqing 404100;2.School of Advanced Agriculture and Bioengineering,Yangtze Normal University,Chongqing 408000)
Abstract [Objective]To study the infection of Azorhizobium caulinodans in tumorous stem mustard and its effect on plant growth promotion.[Method]The differences in growth promoting effects of rhizobia on different varieties of tumorous stem mustard,the effects of different concentrations of rhizobia on the cultivated variety ‘Fuza 2 of tumorous stem mustard and the effects of different inducers on nodulation were analyzed.[Result]The root length and plant height of ‘Fulza 2 increased significantly,and the growth promotion effect was obvious among the 6 stem mustard varieties infected with nitrogen-fixing rhizobia.The results of different concentrations of Azorhizobium caulinodans showed that the root length and plant height of ‘Fulza 2 seedlings increased significantly at the concentration of 1.0×108 rhizobium/mL,and the colonization of rhizobium in the root tissues of healthy ‘Fulza 2 seedlings was observed by fluorescence microscopy.After 3 days of treatment,rhizobium could invade and colonize the roots of ‘Fulza 2 seedlings.After 15 days of inoculation,high population density was developed in the local tissues of stems.Horizontal comparison of the three inducers nodulation efficiency showed that the three inducers could form nodule in the roots of stem tumor mustard after 30 days,and the number of nodule increased significantly after 60 days.The nodulation efficiency of 2,4-D was the best,up to 93%,which was significantly higher than that of the other two inducers.[Conclusion] This study lays the foundation for better utilizing the symbiotic system of rhizobia to promote the growth of stem mustard.
Key words Tumorous stem mustard;Azorhizobium caulinodans;Induction nodulation;Growth-promoting effect
基金项目 重庆市高校创新研究群体项目(CXQT21029)。
作者简介 毛仲玉(1997—),女,黑龙江大兴安岭人,硕士研究生,研究方向:作物病害防治。*通信作者,教授,博士,硕士生导师,从事主要土传病害、植物寄生线虫等发病规律和致病机理研究。
收稿日期 2023-08-09
茎瘤芥(Brassica juncea var.tumida)是重庆地区主栽的经济作物之一,其茎部发生膨大,是制作榨菜的主要原料,具有很高的经济价值[1]。现代营养学认为,榨菜能健脾开胃、补气添精、增食助神,榨菜与法国酸黄瓜、德国甜酸甘蓝并称为世界三大名腌菜[2]。
根瘤菌(Rhizobium)属于革兰氏阴性杆菌,可侵入豆科植物体内并在根部形成根瘤[3]。田菁茎瘤固氮根瘤菌(Azorhizobium caulinodans)是根瘤菌一个新属——固氮根瘤菌属[4],从豆科植物田菁中分离,与其他根瘤菌属的不同点是根瘤菌可以完成自生固氮。田菁茎瘤固氮根瘤菌可以把分子态氮转化成为植物可吸收利用的氨态氮形式,对植物生长具有促生作用,同时还可提高植物抵抗不利环境及病原菌的免疫能力,从而达到增加作物产量的目的[5-6]。近年来,人们通过基因标记等检测手段跟踪根瘤菌在非豆科植物根圈的定殖动态[7],发现许多根瘤菌在非豆科植物(水稻、油菜、小麦和棉花等)的根圈具有较强的定殖能力,并对植物根系以及地上部分的生长有很好的促进作用[8]。
诱导剂也是植物生长激素,与激素相对应物质结合可完成对植物生长的调节作用。可以与植物激素完成结合引起细胞发生生理生化变化的蛋白质定义为激素受体[9]。激素受体位点的分布较广,如细胞质、细胞核、细胞质膜[10]。植物自身具有激素种类较多,故有较多种类激素受体分布在细胞不同位置。诱导剂作用于各位点受到激素影响,会引起膜结构和功能发生改变,使一些依附在位点的酶和酶原失活或活化。酶系统发生改变会引起整个细胞的生理生长和新陈代谢功能也在一定程度上发生改变[11]。
基于根肿病、根瘤和根结线虫在植物根系寄生位点相同,引起根部形成瘤状相似。该研究根据根瘤菌对植物生长具有一定促生作用的特点,优化根瘤菌侵染茎瘤芥体系,引根瘤菌侵入茎瘤芥根部并定殖,研究根瘤菌对茎瘤芥的促生作用,为更好地利用根瘤菌促进茎瘤芥生长的共生体系打下基础。
1 材料与方法
1.1 试验材料 试验于2019年9月至2022年5月在重庆市涪陵区长江师范学院现代农业与生物工程学院病虫害防治实验室中进行。供试田菁茎瘤固氮根瘤菌Azorhizobium caulinodans ORS 571,由湖南农业科学院植物保护研究所提供;茎瘤芥品种“涪杂2号”“永安小叶”“永安传奇”“高山青”“早青2号”“成都郫县榨菜”由长江师范学院刘义华老师馈赠和重庆市涪陵区农贸市场购买;诱导剂选用2,4-D、豆科威、氯黄隆。
1.2 试验方法
1.2.1 根瘤菌对不同品种茎瘤芥侵染。
选取6个茎瘤芥品种种子,分别放置2 mL已灭菌的离心管中,用50%次氯酸钠浸泡种子10 min,期间振荡离心管确保所有种子浸泡,倒出清洗液后使用移液枪吸取无菌水冲洗5次,进行表面消毒后放置在装有灭菌琼脂组培瓶中,每个品种每瓶10粒,设5个重复[12],种子萌发2 d后幼苗用于根瘤菌接种试验。挑选生长状态大致相同的幼苗,吸取OD600在0.6~0.8的菌液并稀释至1.0×108个/mL菌液加至琼脂培养基上。对照组接等量PBS缓冲液,设5个重复。培养条件同上,接菌培养后9 d后调查茎瘤芥生长情况。无菌水冲洗,自然风干后放置黑色桌面拍照,测量其根长和株高,取代表性幼苗制片用于荧光显微镜观察。
1.2.2 不同浓度根瘤菌对茎瘤芥侵染。
将已消毒的“涪杂2号”种子置于琼脂-水固体培养基上限菌培养,待种子萌发至两叶一心期时,镊子剔除未萌发的种子,留有生长状态大致相同的幼苗。将对数生长期的根瘤菌菌液放置50 mL离心管中,4 500 r/min离心10 min收集菌体,用PBS缓冲液分别稀释为1.0×109、1.0×108、1.0×107、1.0×106 个/mL 4个不同浓度备用。分别吸取不同浓度1 mL根瘤菌菌液至培养基表面,每个浓度设4个重复,每瓶10粒,平行对照接等量PBS,设4个重复[4]。接菌培养9 d后,调查茎瘤芥幼苗生长情况并用直尺测量根长和株高。
1.2.3 根瘤菌在茎瘤芥根系定殖情况观察。
室内条件下,选用“涪杂2号”饱满种子表面消毒,消毒方式同“1.2.1”。置于琼脂-水固体培养基上限菌培养,萌发至两叶一心期,每个组培瓶吸取1 mL 1.0×108个/mL PBS稀释菌液加至琼脂-水固体培养基表面,使茎瘤芥幼苗接菌。接菌后,封口膜密封组培瓶以免污染,放置常规智能培养架限菌培养[13]。设置接菌3、6、9、12、15、18、21 d 等时间梯度,定期用荧光显微镜检测茎瘤芥幼苗根部被绿色荧光蛋白(GFP)标记根瘤菌定殖情况。
1.2.4 不同浓度根瘤菌结瘤诱导剂对茎瘤芥根系结瘤的影响。
将2,4-D、氯黄隆和豆科威3种诱导剂浓度梯度依次稀释为0.5、1.0、2.5 mg/L,同时将对数生长期的根瘤菌用PBS缓冲液稀释浓度至1.0×108个/mL备用。表面消毒的茎瘤芥“涪杂2号”种子放置滤纸上催芽,封口膜贴封培养皿进行限菌培养。3种诱导剂的每个处理10粒,设5个重复,萌发至两叶一心期,每个处理加入不同浓度诱导剂后再同时加入等量的1 mL 的1.0×108个/mL根瘤菌菌液,于24 ℃温室培养。30 d后观察根部结瘤情况和测量各处理下茎瘤芥的根长、株高、叶长、根重和叶重,分析不同诱导剂与根瘤菌组合使用对茎瘤芥生理指标的影响。
1.2.5 不同剂量根瘤菌结瘤诱导剂对茎瘤芥根系结瘤的影响。
种子消毒方式同“1.2.1”,限菌培养。选用稀释至2.5 mg/L 的3种诱导剂和稀释至1.0×108个/mL根瘤菌菌液备用,待种子培养至两叶一心时移至花盆,在幼苗生长周围分别用注射剂加入1和5 mL 3种诱导剂,同时加入等量根瘤菌菌液,每个处理10株,设4个重复。30和60 d后观察各处理下茎瘤芥的结瘤情况差异。
1.2.6 结瘤幼苗根部及土壤固氮酶活性测定。
种子表面消毒方法同“1.2.1”,种子生长至两叶一心期时,在幼苗根部接5 mL稀释至2.5 mg/L 2,4-D和1.0×108个/mL根瘤菌菌液。同等培养条件下,幼苗接5 mL的PBS作为对照,30 d后观察结瘤情况。待调查处理组幼苗根部形成根瘤后,测定固氮酶活性。
1.2.7 根肿病分级标准及相关计算。
根肿病分级划分标准:0级,根部无症状;1级,侧根有肿块,主根无肿块;2级,主根有肿块,侧根无肿块;3级:主、侧根均有肿块;4级,主、侧根有大量严重肿块[14]。
相关计算公式:结瘤率=结瘤株数/调查株数×100%;单位根瘤重量固氮酶活性SNA=还原的乙烯量/(根瘤干重×时间);病情指数=100×∑(各级病株数×各级代表值)/(调查总株数×最高级代表值)。
1.3 数据处理 采用Excel 2010对试验数据进行整理,用SPSS进行数据统计分析。对根瘤菌侵染不同浓度根瘤菌处理茎瘤芥根长和株高进行正态性检验,通过单因素方差分析比较对照组和处理组之间的差异性,并用最小显著法(LSD)进行多重比较,利用Excel进行柱形图和误差线的绘制。
2 结果与分析
2.1 根瘤菌对不同品种茎瘤芥侵染分析
接菌9 d后通过荧光显微镜检测到根瘤菌在各茎瘤芥品种根部均有定殖(图1)。根瘤菌在不同品种茎瘤芥根部的定殖部位大致相同,多定殖于幼苗根部表皮细胞和细胞间隙,但具体的分布数量则有所不同。其中检测到根瘤菌在“涪杂2号”根部组织定殖量最多,其次为“永安传奇”和“永安小叶”,根瘤菌定殖量最少的为“早青2号”。“涪杂2号”根部组织观察到明亮的绿色荧光(图1A),检测到的GFP标记明显多于其他茎瘤芥品种。根瘤菌在茎瘤芥根部呈点状分布且分布较零散。试验证明,根瘤菌同样可以存在于非豆科植物内部组织。
2.2 根瘤菌侵染不同品种茎瘤芥生理指标差异分析
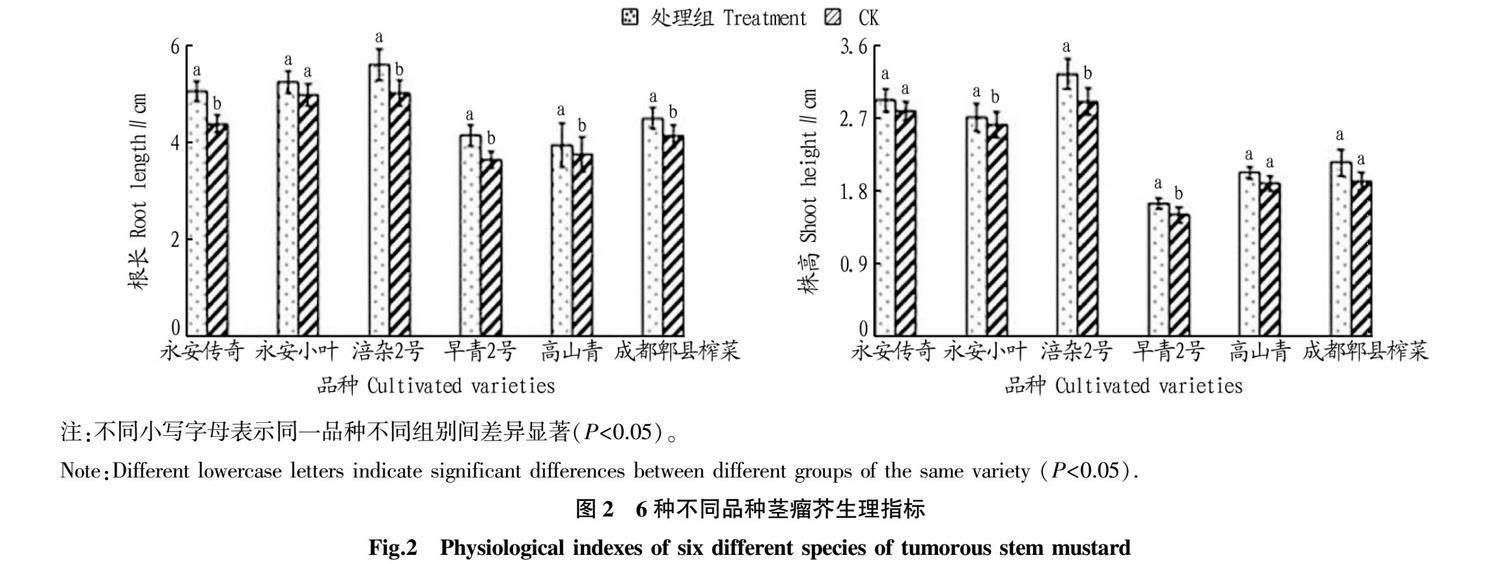
限菌培养9 d后,测量各处理下的30株茎瘤芥根长和株高并对数据进行正态性检验,其根长和株高数据符合正态分布。生理指标的检测结果(图2)表明,根瘤菌对不同的茎瘤芥品种根长和株高产生不同影响,经LSD检验,“涪杂2号”和“早青2号”根长和株高处理组均显著高于对照组;“永安小叶”根长处理组和对照组差异不显著,但株高差异显著;“永安传奇”根长较未接菌组(CK)差异显著,株高差异不显著;“高山青”和“成都郫县榨菜”根长处理组和对照组差异显著,株高差异均不显著。
“永安小叶”根长较对照组提高了5.5%,株高较对照组提高了3.0%;“永安传奇”根长较对照组提高了6.8%,株高较对照组提高了4.8%;“早青2号”根长较对照组提高了3.2%,株高较对照组提高了2.5%;“成都郫县榨菜”根长较对照提高了8.6%,株高较对照组提高了11.0%;“涪杂2号”根长较对照组提高了11.6%,株高处理组较对照组提高了12.1%;“高山青”根长较对照组提高了4.5%,株高较对照组提高了4.1%。其中“涪杂2号”根长和株高经根瘤菌侵染后促生作用最为明显,“涪杂2号”根长和株高增加是“高山青”的2倍。综上所述,适宜浓度根瘤菌对不同品种茎瘤芥生长均具有促生作用,其中“涪杂2号”接菌幼苗根长和株高较对照组差异均显著且“涪杂2号”作为茎瘤芥栽培常用品种生长状态良好,故选用茎瘤芥“涪杂2号”品种用于深入研究根瘤菌与茎瘤芥相互作用的分子机制。
2.3 不同浓度根瘤菌侵染茎瘤芥的生理指标检测分析
经“2.2”结果分析,使用不同浓度根瘤菌对茎瘤芥“涪杂2号”的生长产生不同程度的影响,其中1.0×108个/mL的根瘤菌对茎瘤芥“涪杂2号”生长的影响最大且有明显的促生作用。室内条件下接菌9 d后测量不同浓度处理下30株茎瘤芥幼苗根长和株高并对数据进行方差分析,结果显示(图3),1.0×108个/mL处理下的幼苗根长和株高显著高于其他处理,1.0×107和1.0×106个/mL之间幼苗根长差异不显著,1.0×109、1.0×107和 1.0×106个/mL之间幼苗株高差异不显著。1.0×108和1.0×107个/mL的根瘤菌侵染茎瘤芥幼苗根长较对照分别提高了15.8%和5.8%,株高较对照分别提高了22.5%和21.7%。1.0×109个/mL株高较对照提高了7.8%,1.0×106个/mL株高较对照提高了1.1%,但在1.0×109个/mL浓度下,处理组根长较对照下降4.8%,而1.0×106个/mL浓度下,根长较对照没有明显差异。综合以上分析得出,1.0×108 个/mL浓度处理茎瘤芥的促生作用效果最好,可作为试验适宜浓度深入研究田菁茎瘤固氮根瘤菌与茎瘤芥相互作用的分子机制。
2.4 根瘤菌在茎瘤芥根部定殖情况分析
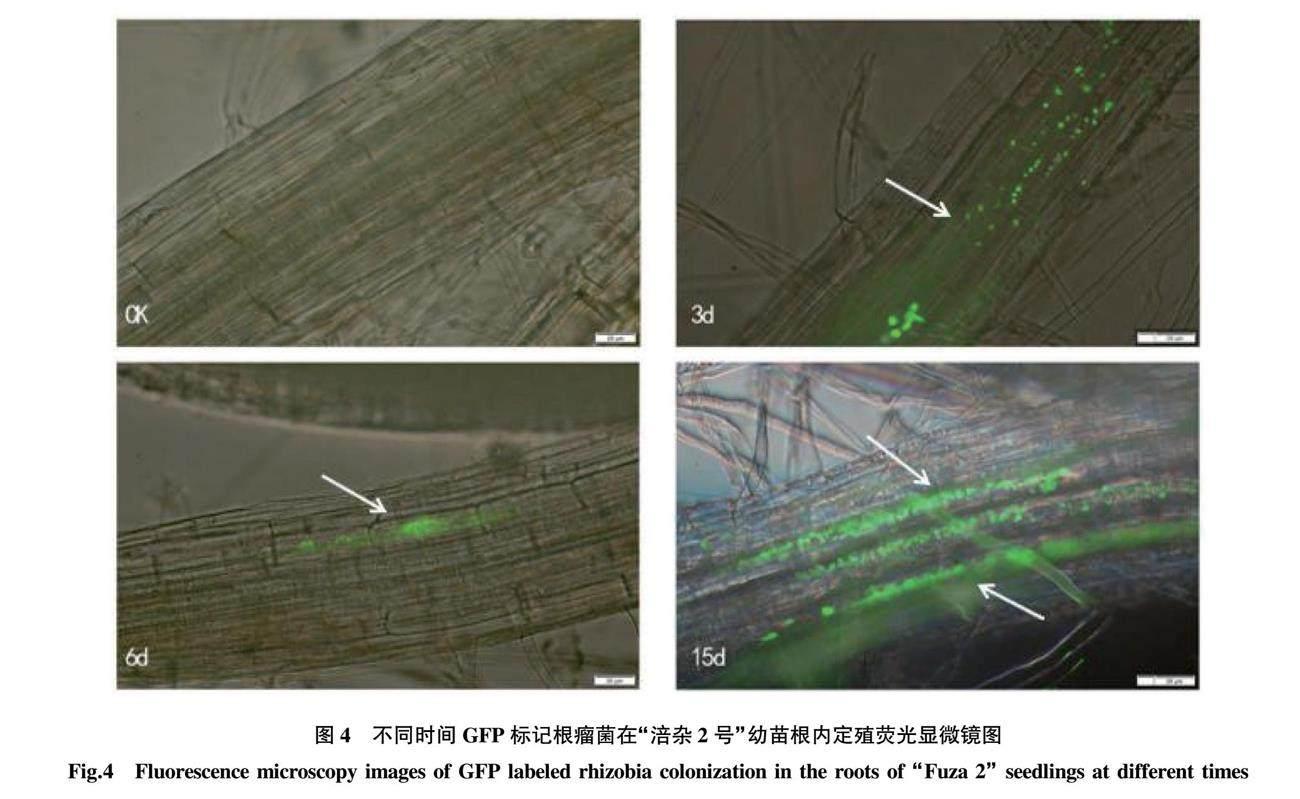
此次试验在不同时间梯度利用荧光显微镜检测根瘤菌在茎瘤芥幼苗根部的定殖情况,结果表明,根瘤菌在侵染茎瘤芥3 d时定殖于幼苗根部组织,随时间推移根瘤菌的定殖量递增,在接菌15 d时,根瘤菌的定殖量已在幼苗根部大量繁殖,并在局部发展为一定范围的群体密度(图4)。根瘤菌不仅可侵染非豆科植物,还可定殖于植物根的表皮、皮层的细胞间隙和细胞内,形成生态位(ecological niche)。经荧光显微镜检测,根瘤菌侵染非豆科植物茎瘤芥根部的定殖规律与根瘤菌侵入豆科植物体内大致相似,侵入植物根部组织定殖的方式均为“裂隙进入”,并随着时间推移根瘤菌可在茎瘤芥根部形成一定范围的群体密度。
2.5 不同浓度诱导剂处理茎瘤芥生理指标差异分析
不同浓度诱导剂处理茎瘤芥30 d后,对每组处理下的30株幼苗进行调查,结果发现(图5),茎瘤芥的根长、株高、叶长、根重、叶重均有明显的差异,其中1.0 mg/L豆科威对茎瘤芥的生理生长影响最大。1.0 mg/L豆科威幼苗株高高于0.5、1.0、2.5 mg/L的2,4-D和0.5、1.0 mg/L的氯磺隆,低于2.5 mg/L氯磺隆处理下的株高。1.0 mg/L处理下豆科威叶长为16.57 cm,高于氯磺隆3个浓度下的叶长。1.0 mg/L豆科威根重为0.53 g,与2.5 mg/L氯磺隆根重差异不大,但均高于其他处理下的根重。综上所述,使用结瘤诱导剂3个浓度诱导茎瘤芥,1.0 mg/L豆科威对茎瘤芥生理生长没有表现出明显的抑制作用,在1.0 mg/L豆科威处理下,“涪杂2号”幼苗的生长状态最好。但3个诱导剂稀释3个浓度使用1 mL剂量下处理幼苗均未诱导茎瘤芥根部结瘤。
2.6 不同剂量诱导剂处理茎瘤芥结瘤差异分析
接菌30 d后调查茎瘤芥在不同剂量根瘤菌结瘤诱导剂处理下结瘤情况,调查结果(图6)表明,3种诱导剂使用浓度为2.5 mg/L和1 mL剂量处理下均未诱导茎瘤芥形成根瘤,但2.5 mg/L浓度处理下使用剂量为5 mL的3种诱导剂均诱导茎瘤芥根部形成根瘤。这一现象说明诱导剂使用量是影响茎瘤芥结瘤的重要原因。5 mL的2,4-D和根瘤菌同时使用下,茎瘤芥结瘤效果最明显且形成的类根瘤最多,其次为5 mL豆科威和5 mL氯磺隆。2,4-D和氯磺隆加菌形成的类根瘤形态大致相同,均呈现半圆球状,而豆科威加菌形成的类根瘤呈现半圆球状和短棒状。同样培养条件下,未加入诱导剂仅使用根瘤菌培养的对照组茎瘤芥,虽有根瘤菌定殖在根部组织,但也未诱导茎瘤芥在根部形成根瘤。
2.7 不同剂量诱导剂处理茎瘤芥生理指标差异分析
调查不同剂量诱导剂处理60 d后的30株茎瘤芥生理指标影响的差异情况,结果表明(图7), 2.5 mg/L浓度及5.0 mL剂量的2,4-D和根瘤菌菌液等量处理茎瘤芥,根鲜重最大,均值高达1.47 g,低于对照组5%,分别高于氯磺隆和豆科威处理下12%和11%。经最小显著差异法检验,2,4-D较对照组差异不显著,较氯磺隆及豆科威差异显著。综上所述,3种诱导剂加菌使用较对照茎瘤芥生长均有一定影响,其中2,4-D较对照根鲜重差异不显著,表明2,4-D茎瘤芥生长没有明显的抑制作用,而氯磺隆和豆科威处理下对茎瘤芥根鲜重有明显的抑制作用,故选用结瘤效果最佳且对茎瘤芥生长影响较小的2,4-D为后期试验诱导剂。
2.8 根瘤菌在类根瘤中的定殖观察
在茎瘤芥根部形成根瘤后,取2,4-D浓度为2.5 mg/L和剂量为5 mL处理下形成
根瘤的茎瘤芥幼苗,用于检测根瘤中根瘤菌的定殖情况。茎瘤芥幼苗根部在2,4-D和根瘤菌侵染下培养30 d,在茎瘤芥根部形成根瘤,通过荧光显微镜观察,根瘤菌不仅可在茎瘤芥根系自然开口和根系细胞间隙定殖,还可进入根瘤细胞间隙并在根瘤组织中大量增殖(图8)。
2.9 茎瘤芥结瘤根部和土壤固氮酶活性差异分析
从图9可以看出,茎瘤芥接菌处理组和对照组固氮酶活性差异显著,形成根瘤的根部固氮酶活性为30.21 IU/g,对照组为28.57 IU/g;对培养茎瘤芥土壤进行检测,发现对照组和处理组差异明显,其处理组固氮酶活性为31.73 IU/g,对照组为29.70 IU/g。综上所述,处理组的固氮酶活性虽高于对照组,但对照组未接根瘤菌和处理组一样均表现出一定的固氮酶活性,这可能是因为在接菌过程中,空气中携带根瘤菌迁移于对照组,使其也受到一定影响。
3 结论与讨论
根瘤菌侵染6个品种茎瘤芥。利用荧光显微镜观察,结果显示,根瘤菌在6个品种茎瘤芥根部均有定殖,同时对6个品种茎瘤芥的生长均有促生作用;其中,“涪杂2号”根长和株高较对照差异显著,根瘤菌对茎瘤芥生长起促生作用,是其作为外源生物侵入植物体内形成联合作用,同时未表现出外观病理和防御反应,从而促进非豆科植物的生长和产量的提高[15],也可能是因为田菁茎瘤固氮根瘤菌侵入茎瘤芥根部组织中作为内生菌提高了茎瘤芥体内植物激素的有效力,植物激素调节了植物生长,对茎瘤芥的生长发育产生了明显的良好效果,表现出对接菌茎瘤芥的生长状态明显好于未接菌茎瘤芥生长状态。
将根瘤菌菌液稀释4个浓度侵染茎瘤芥“涪杂2号”,PBS缓冲液处理做平行对照。试验结果表明,1.0×108个/mL浓度处理茎瘤芥生长状态最佳,对茎瘤芥生长起到明显的促生作用;其他浓度处理下,茎瘤芥根长较对照没有明显差异或对茎瘤芥生长不具备促生作用。这表明根瘤菌适宜浓度是影响茎瘤芥生长的重要因素之一,过高浓度菌液对茎瘤芥的生长有一定的抑制作用,菌液浓度过低则对茎瘤芥的根长和株高的生长影响不明显。
近几年有研究证明,根瘤菌与非豆科植物相互作用,可以形成生态位,定义为根瘤菌的第3种生活方式,打破了人们对根瘤菌只有2种存在生活形式的认知[16]。该研究用带有GFP 标记的根瘤菌侵染茎瘤芥常用栽培品种“涪杂2号”,结果表明,根瘤菌侵染茎瘤芥3 d时可在根部组织定殖,并随时间推移,15 d时根瘤菌在茎瘤芥根部组织内数量短暂上升,并在局部形成群体密度。说明根瘤菌侵染非豆科植物茎瘤芥过程中可定殖于茎瘤芥根表皮、皮层的细胞间隙和细胞内,形成生态位。这一现象与迟峰[16]观察根瘤菌侵入非豆科植物水稻体内规律大致相似,根瘤菌侵染水稻根部组织定殖方式为“裂隙进入”,并随着时间推移根瘤菌可在茎瘤芥根部形成一定范围的群体密度。
自1983年,聂延富[17]使用植物生长素2,4-D诱导小麦根部形成根瘤,这一研究打破了根瘤菌不能与非豆科植物共生固氮的障碍,人们便试图通过人工诱导的方法促使非豆科植物与根瘤菌形成共生关系。此次试验中,选用2,4-D、氯磺隆和豆科威为试验诱导剂,依次将3种诱导剂稀释为0.5、1.0、2.5 mg/L,结果表明,使用5 mL的2.5 mg/L浓度2,4-D、氯磺隆、豆科威和根瘤菌等量使用,30 d后茎瘤芥根部均可形成根瘤,60 d后类根瘤数量明显增多,其中,60 d时2,4-D结瘤率高达93%,豆科威结瘤率为57%,氯磺隆结瘤率最低(36%),2,4-D诱导效率显著高于其他2种诱导剂。这一现象表明使用诱导剂诱导茎瘤芥根部结瘤,不仅要考虑选用不同诱导剂,还要考虑各诱导剂的浓度和剂量问题。选取5 mL的2.5 mg/L浓度2,4-D 处理下根部形成根瘤的茎瘤芥和对照组茎瘤芥幼苗清洗干净,并取培养茎瘤芥土壤进行固氮酶活性检测,结果显示,处理组和对照组有明显差异,处理组结瘤根部和培养土固氮酶活性均高于对照组。说明根瘤菌不仅可以作用于豆科植物,使其在根部形成特殊固氮结构根瘤,还可定殖于非豆科植物茎瘤芥根部组织中,通过荧光显微镜检测到根瘤中也有根瘤菌定殖,并利用人工诱导的方法诱导非豆科植物根部形成固氮结构根瘤,形成根瘤的幼苗及培养土较对照也具有较高的固氮酶活性。
参考文献
[1] 蔡兆明,程春红,廖静静,等.茎瘤芥异戊烯基转移酶家族基因全基因组鉴定及表达分析[J].西北植物学报,2022,42(1):38-47.
[2] 徐茜,肖波,杨梅,等.生物炭有机肥对榨菜主要性状·产量和品质的影响及效益分析[J].安徽农业科学,2021,49(18):164-167.
[3] 韦革宏,马占强.根瘤菌-豆科植物共生体系在重金属污染环境修复中的地位、应用及潜力[J].微生物学报,2010,50(11):1421-1430.
[4] 陈廷伟,SIEGFRIED SCHERER,PETER BGER.固氮根瘤菌(Azorhizoboium)在人工诱发小麦类根瘤中的固氮作用[J].中国科学(B 辑),1992,22(7):712-716.
[5] 姜南.茎瘤固氮根瘤菌(Azorhizobium caulinodans ORS571)可溶性趋化受体的功能研究[D].烟台:中国科学院烟台海岸带研究所,2016.
[6] 谢应先,陈廷伟,陈婉华,等.固氮根瘤菌的生理特性及对非豆科作物的拌种效果[J].土壤肥料,1995(6):12-16.
[7] 张晓霞,王平,冯新梅,等.外源基因标记的紫云英根瘤菌在水稻根部的定殖研究[J].生态学报,2003,23(4):771-776.
[8] 王平,王勤,冯新梅.华癸根瘤菌在非豆科植物根圈定殖能力的研究[J].华中农业大学学报,1999,18(3):238-241.
[9] 刘思俭,曾淑芳,揭振英,等.植物生长刺激素对细基江篱生长的影响[J].湛江水产学院学报,1989,9(Z1):105-109.
[10] 李剑卓.雄激素受体细胞质膜转移机制及其功能的研究[D].长春:吉林大学,2018.
[11] 林红,程井辰.植物激素对几种禾本科植物外植体的胚胎发生及形态发生途径的影响(简报)[J].植物生理学通讯,1991,27(2):117-119.
[12] 陈廷伟,谢应先,陈婉华,等.非豆科作物共生固氮的研究(Ⅰ):根瘤菌导入非豆科作物结瘤共生[J].自然杂志,1988,11(3):163-167.
[13] 黄隆广.浅谈植物的根瘤[J].植物生理学通讯,1983,19(1):10-14.
[14] 雷娜.大白菜根肿病的防治技术探析[J].农业技术与装备,2019(2):16-17,20.
[15] DAZZO F B,YANNI Y G,RIZK R,et al.Progress in multinational collaborative studies on the beneficial association between Rhizobium leguminosarum bv.trifolii and rice[M].Los Banos,the Philippines:IRRI,2000.
[16] 迟峰.根瘤菌在植物内的迁移运动及其与植物相互作用的蛋白质组学研究[D].北京:中国科学院研究生院(植物研究所),2006.
[17] 聂延富.关于诱导无根瘤植物结根瘤的研究:化学因子2,4-D诱导根瘤菌在小麦上结根瘤[J].自然杂志,1983,6(5):326-336.

