广西规模水禽养殖场鸭疫里默氏杆菌的分离鉴定与耐药性分析
陈晓玉 谭奕舟 莫智杰 胡静 李军 李常挺 白慧丽 王乐平 马春霞 尹杨燕 彭昊 廖玉英


摘要:为了解广西地区规模化水禽养殖场鸭疫里默氏杆菌(Riemerella anatipestifer,RA)的流行血清型、耐药情况及遗传关系,从广西南宁、贵港等地规模化水禽养殖场中临床上疑似感染RA的病死鸭、鹅体内得到5株分离菌,对分离菌进行鉴定,检测其毒力基因,通过多重PCR检测方法鉴定血清型,并对其进行耐药性分析。经试验得到鉴定结果,RA分离菌株在血琼脂培养基上呈平滑圆润、露滴样,圆形隆起的灰白色菌落;革兰氏染色呈阴性短杆菌;5株分离菌经16S rRNA 鉴定均为RA,将其命名为2022NNRA01~2022NNRA05;其中,血清鉴定2022NNRA01为血清1型,其余均为血清2型。药敏试验结果显示,5株RA对青霉素、氨苄西林、阿莫西林、头孢氨苄、头孢噻呋、大观霉素、氟苯尼考、磺氨甲[XCZ1.tif,JZ]唑敏感,对其他抗菌药物呈不同程度的耐药。其中,对安普霉素、庆大霉素、卡那霉素氨基糖苷类药物,四环素类药物多西环素和利福霉素类药物利福平的耐药率为100%。本试验经分离鉴定成功得到5株RA,且其耐药性分析结果可为广西地区RA疾病的疫苗免疫预防选择以及药物治疗提供依据。
关键词:鸭疫里默氏杆菌;分离鉴定;血清型;毒力因子;耐药性;广西
中图分类号:S852.6文献标志码:A
文章编号:1002-1302(2024)09-0213-06
鸭疫里默氏杆菌病又称鸭传染性浆膜炎,是一种由鸭疫里默氏杆菌(Riemerella anatipestifer,RA)引起的败血症急性病,病鸭易患纤维性心包炎、脑膜炎、肝周炎和肺泡炎[1]。该病在世界范围内广泛流行,主要侵害1~8周龄的雏鸭,除此之外还可感染鹅、火鸡等家禽,且感染后发病率和死亡率极高,是一种对水禽业造成严重危害的细菌传染病[2]。
目前,RA病菌主要研究集中于鸭源,但近年来随着养鹅业的发展,RA的流行情况在鹅群中也有上升趋势[2-4]。水禽养殖业在广西养殖业中所占比例不可忽视,广西地区常见的水禽病有RA、大肠杆菌病、禽流感、病毒性肝炎等,其中RA的发病率在逐渐上升,影响了广西地区的鸭鹅养殖业乃至整个水禽业的经济效益,且大部分的调查研究均停留在临床病例报告,未系统地进行分子流行病学研究[5],目前广西地区鸭疫里默氏杆菌病例的流行情况报道甚少,特别是鹅源RA病株;为填补该地区RA病流行病学数据的欠缺,完善我国RA病整体防控方案,本研究对广西地区部分水禽养殖场流行的RA分离菌进行分离鉴定,并采用血清1型、2型和11型RA多重PCR鉴定方法[6]鉴定分离菌的血清型,对其耐药性及遗传关系进行研究,为当地开展针对性的疫苗免疫及临床用药选择提供参考依据。
1 材料与方法
1.1 材料
1.1.1 病料样本
病料样品来源于2021—2022年广西壮族自治区南宁市、贵港市规模化水禽养殖场。病禽咳嗽、体型瘦小、精神状态差、不愿走动、毛色无光泽,解剖病死鸭鹅有较严重的包肝、包心;采集病死鸭鹅的脑、肝和心等组织,收集的组织样本共28份(表1),于-80 ℃冰箱保存备用。
1.1.2 主要试剂与仪器
本试验所用试剂与仪器的主要信息见表2、表3。
1.1.3 引物合成
多重PCR鉴定鸭疫里默氏杆菌血清型引物参考专利[6]合成,引物信息见表4;鸭疫里默氏杆菌毒力基因鉴定引物信息见表5,均由金唯智生物科技有限公司合成。
1.2 方法
1.2.1 病原菌分离与培养
无菌环境中,采集病死鸭鹅的脑、内脏组织,将其接种于鲜血琼脂培养基,再将其放置于厌氧罐中, 37 ℃恒温培养 24~36 h,观察培养病原菌的形态特征,挑取符合要求的单菌落进行培养。
1.2.2 形态鉴定
挑取纯化后的单个待检菌落,按革兰氏染色操作说明书进行染色,于光学显微镜下观察,鉴定其形态特征。
1.2.3 16S rRNA分子生物学鉴定
取纯化的细菌培养液12 000 r/min 离心1 min,去上清液后提取RA病菌的基因组DNA。通用引物序列(表4)进行PCR扩增,PCR反应体系50 μL(表6),PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,52 ℃ 30 s退火,72 ℃ 30 s,34个循环;72 ℃延伸10 min,扩增结果大小为1 450 bp。
将阳性产物送至生工生物工程(上海)有限公司进行测序后得到测序结果,在NCBI[BLAST:Basic Local Alignment Search Tool (nih.gov)]上进行比对分析,根据序列间同源性差异,采用MEGAX软件构建遗传进化树,分析并确定分离菌株的类别。
1.2.4 血清型鉴定
参照文献[6],通过多重PCR检测方法鉴定血清型,特异性扩增RA血清1型、2型和11型引物,所用引物信息见表4,实现对RA血清1型、2型和11型的鉴定。PCR反应体系见表6。PCR反应条件:95 ℃ 5min;95 ℃ 30 s,57.9 ℃ 30 s退火,72 ℃ 60 s,35个循环;72 ℃延伸10 min[6]。
1.2.5 毒力基因检测
参照试剂盒说明书提取RA病菌的基因组DNA,PCR扩增RA毒力基因OmpA、CAMP、wza、AS87_04050、Fur、SIP、TbdR1和luxE,所用引物信息见表5。
1.2.6 细菌药敏试验
采用K-B纸片法对5株菌株进行抗生素药物的敏感试验。无菌操作下,将RA均匀涂布于血琼脂平板上,贴上药敏纸片;置于厌氧罐中,37 ℃培养24 h后,测量抑菌圈直径。根据抑菌圈直径判断RA对各种药物的敏感度,参照美国临床实验室标准化委员会抗微生物药物敏感试验标准。
2 结果与分析
2.1 病原菌分离培养
由图1可知,从多个规模水禽养殖场病死鸭、鹅组织样本上分离得到5株菌株;5株菌株均在鲜血琼脂平板上形成平滑圆润、露滴样的圆形隆起灰白色菌落。
2.2 鉴定结果
2.2.1 形态鉴定
由图2可知,对5株分离的RA进行革兰氏染色,镜检为阴性,单个或成双排列,形态多为短杆状,少数呈椭圆形状。
2.2.2 16S rRNA分子生物学鉴定
由图3可知,5株分离的RA菌株PCR扩增后,获得大小约1 450 bp目的条带,得到5株RA的基因序列,与NCBI上20株RA参考株进行比对,相似性≥98%。由图4可知,2022NNRA01、2022NNRA02、2022NNRA04、2022NNRA05处于同一分支,亲缘性较高,而2022NNRA03和云南分离株RA-1亲缘关系较近。
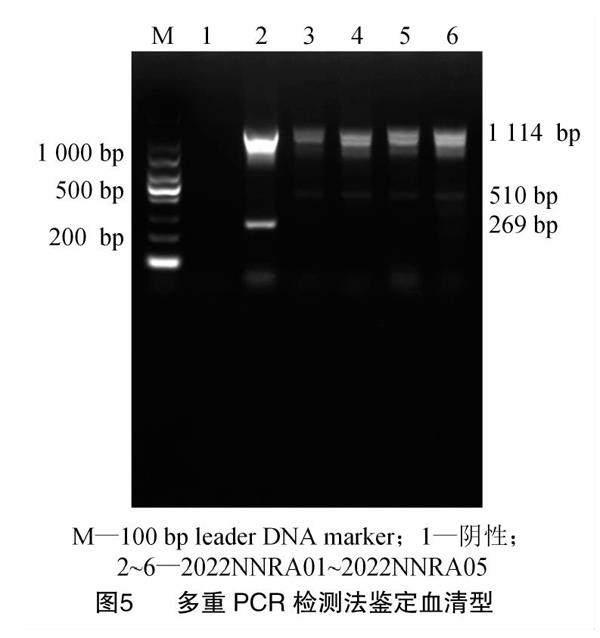
2.3 血清型鉴定
经特异性多重PCR方法鉴定5株鸭疫里默氏杆菌分离株得到结果,由图5可知,电泳图样本中有1 114 bp特异性鉴定条带和269 bp条带, 则为血清1型RA;有1 114 bp特异性鉴定条带和671 bp条带,则为血清2型RA;有1 114 bp特异性鉴定条带和510 bp条带,则为血清11型RA[6]。
血清鉴定结果表明,2022NNRA01为血清1型,2022NNRA02、2022NNRA03、2022NNRA04、2022NNRA05为血清11型。其中,血清1型占比20%,血清11型占比80%。
2.4 毒力基因检测
由图6可知,5株分离菌经过PCR扩增毒力基因特异性片段,2022NNRA01~2022NNRA05均含毒力基因OmpA(663 bp)、wza(939 bp)、luxE(999 bp),5株分离菌均未扩增出AS87_04050毒力基因条带,2022NNRA02、2022NNRA03、2022NNRA04未扩增出CAMP、Fur、SIP、TbdR1毒力基因条带。
2.5 药敏试验
由表7可知,本试验分离得到的5株RA对青霉素、氨苄西林、阿莫西林、头孢氨苄、头孢噻呋、大观霉素、氟苯尼考和磺氨甲[XCZ1.tif;%120%120,JZ]唑8种抗菌药物敏感,对其他7种抗菌药物呈不同程度的耐药。其中,对安普霉素、庆大霉素、卡那霉素氨基糖苷类药物,环丙沙星、恩诺沙星喹诺酮类药物,四环素类药物多西环素和利福霉素类药物利福平均表现出高度耐药。
3 讨论
本研究分离得到的5株RA中,1株分离自病死鹅,RA是当前危害养鹅业的重要传染病之一,雏鹅感染后发病率极高,病死率在10%~40%,最高可达90%[7],10周龄时仍能感染发病,种鹅和成年鹅不易感染。本研究收集不同水禽养殖场发病鸭、鹅的病料,发病雏鹅生活环境较差,雏鹅群在舍内平地圈养,保温设施少、通风差、氨气重,雏鹅群于约15日龄出现发病死亡的严重情况,养鹅场应当密切关注并重视RA病菌的预防,改善鹅场的饲养条件,加强鹅场通风和保湿,在鹅的免疫计划中也应考虑到对RA病菌的免疫。
5株菌均从病样的脑部分离得到,有研究发现病禽感染鸭疫里默氏杆菌后,脑组织神经细胞变大,这与脑部神经细胞受损有关[8]。通过分析分离菌的遗传进化关系发现, 分离自南宁地区的4株鸭疫里默氏杆菌之间的亲缘关系最近,贵港分离株2022NNRA03和同处于西南地区的云南分离株RA-1亲缘关系较近,说明病菌的流行可能和种鸭种鹅的贸易、运输有关,因此该病的检疫工作应引起重视;2022NNRA01与2022NNRA05亲缘关系较近,但分别来自于鸭源和鹅源,可能存在鸭、鹅混合感染的情况,因此鹅养殖地要远离鸭舍、鸡舍,避免鸡、鸭、鹅混养。长期以来在养殖生产中,针对RA病菌是采用疫苗免疫预防、药物治疗相结合的方法进行防控,而效果并不理想。一方面,RA病菌在自然界血清型众多,至少拥有21个血清型,且不同血清型间无交叉免疫保护作用[9];另一方面,当前市面上销售的灭活疫苗并未覆盖所有血清型,这使得疫苗的免疫作用受到限制。
目前,鸭疫里氏杆菌在全国范围内流行,其中广东地区RA以1型为优势血清型,2、3、4、8、10、15也均有流行[10-12];贵州省养鸭业的重点养殖基地三穗地区以2型为主要流行血清型,11型也有流行[13-14];福建省血清型为2型和11型所占比例最高[15]。血清1、2、10、11型在广西桂林地区均有流行,以1型最为多发,百色市分离菌株血清型全为1型[16-17]。本研究采用血清1型、2型和11型RA病菌多重PCR鉴定[6],5株分离株以血清11型所占比例最高。该方法实现对RA病菌血清1型、2型和11型的精确、简便、稳定、高特异和高灵敏性检测,和常规鉴定方法不同,此检测方法降低了劳动成本,成本相对较低,前景好。分析以往广西地区所报道的RA病菌的流行情况,血清型11型可能在南宁的流行趋势相较往年有所上升,该调查有助于了解该地区RA的优势血清型,为进一步选择相应的疫苗提供依据。
RA病菌的致病机理研究发展十分缓慢,本试验中的5株分离菌均含毒力基因OmpA、wza、luxE,但均不含AS87_04050。膜蛋白是革兰氏阴性菌外膜的重要组成部分,参与物质跨膜运输、传导信号、合成能量物质等生命过程[18]。本试验证明,5株基因的表达情况影响RA的感染能力,从而影响宿主对入侵细菌的免疫情况。OmpA为外膜蛋白的主要蛋白,Hu等通过试验评价RA病菌OmpA缺失株Th4ΔOmpA的毒力,结果显示,Th4ΔOmpA的黏附、侵袭能力及对雏禽的致病性明显减弱,证明OmpA参与RA的黏附过程,OmpA基因缺失株Th4ΔOmpA对10日龄樱桃谷鸭致病力大幅度减少,是一种重要的毒力因子[19]。袁彪研究发现,wza基因与荚膜的形成有关,wza基因的缺失导致鸭疫里默氏杆菌生物膜形成能力增加以及表面疏水性升高,RA CH-1Δwza毒力约下降421倍[20]。岳嘉蘋研究发现,luxE基因缺失株Yb2ΔluxE对Vero细胞的黏附侵袭能力均较亲本株显著降低,进而导致细菌的入侵力减弱,该基因缺失后导致鸭疫里默氏杆菌脂蛋白酰化缺陷,致病力相较野生株Yb2显著下降[21]。在本试验5株分离株的检测中,均未出现AS87_04050基因的目的条带;AS87_04050基因与细菌脂多糖的合成和致病性有关,王小兰通过转座子插入诱变技术构建AS87_04050基因缺失株RA2640,研究发现基因缺失株RA2640合成细菌脂多糖受阻,进而感染过程受阻,且毒力下降10万倍以上[22]。
另外,由于在饲养和临床治疗中长期连续使用或不规范使用抗生素,导致RA的耐药谱越来越广。研究表明,不同地区分离的RA病菌对抗生素的敏感程度不同[23]。本研究调查采样的养殖场常使用安普霉素、庆大霉素、卡那霉素、四环素、磺胺嘧啶等药物,药敏试验结果显示,5株RA分离菌多重耐药,对临床常见抗菌素均呈不同程度的耐药性,其中,对上述常见抗生素的耐药率为100%。因此,在临床上选择药物治疗时,应当先检测病菌对抗生素敏感性,为广西药物RA疾病治疗提供试验依据,合理使用抗生素,尽最大可能避免药物的不当使用,控制鸭疫里默氏杆菌出现多重耐药性的发展态势。
4 结论
本研究从广西壮族自治区部分地区的几个规模水禽养殖场中多羽具有典型临床症状的病死鸭、鹅脑组织上分离得到5株鸭疫里默氏杆菌,经分离纯化后通过菌落形态鉴定及分子生物学鉴定,确定5株分离菌均为鸭疫里默氏杆菌,说明该菌在广西地区鸭群、鹅群中有流行的趋势。其中,4株为血清11型,1株为血清1型。药敏试验结果表明,5株鸭疫里默氏杆菌均出现多重耐药性,但对青霉素类药物青霉素、氨苄西林、阿莫西林,头孢菌素类药物头孢氨苄、头孢噻呋和酰氨醇类药物氟苯尼考及氨基糖苷类药物大观霉素敏感。本研究结果可为广西地区RA疾病的疫苗免疫预防的选择、药物治疗提供依据。
参考文献:
[1]王书峰,邱 伟. 鹅鸭疫里默氏杆菌病的流行病学、临床特点、实验室诊断与防控[J]. 现代畜牧科技,2019(12):125-126.
[2]董洪燕,张 燕,王彦红,等. 江苏地区10株鹅源鸭疫里默氏杆菌的耐药性及致病性特征分析[J]. 微生物学通报,2021,48(12):4756-4764.
[3]杨永胜,陈 研,薛亚飞,等. 4株鹅源鸭疫里默氏杆菌生物学特性分析[J]. 中国动物传染病学报,2020,28(5):62-66.
[4]彭 凌,杨旭夫,朱必凤,等. 粤西地区两株鹅源鸭疫里氏杆菌的分离鉴定[J]. 中国兽医科学,2015,45(5):463-468
[5]周英宁,郝 洁,韦英益,等. 广西地区鸭疫里默氏杆菌的分离鉴定与药敏试验分析[J]. 当代畜牧,2018(33):35-39.
[6]朱德康,杨志双,程安春,等. 血清1型、2型和11型鸭疫里默氏菌的PCR鉴定引物、试剂盒及多重PCR鉴定方法:CN110846425A[P]. 2020-02-28.
[7]胡晓苗,戴 银,沈学怀,等. 鹅源鸭疫里默菌的分离鉴定与药敏试验[J]. 中国兽医杂志,2015,51(12):48-49.
[8]Zhu T F,Chen F F,Li J C. A strain of pathogenic Bacillus subtilis results in brain damage in ducklings when co-infected with Riemerella anatipestifer[J]. Polish Journal of Veterinary Sciences,2017,20(4):803-809.
[9]Pathanasophon P,Phuektes P,Tanticharoenyos T,et al. A potential new serotype of Riemerella anatipestifer isolated from ducks in Thailand[J]. Avian Pathology,2002,31(3):267-270.
[10]张济培,张小峰,陈建红,等. 珠三角及邻地鸭疫里默氏杆菌主要生物学特性的研究[J]. 中国预防兽医学报,2012,34(2):100-103.
[11]任晓梅,王小兰,韩文龙,等. 鸭疫里默氏杆菌的分离鉴定与生物学特性研究[J]. 中国动物传染病学报,2018,26(4):47-51.
[12]吴彩艳,廖申权,戚南山,等. 广东省鸭疫里默氏杆菌流行病学监测及遗传进化关系[J]. 华南农业大学学报,2022,43(2):1-10.
[13]陈国权,吴征卓,姚碧琼,等. 鸭疫里默氏杆菌贵州流行株的分离鉴定及耐药性分析[J]. 中国兽医科学,2020,50(6):731-739.
[14]吴征卓,陈国权,姚碧琼,等. 贵州省三穗县鸭疫里默氏杆菌的分离鉴定、毒力基因检测及耐药性分析[J]. 中国畜牧兽医,2021,48(11):4274-4283.
[15]程龙飞,陈红梅,施少华,等. 鸭疫里默氏菌的血清型及药物敏感性分析[J]. 中国动物传染病学报,2013,21(4):23-28.
[16]阳艳洁,蒋福信,王 星,等. 桂林市鸭疫里默氏杆菌的血清型鉴定及耐药性研究[J]. 养禽与禽病防治,2011(11):2-4.
[17]言天久,潘 懿,韦 平,等. 鸭疫里默氏杆菌病病原分离、血清型鉴定及病例防治报告[J]. 中国畜牧兽医,2007,34(12):99-100.
[18]Samsudin F,Ortiz-Suarez M L,Piggot T J,et al. OmpA:a flexible clamp for bacterial cell wall attachment[J]. Structure,2016,24(12):2227-2235.
[19]Hu Q H,Zhu Y Y,Tu J,et al. Identification of the genes involved in Riemerella anatipestifer biofilm formation by random transposon mutagenesis[J]. PLoS One,2012,7(6):e39805.
[20]袁 彪. 鸭疫里默氏菌荚膜多糖输出外膜蛋白wza基因缺失株的构建及功能研究[D]. 成都:四川农业大学,2015:36.
[21]岳嘉蘋. 鸭疫里默氏杆菌毒力相关基因突变株的构建及其生物学特性研究[D]. 北京:中国农业科学院,2014.
[22]王小兰. 鸭疫里默氏杆菌毒力基因的鉴定及功能分析[D]. 北京:中国农业科学院,2015:66.
[23]朱元军,杨德鸿,麦凯杰,等. 浙、闽、粤地区鸭疫里默氏杆菌分离鉴定与药敏实验[J]. 江西畜牧兽医杂志,2019(2):45-47.
收稿日期:2023-07-11
基金项目:广西重点研发计划(编号:AB21238003、AB21220005-4);国家水禽产业技术体系建设专项(编号:CARS-42);广西兽医研究所基本科研业务费(编号:桂科专项22-6、桂科专项23-5);广西农业农村厅科技项目(编号:Z202218、Z202219);广西南宁市良庆区重大科技专项(编号:202118);广西防城港市重点研发计划(编号:AB21014016、AB20014028);广西桂林市重点研发计划(编号:20220136-5);广西南宁市武鸣区重点研发计划(编号:20210102);广西南宁市江南区重点研发计划(编号:20220620-2);广西南宁市青秀区重点研发计划(编号:2022004)。
作者简介:陈晓玉(2000—),女,黑龙江宾县人,硕士研究生,主要从事兽医药理病理研究。E-mail:cxy13766902977@163.com。
通信作者:彭 昊,博士,高级兽医师,主要从事动物疫病防控与病原分子生物学研究,E-mail:hpeng2006@163.com;廖玉英,研究员,主要从事畜禽生态养殖研究,E-mail:315951610@qq.com。

