广西灰窑田史前遗址人类髌骨的形态变异
叶梓琪 何安益 梁优 李法军
摘要:距今约7000~6000 年的广西灰窑田遗址是顶蛳山文化的重要遗址之一,其所出人类遗骸为探讨岭南地区史前时期渔猎- 采集型人群的肢体活动方式、活动强度以及两性劳动分工等问题提供了重要的研究样本。髌骨作为膝关节的重要组成,其形态变异特征在一定程度上可以反应个体膝关节的活动程度与特点。本文采用三维几何形态测量方法对该遗址出土的43 例人类髌骨进行分析,从侧别对称性、性别二态性以及年龄差异性等三个方面考察了髌骨的大小和形态差异。研究结果表明,该遗址古人类髌骨发育存在明显的左侧优势,髌尖呈右偏趋势。男性髌骨尺寸较大,但两性髌骨形态未见显著差异。该遗址个体髌骨形态随年龄增长呈现出与股四头肌力量增强、屈伸运动强度与频率增加相关的变化特征。
关键词:广西;史前人类;灰窑田遗址;髌骨;形态学;几何形态测量
1 引言
灰窑田遗址位于广西南宁青秀区三岸园艺场南部的邕江左岸一级阶地上,为一处史前时期河岸贝丘遗址。1977 年以来,考古工作者对该遗址进行了数次调查。2006 年和2016 年,广西文物保护与考古研究所联合南宁市博物馆对该遗址进行了考古试掘与抢救性发掘,发现了较为丰富的考古文化遗存[1-3]。2006 年度的发掘揭露墓葬50 余座,葬式包括仰身屈肢葬、俯身屈肢葬、侧身屈肢葬、蹲踞葬和肢解葬[3,4]。2016 年度发掘揭露墓葬109 座,墓葬分布范围较大,但主要集中于台地南部边缘,呈东西向带状,葬式与2006 年度所发现的一致。该遗址内陶器发现较少,均为夹砂陶,表面饰绳纹,可辨认出罐与釜类器物。蚌器较多,包含鱼头形蚌刀、蚌铲、蚌匕。骨、牙器较少,有鱼钩、骨锥、骨镞等。石器多见磨制石斧及石锛。也见有大量动物遗骸,包括螺、蚌、鳖、鱼、鹿等,尤其多淡水螺壳。根据发掘中采集的两例碳化植物种子与一例人牙样本,利用加速器质谱分析测定其绝对年代为公元前7000~ 公元前6300 年[5]。结合该遗址文化遗存与绝对年代来看,其属于顶蛳山文化,大致相当于顶蛳山遗址第三期或略晚,距今约7000~6000 年[2,4]。
灰窑田遗址所在的岭南地区处于东北亚与东南亚交汇地带,其史前时期的生业、生产方式均有着独特的地方传统与发展进程,该地区古人类生业方式转变过程以及社会复杂化进程一直是岭南考古的重要论题[6,7]。得益于考古工作的深入开展与技术进步,岭南地区出土了越来越丰富的人骨遗存,为我们探索史前人类不同生业方式下的行为模式重建提供了更多珍贵的样本。近年来,已有学者基于肢骨的骨骼生物力学方法对广西顶蛳山遗址、冲塘遗址、何村遗址、江边遗址以及广东鲤鱼墩遗址古人类行为活动进行了研究[8-10],认为岭南地区史前时期人类肢体运动总体存在显著的性别二态性与较高的活动强度的特点,但各时期人群间存在着活动行为上的差异。然而,探讨古人类肢骨形态变异及运动模式不仅要依赖长骨的研究,还需进行上、下肢各关节区域的形态变化和生物力学分析[11-13]。就下肢而言,以往有关膝关节功能的研究常以股骨远端与胫骨近端的形态分析为主[14-16],而作为膝关节区域的重要组成部分,髌骨较少受到关注。
骨骼功能压力适应理论(Bone functional adaptation)认为,人体在持续接受一定的应力后,相应骨骼会被刺激而建构或重建(即“应变”),导致骨组织物理意义上的形变[17,18]。这一过程会在个体日常行为中不断反馈循环,骨组织不断调整“应变”以维持骨骼肌肉功能的“最佳习惯水平”(Optimum customary level)[17]。髌骨位于整个下肢解剖学结构的中心,股四头肌群在股骨远端合并为一条肌腱,附着于髌底并包裹整个髌骨,继而向下形成髌腱伸入胫骨粗隆处。这一垂直的链条持续地在膝关节屈伸运动中发挥驱动作用[19]。由于髌骨形态受股四头肌、髌韧带以及内、外侧支持带等软组织不同方向“应力”的直接影响,同时屈伸过程中髌股关节面也会频繁接触,因此髌骨形态的变异特征可能会在一定程度上反映某个体相关肌肉与韧带的发育情况以及下肢运动中力的偏向。
虽有学者对东亚地区群体间与人群内部髌骨的发育进行过比较研究[20-23],在髌骨线性测量与形态分类方面也提出了相关标准[24-25],但髌骨自身形态变异以及与相邻长骨的关系研究还相对缺乏。目前,相较于现代人群的髌骨研究而言,有关中国古代人群髌骨研究的相关文献更为罕见。古代不同时期、不同生业方式人群髌骨的形态学变异、两性差异等问题仍需要进行数据积累和系统分析。另一方面,作为人体内最大的籽骨,髌骨在考古遗址中不仅多见,也便于单独采集。因此,本文拟使用三维几何形态测量学方法,对灰窑田遗址古人类髌骨进行测量与可视化分析,以便认识该遗址古人类髌骨形态特点及其群体内部差异,从而为探讨灰窑田遗址古人类的下肢运动方式、强度等特点做基础性的探索工作。
2 材料与方法
2.1 样本
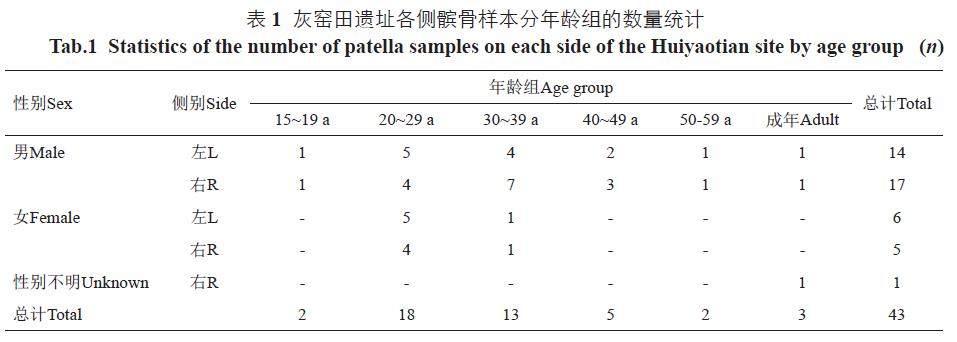
样本来自灰窑田遗址2016 年度发掘出土的人类髌骨,现存于中山大学人类进化与科技考古广东省文科重点实验室。可用于研究的个体数为33 例,髌骨样本共43 例(其中单侧样本23 例,成对样本20 例)。根据骨骼形态及相关参数进行性别和年龄鉴定[26,27]。因样本个体年龄分布较为离散,按十岁划分年龄组,共分为5 组,并将判定为“成年”的个体归为成年组(表1)。男性组中单侧样本15 例,成对样本8 对(16 例),共计31 例;女性组中单侧样本7 例,成对样本2 对(4 例),共计11 例;性别不明组仅1 例右侧样本。
2.2 三维数据采集
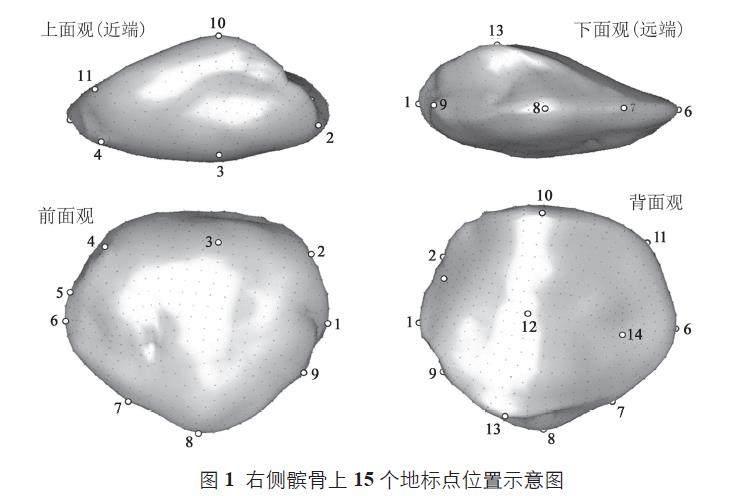
地标点均为Bookstein 所定义的I、II 类点,即组织结构交汇点或生物体表面具有独特性的特殊点以及形变结构曲率最大点[28]。此类地标点在不同个体中同源,能够在尽可能简化的同时有效反映表观的形状变化。参考Rosas 等人提出的髌骨三维地标点设置标准[29],并基于本文样本情况和可视化要求确定了15 个地标点(图1)。通过观察、触摸髌骨上的相应位置并用铅笔进行标记。使用经改进的描骨器对样本进行水平固定夹持,髌面朝下,髌底朝向观察者,以此保证其最大程度的稳定且易于触及所有地标点。使用手持式MicroScribe? G2X 测量臂依序进行三维坐标获取,并通过MicroScribe? Utility 软件导出坐标数据至Microsoft? Excel。
参考Menéndez 等的方法进行观察者内部测量误差检验[30,31],在三个周期内由同一人独立对所有样本进行6 次三维坐标获取。使用R 语言包geomorph[32] 对6 次重复测量数据进行广义普氏分析叠合,然后提取即样本间普氏距离、个体质心大小、描述个体形状变异的前9 个主成分(累计贡献率为80.72%)等三个数据集,分别进行方差分析及可靠性测试。结果显示,各数据集多次测量间方差分析显著性均高于0.5(分别为0.54、0.96、0.55),不存在显著的统计学差异且有较高相似性;组内相关系数均高于0.78(分别为0.782、0.974、0.836),显示出较高的相关性与可重复性。由此证明,实验流程与地标点方案的系统误差与随机误差均属于可接受范围。
2.3 几何形态及统计分析
为保证坐标叠合运算过程的有效性(即地标点同源性),首先使用R 语言包Morpho中的Mirror 指令[33] 将样本量较少的全部左侧髌骨样本坐标进行轴对称镜像处理,但后续分析中仍保持其左侧属性。随后,使用geomorph 对收集的所有坐标数据进行广义普氏分析(简称“广普分析”),通过平移、缩放、旋转等方式对各地标点坐标进行叠加,所有个案被转换到共同原点,缩放至单位质心大小,以达到坐标间距离平方和最小状态,由此消除所有原始标志坐标点的非形态差异。随后使用geomorph 对分析处理后的各组三维坐标数据进行主成分分析(Principal Component Analysis, PCA)并使用Morpho 中getMeaningfulPCs 指令检验其中有意义的主成分。为进一步检验年龄、性别或侧别等不同分组的个体髌骨几何形态变异特异性,使用Morpho 中groupPCA 指令执行基于分组均值协方差矩阵的组间主成分分析。使用MorphoJ[34] 对各分组进行普氏方差分析(ProcrustesAV Analysis),以对比各个组内部髌骨形状变化程度的主要影响因素。
由于广普分析过程中将大小与形状变异进行了区分度量,因此为了解灰窑田遗址古人类髌骨尺寸与形状变异之间的关联,拟合回归直线进行可视化分析。其中自变量表示为质心大小的对数,因变量表示为形状变量对质心大小对数的二元回归系数向量(共同异速生长成分分值),由此可检验尺寸与形状变异间的关联显著性并分别拟合出两侧髌骨形态关联的回归直线,以此代表单位质心大小下形态变异情况与程度差异[35-37]。使用geomorph 和Morpho 完成髌骨三维形态的可视化制图,包括主成分轴上极值形状,组内平均形状等,其余统计分析均通过R 语言完成。
3 结果
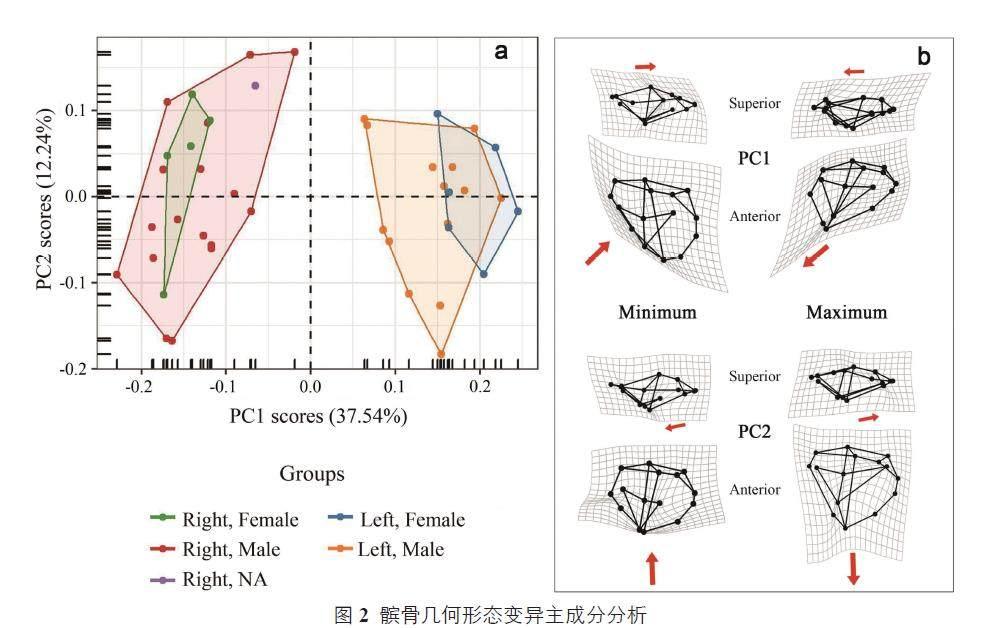
对43 个髌骨样本标志点数据集进行广义普氏分析,得到对应43 个(组)质心尺寸值(Shapiro-Wilk 检验W=0.99, p=0.92;数据呈正态分布)与分析后坐标数据集。对分析后坐标数据集进行主成分分析,结合Cattell 碎石检验及Morpho 最优主成分检验(getMeaningfulPCs),提取主成分分析中前2 个成分(累计贡献率为49.78%)进行解析并可视化形状变异情况(图2)。由图2 可见,各维度地标点坐标的变化具体反映为髌尖的长度与偏侧、髌底厚度与倾斜度以及内外侧面积比例等方面的形状变异。其中前2 个主成分中仅左右体侧的几何形状差异明显,主要反映在PC1 内(累计贡献率为37.54%),两性以及各年龄段形状差异不显著。因此下文进一步使用组间主成分分析,即计算各分组均值的协方差矩阵,并将所有观测值投影至该协方差矩阵的特征空间中,可视化各分组间的形状变异特征。此外,结合质心尺寸数据比较髌骨样本的组间大小差异。
3.1 双侧不对称性
选取遗址中属于10 个个体的20 例成对髌骨,参考Klingenberg 等人的方法使用个体、侧别以及个体与侧别的交叉效应三个变量进行方差分析,来量化成对髌骨的波动不对称性与方向不对称性[38]。其中,波动不对称(fluctuating asymmetry)指个体的不对称性值较总体不对称性均值的偏差,即个体与侧别的交叉效应,记为indi×side。方向不对称(directional asymmetry)即侧别不对称。成对髌骨质心尺寸值呈正态分布(Shapiro-Wilk检验W=0.93; p=0.18),表2 为质心尺寸的方差分析与几何形状的普氏方差分析结果。在个体尺寸(表示为质心尺寸)方面,个体差异(Sm=30.17; R2=0.86)是影响髌骨尺寸的主因。侧别差异(Sm=24.42; R2=0.08)影响尽管略小,但也存在显著的方向不对称性。而相对较小的波动不对称性(Sm=2.249, R2=0.06)反映出不对称中个体差异的贡献较小。对不同性别、年龄组内成对样本尺寸的对称性进行了配对t 检验,显示整体上存在显著的尺寸侧别差异,其中两性内部以及20~29 岁组内呈现出显著的尺寸不对称。
在形状差异方面,普氏方差分析结果显示配对样本中影响髌骨形状变化的主要为侧别差异(Sm=0.40; R2=0.32),即存在显著的方向不对称性。个体差异(Sm=0.07; R2=0.48)也是影响个体形状的主要因素,波动不对称性(Sm=0.03; R2=0.19)的影响则较小(表2)。利用各样本相对于平均形状的普氏距离值(Shapiro-Wilk 检验W=0.97; p=0.74,数据呈正态分布)对各分组内成对样本的形状变异程度进行配对t 检验,未见不同年龄段或性别组内部的形状变异程度差异(表3)。除个体M6-2 外,其余个体均为左侧髌骨尺寸较大,可见灰窑田人群髌骨存在一定的左侧发育优势。髌骨两侧尺寸与形状变异的线性回归检验显示,灰窑田遗址古人类的髌骨尺寸越大,形状特征呈现整体变宽,髌底增陡,股外侧肌斜肌附着区扩大,内侧关节面增大、髌下部变薄的趋势,左侧髌骨的形状变异速率明显较右侧高。对全部样本的主成分分析以及对应主成分极值的薄片样条(TPS)可视化,可见方向不对称性体现于PC1,主要影响来自于点6-7-8-9-1 代表的髌面下部,即髌韧带附着区(图2)。成对样本以及全样本的主成分分析结果均显示,左侧髌骨几何形状呈现髌尖及下部倾向内偏的特征,而右侧髌骨则倾向外偏。
3.2 两性差异
在髌骨质心尺寸均值方面,男性为65.60(n=31; σ=5.36),女性为59.62(n=11;σ=4.86)。对呈正态分布的两性质心尺寸进行独立样本t 检验,结果显示灰窑田遗址两性髌骨质心尺寸有显著的差异(p=0.003),男性髌骨整体尺寸较大;但普氏方差分析(p=0.46)显示形状上没有明显差异。对两性分组进行组间主成分分析,bgPC1 解释了原始方差的58.26%,两性形状差异主要表现为整体厚度、髌底斜率、内侧关节面比例以及股外侧肌斜肌附着区大小的变化。总体而言,基于上述统计学分析以及两性髌骨三维平均形状对比,灰窑田遗址古人类髌骨两性尺寸差异显著但形状差异较小。具体表现为女性髌骨总体较薄,髌尖较短,内侧关节面较小而髌底较平;男性髌骨则整体较厚,髌尖长,髌底较陡且内侧关节面较宽的特征。
3.3 年龄差异
质心尺寸方面,青少年组(15~19 岁)均值为58.86(n=2; σ=1.76),远小于其他成年组。成年组质心尺寸的均值按照由小到大的次序排列,分别为20~29 岁组62.27(n=18;σ=7.04)、30~39 岁组66.60(n=13; σ=4.75)、40~49 岁组64.48(n=5; σ=3.44) 以及50~59 岁组67.19(n=2; σ=2.35)(图3: a)。由于各年龄分组样本量较小而组间量差异较大,对各年龄组的质心尺寸进行Kruskal-Wallis 检验,结果显示在尺寸方面不存在显著的统计学差异(p=0.14)。
形状变异方面,对年龄分组进行组间主成分分析并对两两组间差异执行置换检验,结果显示两两年龄组间不存在显著统计学差异;20~49 岁组几何形状组间差异较小,而青少年个体与老年个体形状表现较相近且均异于20~49 岁组的青壮年个体。图3: b 分别表现了各年龄组的平均形状,其中青少年个体与老年个体均呈现髌尖较长、髌下部较厚的特点。但青少年组与老年组均仅有一个男性个体的双侧样本,并不能很好地呈现年龄差异变化。总体而言,除青少年个体呈现出较小的尺寸与特殊的形状特征外,其余个体并未反映出显著的年龄与变异特征相关性。从形状的微观变化中推断,灰窑田人群15~49 岁组中随着年龄增长呈现出一定的髌尖短缩,髌底斜率减小等变化趋势。
4 讨论
进化人类学领域一系列比较解剖学研究,提供了现代人类髌骨形态结构与其对应运动功能的解释。如Lovejoy 通过对比美洲黑熊、黑猩猩、南方古猿阿法种(Australopithecusafarensis)以及现代人类的膝关节结构,认为直立行走和频繁的膝屈伸运动促使现代人类髌骨形成了突出的垂直脊和复杂的“多面体”关节面(图4),以应对更大角度屈伸中产生的髌股压力[14]。Trinkaus 在有关尼安德特人与现代人膝关节形态的对比研究中指出,由于髌骨整体包埋于股四头肌肌腱内,其整体尺寸一方面受到个体体型差异的重要影响,另一方面也可能反映了对应个体股四头肌的发达程度,较大尺寸的髌骨可能指向了个体更高的负荷或运动强度[39]。Marchi 等对纳勒迪人(Homo naledi)髌骨进行了分析,认为较厚的髌骨会增加股四头肌的力臂,从而提高直立行走或长距离奔跑的能力[40]。总体而言,目前有关髌骨的研究主要集中在种间差异和运动功能分析方面,但此类基于传统线性测量与形态观察方法的研究仅能分别探讨人群中髌骨尺寸或形态的相关特征,无法整合同一个体的综合形态学信息,更无法有效地将此类数据转化为各人群的体质特征与肢体运动表现。近年来,Rosas 等应用三维几何形态测量技术对比尼安德特人(Homo neanderthalensis)与现代人髌骨形态以分析膝关节运动的进化过程[41],为髌骨形态学研究提供了新方法。基于生物体表面同源地标点(landmarks,又称标志点)的采集,三维几何形态测量能够分别提取同一研究对象的尺寸及形状信息,并获得标准化的数据以进行统计分析和几何形态可视化。可视化过程中,地标点标识的几何结构能够直接对应骨骼肌肉解剖学上的形态变异特征,从而与膝关节运动功能特点进行关联解析。由此我们能够更为全面、直观地比较群体内部膝关节运动方式的异同,并为后续更大时空范围的人群比较研究提供行之有效的方案。
参考前人研究以及骨骼功能解剖学理论,基于上文几何形态分析呈现的不同类型,结合个体髌骨样本形态特征,本文试对灰窑田古人类髌骨的形态变异及其反映的功能运动特点进行归纳和分析。1)髌底斜度。前部供股直肌、股内侧、外侧肌以及股中间肌插入附着,后部为髌上脂肪垫[42]。因此,斜度较小(较平坦)的髌底可能更有利于屈膝时股四头肌的向后伸展的活动范围。相关地标点及区域为2-3-4-5-11-10-2(编号参见图1,下同)。2)髌底厚度。作为股四头肌的附着空间,可能与股四头肌的发达程度紧密相关,代表了膝关节伸展的活动强度[39]。相关地标点及区域为2-3-4-5-11-10-2。3)内外侧关节面比例(Wiberg分型)。由于股骨与胫骨间存在生理外翻角度,因此在运动中膝关节会产生横向力,关节面比例属于维持髌骨在股骨滑车轨道中运动的结构之一。内外关节面比的增大可能反映人群下肢运动中外翻的横向力减小[43]。相关地标点及区域为10-12-13。4)关节面凹。可能与长时间跟对应股骨滑车区域接触挤压,关节软骨增厚相应形成关节面凹陷[42],可以反映日常运动中习惯性屈膝的程度。相关地标点及区域为12-14-15。5)下部厚度。前部为髌韧带附着区,后部到关节面下缘为髌下脂肪垫[42]。髌骨下部内收情况在尼安德特人化石中普遍出现,推断其可能与减少髌腱产生的力有关[41]。相关地标点及区域为7-10-9-8-7。6)髌尖长度。受髌韧带附着与牵引,与髌韧带的发达程度、拉力强度紧密相关。较长的髌尖会相应搭配较短的髌韧带,步态实验证明会产生较大的髌韧带力,反之较短的髌尖则需要更大股四头肌力[44]。参照灵长类髌骨形态,较长的髌尖会在膝关节屈伸过程中增加股四头肌的力臂,以增强关节的扭矩或扭转力,可观察到依赖疾驰、跳跃(膝关节的强烈屈伸)为生的灵长类往往有较长的髌尖[45]。相关地标点及区域为8-10。7)髌尖偏侧。受髌韧带附着与牵引,与胫骨内外旋产生的扭转力量方向相关[42]。相关地标点及区域为6-7-8-9-1。
本文的研究结果表明,灰窑田遗址古人类髌骨具有显著不对称性,主要体现在其尺寸以及形状变异特征上。尺寸方面,该人群的左侧髌骨质心尺寸普遍较大;形状变异方面,通过对各配对样本之间普氏距离及PC1 值(主要表现为髌尖偏向变异)的统计发现,所有样本中均存在同一个体左侧髌尖偏向内且右侧髌尖偏向外的现象,即表现为两侧髌尖均向该个体的身体右侧偏侧,且其表现程度并未受性别和年龄因素的影响。从灰窑田遗址古人类髌骨尺寸与形状变异的线性回归分析结果可以看出,尺寸更大的髌骨具有更宽、陡的髌底,更大的内侧关节面、股外侧肌斜肌附着区以及较薄的髌下部等形状特点。结合上文七个功能解剖学方面的信息,也考虑到遗传因素的影响,推测灰窑田遗址人类髌骨的多项形态特征很可能是与高强度膝关节运动相关的,特别是有利于股四头肌附着与屈伸的髌底与维持髌股关节良好运动的关节面结构。
由于髌尖主要受髌韧带拉伸影响,其偏向或与人体测量学上的Q 角(即人体髌骨中心点到胫骨结节连线与髂前上棘到髌骨中心点连线交叉所形成的锐角)大小和胫骨扭转角度相对应。大量现代人群Q 角[46-50] 与胫骨扭转角的相关测量研究均表明其存在非对称性的特点,并在程度上表现出地区人群的差异[51-53]。但目前独立的髌骨形态研究无法与量化的Q 角和胫骨扭转角数值相比较,关于灰窑田遗址古人类髌尖偏侧的侧别差异是否为整个下肢力线不对称性的反映这一问题,仍有待后续对其胫、股骨测量参数的进一步分析。
就两侧髌骨质心尺寸与形状变异特点而言,灰窑田遗址古人类左侧髌骨尺寸较大,变异程度较高(主要是髌尖偏侧)。可见该群体的左侧膝关节显然与右侧膝关节有着不同的运动或负荷模式:髌尖内侧偏可能受左侧胫骨内旋运动强度较高,髌韧带内侧(可能还包括内侧支持带)对髌骨下部的拉力增强等影响;较大的髌骨则可能由于左膝关节相较于右侧承担了更多的负荷、支撑和稳定作用。有研究表明,人类下肢运动中膝关节受胫骨外旋运动影响会产生惯性的外翻力[43],右侧髌尖的外偏侧可能是这一现象的体现。由于本研究缺乏其他经济模式古代人群以及现代人群的数据库对比,因而暂无法说明此现象的普遍性以及运动方式对其影响的具体程度。虽然该人群一些个体髌骨尺寸具有不对称性,但这种现象也可能是遗传因素所决定的,因此还无法完全肯定个体髌骨形态的侧别差异是由日常运动或负荷的非对称性造成的。
本文研究结果发现,灰窑田遗址两性髌骨尺寸上存在较大的性别二态性,这与过去使用传统线性测量学进行的各类人群髌骨研究结果一致[21,22,54]。虽然男性髌骨表现出偏向适应更高强度膝关节运动的形状结构,如髌骨整体较厚、髌尖长、髌底较陡且内侧关节面较宽的特征,但形状上的两性差异并不显著。总体而言,本文研究结果仅显示出髌骨尺寸上具有显著的性别二态性。由此表明,髌骨作为股骨、胫骨间的过渡结构,其几何形态变异特征与股骨、胫骨力学参数所示运动强度的相关性以及对下肢整体的运动方式与强度反映的有效性仍有待探讨。
本次研究结果还表明,灰窑田遗址成年个体髌骨未在年龄方面呈现出尺寸及形状的显著差异。考虑到本文涉及样本的年龄分布不均且处于骨骼生长发育各阶段样本数量过少,尚无法客观还原该人群髌骨生长发育的总体变化过程。但对比成年与未成年个体可知,未成年个体髌骨尺寸显著较小;形状特征与成年个体也有较大差异,存在青、壮年期内(15~49岁)个体髌骨随年龄增长而髌尖缩短、髌下部变薄、髌底趋平、关节面凹加深的趋势。过往研究表明,髌骨尺寸与个体体型密切关联[22],但未有髌骨形状变化趋势与生长发育的相关研究。根据Wheatley 等的研究,由于短髌尖髌骨的质心与股骨相对位置较低,同样力比下髌韧带力下降,股四头肌力上升,其可能是更适应于膝关节屈曲,尤其是深度屈曲的形状结构[44]。灰窑田人群髌骨形状的变化过程可能与髌骨骨骼生长发育、个体膝关节在适应日常运动过程中股四头肌与髌韧带两个力臂的调整影响有关。趋平的髌底也提供了股四头肌更大的屈曲活动空间,而较深的靠近关节面中部关节凹位置可能指向了更高压力和强度的中度屈曲(30°~90°)[42]。
5 结论
本文从侧别对称性、性别二态性以及年龄差异三个维度考察了灰窑田遗址古人类髌骨尺寸及形状的差异。研究结果显示,灰窑田遗址古人类的髌骨发育存在突出的左侧优势,与顶蛳山遗址、何村遗址渔猎- 采集人群的股骨、胫骨生物力学参数所反映优势一致[9-10],表明这一地区渔猎- 采集人群可能长时间从事以左下肢负荷为主的非对称性运动,亦可能与右利手使用引起的“交叉对称”现象相关[55]。灰窑田遗址男性髌骨尺寸较大,且两性髌骨形状不存在统计学上的显著差异,但男性髌骨形状仍展现出更适应于奔跑、跳跃的运动特征,这一特点同样呼应了生物力学研究中性别二态性的发现[9]。此外,在个体发育方面,发现未成年个体的髌骨尺寸偏小,成年个体间尺寸差异不大;形状方面则反映出随年龄增长有髌尖短缩、髌底斜率减小、关节面凹加深的变化,可能与成长过程中股四头肌力量增强、屈伸运动强度与频率增加相关。
虽然初步考察并总结了灰窑田遗址古人类髌骨形态及其与活动行为相关的基本特点,但本文的研究仍旧存在诸多不足。例如,尚未考察其个体体型、体质量等与身体比例的关系,而这些因素对于髌骨的尺寸和形态有决定性影响。此外,有关骨骼功能压力理论尚需更多相应的现代运动行为学研究成果加以验证。除了多元实证性研究外,在数据获取和数据解释时也需充分考虑遗传和发育等因素的影响。
致谢:在样本准备及写作过程中,广东省文物考古研究院陈博宇先生和英国伦敦大学学院人类学系刘纯女士曾给予了无私的帮助。吉林大学考古学院朱泓教授、中国科学院古脊椎动物与古人类研究所刘武研究员和吴秀杰研究员对相关研究一直给予鼓励与支持,刘武研究员还就论文的写作提出了诸多修改意见和建议。学报编审提出的详细写作和修改建议及两位匿名审稿人专业且极具启发性的评审意见使本文内容得到了实质性提升。在此谨致谢忱!
参考文献
[1] 李珍,黄云忠.南宁市灰窑田新石器时代遗址[C].见:国家文物局.2006 年中国重要考古发现[M].北京:文物出版社,2007, 381-382
[2] 梁优,何安益.广西壮族自治区南宁市青秀区灰窑田新石器时代贝丘遗址[Z].见:中国考古学会.中国考古学年鉴(2017)[C].北京:文物出版社,2017, 380-381
[3] Matsumura H, Hung HC, Li Z, et al. Bio-anthropological studies of early Holocene hunter-gatherer sites at Huiyaotian and Liyupo in Guangxi, China[M]. Tokyo: National Museum of Nature and Science Monographs, No.47, 2017
[4] 李珍.邕宁顶蛳山贝丘遗址[J].中国文化遗产,2008, 5: 119-122
[5] Hung H, Zhang C, Matsumura H, et al. Neolithic transition in Guangxi: A long development of hunting-gathering society in southern China[A]. In: Matsumura H, Hung HC, Li Z, et al (eds). Bio-anthropological studies of early Holocene hunter-gatherer sites at Huiyaotian and Liyupo in Guangxi, China[C]. Tokyo: National Museum of Nature and Science Monographs, No.47, 2017, 205-228
[6] 何安益,彭长林,刘资民,等.广西资源县晓锦新石器时代遗址发掘简报[J].考古,2004, 3: 7-30
[7] 张弛,洪晓纯.华南和西南地区农业出现的时间及相关问题[J].南方文物,2009, 3: 64-71
[8] 李法军.鲤鱼墩遗址史前人类行为模式的骨骼生物力学分析[J].人类学学报,2017, 36(2): 193-215
[9] 李法军.华南地区史前人类骨骼的生物力学特征[J].人类学学报,2020, 39(4): 599-615
[10] 梅欣欣.广西崇左冲塘- 何村古人类长骨生物力学研究[D].广州:中山大学硕士学位论文,2020
[11] McHenry HM. Biomechanical interpretation of the early hominid hip[J]. Journal of Human Evolution, 1975, 4(5): 343-355
[12] Turley K, Guthrie EH, Frost SR. Geometric morphometric analysis of Tibial shape and presentation among catarrhine taxa[J].Anatomical Record-Advances in Integrative Anatomy and Evolutionary Biology, 2011, 294(2): 217-230
[13] Knigge RP, Tocheri MW, Orr CM, et al. Three-dimensional geometric morphometric analysis of talar morphology in extant gorilla taxa from highland and lowland habitats[J]. Anatomical Record-Advances in Integrative Anatomy and Evolutionary Biology, 2015, 298(1): 277-290
[14] Lovejoy CO. The natural history of human gait and posture: Part 3. The knee[J]. Gait & posture, 2007, 25(3): 325-341
[15] Frelat MA, Shaw CN, Sukhdeo S, et al. Evolution of the hominin knee and ankle[J]. Journal of Human Evolution, 2017, 108: 147-160
[16] 惠家明.现代人股骨远端形态变异及其功能适应性——以全新世中国人群为例[D].北京:中国科学院大学硕士学位论文,2020
[17] Lanyon LE, Goodship AE, Pye C , et al. Mechanically adaptive bone remodelling[J]. Journal of biomechanics, 1982, 15(3): 141-154
[18] Ruff C, Holt B, Trinkaus E. Who's afraid of the big bad Wolff?:“Wolff's law” and bone functional adaptation[J]. American Journal of Physical Anthropology, 2006, 129(4): 484-498
[19] Dwek JR, Chung CB. The patellar extensor apparatus of the knee[J]. Pediatric Radiology, Springer, 2008, 38(9): 925-935
[20] 杜清太.长春地区出土的髌骨测量[J].人类学学报,1984, 3(2): 114-117
[21] 周盛斌,张飚,荣玉山,等.中国汉族成人髌骨性别判别初步研究[J].人类学学报,1997, 1: 32-38
[22] 张继宗.法医人类学基础[M].北京:科学出版社,2007
[23] Morimoto I. Secular Trend in Emargination of the Japanese Patella, with Special Reference to the Skeletal Gracility of the Earliest Jomon People[J]. Journal of the Anthropological Society of Nippon, 1975, 83(1): 85-94
[24] Martin R, Saller K. Lehrbuch der Anthropologie II[M]. Stuttgart: G. Fischer, 1957
[25] Wiberg G. Roentgenographs and anatomic studies on the femoropatellar joint: with special reference to chondromalacia patellae[J].Acta Orthopaedica Scandinavica, 1941, 12(1-4): 319-410
[26] 朱泓 (主编).体质人类学[M].北京:高等教育出版社,2004
[27] White T D, Folkens P A. The human bone manual[M]. Burlington: Elsevier, 2005
[28] Bookstein FL. Morphometric tools for landmark data[M]. Cambridge: Cambridge University Press, 1997
[29] Rosas A, Agustina BL, García-Martínez D, et al. Analyses of the neandertal patellae from El Sidrón (Asturias, Spain) with implications for the evolution of body form in Homo[J]. Journal of Human Evolution, 2020, 141: 102738
[30] Menéndez LP. Comparing methods to assess intraobserver measurement error of 3D craniofacial landmarks using geometric morphometrics through a digitizer arm[J]. Journal of Forensic Sciences, 2017, 62(3): 741-746
[31] Palancar CA, Torres-Tamayo N, García-Martínez D, et al. Comparative anatomy and 3D geometric morphometrics of the El Sidrón atlases (C1)[J]. Journal of Human Evolution, 2020, 149: 102897
[32] Adams DC, Otárola-Castillo E. Geomorph: An R package for the collection and analysis of geometric morphometric shape data[J].Methods in Ecology and Evolution, 2013, 4(4): 393-399
[33] Schlager S. Chapter 9 - morpho and rvcg-shape analysis in R: R-packages for geometric morphometrics, shape analysis and surface manipulations[A]. In: Zheng G, Li S, Székely G(eds). Statistical shape and deformation analysis[M]. New York: Academic Press, 2017, 217-256
[34] Klingenberg CP. MorphoJ: An integrated software package for geometric morphometrics[J]. Molecular Ecology Resources, 2011,11(2): 353-357
[35] Schaefer K, Mitteroecker P, Gunz P, et al. Craniofacial sexual dimorphism patterns and allometry among extant hominids[J].Annals of Anatomy - Anatomischer Anzeiger, 2004, 186(5): 471-478
[36] Klingenberg CP. Size, shape, and form: Concepts of allometry in geometric morphometrics[J]. Development Genes and Evolution,2016, 226(3): 113-137
[37] Renaud S, Ecalle B, Claisse P, et al. Patterns of bilateral asymmetry and allometry in late Devonian Polygnathus conodonts[J].Palaeontology, John Wiley & Sons, Ltd, 2021, 64(1): 137-159
[38] Klingenberg CP, McIntyre GS. Geometric morphometrics of developmental instability: Analyzing patterns of fluctuating asymmetry with Procrustes methods[J]. Evolution, Wiley Online Library, 1998, 52(5): 1363-1375
[39] Trinkaus E. Functional aspects of Neandertal pedal remains[J]. Foot and Ankle, 1983, 3(6): 377-390
[40] Marchi D, Walker C S, Wei P, et al. The thigh and leg of Homo naledi[J]. Journal of Human Evolution, 2017, 104: 174-204
[41] Rosas A, Agustina BL, García-Martínez D, et al. Analyses of the neandertal patellae from El Sidrón (Asturias, Spain) with implications for the evolution of body form in Homo[J]. Journal of Human Evolution, 2020, 141: 102738
[42] Scuderi GR, Kibiuk LV, Insall JN. The patella[M]. New York: Springer, 1995
[43] Trinkaus E. Human patellar articular proportions: recent and Pleistocene patterns[J]. Journal of Anatomy, 2000, 196(3): 473-483
[44] Wheatley MGA, Clouthier AL, Thelen DG, et al. Patella Apex Influences Patellar Ligament Forces and Ratio[J]. Journal of Biomechanical Engineering, American Society of Mechanical Engineers Digital Collection, 2021, 143(8): 081014
[45] Pina M, Almécija S, Alba DM, et al. The middle Miocene ape Pierolapithecus catalaunicus exhibits extant great ape-like morphometric affinities on its patella: Inferences on knee function and evolution[J]. PLOS ONE, 2014, 9(3): e91944
[46] Hahn T, Foldspang A. The Q angle and sport[J]. Scandinavian journal of medicine & science in sports, Wiley Online Library, 1997, 7(1): 43-48
[47] Livingston LA. The quadriceps angle: A review of the literature[J]. Journal of Orthopaedic & Sports Physical Therapy 1998, 28(2): 105-109
[48] Livingston LA, Mandigo JL. Bilateral Q angle asymmetry and anterior knee pain syndrome[J]. Clinical biomechanics, 1999, 14(1): 7-13
[49] Raveendranath R, Nachiket S, Sujatha N, et al. Bilateral variability of the quadriceps angle (Q angle) in an adult indian population[J]. Iranian journal of basic medical sciences, 2011, 14(5): 465
[50] Prakash S, Choudhary M, Manjappa C. Influence of gender and bilateral variability of the quadriceps angle (Q angle) among adults[J]. International Journal of Orthopaedics Sciences, 2019, 5(2): 688-691
[51] Shultz SJ, Nguyen AD. Bilateral asymmetries in clinical measures of lower-extremity anatomic characteristics[J]. Clinical journal of sport medicine, 2007, 17(5): 357-361
[52] Eckhoff DG, Jacofsky DJ, Springer BD, et al. Bilateral symmetrical comparison of femoral and tibial anatomic features[J]. The Journal of Arthroplasty, 2016, 31(5): 1083-1090
[53] 郑靖中.西安地区现代人胫骨的人类学研究[J].人类学学报,1987, 6(1): 19-27
[54] Introna F, Di Vella G, Campobasso CP. Sex determination by discriminant analysis of patella measurements[J]. Forensic Science International, 1998, 95(1): 39-45
[55] Auerbach BM, Ruff CB. Limb bone bilateral asymmetry: Variability and commonality among modern humans[J]. Journal of Human Evolution, 2006, 50(2): 203-218
基金项目:华南史前人类遗骸反映的文化行为研究(13CKG002);广西史前时期人骨综合研究(23000-71210418)

