Wus2和IPT转基因番茄类愈伤组织的转录组分析
何鑫鑫,黄家权

摘 要:以AC(Ailsa Craig)番茄为材料,采用Fast-TrACC(fast-treated agrobacterium co-culture)农杆菌转化体系,利用RNA-Seq测序和荧光定量PCR技术,比较了转化DRs(Wus2和IPT)形成的类愈伤组织与普通下胚轴之间的基因表达差异。基因表达结果分析表明,有60个差异表达基因在激素信号转导通路中富集,其中上调表达基因34个,下调表达基因26个;体细胞胚形成关键基因ECP63、AGL15、FUS3、ABI3、WUS和CUC2上调表达超过4倍;ENOD93和CKX2基因在类愈伤组织中的表达量上升超过1000倍,前者编码早期结瘤素蛋白ENOD93,后者编码细胞分裂素氧化酶2,用于催化细胞分裂素的降解,参与氮同化和光合作用的基因低表达。研究结果可为深入解析番茄类愈伤组织发生的分子机制和发掘关键调控基因奠定基础,为番茄活体体内转化提供理论依据。
关键词:番茄;植物内转化;RNA-Seq;类愈伤组织;发育因子
中图分类号:S641.2 文献标志码:A 文章编号:1673-2871(2024)06-027-10
Transcriptome analysis of transgenic tomato callus tissues from Wus2 and IPT
HE Xinxin, HUANG Jiaquan
(School of Tropical Agriculture and Forestry, Hainan University/Sanya Nanfan Research Institute of Hainan University, Sanya 572025, Hainan, China)
Abstract: AC(Ailsa Craig)tomato (Solanum lycopersicum L.) was used as the experimental material and the Fast-TrACC(fast created Agrobacterium co culture)Agrobacterium transformation system was used in this study. RNA-Seq sequencing and fluorescence quantitative PCR technology were used to compare the gene expression differences between the callus-like tissues formed after transforming DRs(Wus2 and IPT)and the common hypocotyls. The analysis of gene expression results showed that 60 differentially expressed genes were enriched in the hormone signal transduction pathway, including 34 upregulated genes and 26 downregulated genes. The key genes for somatic embryo formation, ECP63, AGL15, FUS3, ABI3, WUS, and CUC2, are upregulated by more than 4-fold expression; the expression levels of ENOD93 and CKX2 genes in callus-like tissues increased by more than 1000 times. The former encodes the early nodulin protein ENOD93, while the latter encodes cytokinin oxidase 2, which catalyzes the degradation of cytokinin. Low expression of genes involved in nitrogen assimilation and photosynthesis. The research results can lay a foundation for a better understanding of the molecular mechanism of tomato callus-like tissues formation and the discovery of key regulatory genes, providing a theoretical basis for tomato in plant transformation.
Key words: Tomato; In-planta transformation; RNA-Seq; Callus-like tissue; Development regulators
遗传转化是分析基因功能的重要手段,也是获得新材料的重要途径。根癌农杆菌介导的遗传转化是植物中应用最为广泛的遗传转化方法[1-2],根癌农杆菌能够侵入植物细胞并将携带外源基因的T-DNA整合到植物基因组中遗传给后代,实现外源基因的遗传转化。通常,根癌农杆菌介导的遗传转化需要与植物组织培养结合,耗时较长,步骤多,基因型依赖且影响转化效率的因素较多。植物内转化能减少或避免外源植物激素的使用,减轻植物细胞的伤害及变异,提高转化效率,扩大受体系统的应用范围,并能确保引入的基因更好地适应环境,在植物中稳定表达,因此该方法近年来已成为研究的热点。但是对大部分植物而言,植物内转化仍存在转化效率不高、受植物生理状态影响和可重复性差等问题。
研究发现,一些植物发育调节因子(developmental regulators,DRs),如WUSCHEL(WUS)、ISOPENTYLTRANSFERS(IPT)、BABY BOOM(BBM)、STM、WOUND INDUCED DEDIFFERENTIATION 1(WIND1)的表达能够诱导特定的发育程序,从而决定分生组织的分化方向。WUS在分生组织干细胞中心表达,能维持干细胞活性,保持干细胞处于未分化状态。WUS转录因子能通过胞间连丝移动到干细胞中[3],调节目标位点的组蛋白乙酰化,控制生长素信号传导和反应途径,使生长素在局部积累并启动细胞分化[4]。WUS的同源基因Wus2编码一种同源异型结构域蛋白,参与顶端分生组织的维持[5]。Wus2能直接诱导高粱、玉米、烟草等植物体细胞胚的形成和再生[6-8]。IPT编码的IPT酶是一种异戊烯基转移酶,能够催化异戊烯基焦磷酸和单磷酸腺苷分解产生异戊烯基单磷酸腺苷。IPT酶被认为是高等植物细胞分裂素生物合成的限速酶[9],在植物芽形成中起关键作用。在苹果中过表达MdIPT1可使其愈伤组织在缺乏细胞分裂素的培养基上保持活力[10]。拟南芥的3个IPT基因家族成员(AtIPT7、AtIPT8和AtIPT9)均可促进胚性愈伤组织形成和芽再生[11-12]。Maher等[8]利用双生病毒载体,高表达不同的DRs组合,通过分生组织从头诱导的方式实现了烟草幼苗的植物内转化,并将外源基因传递给了下一代。然而,DRs促进类愈伤组织形成以及芽分化的分子途径还不清楚。在本研究中,以番茄为材料,通过转录组测序分析研究了类愈伤组织中基因的差异表达,以探究在DRs表达的条件下类愈伤组织形成的机制,为进一步提高植物内转化效率和实现多种作物的植物内转化提供了理论依据。
1 材料与方法
1.1 材料
1.1.1 植物材料 番茄材料是Ailsa Craig(AC),由海南大学陈银华老师赠予,本课题组(热带特色果树团队)留种扩繁。
1.1.2 其他材料 载体pMKV057在Daniel Voytas实验室购买,其T-DNA区域携带菜豆矮缩病毒(bean yellow dwarf virus)复制子,用于表达 FireKy Luc+、Wus2和IPT。大肠杆菌GV3101在上海唯地生物技术有限公司购买。FireKy Luc+的引物由北京擎科生物科技股份有限公司合成,正向引物序列为 5'- GAGATACGCCCTGGTTC -3',反向引物序列为 5'- GCGGTTGTTACTTGACTGG -3',2个引物间的片段长度为1434 bp。细菌质粒的DNA用SanPre Column PlASmid Mini-Preps Kit(生工生物工程股份有限公司)提取,番茄DNA用SteadyPure通用型基因组DNA提取试剂盒(艾科瑞生物工程有限公司)提取。
1.2 方法
试验时间为2021年9月至2024年6月,地点是海南大学农科楼东副南楼311实验室。
1.2.1 番茄转化方法 将450粒番茄种子在清水中浸泡20 min,50 ℃恒温水浴30 min,4 ℃静置5 h。然后用70%酒精消毒1 min,清水清洗4次,在超净台上用8%的次氯酸钠消毒10 min,无菌水冲洗5次,用无菌滤纸吸去种子表面多余的水分后,接种于1/2 MS固体培养基(pH 5.7)上(图1-A),25 ℃暗培养3 d,然后转移至光照培养箱(25 ℃,湿度70%,16 h/8 h光暗周期),种子约1周萌发。
用含有目的基因的质粒转化根癌农杆菌GV3101并验证后,将根癌农杆菌涂布于含有3种抗生素(50 mg·L-1 kan、50 mg·L-1 rif、40 mg·L-1 gent)的YEB平板上,28 ℃暗培养1 d。收集菌体,重悬于AB∶MES(3 g·L-1 K2HPO4,1 g·L-1 Na2HPO4,1 g·L-1 NH4Cl,0.31 g·L-1 MgSO4·7 H2O,10.66 g·L-1 MES,20 g·L-1葡萄糖,0.1491 g·L-1 KCl,0.0111 g·L-1 CaCl2,0.0015 g·L-1 FeSO4,pH 5.7)溶液中,加入200 μmol·L-1乙酰丁香酮(AS),使菌液OD600=0.3,28 ℃摇菌过夜。离心收集农杆菌,重悬于含AB∶MES和1/2 MS的(1∶1,V/V)的混合液中,加入200 μmol·L-1的AS和0.01%的Silwet L-77,使工作菌液OD600=0.10~0.18。
选择400株具有2片子叶的番茄无菌苗,浸泡在含有工作菌液的150 mL锥形瓶中,轻轻摇晃15 min,倒掉多余液体后,将番茄苗放置在25 ℃培养箱中暗培养2 d(图1-B)。用无菌水冲洗番茄苗,无菌滤纸擦干,挑选子叶完整的100株番茄苗,移至装有1/2 MS选择培养基(含有300 mg·L-1特美汀,150 mg·L-1头孢霉素)的组培瓶中,3次重复,每个组培瓶中5株番茄苗,放置在光照培养箱中(25 ℃,湿度70%,16 h/8 h光暗周期),每周更换1次培养基。2周后,番茄幼苗下胚轴膨大,形成类愈伤组织(图1-C),这时大部分类愈伤组织保持不分化的状态,小部分类愈伤组织分化出芽。将不定芽切下转移至新的1/2 MS培养基上,放在光照培养箱中培养,每2 d继代1次。部分芽能正常生长(图1-D)。
1.2.2 转基因阳性植株的验证 随机选择3株转化后的番茄,按照DNA提取试剂盒的说明步骤提取其类愈伤组织的DNA进行PCR鉴定,阳性对照为提取的含目的基因的根癌农杆菌质粒,阴性对照为不含目的基因的根癌农杆菌侵染后的番茄下胚轴。PCR 反应体系为10 μL,包括2 μL ddH2O、5 μL 2×Rapid Taq Master Mix、1 μL上游引物、1 μL下游引物和1 μL提取的DNA。PCR的反应程序如下:95 ℃预变性5 min;95 ℃变性10 s、48 ℃退火30 s、72 ℃延伸90 s为1个循环,进行30个循环;最后72 ℃延伸10 min。
1.2.3 转录组学测序分析 对照组为不含目的基因的根癌农杆菌侵染后的番茄下胚轴,处理组为含目的基因的根癌农杆菌侵染后的番茄下胚轴长出的类愈伤组织,每个处理3个样本,每个样本0.8 g(大约20株番茄可收集0.8 g类愈伤组织),共6个样本。RNA-Seq测序在北京诺禾致源技术股份有限公司进行。用hisat2将clean data比对至番茄基因组Solanum lycopersicum ITAG 5.0,选择 FDR<0.05和|log2(fold change)|≥1作为筛选差异表达基因的(differentially expressed gene,DEG)条件。用OmicShare云平台工具(https://www.omicshare.com/tools)对差异表达基因进行GO(Gene Ontology)富集分析和KEGG(kyoto encyclopedia of genes and genomes)富集分析。
1.2.4 荧光定量PCR 选择13个差异表达基因进行RT-qPCR(quantitative real-time PCR)验证,以番茄中的SAND基因作为内参基因,因为其在茎中的表达比TIP41、Actin、CAC和Expressed稳定[13]。每个基因的定量分析设置3次重复,采用相对定量2-ΔΔCt法分析结果。将转录组测序用到的RNA通过逆转录试剂盒PrimeScriptTM 1st stand cDNA Synthesis Kit(Takara)合成cDNA第一链,然后在MA-6000实时荧光定量仪上进行qRT-PCR。qRT-PCR反应体系为20 μL,包括10 μL 2×SYBR real-time PCR premixture、0.4 μL 10 μmol·L-1上游引物、0.4 μL 10 μmol·L-1下游引物、1 μL cDNA和8.2 μL RNase free ddH2O。qRT-PCR的反应程序如下:95 ℃预变性 5 min,95 ℃变性15 s,60 ℃退火和延伸30 s,进行40个循环。
1.2.5 数据分析 每100株转化后的番茄为1个重复,共3个重复,采用完全随机试验设计。试验数据用单因素方差分析,用邓肯新复极差法进行处理间的显著性分析,数据处理软件选用DPS 6.5.5.8,图片制作采用Excel 2021、GraphPad Prism 8和Microsoft PowerPoint 2021。
类愈伤组织诱导率/%=产生类愈伤组织的株数/总株数×100;平均每株类愈伤组织数量=类愈伤组织数量/产生类愈伤组织的株数;不定芽分化率/%=分化出的不定芽数量/类愈伤组织数量×100。
2 结果与分析
2.1 番茄类愈伤组织的诱导率及不定芽分化率
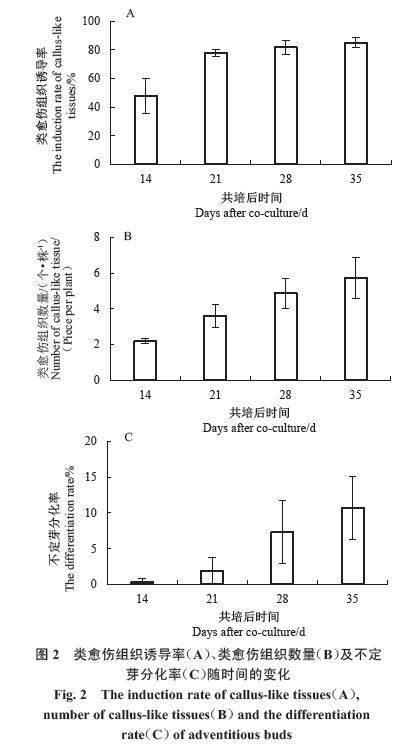
由图2可知,番茄与根癌农杆菌共培后,前35 d的类愈伤组织诱导率、平均每株类愈伤组织数量和不定芽分化率,都随时间的延长而增高。番茄的类愈伤组织诱导率在14~21 d期间升高最快,第21天的类愈伤组织诱导率为77.98%,第28天和第35天的类愈伤组织诱导率虽然有略微增长,但总体趋于平稳(图2-A)。平均每株番茄的类愈伤组织数量也逐渐增加(图2-B)。虽然类愈伤组织诱导率较高,但不定芽分化率较低,第14天、第21天、第28天和第35天的分化率分别为0.29%,1.94%,7.30%和10.74%(图2-C)。
2.2 转化组织的检测
为了检测这些类愈伤组织是否含外源基因,提取了3个类愈伤组织的DNA和1个不含目的基因的根癌农杆菌侵染后的下胚轴DNA,以其为模板对FireKy Luc+基因进行PCR检测。结果显示,3个类愈伤组织都有1434 bp目的条带,而阴性对照中没有对应的目标条带(图3)。这表明类愈伤组织可能是基因转化后的产物。
2.3 基因差异表达分析
为了探究外源基因Wus2和IPT对番茄类愈伤组织形成的影响,对处理组(类愈伤组织)和对照组(下胚轴)进行了转录组测序分析。在得到的4928个差异表达基因中, 2676(54.30%)个基因表达上调,2252(45.70%)个基因表达下调(图4)。
2.3.1 差异表达基因GO分析 对差异表达的基因进行GO分类以及富集分析,发现在生物学过程中,DEGs在代谢过程、细胞过程和单有机体过程富集最多;在细胞组分中,DEGs在细胞膜、细胞和细胞区域富集最多;在分子功能中,DEGs在结合和催化活性过程富集最多(图5)。
2.3.2 植物激素信号转导 植物激素信号转导路径的分析结果表明,植物内源激素广泛参与类愈伤组织的形成过程(图6)。富集到激素信号转导通路的差异基因共有60个,其中上调表达基因34个,下调表达基因26个。
2.3.3 差异表达基因KEGG pathway分析 对DEGs进行KEGG通路富集分析的结果表明,差异表达基因在代谢途径、次生代谢产物的生物合成、光合作用、光合作用-天线蛋白、光合生物的固碳作用、半胱氨酸和蛋氨酸代谢、碳代谢、氮代谢、DNA复制、植物病原体相互作用,以及萜、哌啶和吡啶生物碱的生物合成通路上显著富集(图7)。还发现SlCAB、SlLHCA、SlLHCB、SlNPF、SlGS2和SlCYCB在类愈伤组织中的表达量都低于对照组,暗示了绿色组织细胞的不正常发育,这也许是不定芽分化率较低的原因之一(图8)。
2.3.4 体细胞胚形成相关基因的表达 在转化Wus2和IPT形成的类愈伤组织中,与体细胞胚形成有关的基因如 ECP63、AGL15、GA2OX6、FUS3、ABI3、WUS和CUC2,其中WUS表达量上升超过32倍,ECP63、AGL15、FUS3、ABI3、WUS和CUC2表达量上升超过4倍,这表明它们可能在类愈伤组织形成过程中发挥着重要作用(图9),并且它们的表达可能是芽形成的先决条件。
2.3.5 类愈伤组织中的高度上调基因 在类愈伤组织中高度上调的基因中,除了通过农杆菌转移的靶基因IPT和Wus2外,还有5个基因经历了超过1000倍的上调,即HIGD、ACS2、ENOD93、CKX2和AAT(图10),虽然它们之间没有直接的功能关系,但具有被非生物胁迫诱导的共同特征。
2.4 差异表达基因的qRT-PCR分析
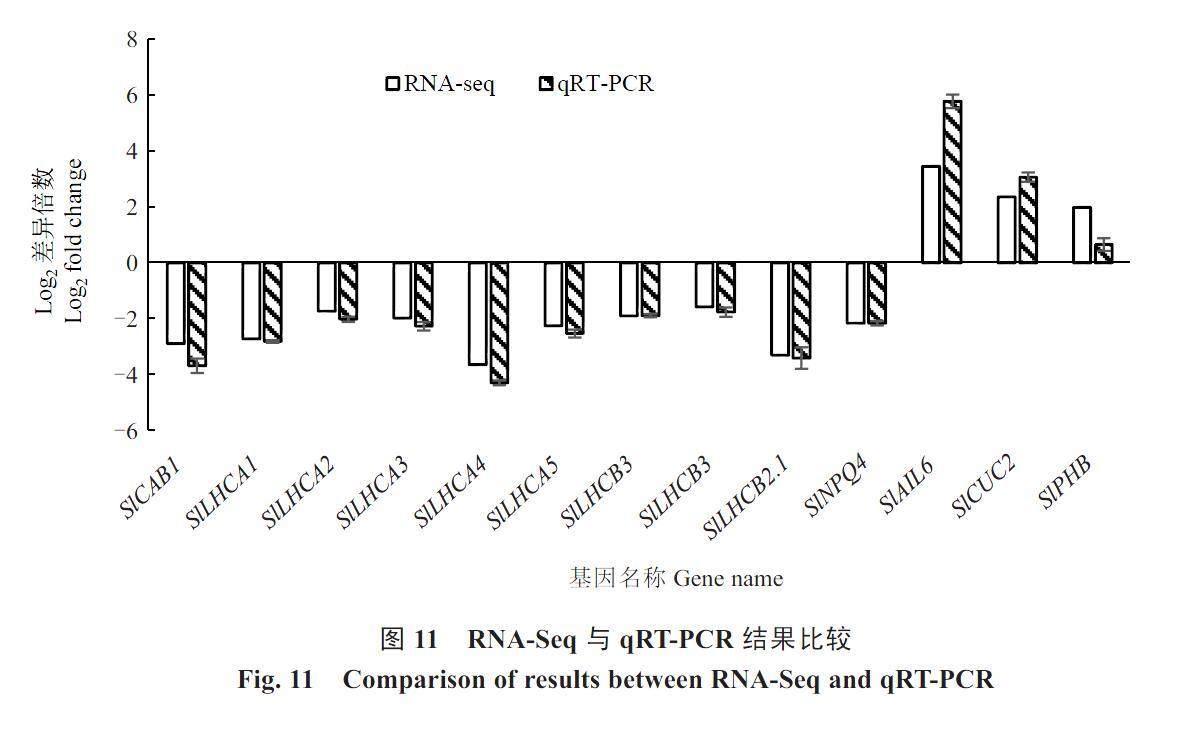
为了验证RNA-seq数据的准确性,选择了13个具有显著表达波动的基因进行qRT-PCR,这些基因与绿色组织细胞的发育和芽的形成有关。qRT-PCR数据显示出与RNA-seq结果相似的趋势(图11),表明RNA-seq可以准确地反映基因的相对表达水平。
3 讨论与结论
通过根癌农杆菌介导的遗传转化法,将Wus2和IPT基因转入番茄幼苗后,番茄下胚轴细胞的生理过程发生了转变,从营养状态转变到类似生殖或逆境状态,从而导致了类愈伤组织的形成。在此过程中,ECP63、WUS和CUC2均上调表达,这表明了番茄下胚轴向胚性愈伤组织的转变。ECP63是从胡萝卜胚性培养物中分离得到的典型的LEA 基因[14],参与了种子成熟与耐旱过程,在胚性细胞和不同发育时期的胚状体中高度表达,但在幼苗和非胚性细胞中不表达[15]。在ecp63缺失的突变体中,外植体胚胎发生的潜能显著降低[16]。WUS蛋白是AGAMOUS基因的激活因子,参与调节茎部分生组织中干细胞的维持,保持干细胞处于未分化状态[17]。CUC基因在中间区域的表达有2个主要功能,一是抑制细胞的增殖和分化,分隔出2个发育中的子叶边界,二是启动STM在中间的表达[18],且CUC基因在胚胎发生过程中对生长素生物合成基因的表达起着重要的调控作用,这可能有助于子叶边界的发育[19]。
许多与内源激素合成和调控有关基因的表达也发生了改变,这说明植物激素在类愈伤组织形成过程中起着关键作用。在细胞分裂素、乙烯和赤霉素的信号转导途径中,各富集了3个、4个和3个差异表达基因。CKX2、ACS2和GA2OX6分别编码了细胞分裂素、乙烯和赤霉素合成过程中的关键酶,它们在类愈伤组织形成过程中均上调表达。在前人的研究中,细胞分裂素可以促进细胞分裂和诱导芽的分化,甚至可以直接诱导猪血木叶片和叶柄的体细胞胚发生[20],而过表达CKX2则降低了内源细胞分裂素含量,使叶片缓慢变小[21] 。GA2OX6编码的赤霉素2-氧化酶可以使赤霉素失活,而赤霉素被认为不利于细胞分化[22],在添加赤霉素情况下体细胞胚胎的存活率不足3%[23],但也有研究认为相对较低的细胞分裂素和赤霉素含量有助于胚性愈伤组织的形成[24]。乙烯诱导体细胞胚形成的作用存在一些争议。比如胚性愈伤组织中乙烯产量的增加会破坏对拟南芥体细胞胚的诱导[25],但是乙烯生物合成和响应基因的上调却是紫花苜蓿叶片外植体诱导体细胞胚胎发生所必需的[26]。AGL15、FUS3和ABI3则通过复杂的调控网络影响赤霉素积累、生长素反应和乙烯积累,将有生物活性的赤霉素转化成无生物活性的赤霉素,进而影响体细胞胚的形成。ABI3是脱落酸信号传导途径的中心调节因子[27],FUS3通过调节脱落酸和赤霉素2种激素的合成来参与控制叶片器官的形成[28],ABI3和FUS3相互正向调控并调控自身的表达[29]。AGL15可以正向调控ABI3、GA2OX6、AtIAA30、miR167A、SERF1的表达,负向调控TIR1、ARF6、ARF8的表达和赤霉素的生物合成,FUS3与AGL15之间相互正向调控[30]。
根癌农杆菌介导的植物内转化虽然可能不受基因型的限制,但同时也存在一些问题,如芽不能正常伸长,这可能是CKX2的高表达和绿色组织细胞发育不完全导致的。在前人的研究中,番茄茎尖叶片的起始只有在光照下才能发生,暗处理会抑制叶片发育[31];绿色组织细胞通过光合作用产生蔗糖,蔗糖被转运到芽原基并转化为葡萄糖,以激活葡萄糖-TOR信号通路,从而用于芽原基或分生组织的发育[32]。所以或许可以通过延长光照时间、提高光照度或者添加外源细胞分裂素来促进芽的生长发育,但还需要进一步的试验来验证。
参考文献
[1] AZIZI-DARGAHLOU S,POURESMAEIL M.Agrobacterium tumefaciens-mediated plant transformation: A review[J].Molecular Biotechnology[2023-07-01].https://link.springer.com/article/10.1007/s12033-023-00788-x.
[2] SINGH R K,PRASAD M.Advances in Agrobacterium tumefaciens-mediated genetic transformation of graminaceous crops[J].Protoplasma,2016,253(3):691-707.
[3] DAUM G,MEDZIHRADSZKY A,SUZAKI T,et al.A mechanistic framework for noncell autonomous stem cell induction in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United Stated of America,2014,111(40):14619-14624.
[4] MA Y F,MIOTK A,?UTIKOVI? Z,et al.WUSCHEL acts as an auxin response rheostat to maintain apical stem cells in Arabidopsis[J].Nature Communications,2019,10:5093.
[5] MAYER K F X,SCHOOF H,HAECKER A,et al.Role of WUSCHEL in regulating stem cell fate in the Arabidopsis shoot meristem[J].Cell,1998,95(6):805-815.
[6] CHE P,WU E,SIMON M K,et al.Wuschel2 enables highly efficient CRISPR/Cas-targeted genome editing during rapid de novo shoot regeneration in sorghum[J].Communications Biology.2022,5(1):344.
[7] MASTERS A,KANG M,MCCAW M,et al.Agrobacterium-mediated immature embryo transformation of recalcitrant maize inbred lines using morphogenic genes[J].Journal of Visualized Experiments,2020(156):e60782.
[8] MAHER M F,NASTI R A,VOLLBRECHT M,et al.Plant gene editing through de novo induction of meristems[J].Nature Biotechnology,2020,38(1):84-89.
[9] TAKEI K,SAKAKIBARA H,SUGIYAMA T.Identification of genes encoding adenylate isopentenyltransferase,a cytokinin biosynthesis enzyme,in Arabidopsis thaliana[J].Journal of Biological Chemistry,2001,276(28):26405-26410.
[10] JIA P,WANG Y,SHARIF R,et al.MdIPT1,an adenylate isopentenyltransferase coding gene from Malus domestica,is involved in branching and flowering regulation[J].Plant Science,2023,333:111730.
[11] SUN J Q,NIU Q W,TARKOWSKI P,et al.The Arabidopsis AtIPT8/PGA22 gene encodes an isopentenyl transferase that is involved in de novo cytokinin biosynthesis[J].Plant Physiology,2003,131(1):167-176.
[12] LI K,WANG J,LIU C L,et al.Expression of AtLEC2 and AtIPTs promotes embryogenic callus formation and shoot regeneration in tobacco[J/OL].BMC Plant Biology,2019,19(1):314.
[13] 韩晓雪,韩佳轩,姜晶.番茄在非生物胁迫下实时定量RT-PCR中内参基因的筛选[J].分子植物育种,2015,13(4):822-831.
[14] YANG H P,SAITOU T,KOMEDA Y,et al.Arabidopsis thaliana ECP63 encoding a LEA protein is located in chromosome 4[J].Gene,1997,184(1):83-88.
[15] 朱长甫,镰田博,原田宏,等.与胡萝卜胚胎发生相关的胚性细胞蛋白63 cDNA分离及其基因表达研究[J].植物学报,1997,39(12):1091-1098.
[16] NOWAK K,GAJ M D.Stress-related function of bHLH109 in somatic embryo induction in Arabidopsis[J].Journal of Plant Physiology,2016,193:119-126.
[17] IKEDA M,MITSUDA N,OHME-TAKAGI M.Arabidopsis WUSCHEL is a bifunctional transcription factor that acts as a repressor in stem cell regulation and as an activator in floral patterning[J].Plant Cell,2009,21(11):3493-3505.
[18] JENIK P D,GILLMOR C S,LUKOWITZ W.Embryonic patterning in Arabidopsis thaliana[J].Annual Review of Cell and Developmental Biology,2007,23:207-236.
[19] YAMADA M,TANAKA S,MIYAZAKI T,et al.Expression of the auxin biosynthetic genes YUCCA1 and YUCCA4 is dependent on the boundary regulators CUP-SHAPED COTYLEDON genes in the Arabidopsis thaliana embryo[J].Plant Biotechnology,2022,39(1):37-42.
[20] XIONG Y P,CHEN S Y,WU T,et al.Shoot organogenesis and somatic embryogenesis from leaf and petiole explants of endangered Euryodendron excelsum[J].Scientific Reports,2022,12(1):20506.
[21] WERNER T,MOTYKA V,LAUCOU V,et al.Cytokinin-deficient transgenic Arabidopsis plants show multiple developmental alterations indicating opposite functions of cytokinins in the regulation of shoot and root meristem activity[J].Plant Cell,2003,15(11):2532-2550.
[22] RAMAKRISHNA D,SHASTHREE T.High efficient somatic embryogenesis development from leaf cultures of Citrullus colocynthis (L.) Schrad for generating true type clones[J].Physiology and Molecular Biology of Plants,2016,22(2):279-285.
[23] OLIVEIRA F L R,SANTANNA-SANTOS B F,FRAGA H P F,et al.Embryogenic cultures and somatic embryos development from mature seeds of jabuticaba (Plinia cauliflora (Mart.) Kausel)[J].Anals Da Academia Brasileira De Ciencias,2022,94(4):e20201073.
[24] WU G Y,WEI X L,WANG X,et al.Changes and transcriptome regulation of endogenous hormones during somatic embryogenesis in Ormosia henryi Prain[J].Frontiers in Plant Science,2023,14:1121259.
[25] BAI B,SU Y H,YUAN J,et al.Induction of somatic embryos in Arabidopsis requires local YUCCA expression mediated by the down-regulation of ethylene biosynthesis[J].Molecular Plant,2013,6(4):1247-1260.
[26] MANTIRI F R,KURDYUKOV S,LOHAR D P,et al.The transcription factor MtSERF1 of the ERF subfamily identified by transcriptional profiling is required for somatic embryogenesis induced by auxin plus cytokinin in Medicago truncatula[J].Plant Physiology,2008,146(4):1622-1636.
[27] NAMBARA E,KEITH K,MCCOURT P,et al.A regulatory role for the ABI3 gene in the establishment of embryo maturation in Arabidopsis thaliana[J].Development,1995,121(3):629-636.
[28] GAZZARRINI S,TSUCHIYA Y,LUMBA S,et al.The transcription factor FUSCA3 controls developmental timing in Arabidopsis through the hormones gibberellin and abscisic acid[J].Developmental Cell,2004,7(3):373-385.
[29] TO A,VALON C,SAVINO G,et al.A network of local and redundant gene regulation governs Arabidopsis seed maturation[J/OL].Plant Cell,2006,18(7):1642-1651.
[30] ZHENG Q L,ZHENG Y M,JI H H,et al.Gene regulation by the AGL15 transcription factor reveals hormone interactions in somatic embryogenesis[J/OL].Plant Physiology,2016,172(4):2374-2387.
[31] YOSHIDA S,MANDEL T,KUHLEMEIER C.Stem cell activation by light guides plant organogenesis[J].Genes & Development,2011,25(13):1439-1450.
[32] SONG X H,GUO P R,XIA K K,et al.Spatial transcriptomics reveals light-induced chlorenchyma cells involved in promoting shoot regeneration in tomato callus[J].Proceeding of the National Academy of Science United States of America,2023,120(38):e2310163120.

