迷走神经刺激术治疗超难治性癫痫持续状态2例
彭鑫涛 孙卫进 马凯强 王雄飞 周健 王梦阳 王静 李天富 栾国明 关宇光
【摘要】 目的 探究迷走神经刺激术(VNS)治疗超难治性癫痫持续状态(SRSE)的疗效。方法 纳入2例分别于2012年2月28日和2020年6月10日在首都医科大学三博脑科医院行VNS的SRSE患者,分析其临床特征及手术疗效。结果 2例患者术中情况良好,病例1于刺激器开机1周后癫痫持续状态(SE)消失,术后7年随访提示未再发生SE且癫痫发作频率减少50%;病例2于刺激器开机1个月后SE消失,术后2年随访提示未再发生SE且癫痫发作频率减少80%。结论 VNS是治疗SRSE的安全有效手段。
【关键词】 超难治性癫痫持续状态;迷走神经刺激术;疗效
【中图分类号】 R742.1;R651 【文献标志码】 A 【文章编号】 1672-7770(2024)03-0262-05
癫痫持续状态(status epilepticus,SE)指发作自行终止的机制失败或异常持续发作的机制启动所导致的一种临床状态,可以导致包括神经元死亡、损伤和神经网络改变等不良后果[1]。当使用麻醉药物(如异丙酚、咪达唑仑等)治疗SE超24 h(包括麻醉剂维持或减量过程),SE仍无缓解或复发时,定义为超难治性癫痫持续状态(super-refractory status epilepticus,SRSE)[2],发病率为每年0.7/10万~3/10万[34]。SE的病死率为5%~25%,其中约30%的死亡患者与SRSE相关,且大多SRSE患者出现了不同程度的残障[56]。据报道,迷走神经刺激术(vagus nerve stimulation,VNS)可终止约74%SRSE患者的癫痫持续状态[7],但目前国内相关报道较少见。本研究回顾性分析了首都医科大学三博脑科医院收治的2例SRSE患者的临床特征及辅助检查结果,并讨论了VNS的疗效。现报告如下。
1 一般资料
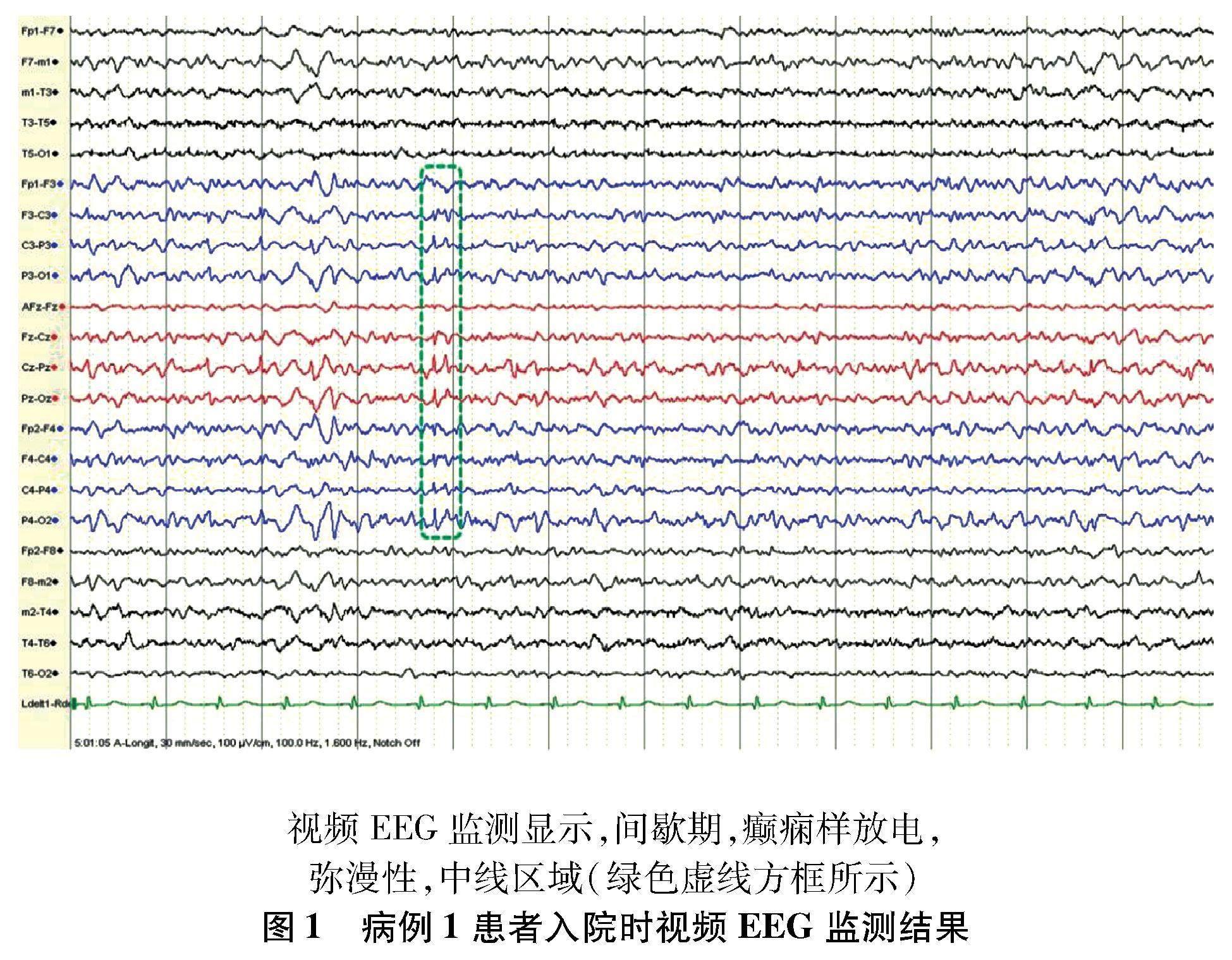
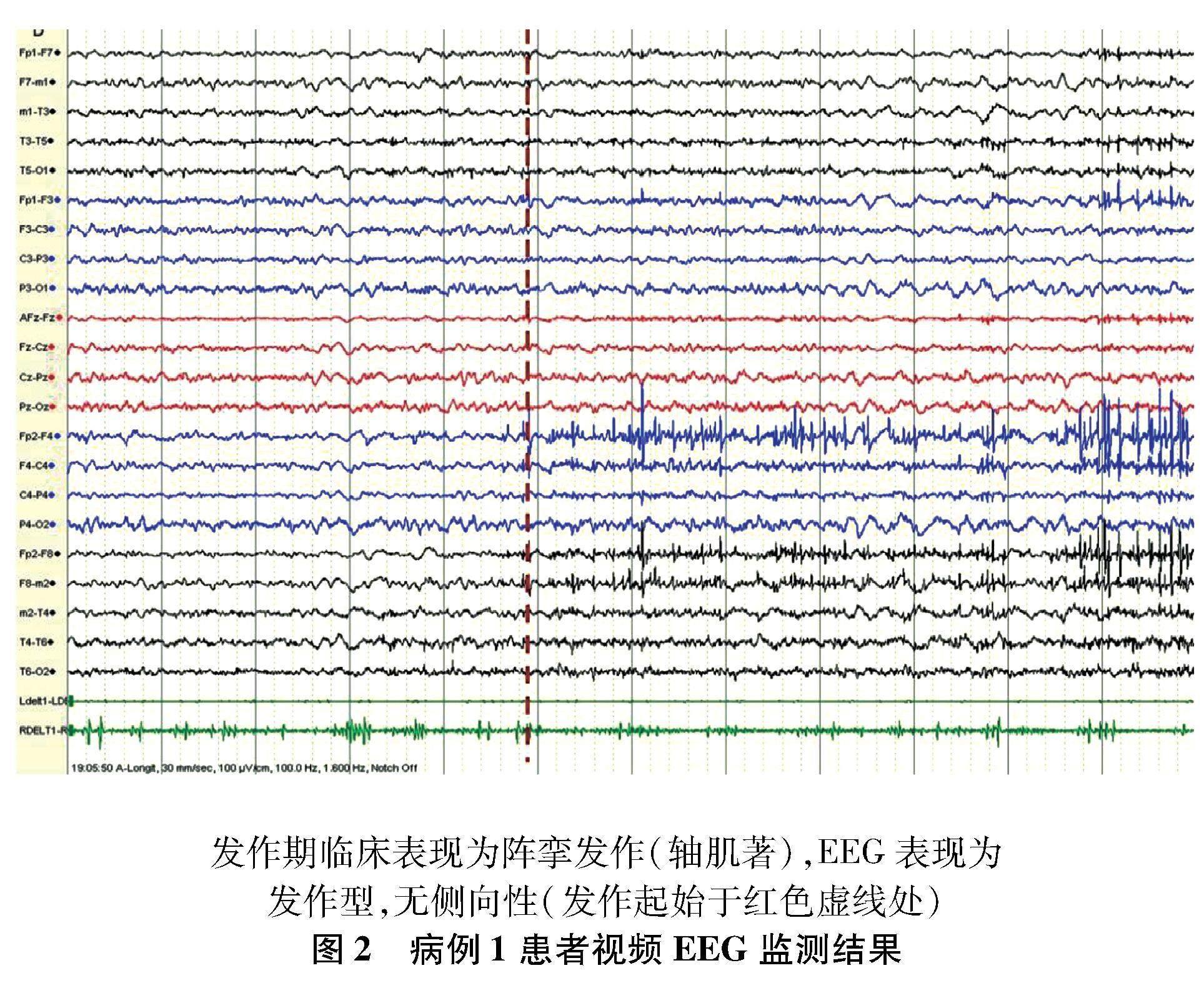
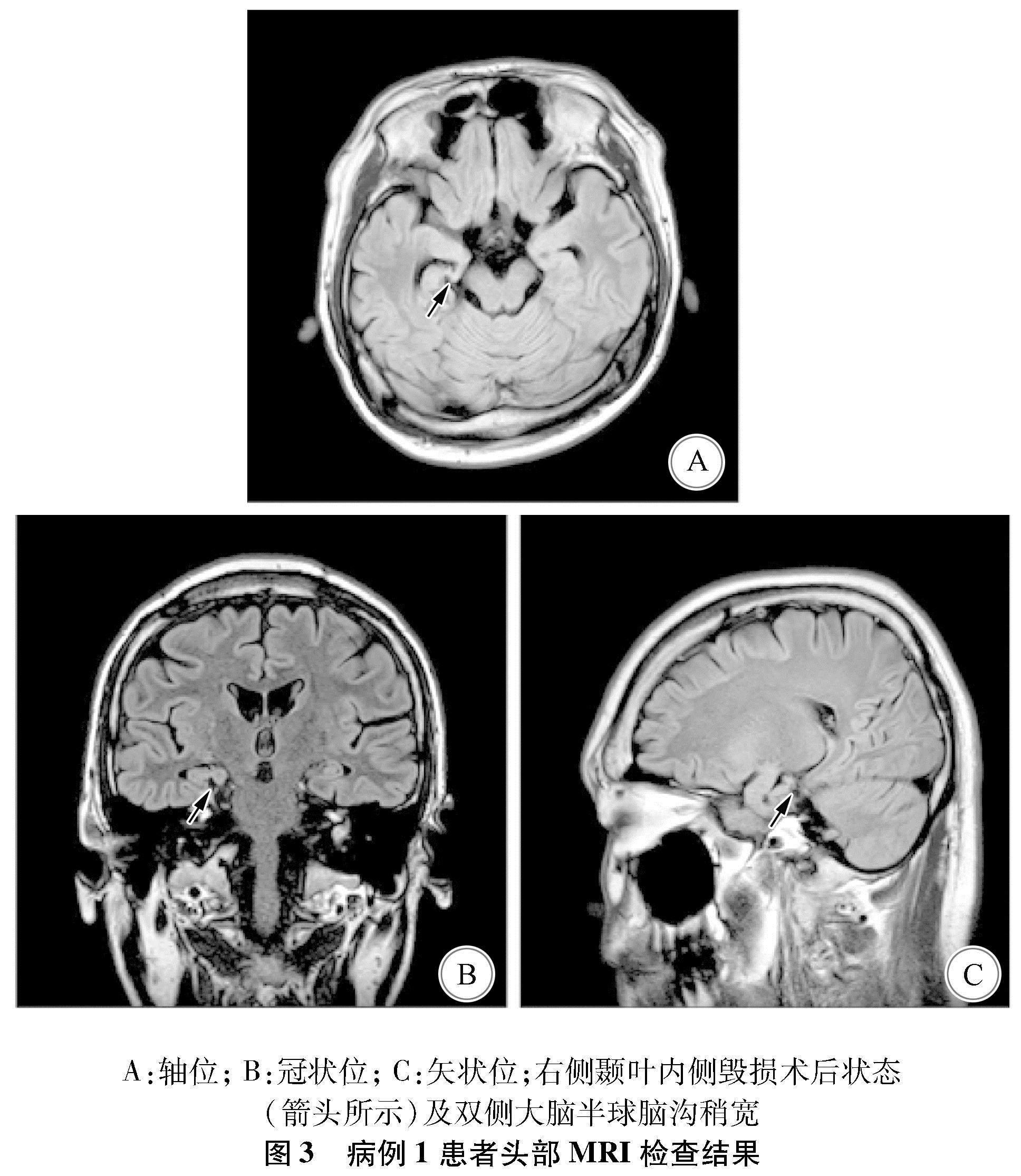
1.1 病例1 患者男,17岁,因“发作性抽搐9年”于2012年2月28日收治入院。患者于8岁时首次发病,发作形式表现为无明显诱因突发眨眼、双眼上翻、右摇头,伴口角抽动或右肢僵硬,意识清楚,发作持续时间约20 s,发作频率每1~2个月1次,多在清晨刚睡醒时发作。12岁行无框架立体定向微电极引导右侧杏仁核毁损术,术后症状无明显好转。15岁时发作表现为摇头,发作持续时间约20 s,频率约每周2次。16岁后发作时间增加至1 min,成簇发作,时常出现全身强直阵挛,最长持续5 min。同年出现SE,表现为眼睑抽搐,头眼偏向右侧,继之出现全面性强直阵挛发作(generalised tonic-clonic seizure,GTCS),意识丧失,给予地西泮、咪达唑仑、苯巴比妥治疗后好转。17岁时再次无诱因出现SE,于当地医院行气管切开及呼吸机辅助呼吸等急救治疗,后转入首都医科大学三博脑科医院。曾用药包括卡马西平、托吡酯、丙戊酸钠、丙戊酸镁、氯硝西泮、苯巴比妥、苯妥英钠、奥卡西平等多种药物,不能控制发作。现用药为丙戊酸钠500 mg bid;奥卡西平750 mg bid;左乙拉西坦1 000 mg bid;氯硝西泮2 mg bid。既往史、家族史、个人史无特殊。入院查体示,镇静状态,气管切开状态,双侧瞳孔等大,直径约2.0 mm,直径及间接对光反射灵敏,肌力及肌张力检查不合作,病理征阴性,脑膜刺激征阴性。入院时视频脑电图(electroencephalogram,EEG)监测结果:(1)间歇期示癫痫样放电,弥漫性,中线区著(图1);(2)发作期临床表现为阵挛发作(轴肌著),EEG示发作型,无侧向性(图2)。核磁共振成像(magnetic resonance imaging,MRI)示,右侧颞叶内侧毁损术后状态及双侧大脑半球脑沟稍宽(图3)。
入院诊断为癫痫持续状态。入院后在既往口服抗癫痫药物的基础上,给予咪达唑仑(10 mg/h)持续泵入及苯巴比妥注射液(200 mg qd)肌肉注射治疗48 h,约10 min左右发作1次。联合丙泊酚(60 mg/h)持续泵入后发作频率减少至每小时发作1次。经多学科会诊,考虑该患者诊断为SRSE,在目前药物治疗下仍不能有效控制发作。经家属同意行迷走神经刺激器植入术(图4),术后应用咪达唑仑及苯巴比妥治疗。术后1周迷走神经刺激器开机(频率20 Hz,脉宽500 μs,开机30 s,关机5 min,刺激电流0.25 mA)并继续配合麻醉药物治疗。术后2周未再出现SE,且癫痫发作逐渐减少(发作形式同术前),同时开始减少咪达唑仑及苯巴比妥剂量。术后11周癫痫发作减少至每周1次。术后12周顺利出院,迷走神经刺激器参数为频率20 Hz,脉宽500 μs,开机30 s,关机3 min,刺激电流3 mA。出院后继续口服抗癫痫药物,丙戊酸钠缓释片750 mg bid;奥卡西平片750 mg bid;左乙拉西坦片1 000 mg bid;氯硝西泮片2 mg bid。
术后随访未再出现SE。术后1年9个月,癫痫发作频率约为每周1次(频率减少50%),复查EEG提示间歇期放电范围缩小,放电量减少(图5)。术后第7年,发作频率增加至每周3~4次,查看迷走神经刺激器电量耗尽,更换脉冲发生器后,患者发作频率恢复至每周1次。
1.2 病例2 患者男,20岁,因“发作性抽搐17年”于2020年6月10日收治入院。患者于2岁时首次发作,发作形式为发热达38.9 ℃后出现意识丧失伴身体瘫软,无抽搐表现,于当地医院行地西泮静脉滴注后症状得以控制。此后每次发作前无高热。发作持续时间约5~10 min,发作频率约3~6个月1次。4岁后发作形式改变,表现为意识丧失、头偏向右侧、四肢屈曲僵硬,且发作前自觉有预感,发作持续时间5~10 min,频率不规律,4个月1次至每天数次不等,过度劳累、饮食过饱、食用冰制食品后易诱发。20岁情绪剧烈波动后发作,多次发作且意识不清累计超过30 min,遂以“癫痫持续状态”收入首都医科大学三博脑科医院。视频EEG示,间歇期双侧前头部癫痫样放电,发作期(72次发作/1.5 h)弥漫性低幅快波。曾口服托吡酯、拉莫三嗪等,未见好转。患者自12岁起至入院前自行停止口服抗癫痫药。既往史、家族史、个人史无特殊。入院查体示,一般情况可、神清、言语清晰、对光反射灵敏、病理征阴性、脑膜刺激征阴性。入院时视频EEG监测结果:(1)间歇期示,癫痫样放电,弥漫性,双侧前头部(图6);(2)发作期临床表现为短暂性强直发作持续状态,EEG示发作型,弥漫性(图7)。MRI示右颞叶内侧异常信号,考虑脉络膜裂囊肿压迫右侧海马上缘。
入院诊断为癫痫持续状态。入院后给予患者苯巴比妥、奥卡西平、托吡酯等多种抗癫痫药物,但仍不能控制发作,加用咪达唑仑后发作频率减少,减少咪达唑仑用量后发作频率明显增加。经讨论,由于患者经多种抗癫痫药治疗无效且静脉输注咪达唑仑后仍间断发作,考虑为SRSE,经患者及其家属同意决定行“左侧迷走神经刺激器植入术”。术后1~19 d,患者神志不清,且频繁出现双上肢强直发作,给予丙泊酚、咪达唑仑及氯硝西泮(0.5 mg tid)治疗但控制不佳。术后20 d继续给予麻醉药物治疗,发作频率减少。术后21 d减少麻醉药物剂量,迷走神经刺激器开机(频率20 Hz,脉宽500 μs,开机30 s,关机5 min,刺激电流0.75 mA)。此后逐渐减停麻醉药物并调整抗癫痫药(奥卡西平450 mg bid;苯巴比妥30 mg tid;托吡酯100 mg bid;氯硝西泮0.5 mg tid)治疗,患者意识逐渐清楚,发作被明显控制。术后1个月患者意识清楚,体征稳定,准予出院,出院后用药同前。
术后随访未再出现SE。术后2个月出现失神发作,发作持续约数秒,发作频率为每天20次。及时为其调整抗癫痫药后(奥卡西平450 mg bid;苯巴比妥30mg tid;托吡酯100 mg bid;氯硝西泮0.75 mg tid)发作频率较术前减少约80%。术后2年,患者自行减少服氯硝西泮后出现肢体轻微快速抖动,持续1 s,数月发作1次。后恢复服用氯硝西泮,肢体抖动症状消失。复查脑电图提示间歇期放电范围缩小,放电量减(图8)。
2 讨 论
SRSE的院内死亡率高达24.1%[8],但至今仍无安全可靠的治疗方案。目前对于SRSE的处理,最基础的是抗癫痫药联合麻醉药物治疗。及时静脉输注麻醉药物大概率可以迅速终止SRSE,但易复发且由于缺乏研究数据支持,并不清楚选择哪种麻醉药物最为理想[2,89]。当药物无法控制SRSE患者癫痫发作时,可以考虑采用辅助检查精准定位致痫灶后行手术切除或毁损病灶。然而,有时无法安全地去除病灶(如癫痫病灶位于功能区或病灶分布广泛),而且各种因素(患者及其家属不能准确描述病史、医师专业水平不足、检查技术落后等)也常常导致医师无法准确定位病灶。此时可考虑对症治疗,如VNS。
作为神经调控技术之一的VNS,通过与脉冲发生器连接的植入电极对左颈迷走神经进行间歇性电刺激,通常是刺激30 s,停止5 min。其分别于1994年在欧洲和1997年在美国被批准作为药物难治性癫痫的辅助治疗方式[7]。虽然VNS控制癫痫发作的机制尚不明确,但对部分患者有确切疗效。在接受VNS治疗后,有50%~63%的药物难治性癫痫患者发作频率减少50%以上,8%~12%患者实现癫痫无发作[1011]。此外,国内外均有将VNS成功应用于SE的报道。
Helmers等[12]认为,VNS在减少SE的发生和再发生上具有显著意义。Grioni等[13]报道了4例行VNS的SRSE患者,其中1例在术后8个月后因频繁出现SE而死亡,其余3例患者在术后45个月内均无SE出现且癫痫发作频率减少80%以上。中国的一项研究显示,VNS治疗可使55.81%的SE患者癫痫发作频率减少50%以上,且不再出现SE[14]。本研究的2例SRSE患者VNS术后未再发生SE,癫痫发作频率分别减少50%和80%,间歇期癫痫样放电量及放电范围均有不同程度的减小。此结果在一定程度上验证了VNS治疗SRSE的有效性及安全性,但目前并无足够的临床证据证明VNS适用于局灶性SE。首都医科大学三博脑科医院曾有2例Rasmussen脑炎并发局灶性癫痫持续状态患者,应用VNS治疗后癫痫发作并未得到控制。
在VNS的参数调节方面,以往研究证明高刺激参数更有助于控制癫痫的发作[1516],但过高的刺激参数可能会导致喉部疼痛、咳嗽、吞咽困难和声音改变等不良反应[17]。因此,本研究中2例患者均待其术后状态稳定后再开机刺激(保证其可准确描述自身情况),并将电流调整至患者可接受的最佳参数。之后随患者对刺激的适应,逐渐增加电流强度至患者不出现或仅出现可耐受的不良反应(通常≤3 mA)。Dibué-Adjei等[7]的研究中,患者最终接受的电流刺激强度为1~3 mA,而本研究病例1开机电流仅为0.25 mA便取得明显效果,其主要原因在于配合积极的药物治疗,且随患者病情变化,最终将电流调整至3 mA,并停止麻醉药物的使用。
虽然本研究的病例在经VNS治疗后预后良好,但不能忽略抗癫痫药物治疗仍然是重要的基础治疗方式。病例1术后规律口服抗癫痫药,癫痫发作频率稳定在术前的50%。病例2术后2个月每日癫痫失神发作约20次,及时为其调整抗癫痫药后发作频率减少约80%。其自行减少服用氯硝西泮后出现肢体轻微快速抖动症状(数月1次),恢复服用氯硝西泮后,肢体抖动症状即消失。这说明VNS作为一种辅助治疗手段,必须配合合理药物治疗才能有效发挥其抗癫痫作用。
由于本研究的病例数量有限,尚需要大量的病例并延长随访时间以进一步证实VNS的安全性和有效性。但仍希望本研究能为医师们提供新的启示,探索出针对SRSE安全有效的治疗方案,减少SRSE发生率和病死率,改善患者的预后和生活质量。
利益冲突:所有作者均声明不存在利益冲突。
[参 考 文 献]
[1] Betjemann JP,Lowenstein DH.Status epilepticus in adults[J].Lancet Neurol,2015,14(6):615624.
[2] Shorvon S,Ferlisi M.The treatment of super-refractory status epilepticus:a critical review of available therapies and a clinical treatment protocol[J].Brain,2011,134(Pt 10):28022818.
[3] Strzelczyk A,Ansorge S,Hapfelmeier J,et al.Costs,length of stay,and mortality of super-refractory status epilepticus:a population-based study from Germany[J].Epilepsia,2017,58(9):15331541.
[4] Kantanen AM,Reinikainen M,Parviainen I,et al.Incidence and mortality of super-refractory status epilepticus in adults[J].Epilepsy Behav,2015,49:131134.
[5] Koubeissi M,Alshekhlee A.In-hospital mortality of generalized convulsive status epilepticus:a large US sample[J].Neurology,2007,69(9):886893.
[6] Alvarez V,Drislane FW.Is favorable outcome possible after prolonged refractory status epilepticus?[J].J Clin Neurophysiol,2016,33(1):3241.
[7] Dibué-Adjei M,Brigo F,Yamamoto T,et al.Vagus nerve stimulation in refractory and super-refractory status epilepticus-A systematic review[J].Brain Stimul,2019,12(5):11011110.
[8] Cornwall CD,Krigrd T,Kristensen JSS,et al.Outcomes and treatment approaches for super-refractory status epilepticus:a systematic review and meta-analysis[J].JAMA Neurol,2023,80(9):959968.
[9] 梅珊珊,李云林,王晓飞,等.超难治性癫痫持续状态病例分析及文献复习[J].临床神经外科杂志,2015,12(3):195198.
Mei SS,Li YL,Wang XF,et al.Clinical analysis and review of the literatures for super-refractory status epilepticus[J].J Clin Neurosurg,2015,12(3):195198.
[10]Jain P,Arya R.Vagus nerve stimulation and seizure outcomes in pediatric refractory epilepsy:systematic review and meta-analysis[J].Neurology,2021,96(22):10411051.
[11]Englot DJ,Rolston JD,Wright CW,et al.Rates and predictors of seizure freedom with vagus nerve stimulation for intractable epilepsy[J].Neurosurgery,2016,79(3):345353.
[12]Helmers SL,Duh MS,Guérin A,et al.Clinical outcomes,quality of life,and costs associated with implantation of vagus nerve stimulation therapy in pediatric patients with drug-resistant epilepsy[J].Eur J Paediatr Neurol,2012,16(5):449458.
[13]Grioni D,Landi A,Fiori L,et al.Does emergent implantation of a vagal nerve stimulator stop refractory status epilepticus in children?[J].Seizure,2018,61:9497.
[14]邹国涛,张伟,谢灵秉,等.迷走神经刺激联合咪达唑仑对癫痫持续状态患儿的疗效研究[J].重庆医学,2016,45(13):18311833.
Zou GT,Zhang W,Xie LB,et al.Effect of vagal nerve stimulation combined with midazolam on children with status epilepsy[J].Chongqing Med,2016,45(13):18311833.
[15]Loerwald KW,Borland MS,Rennaker RL 2nd,et al.The interaction of pulse width and current intensity on the extent of cortical plasticity evoked by vagus nerve stimulation[J].Brain Stimul,2018,11(2):271277.
[16]Thompson SL,OLeary GH,Austelle CW,et al.A review of parameter settings for invasive and non-invasive vagus nerve stimulation (VNS) applied in neurological and psychiatric disorders[J].Front Neurosci,2021,15:709436.
[17]Alexander GM,Huang YZ,Soderblom EJ,et al.Vagal nerve stimulation modifies neuronal activity and the proteome of excitatory synapses of amygdala/piriform cortex[J].J Neurochem,2017,140(4):629644.

