无花果可溶性糖含量测定






摘 要:为了建立一个可靠且高效的测定方法,专门用于测量不同成熟度无花果中的可溶性糖含量,深入探索并精确改进蒽酮-硫酸比色法。根据研究目的,针对性优化了显色时间、蔗糖标准液浓度与冷却比色时间,建立了可用于无花果果实可溶性糖含量测定的蒽酮-硫酸比色法。实验结果显示,最佳显色时间为10 min,最佳蔗糖标准溶液浓度为100 μg·mL-1,最佳冷却比色时间为20 min。回归方程y=0.005x+0.153 4(R2=0.998 2)。通过检测不同成熟度的无花果,发现糖度变化趋势与可溶性糖含量变化趋势一致,可溶性糖含量可作为无花果产品质量控制指标。
关键词:无花果;可溶性糖;蒽酮-硫酸比色法
Method for Determination of Soluble Sugar Content in Fig
SU Yunting1, PAN Shihui2*
(1. Weihai Vocational College, Weihai 264200, China; 2. Shandong University, Weihai 264209, China)
Abstract: In order to establish a reliable and efficient assay specifically for measuring the soluble sugar content in figs of different ripenesses, the anthone-sulfate colorimetric method was explored in depth and precisely improved. According to the purpose of the study, the color development time, the concentration of sucrose standard solution and the cooling colorimetric time were optimized, and an anthone-sulfate colorimetric method was established for the determination of soluble sugar content in fig fruit. The experimental results showed that the optimal color development time was 10 min, the optimal concentration of sucrose standard solution was 100 μg·mL-1, and the optimal cooling colorimetric time was 20 min. The regression equation y=0.005x+0.153 4 (R2=0.998 2). By detecting figs with different ripeness, it was found that the change trend of sugar content was consistent with the change trend of soluble sugar content, and the soluble sugar content could be used as a quality control index for fig products.
Keywords: fig; soluble sugar; anthrone-sulfuric acid colorimetry
可溶性糖在水果和蔬菜中的重要性是显而易见的,主要由单糖和寡糖组成。果蔬品质和成熟度会影响糖含量,因此评估果蔬生理状态的重要性不言而喻[1-2]。除了苯酚-硫酸法[3]、酶法[4]、高效液相色谱法[5]等方法外,蒽酮-硫酸比色法因其简便、准确而获得广泛使用。该方法通过糖类与硫酸反应生成脱水产物,再与蒽酮试剂反应,形成特定色素,颜色深浅与糖含量成正比[6]。因此,蒽酮-硫酸比色法是一种灵敏、简单、经济、易操作的糖含量测定方法,有助于快速准确地评估果蔬糖类含量,提供重要数据支持,推动果蔬生产和营养研究的发展[7]。
无花果风味独特,含有丰富的果糖、葡萄糖、氨基酸、维生素和微量元素等物质,药用价值高[8]。无花果的甜味主要来源于高含量的果糖和葡萄糖,这些可溶性糖不仅影响其口感,还对不同成熟度的无花果的口感和贮藏特性产生重要影响。因此,测定无花果不同成熟度的可溶性糖含量对评价无花果品质和无花果保鲜具有重要意义。通过研究和了解无花果中的可溶性糖含量,能够更好地挖掘其营养和药用价值,同时为无花果产业的发展提供有效支持。
1 材料与方法
1.1 材料
采用威海市荣成无花果种植交易中心提供的原材料,分别选择七成熟、八成熟和十成熟不同阶段的无花果进行实验。保证果实新鲜完整,无损伤、无病虫害,且形态、色泽、大小一致[9]。挑选后将这些果实装入泡沫箱,运送至实验室进行后续处理[10]。
1.2 仪器与设备
分光光度计(UV754N)、手持式折射仪(WZS-32手持糖度计)、干燥箱(DHG-9053A)、水浴锅(GSY—II)、离心机(TD4)、比色管(25 mL)、移液管(1 mL、2 mL、10 mL)、研钵、滤纸、漏斗、玻璃棒、离心管、容量瓶(100 mL)、电子分析天平(ME104E)等。
1.3 试剂配制
1.3.1 蒽酮-乙酸乙酯试剂
取分析纯蒽酮试剂1.0 g,精确称量后,以50 mL分析纯乙酸乙酯溶解,确保均匀混合后,贮存于棕色瓶中,并在避光暗处保存。每次使用前,轻摇使溶液均匀。若出现结晶,可通过电炉适度加热溶解,确保实验所需溶液的纯度与稳定性。
1.3.2 1%蔗糖标准液
将蔗糖试剂(分析纯)在80 ℃恒温干燥箱中烘干至恒定重量后,精密称取1.000 g,先加入少量蒸馏水溶解,随后向100 mL的容量瓶中加入适量蒸馏水以进行初步溶解,接着缓慢倒入0.5 mL浓硫酸,并使用蒸馏水定容至刻度。
1.3.3 蔗糖标准溶液的配制
蔗糖标准溶液(100 μg·mL-1)配制:用移液管精确吸取1.0 mL 1%蔗糖标准液,将其置于100 mL容量瓶中,并加入适量蒸馏水至刻度线,随后摇匀即可。
蔗糖标准溶液(50 μg·mL-1)配制:取0.5 mL 1%蔗糖标准液至100 mL容量瓶,加入蒸馏水至刻度线,摇匀混合即可。
蔗糖标准溶液(10 μg·mL-1)配制:使用10 mL移液管量取100 μg·mL-1蔗糖标准溶液,置于100 mL容量瓶中,加入蒸馏水至刻度线定容,摇匀混合即可。
1.4 显色时间、蔗糖标准溶液浓度的确定
分别取10 μg·mL-1、50 μg·mL-1、100 μg·mL-1蔗糖标准溶液各1 mL,加入不同比色管内,向比色管中按顺序加入0.5 mL蒽酮和4.5 mL浓硫酸,充分振荡,加盖后立即将比色管放入沸水浴中,经逐管、准确沸水浴保温2 min、4 min、6 min、8 min、10 min、12 min之后,取出比色管,于自来水中冲洗至室温后,在630 nm波长下,利用紫外分光光度计对吸光度进行测量,并以蒸馏水作为参照物,每支比色管需重复进行3次测量以确保结果的准确性。
1.5 显色后冷却比色时间的确定
在不同的比色管中各加入1 mL的100 μg·mL-1蔗糖标准溶液,按顺序加入0.5 mL蒽酮和4.5 mL浓硫酸于各比色管内,充分振荡,加盖后立即将比色管放入沸水浴中,经逐管、准确沸水浴保温10 min之后,取出比色管,于自来水中冲洗至室温,样品冷却10 min、12 min、14 min、16 min、18 min、20 min、22 min、24 min、26 min和28 min后,利用紫外分光光度计分别测量630 nm处的吸光度,并以蒸馏水作为参照物,每支比色管进行3次重复测量。
1.6 标准曲线的制作
取6支25 mL比色管(每个样品两组重复),依次编号后,加入100 μg·mL-1蔗糖溶液和适量蒸馏水(见表1)。随后向比色管内加入0.5 mL蒽酮和4.5 mL浓硫酸,振荡后盖好,放入沸水浴中保温10 min后取出,自来水下冷却至室温。以0号管为对照,使用紫外分光光度计,在630 nm波长下测量吸光度。每支比色管重复测定3次。若吸光度超过0.8,则需要稀释后重新测定,使用Excel制作标准曲线。
1.7 无花果中可溶性糖的提取及测定
1.7.1 提取
取七成熟、八成熟、十成熟无花果果肉各1.0 g,尽量剪碎,置于研钵中,研磨成浆状。随后转入比色管中,加入10 mL蒸馏水,加盖后用封口膜封口,在沸水浴煮沸提取30 min,取出,置于自来水中冲洗至室温。滤液转入100 mL容量瓶中。剩余残渣回收到比色管中,添加10 mL蒸馏水,沸水浴中加热10 min,冷却过滤后转入容量瓶中合并滤液。比色管和残渣用水漂洗,滤液转移到100 mL容量瓶内合并滤液,蒸馏水定容。
1.7.2 测定
分别取七成熟、八成熟、十成熟无花果果实样本提取液0.5 mL至25 mL的比色管中,加1.5 mL蒸馏水,向比色管中按顺序分别加入0.5 mL蒽酮和4.5 mL浓硫酸,充分振荡后,立即将比色管置于沸水浴中,经逐管、准确沸水浴保温10 min后,取出置于自来水中冲洗至室温,测定样品提取液在630 nm处的吸光度值。重复测定3次。根据吸光度值折合蔗糖含量,用式(1)计算不同成熟度无花果的可溶性糖含量。
式中:c为从标准曲线检索的对应的蔗糖质量,µg;v为无花果果实样本提取液总体积,mL;N为样品提取液稀释倍数;vs为测定时所取样本提取液体积,mL;W为样品重量,g。
1.8 无花果糖度测定
取七成熟、八成熟、十成熟无花果样品(果肉部分5.0 g),放入研钵中研磨成浆状,将浆液转入离心管中,4 000 r·min-1离心10 min,随后取上清液进行糖度测定。
2 结果与分析
2.1 显色时间和蔗糖标准溶液浓度的确定
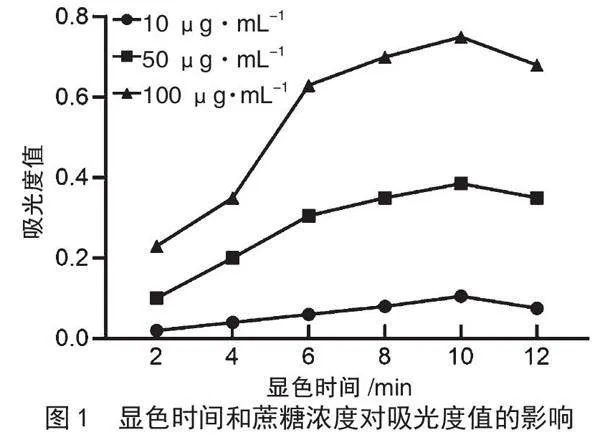
根据图1的结果,不同蔗糖标准溶液浓度和不同显色时间下的吸光度值存在差异。随着显色时间延长,蔗糖溶液的吸光度值逐渐增加,在10 min时达到最大值,然后稍有减少。不同蔗糖标准溶液浓度在显色10 min时吸光度值均达到峰值,浓度越高吸光度值越大。100 μg·mL-1蔗糖标准溶液的吸光度值范围适中,因此选择10 min显色时间和100 μg·mL-1蔗糖标准溶液制作标准曲线。
2.2 冷却比色时间的确定
如图2所示,随着冷却时间延长,蔗糖标准溶液的吸光度逐渐增加,冷却20 min后吸光度值开始稳定。因此,在本实验中,选择冷却20 min进行比色。
2.3 标准曲线绘制
根据蔗糖标准溶液中蔗糖质量和对应的630 nm处吸光度值,制作标准曲线(图3)。回归方程为y=0.005x+0.153 4(R2=0.998 2),其中x为蔗糖质量(μg),y为吸光度值。
2.4 不同成熟度无花果中可溶性糖含量
不同成熟度无花果可溶性糖含量如图4所示,七成熟、八成熟和十成熟无花果果实的可溶性糖含量分别为4.88%、11.71%、12.08%。说明随着无花果成熟度的提升,可溶性糖逐渐积累。相比七成熟果实,八成熟和十成熟果实可溶性糖含量上升明显,尤其从七成熟转变为八成熟时,糖的积累速度明显较快。因此,可溶性糖含量可作为无花果成熟度判断的重要指标之一。
2.5 不同成熟度无花果糖度
无花果果实的可溶性糖含量随着成熟度增加而提高,影响其口感和甜度。如图5所示,七成熟无花果果实的糖度为13.89%,十成熟无花果果实的糖度可达18.03%,糖度上升明显,说明无花果在成熟过程中逐渐累积可溶性糖类等物质。这一结果与图4中的可溶性糖含量变化趋势相符,显示糖类对无花果果实的甜度有显著影响。果实的糖度增加可提升果实口感和甜味,因此了解无花果糖类含量对产品质量的评估具有重要意义。
3 结论
蒽酮-硫酸比色法利用浓硫酸将样品提取液中的多糖水解成单糖,因此适用于几乎所有碳水化合物的测定。通过本研究确定了蒽酮-硫酸比色法的显色反应时间、蔗糖标准溶液浓度和冷却比色时间,明确了测定不同成熟度无花果中可溶性糖含量的方法和条件。水果和蔬菜组织中的可溶性糖含量与其品质、成熟度和贮藏性密切相关。糖类是水果和蔬菜的重要贮能物质,也是其甜味的来源。无花果果实的糖度随着无花果成熟度的提升而持续升高。可溶性糖含量可作为无花果成熟度判断的重要指标之一,具有重要意义。本研究为无花果成熟度评估提供了有效的测试方法和关键参数。
参考文献
[1] DE SOUZA MACHADO A A,LAU C W,TILL J,et al.
Impacts of microplastics on the soil biophysical environment[J].Environmental Science amp; Technology,2018,52(17):9656-9665.
[2]HUERTA LWANGA E,GERTSEN H,GOOREN H,et al.Microplastics in the terrestrial ecosystem: implications for Lumbricus terrestris (Oligochaeta, Lumbricidae)[J].Environmental Science amp; Technology,2016,50(5):2685-2691.
[3]SERNA-GALVIS E A,TROYON J A,GIANNAKIS S,et al.Photoinduced disinfection in sunlit natural waters: measurement of the second order inactivation rate constants between E. coli and photogenerated transient species[J].Water Research,2018,147:242-253.
[4]KVIATKOVSKI I,MINZ D.A member of the Rhodobacteraceae promotes initial biofilm formation via the secretion of extracellular factor(s) [J].Aquatic Microbial Ecology,2015,75(2):155-167.
[5]LIANG S,LIN H,YAN X,et al.Electro-oxidation of tetracycline by a Magnéli phase Ti4O7 porous anode: kinetics, products, and toxicity[J].Chemical Engineering Journal,2018,332:628-636.
[6]LI L,SHAN D,ZHOU C.Preparation and degradation of PLA/chitosan composite materials[J].Journal of Applied Polymer Science,2004,91(1):274-277.
[7]INSOMPHUN C,CHUAH J-A,KOBAYASHI S,et al.Influence of hydroxyl groups on the cell viability of polyhydroxyalkanoate (PHA) scaffolds for tissue engineering[J].ACS Biomaterials Science amp; Engineering,2017,3(12):3064-3075.
[8]吴亚林,黄静,潘远江.无花果多糖的分离、纯化和鉴定[J].浙江大学学报(理学版),2004(2):177-179.
[9]苏云婷,范琳,潘世会.威海市不同成熟度青皮无花果春果的形态和质构分析[J].乡村科技,2022,13(20):75-79.
[10]罗自生.气改贮藏对桑果生理的影响[J].中国食品学报,2003(3):51-54.
作者简介:苏云婷(1990—),女,山东济宁人,博士,讲师。研究方向:生物技术和生物制品研发等。
通信作者:潘世会(1989—),男,山东济宁人,博士,实验师。研究方向:食品生物技术等。E-mail:panshihui@sdu.edu.cn。

