东北温带森林不同材性树种木质部解剖和水力性状


摘要:【目的】木质部解剖结构影响树木水分运输效率和抗旱能力,进而影响树木的生长和生存,因此,研究木质部解剖和水力性状有利于阐明树木应对环境变化的响应和适应机制。【方法】以东北温带森林20种主要树种(11种散孔材、5种环孔材和4种无孔材)为研究对象,比较不同材性树种茎解剖性状和水力性状的差异,并分析水力性状与解剖性状之间的关系。【结果】不同材性树种的解剖性状[导管(管胞)平均直径、最大导管(管胞)直径、导管(管胞)密度、平均导管(管胞)面积、管腔面积占比]和水力性状[理论导水率、水力直径、导管(管胞)机械强度、胡伯尔值(边材面积/叶面积)]
均差异显著(Plt;0.05)。环孔材树种理论导水率显著高于散孔材和无孔材(Plt;0.05),而无孔材树种管胞机械强度显著高于散孔材和环孔材树种的导管机械强度(Plt;0.05)。理论导水率与所有解剖性状均呈显著相关关系(Plt;0.05);除导管(管胞)壁厚度和最大导管长度以外,胡伯尔值与其他解剖性状均显著相关(Plt;0.05),但木材密度与所有解剖性状(导管长度除外)的关系均不显著。【结论】木材密度不能反映东北温带森林树木的水力性状,树木茎导水能力依赖于木质部解剖结构和树木水分供需平衡关系。
关键词:木质部解剖;水力性状;木材密度;胡伯尔值;木材材性
中图分类号:S718;TS612 文献标志码:A开放科学(资源服务)标识码(OSID):
文章编号:1000-2006(2024)03-0229-08
Xylem anatomical and hydraulic traits of trees with different wood properties in a temperate forest in northeast China
ZHANG Rui, ZHOU Zhenghu, WANG Chuankuan, JIN Ying*
(Center for Ecological Research, Key Laboratory of Sustainable Forest Ecosystem Management-Ministry of Education, Northeast Forestry University, Harbin 150040, China)
Abstract:【Objective】Xylem anatomy affects the water transport efficiency and drought resistance of trees, which in turn affects tree growth and survival. Therefore, studying xylem anatomical and hydraulic traits will enable a better understanding of the response and adaptation mechanisms of trees to environmental changes. 【Method】Here, we measured xylem anatomical and hydraulic traits in 20 tree species with three different wood properties (11 diffuse-porous, 5 ring-porous, and 4 non-porous) in a temperate forest in northeastern China. Our aim was to examine the differences in stem anatomical and hydraulic traits of tree species with three different wood properties and explore the potential relationships between stem hydraulic and anatomical traits. 【Result】We found that there were significant differences in the anatomical traits (mean vessel (tracheid) diameter, maximum vessel (tracheid) diameter, vessel (tracheid) density, mean vessel (tracheid) area, proportion of lumen area), and hydraulic traits (theoretical hydraulic conductivity, hydraulic diameter, vessel (tracheid) mechanical strength, Huber value) among the tree species with different woody properties (Plt;0.05). The ring-porous trees had the highest theoretical hydraulic conductivity, whereas the non-porous trees had the highest tracheid mechanical strength. Theoretical hydraulic conductivity was significantly correlated with all anatomical traits. Huber values (sapwood area/leaf area) were significantly correlated with all anatomical traits (Plt;0.05), except vessel (tracheid) wall thickness and maximum vessel length. However, there were no significant correlations between wood density and all anatomical traits (except vessel length). 【Conclusion】We concluded that wood density cannot better reflect the hydraulic traits of trees in temperate forests in northeastern China and that their water transport capacity is dependent on the xylem anatomical structure and the balance between a tree’s supply and demand for water.
Keywords:xylem anatomy; hydraulic traits; wood density; Huber values; wood property
树木木质部主要负责从根到叶片的水分和养分运输,并为维管植物提供机械支撑[1-2]。木质部解剖结构特性,如导管直径、壁厚、密度、排列方式、长度和纹孔特性等,影响树木的水分运输效率和抗旱能力,进而影响树木的生长和生存[2-4]。水分运输效率较高的树种通常具有较大的导管直径和长度,较低的导管密度[5-7],而这些解剖结构均会导致较低的栓塞抵抗力。不同材性树种具有不同的木质部解剖结构,使其水分运输效率和栓塞抵抗力存在显著差异。无孔材树种木质部结构相对简单,90%都是由管胞组成,其较低的管胞直径和管胞长度导致其导水率较低[8]。阔叶树种通常划分为散孔材和环孔材两个功能类群:与环孔材相比,散孔材树种的导管在一个年轮里分布均匀,其导管数目较多,孔径较小,导管较短[9]。环孔材树种是在散孔材树种的基础上进化而来的,在环孔材树种的年轮里,能够明显区分出早材和晚材,早材导管孔径比晚材导管孔径大,且导管数目较少,长度较长[10]。因此,研究木质部解剖性状有助于理解树种的水力结构,为揭示3种材性树种的水力适应性和耐旱机制提供科学依据。
干旱和冻融事件是诱导木质部栓塞的主要原因[11]。无孔材树种由于其较低的管胞直径和较大的管胞密度,使其导水率较低,对干旱和冻融事件具有较强的抵抗力[12]。环孔材树种具有较大的导管直径和较长的导管长度使其导水率较高,但这是以牺牲对干旱和冻融诱导栓塞的抵抗力为代价的,散孔材树种介于两种材性之间[10]。然而,Skelton等[13]研究北美西部19种橡树(Quercus spp.)树种的茎栓塞脆弱性,发现环孔材树种对干旱诱导的栓塞并不一定脆弱;Yin等[14]整合分析全球140种树种的水力数据时发现部分针叶树种的栓塞脆弱性比散孔材和环孔材树种更高。因此,研究3种材性树种的木质部解剖结构,有助于揭示不同材性树种的水分运输效率和对干旱及冻融事件的抵抗力。
木材密度和胡伯尔值(Huber values,HV)是反映植物碳分配的重要性状。以往研究及一些生态系统模型中通常用木材密度反映植物的输水能力和栓塞抵抗力[15-16],且假设木材密度较高的植物,其更多的碳用于加固导管壁厚,导致导管直径较小,导管密度增加,进而使得该树种导水率和栓塞抵抗力较低。胡伯尔值是边材面积与支撑叶面积的比值,反映边材面积和叶面积的相对分配,是衡量植物水分平衡和干旱响应的重要参数[17-18]。在干旱环境下,植物会通过增加胡伯尔值以提高单位边材面积给叶片提供水分的能力[17]。然而,胡伯尔值与导管(管胞)面积、导管(管胞)平均直径以及导管(管胞)密度等解剖性状的关系还不明确。
东北温带森林占我国森林面积和蓄积量1/3以上,对维持全国经济和生态安全具有举足轻重的作用[19],但该区域的温带森林将面临干旱胁迫的影响[20-21]。鉴于此,本研究以东北温带森林20种主要树种为研究对象,测定茎解剖和水力性状,比较3种材性树种茎水力性状和解剖性状的差异,分析水力性状与解剖性状的关系,为预测树木对气候变化的适应性提供参考依据。
1 材料与方法
1.1 研究地概况
研究样地位于黑龙江省帽儿山森林生态系统国家野外科学观测研究站(127°30′ E,45°20′ N),平均海拔400 m,平均坡度10°~15°。地带性土壤为暗棕色森林土。该地区受大陆性季风气候影响,四季分明,夏季温和且湿润,冬季寒冷而干燥,平均年降水量约723 mm,81%的降水集中在5—9月,年均气温2.8 ℃,1月平均气温-20.7 ℃,7月平均气温20.5 ℃。无霜期130~172 d[21]。
1.2 树种选择
帽儿山森林生态站的典型植被是原始阔叶红松林皆伐后形成的天然次生林(落叶阔叶树种组成)和人工林(主要造林树种是针叶树)。选择东北温带森林20种主要乔木树种,分别代表3种材性,包括11种散孔材树种、5种环孔材树种,以及4种无孔材树种(表1)。每个树种选取成熟且健康的3株样木,于2019年的生长季通过爬树并结合高枝剪获取树冠上部、长势良好且向阳的枝条,带回实验室进行测定。茶条槭(Acer tataricum subsp. ginnala)、稠李(Prunus padus)、暴马丁香(Syringa reticulata subsp. amurensis)、青楷槭(Acer tegmentosum)4种树种树龄为10~20 a,其他所有树种的林龄均为40~50 a。
1.3 茎解剖性状测定
从每个树种剪下来的大枝上选择一段长2~3 cm、直径0.8~1.2 cm的3~4年生茎段,去掉树皮放在固定液(体积分数70%乙醇、甲醛、乙酸体积比为9∶0.5∶0.5;固定液用量为样品体积的50倍)中,并将固定液放在4 ℃冰箱中保存。回到实验室以后,用GSL-1 Microtome切片机在每个茎段的横切面上切取15~25 μm厚的完整薄片,切片用质量分数为0.1%番红染液染色5~6 min,染色完成后将切片放入清水中漂洗浮色,然后用酒精对切片进行脱色处理,制成临时装片。在显微镜(Olympus BX53)20倍下获取不同方向的横切面照片,取最外层3年均匀分布的3个扇面。拍照结束以后用中性树胶与二甲苯(体积比1∶1)的混合液制成永久封片进行保存。
使用ImageJ软件的多功能选择工具识别导管和管胞。直接测定导管(管胞)平均面积(A,μm2),每个扇面至少测量2 000~3 000个管胞或100~500个导管。导管(管胞)平均直径(D,μm)根据每个管腔的横切面积与直径的关系[22]
计算得到:D=4A/π。由于实际的水分输送效率会受到导管(管胞)不规则形状、管腔直径的纵向变化以及导管(管胞)壁不规则结构的影响,所以使用水力直径(Dh,mm)对导管(管胞)平均直径进行校正[23],计算公式如下:
式中:n为导管(管胞)数量。
使用哈根泊肃叶方程计算理论导水率[23] [Kh,kg/(m·MPa·s)],用来反映导管(管胞)水平的水分运输效率:
式中:ρω为水在20 ℃的密度(998.2 kg/m3);η为水在20 ℃的黏滞系数(1.002 × 10-3 Pa·s);VD为导管(管胞)密度,个/mm2,通过所测量区域导管(管胞)数量除以该区域面积得到;Dh为水力直径,mm。
选择已经测量导管(管胞)面积的区域,测量50~150个相邻导管(管胞)壁厚度,具体数量根据导管(管胞)密度进行确定;导管(管胞)机械强度为导管(管胞)双壁厚度与管腔直径比值的平方[24];导管(管胞)面积占比为导管(管胞)总面积与所测量区域面积的比值[25]。
1.4 最大导管长度测定
从剪下来的大枝上选择长1.5 m的枝条,采用气体注入法测定最大导管长度[26]。将枝条一端放入水中,另一端与注气设备相连,缓慢持续地将空气注入到枝条内,放入水中的一端以1 cm的间隔剪断,直至有连续气泡出现,此时的枝条长度即为最大导管长度。
1.5 木材密度和胡伯尔值测定
从侧枝上选取3个长3 cm的茎段去除树皮,在清水中浸泡48 h。首先用排水法测定茎段体积,然后将样品放在75 ℃的烘箱中,烘干48 h,并记录干质量。木材密度(WD,g/cm3)是干质量与茎段体积的比值。此外,从剪下来的大枝上选择一个没有被剪过且没有掉叶的枝条,将所有的叶子取下来,用便携式扫描仪(Epson Perfection V330 Photo)扫描叶面积和茎段横截面积,测定枝条总叶面积(AL,m2)和木质部边材面积(AS,m2)。胡伯尔值(HV)是边材面积与叶面积的比值,即 HV = AS/AL。
1.6 数据分析
采用SPSS 22.0对所测数据进行统计分析。采用单因素分析法(one-way ANOVA)检验3种材性树种之间解剖性状与水力性状的差异性;采用回归分析分别建立理论导水率、木材密度、胡伯尔值与所有解剖性状之间的相关性。利用SigmaPlot 14.0软件作图。
2 结果与分析
2.1 不同材性树种茎解剖性状及水力性状间的差异
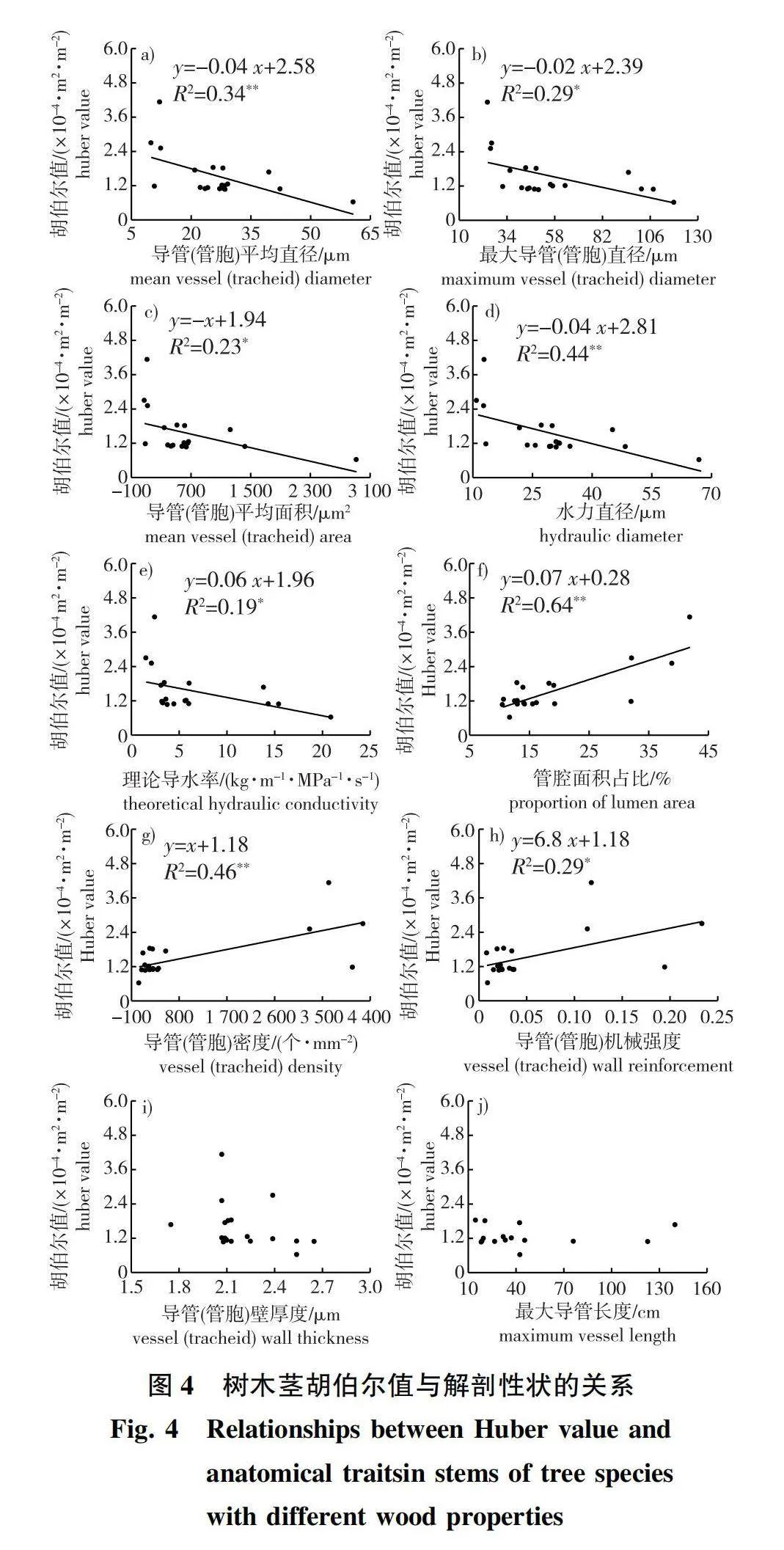
不同材性树种之间导管(管胞)平均直径、最大导管(管胞)直径、导管(管胞)平均面积、水力直径和理论导水率差异显著(Plt;0.05),均表现为环孔材gt;散孔材gt;无孔材,但散孔材与无孔材之间的导管(管胞)平均面积差异不显著(图1)。无孔材树种的管腔面积占比、导管(管胞)密度、导管(管胞)机械强度和胡伯尔值显著大于散孔材与环孔材(Plt;0.05),而散孔材与环孔材树种之间差异不显著。3种材性树种导管(管胞)壁厚度和木材密度差异均不显著。环孔材树种最大导管长度显著高于散孔材,是散孔材的3.4倍。由于无孔材树种的最大管胞长度较短,所以无法使用气体注入法测定,因此没有对无孔材树种的最大管胞长度进行测试。
2.2 树木茎水力性状与解剖性状的关系
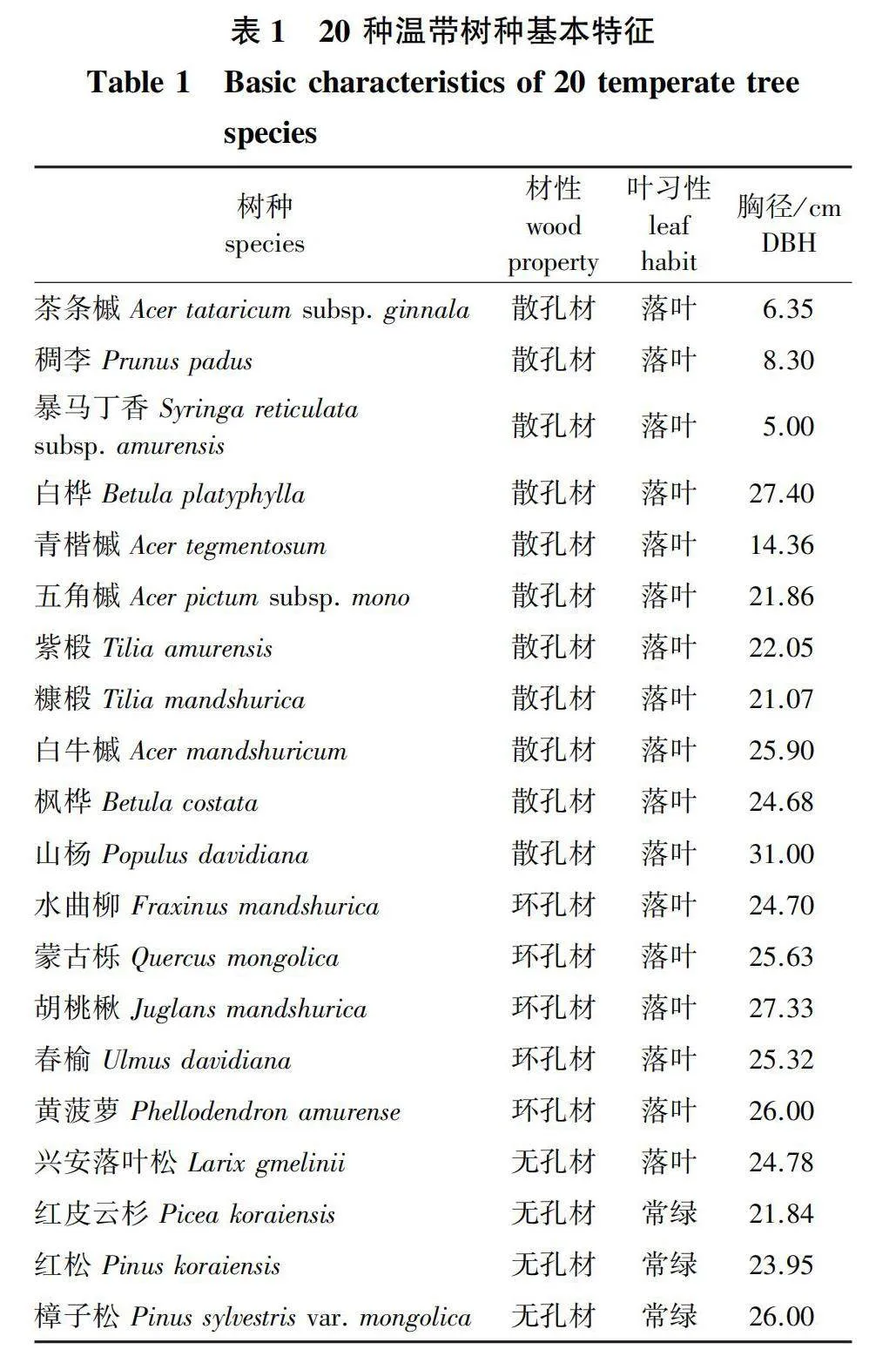
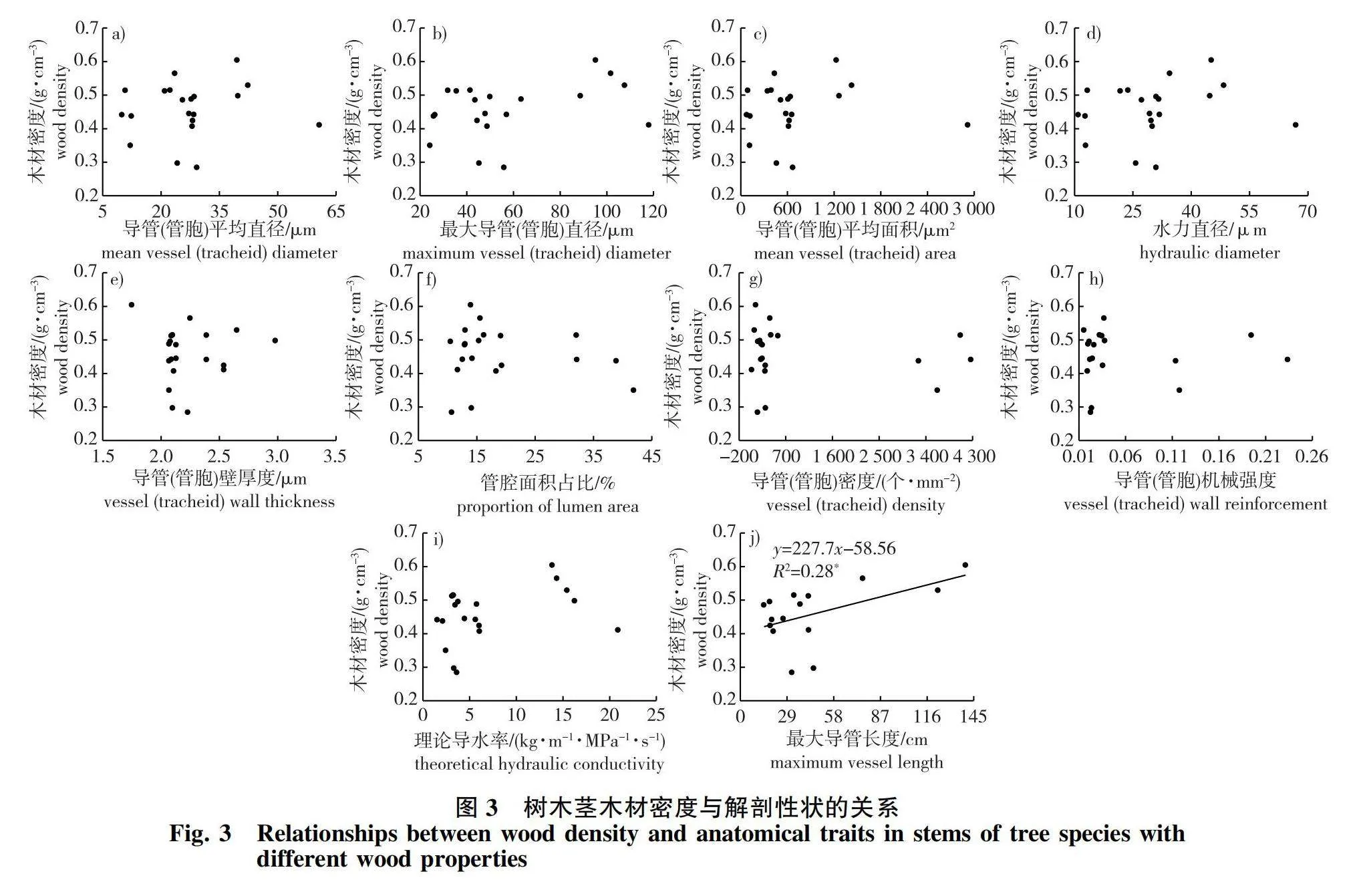
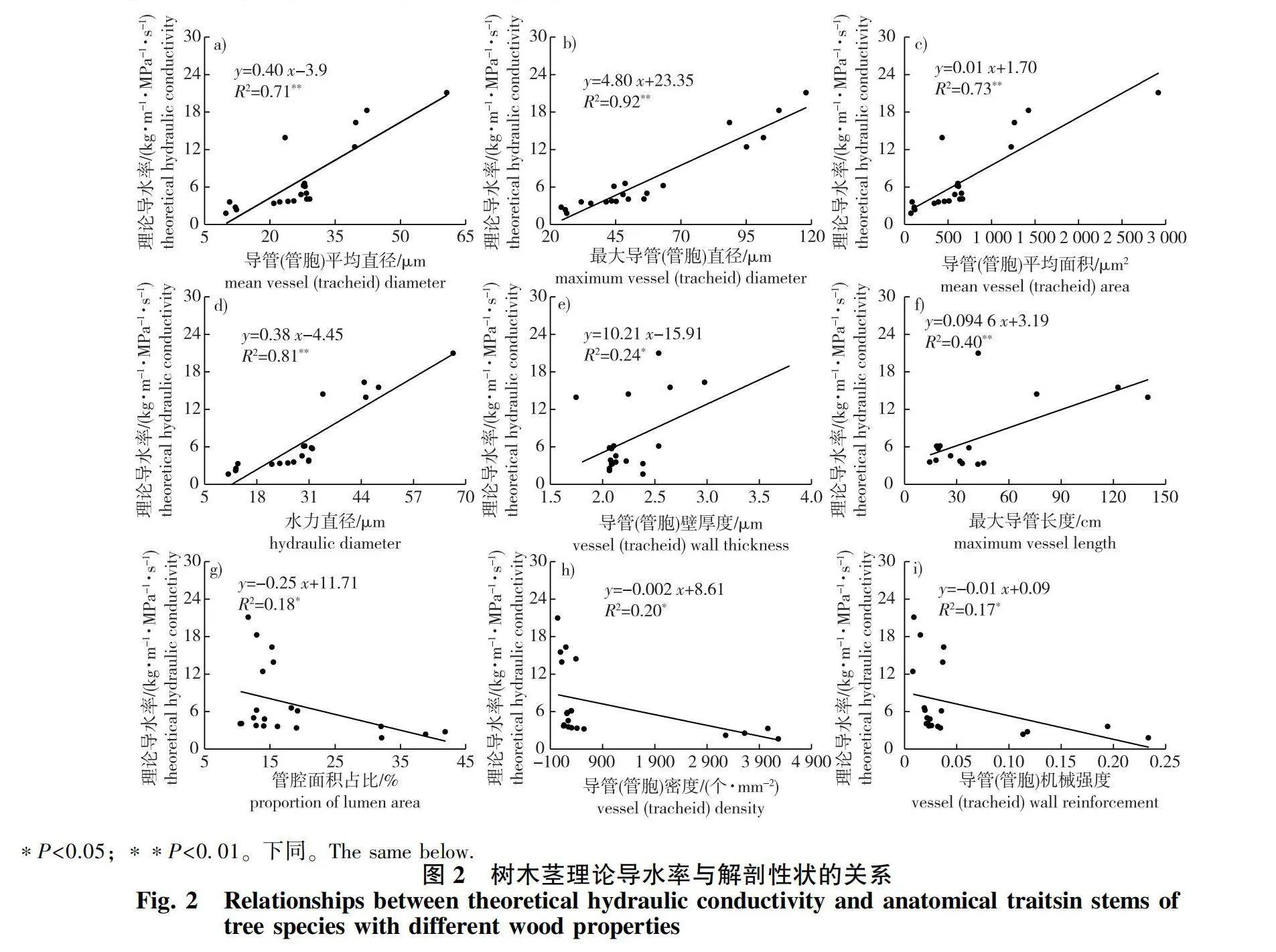
理论导水率与导管(管胞)平均直径、最大导管(管胞)直径、导管(管胞)平均面积、水力直径和最大导管长度均呈极显著正相关,而与导管(管胞)壁厚度管腔面积占比、导管(管胞)密度以及机械强度呈显著负相关(图2)。木材密度与解剖性状和水力性状均无显著相关关系,而被子植物的最大导管长度与木材密度呈显著正相关(图3)。胡伯尔值与导管(管胞)平均直径、最大导管(管胞)直径、导管(管胞)平均面积、水力直径和理论导水率均呈显著负相关,与管腔面积占比、导管(管胞)密度、导管(管胞)机械强度呈显著正相关,与导管(管胞)壁厚度和最大导管长度关系不显著(图4)。
3 讨 论
3.1 茎木质部解剖和水力性状的变异性
Chave等[5]的全球整合分析研究发现木材平均导管(管胞)直径、最大导管长度和理论导水率的变化范围分别为10~500 μm、0.1~1 800 cm和0.3~200 kg/(m·MPa·s)。本研究地区20个树种的导管(管胞)直径变化范围为9.97~60.71 μm,最大导管长度为14.70~139.97 cm,理论导水率为1.55~20.91 kg/(m·MPa·s),位于全球树种变化范围的低数值区间段。一般而言,导管越长越宽,其对水流的阻力就越小,而较大的导管直径会大大降低安全性,尤其是对冻融诱导的空穴化更为脆弱[5, 24]。本研究地区树种位于我国温带地区,冬季易发生冻融诱导的栓塞事件,因此,其较低的导管(管胞)直径和最大导管长度降低了冬季发生冻融诱导栓塞的风险,但同时也降低了这些树种的理论导水率[20]。Niu等[27]报道了长白山地区主要树种(其中很多树种与本研究相同)的茎解剖特征,研究发现长白山地区散孔材和环孔材树种水力直径的平均值分别为31.21和86.39 μm,均高于本研究地区的树种(28.50和47.99 μm)。而帽儿山地区(年均温为2.8 ℃,年降水量为723 mm)比长白山地区(年均温为3.3 ℃,年降水量为695 mm)气候更加湿润寒冷,这进一步证明本研究地区的树种会通过调整解剖性状来适应低温环境。
3.2 不同材性树种水力性状差异的解剖机制
不同材性树种理论导水率差异显著(Plt;0.05),且环孔材和散孔材树种显著高于无孔材,这可能是由于环孔材和散孔材树种依靠直径较大的导管进行水分运输。而无孔树种较大的管胞密度,使其管胞腔面积占比显著高于其他两种材性树种,但这并没有补偿其低管胞直径导致的低导水率。此外,还发现理论导水率与最大导管长度显著正相关,这是因为导管长度越长,水流通过导管间的次数越少,产生的阻力也越小[28]。Steppe等[29]基于欧洲水青冈(Fagus sylvatica)和夏栎(Quercus robur)的研究发现环孔材树种的理论导水率显著高于散孔材,与本研究结果相似。
导管(管胞)机械强度是导管(管胞)双壁厚度与管腔直径比值的平方,用来支撑木质部管道网络以抵抗由负压引起的内爆[30]。在充水和充气导管之间的双壁中会产生较大的弯曲应力,细胞壁必须足够坚固以承受这种应力,因此,在负压下运输水分的管道需要加固木质化的细胞壁以防止管道破裂[31]。本研究发现无孔材树种管胞机械强度显著高于散孔材和环孔材树种(Plt;0.05),表明无孔材树种较大的管胞机械强度可避免植物在负压下木质部管胞壁的破坏,从而防止栓塞的形成。本研究中,无孔材树种的管胞直径显著小于散孔材和环孔材,管胞密度和管胞面积占比显著高于散孔材和环孔材树种。无孔材树种较小的管胞直径使其管腔中所含的气体较少且气泡的直径也相对较小,因此更不易发生栓塞[32]。而较大的管胞密度也增加了运输路径的冗余,即发生栓塞时有更多的功能型管胞可以代替栓塞管胞发挥作用[33],且单位面积内更多的管胞意味着单位面积内细胞壁占比较多而管腔占比较少,这进一步限制了气体扩散[32-33],从而降低栓塞发生的风险。此外,以往研究普遍认为与散孔材相比,环孔材树种栓塞脆弱性较高是由于其具有较低的导管机械强度、导管密度、导管壁厚度[27, 34]。然而,本研究发现散孔材和环孔材树种之间导管机械强度、导管密度、导管壁厚度差异均不显著,这表明单独的解剖性状并不能完全解释物种的抗栓塞能力,可能还受纹孔结构的影响[13]。殷笑寒等[28]的研究表明,与散孔材树种相比,环孔材树种较低的栓塞抵抗力是由于其拥有较大的纹孔开口面积和纹孔开口比例。
3.3 木材密度和胡伯尔值与解剖性状的关系
本研究发现尽管环孔材、散孔材和无孔材树种导管(管胞)直径、导管(管胞)面积、导管(管胞)密度以及导管(管胞)面积占比等解剖性状差异显著,但木材密度差异不显著,且木材密度与理论导水率和导管(管胞)机械强度等解剖性状之间并无显著相关性,说明木材密度并不能反映本研究地区树种的导水能力和栓塞抵抗力。Santiago等[35]研究法属圭亚那的14个亚马逊雨林树种时发现木材密度与茎导水能力无显著相关性,Zanne等[36]也认为木材密度是一种几乎与导水能力完全无关的性状。此外,木材密度与导管(管胞)直径、导管(管胞)面积、导管(管胞)密度、导管(管胞)壁厚以及导管(管胞)面积占比之间均没有显著的相关性,这可能是由于木材密度主要与起机械支撑作用的纤维细胞特性相关[37-39]。在今后的研究中,需要直接测量纤维细胞直径和密度等解剖性状来解释茎水力结构的差异。
本研究发现无孔材树种的胡伯尔值显著高于散孔材和环孔材(Plt;0.05),这与李媛媛[20]的研究结果一致,说明管腔较大的散孔材与环孔材树种,采取高效输水的水分运输策略,保证叶片得到充足的水分供应,从而使叶片在水分充足时期尽可能地多积累光合产物[40]。本研究还发现胡伯尔值与反映植物导水能力的解剖性状[平均导管(管胞)直径、平均导管(管胞)面积、最大导管(管胞)直径、水力直径、理论导水率]呈显著负相关关系,与反映植物抗旱能力的解剖性状[导管(管胞)密度和机械强度]呈显著正相关关系,表明本研究地区树种茎的“导水能力-栓塞抗性-叶茎碳分配比例(胡伯尔值)”之间存在相关关系。无孔材树种较小的管胞直径和管胞面积,使其输水能力较低,但木质部栓塞抵抗力较高。根据植物水分运输能力与结构调整之间的平衡关系,无孔材树种会减少单位边材面积支持的叶面积(高胡伯尔值),以补偿其较低的水分运输效率[17]。与本研究相似,Oyanoghafo等[41]指出胡伯尔值越大越抗旱,且较高的胡伯尔值是一种干旱回避策略,有助于植物在高蒸发需求时期减少植物的暴露和压力,进而适应干旱的环境[42]。
参考文献(reference):
[1]SPERRY J S, MEINZER F C, MCCULLOH K A. Safety and efficiency conflicts in hydraulic architecture:scaling from tissues to trees[J]. Plant Cell Environ, 2008, 31(5): 633-645. DOI: 10.1111/j.1365-3040.2007.01765.x.
[2]ZHANG S B, WEN G J, QU Y Y, et al. Trade-offs between xylem hydraulic efficiency and mechanical strength in Chinese evergreen and deciduous savanna species[J]. Tree Physiol, 2022, 42(7): 1337-1349. DOI: 10.1093/treephys/tpac017.
[3]荆烁, 孙慧珍. 东北东部山区主要树种枝条及其组分水力特征[J]. 南京林业大学学报(自然科学版), 2021, 45(4): 159-166. JING S, SUN H Z. The hydraulic characteristics of the whole branch and its components of the major tree species in the eastern region of northeast China[J]. J Nanjing For Univ (Nat Sci Ed), 2021, 45(4): 159-166. DOI: 10.12302/j.issn.1000-2006.202003027.
[4]GLEASON S M, WESTOBY M, JANSEN S, et al. Weak tradeoff between xylem safety and xylem-specific hydraulic efficiency across the world’s woody plant species[J]. New Phytol, 2016, 209(1): 123-136. DOI: 10.1111/nph.13646.
[5]CHAVE J, COOMES D, JANSEN S, et al. Towards a worldwide wood economics spectrum[J]. Ecol Lett, 2009, 12(4): 351-366. DOI: 10.1111/j.1461-0248.2009.01285.x.
[6]TRUEBA S, DELZON S, ISNARD S, et al. Similar hydraulic efficiency and safety across vesselless angiosperms and vessel-bearing species with scalariform perforation plates[J]. J Exp Bot, 2019, 70(12): 3227-3240. DOI: 10.1093/jxb/erz133.
[7]徐茜, 陈亚宁. 胡杨茎木质部解剖结构与水力特性对干旱胁迫处理的响应[J]. 中国生态农业学报, 2012, 20(8): 1059-1065. XU Q, CHEN Y N. Response of anatomy and hydraulic characteristics of xylem stem of Populus euphratica Oliv. to drought stress[J]. Chin J Eco Agric, 2012, 20(8): 1059-1065. DOI: 10.3724/SP.J.1011.2012.01059.
[8]MCCULLOH K, SPERRY J S, LACHENBRUCH B, et al. Moving water well: comparing hydraulic efficiency in twigs and trunks of coniferous, ring-porous, and diffuse-porous saplings from temperate and tropical forests[J]. New Phytol, 2010, 186(2): 439-450. DOI: 10.1111/j.1469-8137.2010.03181.x.
[9]李吉跃, 翟洪波. 木本植物水力结构与抗旱性[J]. 应用生态学报, 2000, 11(2): 301-305. LI J Y, ZHAI H B. Hydraulic architecture and drought resistance of woody plants[J]. Chin J Appl Ecol, 2000, 11(2): 301-305. DOI: 10.13287/j.1001-9332.2000.0079.
[10]BUSH S E, PATAKI D E, HULTINE K R, et al. Wood anatomy constrains stomatal responses to atmospheric vapor pressure deficit in irrigated, urban trees[J]. Oecologia, 2008, 156(1): 13-20. DOI: 10.1007/s00442-008-0966-5.
[11]MCCULLOH K A, AUGUSTINE S P, GOKE A, et al. At least it’s a dry cold:the global distribution of freeze-thaw and drought stress and the traits that may impart poly-tolerance in conifers[J]. Tree Physiol, 2023, 43(1): 1-15. DOI: 10.1093/treephys/tpac102.
[12]PITTERMANN J, SPERRY J S. Analysis of freeze-thaw embolism in conifers: the interaction between cavitation pressure and tracheid size[J]. Plant Physiol, 2006a, 140(1): 374-382. DOI: 10.1104/pp.105.067900.
[13]SKELTON R P, ANDEREGG L D L, DIAZ J, et al. Evolutionary relationships between drought-related traits and climate shape large hydraulic safety margins in western North American oaks[J]. Proc Natl Acad Sci USA, 2021, 118(10): e2008987118. DOI: 10.1073/pnas.2008987118.
[14]YIN J J, BAUERLE T L. A global analysis of plant recovery performance from water stress[J]. Oikos, 2017, 126(10): 1377-1388. DOI: 10.1111/oik.04534.
[15]SANTIAGO L S, GOLDSTEIN G, MEINZER F C, et al. Leaf photosynthetic traits scale with hydraulic conductivity and wood density in Panamanian forest canopy trees[J]. Oecologia, 2004, 140(4): 543-550. DOI: 10.1007/s00442-004-1624-1.
[16]SWENSON N G, ENQUIST B J. Ecological and evolutionary determinants of a key plant functional trait:wood density and its community-wide variation across latitude and elevation[J]. Am J Bot, 2007, 94(3): 451-459. DOI: 10.3732/ajb.94.3.451.
[17]ZHU L W, ZHAO P. Climate-driven sapwood-specific hydraulic conductivity and the huber value but not leaf-specific hydraulic conductivity on a global scale[J]. Sci Total Environ, 2022, 857(1): 159334. DOI: 10.1016/j.scitotenv.2022.159334.
[18]MENCUCCINI M, ROSAS T, ROWLAND L, et al. Leaf economics and plant hydraulics drive leaf:wood area ratios[J]. New Phytol, 2019, 224(4): 1544-1556. DOI: 10.1111/nph.15998.
[19]WANG C K. Biomass allometric equations for 10 co-occurring tree species in Chinese temperate forests[J]. For Ecol Manag, 2006, 222(1/2/3): 9-16. DOI: 10.1016/j.foreco.2005.10.074.
[20]李媛媛. 东北主要树种关键物候期木质部水力结构变化特征[D]. 哈尔滨: 东北林业大学, 2019. LI Y Y. The xylem hydraulic architecture characteristics of key phenology for the major tree species of northeast China[D]. Harbin: Northeast Forestry University, 2019. DOI: 10.27009/d.cnki.gdblu.2019.000675.
[21]JIN Y, WANG C K, ZHOU Z H, et al. Contrasting responses of hydraulic traits between leaf and branch to 16-year nitrogen addition in a larch plantation[J]. For Ecol Manag, 2020, 475: 118461. DOI: 10.1016/j.foreco.2020.118461.
[22]SCHOLZ A, KLEPSCH M, KARIMI Z, et al. How to quantify conduits in wood?[J]. Front Plant Sci, 2013, 4: 56. DOI: 10.3389/fpls.2013.00056.
[23]POORTER L, MCDONALD I, ALARCÚN A, et al. The importance of wood traits and hydraulic conductance for the performance and life history strategies of 42 rainforest tree species[J]. New Phytol, 2010, 185(2): 481-492. DOI: 10.1111/j.1469-8137.2009.03092.x.
[24]HACKE U G, SPERRY J S. Functional and ecological xylem anatomy[J]. Perspect Plant Ecol Evol Syst, 2001, 4(2): 97-115. DOI: 10.1078/1433-8319-00017.
[25]CHEN Z C, ZHANG Y T, YUAN W J, et al. Coordinated variation in stem and leaf functional traits of temperate broadleaf tree species in the isohydric-anisohydric spectrum[J]. Tree Physiol, 2021, 41(9): 1601-1610. DOI: 10.1093/treephys/tpab028.
[26]ZHANG Q W, ZHU S D, JANSEN S, et al. Topography strongly affects drought stress and xylem embolism resistance in woody plants from a Karst forest in southwest China[J]. Funct Ecol, 2020, 35(3): 566-577. DOI: 10.1111/1365-2435.13731.
[27]NIU C Y, MEINZER F C, HAO G Y, et al. Divergence in strategies for coping with winter embolism among co-occurring temperate tree species:the role of positive xylem pressure, wood type and tree stature[J]. Funct Ecol, 2017, 31(8): 1550-1560. DOI: 10.1111/1365-2435.12868.
[28]殷笑寒, 郝广友. 长白山阔叶树种木质部环孔和散孔结构特征的分化导致其水力学性状的显著差异[J]. 应用生态学报, 2018, 29(2): 352-360. YIN X H, HAO G Y. Divergence between ring and diffuse-porous wood types in broadleaf trees of Changbai Mountains results in substantial differences in hydraulic traits[J]. Chin J Appl Ecol, 2018, 29(2): 352-360. DOI: 10.13287/j.1001-9332.201802.035.
[29]STEPPE K, LEMEUR R. Effects of ring-porous and diffuse-porous stem wood anatomy on the hydraulic parameters used in a water flow and storage model[J]. Tree Physiol, 2007, 27(1): 43-52. DOI: 10.1093/treephys/27.1.43.
[30]PITTERMANN J, SPERRY J S, HACKE U G, et al. Inter tracheid pitting and the hydraulic efficiency of conifer wood: the role of tracheid allometry and cavitation protection[J]. Am J Bot, 2006b, 93(9): 1265-1273. DOI: 10.3732/ajb.93.9.1265.
[31]HACKE U G, SPERRY J S, POCKMAN W T, et al. Trends in wood density and structure are linked to prevention of xylem implosion by negative pressure[J]. Oecologia, 2001, 126(4): 457-461. DOI: 10.1007/s004420100628.
[32]PITTERMANN J, CHOAT B, JANSEN S, et al. The relationships between xylem safety and hydraulic efficiency in the Cupressaceae:the evolution of pit membrane form and function[J]. Plant Physiol, 2010, 153(4): 1919-1931. DOI: 10.1104/pp.110.158824.
[33]SONG Y, POORTER L, HORSTING A, et al. Pit and tracheid anatomy explain hydraulic safety but not hydraulic efficiency of 28 conifer species[J]. J Exp Bot, 2022, 73(3): 1033-1048. DOI: 10.1093/jxb/erab449.
[34]黄恺翔, 俞重阳, 钱海蓉, 等. 鸡公山国家级自然保护区散孔材、环孔材树种木质部结构和功能的关系[J]. 浙江农林大学学报, 2022, 39(2): 244-251. HUANG K X, YU C Y, QIAN H R, et al. Relationship between xylem structure and function of diffuse-porous and ring-porous wood species in Jigongshan Nature Reserve[J]. J Zhejiang Aamp;F Univ, 2022, 39(2): 244-251. DOI: 10.11833/j.issn.2095-0756.20210628.
[35]SANTIAGO L S, GUZMAN M E D, BARALOTO C, et al. Coordination and trade-offs among hydraulic safety, efficiency and drought avoidance traits in Amazonian rainforest canopy tree species[J]. New Phytol, 2018, 218(3): 1015-1024. DOI: 10.1111/nph.15058.
[36]ZANNE A E, WESTOBY M, FALSTER D S, et al. Angiosperm wood structure:global patterns in vessel anatomy and their relation to wood density and potential conductivity[J]. Am J Bot, 2010, 97(2): 207-215. DOI: 10.3732/ajb.0900178.
[37]ZIEMINSKA K, BUTLER D W, GLEASON S M, et al. Fiber wall and lumen fractions drive wood density variation across 24 Australian angiosperms[J]. AoB Plants, 2013, 5. DOI: 10.1093/aobpla/plt046.
[38]ZIEMINSKA K, ROSA E, GLEASON S M, et al. Wood day capacitance is related to water content, wood density, and anatomy across 30 temperate tree species[J]. Plant Cell Environ, 2020, 43(12): 3048-3067. DOI: 10.1111/pce.13891.
[39]赵乐文, 陈梓熠, 邹滢, 等. 九种维管植物水力性状的演化趋势[J]. 植物生态学报, 2018, 42(2): 220-228. ZHAO L W, CHEN Z Y, ZOU Y, et al. Changes in hydraulic traits of nine vascular plants from different evolutionary lineages[J]. Chin J Plant Ecol, 2018, 42(2): 220-228. DOI: 10.17521/cjpe.2017.0258.
[40]李泽东. 山东低山丘陵区不同类型树种木质部与叶片解剖特征及水力特性分析[D]. 泰安: 山东农业大学, 2020. LI Z D. Analysis of xylem and leaf anatomical characteristics and hydraulics characteristics of different tree species in low mountains and hilly region of Shandong Province[D]. Taian:Shandong Agricultural University, 2020. DOI: 10.27277/d.cnki. gsdnu.2020.000503.
[41]OYANOGHAFO O O, BRIEN C O, CHOAT B, et al. Vulnerability to xylem cavitation of Hakea species (Proteaceae) from a range of biomes and life histories predicted by climatic niche[J]. Ann Bot, 2021, 127(7): 909-918. DOI: 10.1093/aob/mcab020.
(责任编辑 李燕文)

