不同油梨品种果面蜡质超微结构和组分分析
薛唯佳 张佳丽 李艳霞 马蔚红 刘进平 王甲水 杨宏宾
DOI:10.13925/j.cnki.gsxb.20230565
摘 要:【目的】明确不同油梨品种果面蜡质的微观结构和化学组成,为深入研究蜡质功能提供基础数据。【方法】以5个不同油梨品种(Peterson、RKYYL6-2、Pollock、Walter Hole和RKYYL8-13)为研究材料,利用阿拉伯树胶分离果实外蜡,通过三氯甲烷提取果实内蜡,利用扫描电镜、GC-MS和GC-FID对油梨果面蜡质的超微结构、化学成分及含量进行研究。【结果】油梨蜡质的晶体结构主要为相互堆叠的片状和颗粒状。油梨外蜡的化学成分由六大类物质组成,分别为烷烃、醛类、酸类、醇类、甾醇和单酰甘油;除以上物质外,油梨内蜡的化学成分还包括生育酚。5个油梨品种的外蜡含量为0.17~0.87 μg·cm-2,内蜡含量为2.00~8.22 μg·cm-2;其中,RKYYL6-2的外蜡、内蜡含量最低,而Walter Hole的外蜡、内蜡含量最高。进一步对外蜡、内蜡各组分含量在不同品种间进行统计分析,结果表明,Walter Hole外蜡、内蜡中的烷烃(C27除外)、醛类、酸类和醇类含量高于其他品种,且Walter Hole内蜡中的生育酚含量在5个品种中最高;Peterson外蜡、内蜡中的甾醇含量在所有品种中最高;Peterson外蜡中的单酰甘油含量显著高于其他品种,而Walter Hole内蜡中的单酰甘油含量在5个品种中最高。【结论】油梨蜡质的晶体结构通常为片状和颗粒状,不同油梨品种的果实在外蜡、内蜡的含量和化学组成上差异明显。研究结果为进一步明确油梨蜡质的生物学功能奠定了基础。
关键词:油梨;果实;表皮蜡质
中图分类号:S667.9 文献标志码:A 文章编号:1009-9980(2024)05-0956-12
收稿日期:2023-12-29 接受日期:2024-03-10
基金项目:中央级公益性科研院所基本科研业务费专项(1630092023006);海南省重点研发项目(ZDYF2024XDNY236)
作者简介:薛唯佳,在读硕士研究生,研究方向为果树种质资源精准评价与利用。E-mail:1021573732@qq.com
*通信作者 Author for correspondence. Tel:0898-66961361,E-mail:yanghongbin1993@163.com
果 树 学 报 2024,41(5): 956-967
Journal of Fruit Science
Ultramicrostructural and compositional analyses of fruit cuticular wax in different avocado varieties
XUE Weijia1, 2, ZHANG Jiali2, LI Yanxia2, MA Weihong2, LIU Jinping1, WANG Jiashui2, YANG Hongbin2*
(1School of Tropical Agriculture and Forestry, Hainan University, Danzhou 571737, Hainan, China; 2Tropical Crops Genetic Resources Institute of Chinese Academy of Tropical Agriculture Sciences, Haikou 571101, Hainan, China)
Abstract: 【Objective】 The fruit surface is covered with the cuticular wax layer composed of very long-chain fatty acids (VLCFA) and their derivatives and alicyclic compounds. The fruit cuticular wax can reduce postharvest water loss, and prevent the invasion of microorganisms and pathogens, playing an important role in the growth, development and post-harvest storage of fruit. Avocado (Persea americana Mill.) is one of the typical climacteric fruit, and postharvest water loss and rot of fruit often occur, causing huge economic losses. However, there have been few reports on the study of avocado fruit cuticular wax. This study aimed to clarify the microstructure and chemical composition of the fruit cuticular wax in different avocado varieties, and provide basic data for further research on the cuticular wax functions. 【Methods】 In this work, 5 avocado varieties (Peterson, RKYYL6-2, Pollock, Walter Hole and RKYYL8-13) were used for the analysis of the fruit cuticular wax. Firstly, we observed the ultrastructure of the avocado fruit cuticular wax using the scanning electron microscope, and then separated and extracted the epicuticular wax and intracuticular wax of the avocado fruit. The extraction methods of the epicuticular wax and intracuticular wax were as follows: firstly the gum arabic was applied evenly on the surface of the avocado fruits to separate the epicuticular wax; then, the fruits were immersed to extract the intracuticular wax of the fruits. The chemical composition and content of epicuticular wax and intracuticular wax of avocado fruit were further analyzed by GC-MS and GC-FID. 【Results】 The observation of scanning electron microscope showed that the cuticular wax crystals on the avocado fruit surface were mainly plates and granules. At ×30 000 and ×100 000 magnification, the plates wax crystals were clearly found on the fruit surface on Peterson and RKYYL6-2. The crystals of the cuticular wax of Pollock were relatively small, but the plates structure could also be observed at ×100 000 magnification. The crystals of the cuticular wax of Walter Hole was relatively large, and the continuous cuticular wax crystals could be observed at ×5000 magnification, and the crystal structure of cuticular wax of Walter Hole was also plates at ×30 000 and ×100 000 magnification. The crystal structure of the cuticular wax of RKYYL8-13 was different from those of the above-mentioned varieties. At ×30 000 and ×100 000 magnification, the crystals of the cuticular wax of RKYYL8-13 appeared granular and closely stacked. Subsequently, we analyzed the content and chemical composition of the epicuticular wax and intracuticular wax of the 5 avocado varieties. The chemical composition of the avocado epicuticular wax consisted of six types of compounds, namely alkanes, aldehydes, fatty acids, alcohols, steroids and monoacylglycerols; besides the above compounds, the chemical composition of the avocado intracuticular wax also included tocopherols. In terms of the carbon chain distribution of each component of the epicuticular wax, the carbon chain numbers of the alkanes included C23, C25, C27, C29 and C31, and the aldehydes were C30 and C32, the fatty acids were C28, C30 and C32, and the alcohols were C26, C28, C30, C32 and C34, the steroids included stigmasterol and β-Sitosterol, and monoacylglycerols included 1-Monopalmitin and 1-Monostearin. Besides the above wax components of the different carbon chain lengths, the intracuticular wax also contained C26 fatty acid, C34 fatty acid, δ-tocopherol, γ-tocopherol and α-tocopherol. In terms of the cuticular wax content, the epicuticular wax content of the 5 avocado varieties ranged from 0.17 to 0.87 μg·cm-2, and the intracuticular wax content ranged from 2.00 to 8.22 μg·cm-2; the content of epicuticular wax and intracuticular wax of the RKYYL6-2 was the lowest among the 5 varieties, while Walter Hole was the highest. In most varieties, the alkane had the highest content among the components of the epicuticular wax and intracuticular wax. The intracuticular wax embedded in the cutin and the epicuticular wax covered the outermost layer and together formed the cuticular wax. In terms of the total cuticular wax (the sum of epicuticular wax and intracuticular wax), the variety with the lowest total cuticular wax content was RKYYL6-2, only 2.17 μg·cm-2; Walter Hole had the highest total wax content, up to 9.09 μg·cm-2; and Peterson, Pollock and RKYYL8-13 had similar total cuticular wax content of 4.13, 4.29 and 4.73 μg·cm-2, respectively. In terms of the proportion of the fruit epicuticular wax and intracuticular wax in the total cuticular wax, among the 5 avocado varieties, the content of the epicuticular wax of avocado only accounted for 8.02%-12.81% of the total wax content, while the content of the intracuticular wax accounted for 87.19%-91.99%. Therefore, the proportion of the intracuticular wax in the total cuticular wax was much higher than that of the epicuticular wax. 【Conclusion】 The crystal structure of avocado wax was usually plates or granular, and different avocado varieties apparently differed in the content and chemical composition of the epicuticular wax and intracuticular wax. The research results would be helpful for further clarification of the biological functions of the cuticular wax of avocado fruits.
Key words: Avocado; Fruit; Cuticular wax
薛唯佳
绿色植物在登陆过程中,为应对陆生环境不利的生存条件,进化出了具有保护作用的蜡质层,它存在于所有陆生植物的地上部分(叶、茎和花等),可有效减少植物非气孔失水、降低水分蒸腾、提高自身耐旱性;同时,表皮蜡质也在减弱紫外线伤害以及抵抗病虫害等方面发挥重要作用[1]。植物表皮蜡质由脂肪族物质和脂环族物质组成,其中脂肪族物质主要包括烷烃、醛类、超长链脂肪酸、醇类、酮类、酯类等,而脂环族物质由三萜类、生育酚、甾醇等化合物组成[2]。根据存在位置不同,表皮蜡质可分为嵌入角质的内蜡(intracuticular wax)和覆盖于最外层的外蜡(epicuticular wax)[1],部分外蜡可堆叠组装成二维和三维结构,在扫描电镜中呈片状、棒状、管状、颗粒状等晶体形态[3]。
果实表面同样覆盖有蜡质层,且部分呈现出白霜、白粉、光亮等肉眼可见的形态[4]。近年来研究人员对柑橘、苹果、蓝莓、杧果、蔓越莓和番茄等果实的蜡质进行了系统研究,明确了果实蜡质的化学组成、晶体结构和部分生物学功能[5]。在柑橘上,王金秋等[6]分析了3种柑橘类型的果面蜡质,发现其主要化学成分为醛类、烷烃、三萜类、醇类和脂肪酸,蜡质晶体呈倒伏片状;Yang等[7]进一步通过QTL分析,发现柑橘果面蜡质可减少果实采后失水,延长果实货架期。在苹果蜡质的研究中,Chai等[8]对10个苹果品种的果面蜡质进行测定,发现其蜡质由烷烃、伯醇、脂肪酸等物质组成,晶体结构为有裂缝的片状、网状;采后进一步试验的结果表明,蜡质中烷烃含量对苹果采后贮藏性能和品质保持有重要作用。在蓝莓上,Chu等[9]对蓝莓果面蜡质进行研究,发现其蜡质主要成分为三萜类和β-二酮,晶体结构为管状;Kong等[10]通过采后贮藏研究,发现蓝莓果面蜡质能够减缓果实失水。在芒果中,Wu等[11]对4种杧果果面蜡质进行研究,发现其蜡质晶体呈不规则板状,主要由初级醇、三萜类和酯类等物质组成,同时发现表皮蜡质能有效阻碍炭疽病菌对杧果的入侵。在蔓越莓中,Croteau等[12]对蔓越莓果面蜡质进行研究,发现其蜡质主要由脂肪酸、烷烃和醛类物质组成;Erndwein等[13]进一步研究发现,蔓越莓果面蜡质可抵御光照胁迫,降低果实日灼病的发病程度。在对番茄的研究中,Leide等[14]发现番茄果面蜡质主要由烷烃、三萜类和甾醇等物质组成;Wu等[15]研究发现番茄果面蜡质中的烷烃对果实采后贮藏保鲜有重要作用。
果实蜡质结构可分为表皮细胞最外层的外蜡和嵌在角质中无定形的内蜡两层。同一物种中,外蜡和内蜡的化学组成和含量也存在差异。目前,在柑橘、葡萄等果实中已经开展了外蜡和内蜡化学组成的比较分析。王金秋等[6]对柑橘果实的外蜡和内蜡进行比较分析,发现甾醇和三萜类物质主要分布在柑橘内蜡中,外蜡中无法检测到;烷烃在内蜡中的含量也高于外蜡;而外蜡中伯醇和脂肪酸的占比高于内蜡。Yang等[16]对葡萄果实的外蜡和内蜡也进行了研究,发现三萜类物质主要在葡萄内蜡中,外蜡中三萜类含量较少,而脂肪酸物质主要分布在外蜡中,烷烃类物质在内蜡和外蜡中分布均匀;进一步研究发现,除去外蜡的葡萄果实,经采后贮藏,其外蜡能够恢复[17]。
油梨(Persea americana Mill.)又称鳄梨、牛油果,富含不饱和脂肪酸,营养丰富,是风靡全球的健康食品[18]。作为典型的呼吸跃变型果实,油梨采收后,呼吸强度大、代谢速率高[19],失鲜失重和果实腐烂是油梨采后生产面临的突出问题,造成巨大经济损失[20-21]。果面蜡质是果实抵御外界不利环境的关键屏障,可有效减少果实采后失水,防止病原菌入侵,延长果实货架期[22]。然而,关于油梨果面蜡质的研究鲜见报道,严重制约了油梨采后贮藏保鲜新技术的开发。为此,笔者在本研究中利用扫描电子显微镜(SEM)、气相色谱-质谱联用仪(GC-MS)和气相色谱-火焰离子化检测器(GC-FID),对5个油梨品种果面蜡质的晶体结构、外蜡和内蜡的含量及化学组成进行研究。研究结果加深了对油梨果面蜡质的理解,为进一步确定油梨蜡质的生物学功能及油梨保鲜新技术的开发奠定了基础。
1 材料和方法
1.1 试验材料
Peterson、RKYYL6-2、Pollock、Walter Hole和RKYYL8-13均采自位于海南省儋州市的海南省省级油梨种质资源圃,其中Peterson、Pollock、Walter Hole为国外商业品种,RKYYL6-2和RKYYL8-13为海南本地品种。采摘时间为2023年8—9月,各品种均达到商业采摘期。每个油梨品种选取大小均一、无病虫害、果面光洁的健康果实,收获后立即运回实验室,进行下一步试验处理。
1.2 扫描电镜观察
用手术刀在油梨果实赤道部位切取3 mm×3 mm大小的表皮,每个品种取6片,置于装有2.5%戊二醛固定液的离心管中进行固定。随后,用不同浓度的乙醇对样品进行逐级脱水。脱水过程为:用30%、50%、70%的乙醇逐级脱水15 min,用90%的乙醇脱水10 min,用100%的乙醇脱水2次,每次10 min;最后将样品放于叔丁醇置换液中浸泡3次,每次20 min。脱水干燥后的样品用EICO IB.5 ION coater镀上10-20 ?的金颗粒,涂覆75 s。最后用Zeiss Sigma 300场发射扫描电子显微镜(SEM)对果面蜡质的超微结构进行观察。
1.3 果实蜡质的提取
外蜡提取,每个品种选取表面无破损果实15个,每5个果实为1个生物学重复。阿拉伯树胶粉用三氯甲烷去除杂质后,配成浓度为90%(w/V)的乳浊液,用刷子将其均匀涂在果实表面,放置5 h左右,剥离干燥的阿拉伯树胶,以上步骤重复1次。收集两次获取的阿拉伯树胶,常温干燥保存。将所得阿拉伯树胶研磨均匀,取16 g粉末溶于25 mL蒸馏水中混合均匀,随后加入75 mL三氯甲烷和200 μL正二十四烷内标(质量浓度为1 mg·mL-1),剧烈震荡,萃提阿拉伯树胶中的外蜡。萃提待分层后,取下层三氯甲烷溶液,加入0.2 g无水硫酸钠,随后进行过滤。含有外蜡的三氯甲烷溶液在N2下吹干,最后加入100 μL N,O-双(三甲基硅)三氟乙酰胺(含三甲基氯硅烷)在70 ℃衍生化60 min。接着,在衍生化后的样品中加入100 μL色谱纯的三氯甲烷。用孔径0.22 μm的针筒微孔尼龙滤膜将上述液体过滤至玻璃内插管中,待上样。
内蜡提取,每个品种选取表面无破损且已去除外蜡的果实15个,每5个果实为1个生物学重复。将上述去除外蜡的果实置于三氯甲烷中浸提3 min,提取后加入200 mL正二十四烷内标(质量浓度1 mg·mL-1)。最后将含有内蜡的三氯甲烷溶液用N2吹干、衍生化,待上样。
1.4 果实蜡质的测定与分析
蜡质通过气相色谱仪器进行定量,测定条件为气相-色谱火焰离子化检测器(GC-FID,Agilent 7890B),HP-5MS色谱柱(30 m × 0.25 mm × 0.25 μm),N2为载气,恒流模式(1.2 mL·min-1),进样口和检测器温度为250 ℃。升温程序为:初始温度70 ℃,保持1 min,随后30 ℃·min-1升高至220 ℃,保持1 min,再以4 ℃·min-1升高至300 ℃,保持14 min,然后再以10 ℃·min-1升高至320 ℃,保持1 min,分流比10∶1,进样量1 μL。根据内标的含量和峰面积,以及目标物质的峰面积,计算蜡质各组分的含量和总蜡含量。蜡质组分的定性通过气相色谱-质谱联用(GC-MS)确定,具体如下:Agilent 7890B-5977A气质联用仪,EI离子源(70 eV),扫描范围50~650 m/z,以氦气(1.2 mL·min-1)为载气,色谱柱以及升温程序等与GC-FID条件一致。果实表面积计算方法如下:将油梨果实的果皮用刀片剥离,描绘在纸上,用扫描仪扫描成图片,随后通过Photoshop软件计算果皮的面积。
1.5 数据统计与分析
采用Excle 2010对数据进行整理与分析,用Origin 2021作图。所有数据均为3个生物学重复,以平均值±标准差表示。
2 结果与分析
2.1 不同油梨品种果面蜡质的超微结构观察
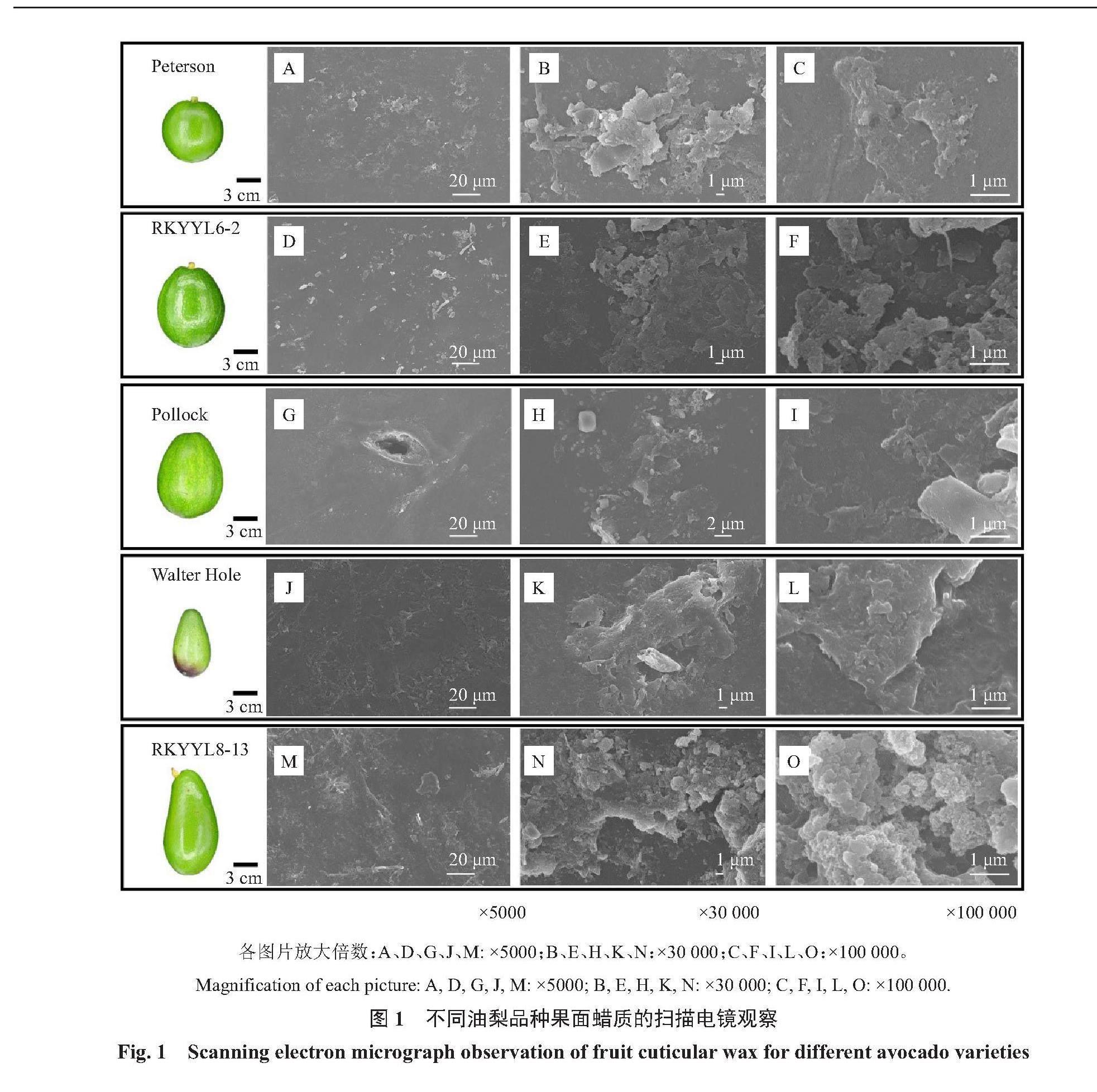
利用SEM对5个油梨品种果实表皮蜡质的超微结构进行观察,发现油梨果面的蜡质晶体以片状和颗粒状为主,且相互堆叠。Peterson、RKYYL6-2在5000倍下能够看到形似颗粒散落于表面的蜡质晶体(图1-A、D),在30 000和100 000倍下能清晰地看到片状蜡质晶体附着于表面(图1-B、C、E、F);Pollock的晶体颗粒相对较小(图1-G),但在100 000倍下同样能够看到片状结构的堆叠(图1-I);Walter Hole的蜡质晶体相对较大,在5000倍下即可看到连片的蜡质晶体,在100 000倍下显示该品种蜡质的晶体结构也为片状(图1-J、K、L);RKYYL8-13的蜡质晶体结构与上述品种略有不同,在30 000和100 000倍的放大倍数下,该品种的蜡质晶体呈现颗粒状,且紧密堆叠(图1-M、N、O)。
2.2 不同油梨品种果实外蜡化学成分和含量的比较分析
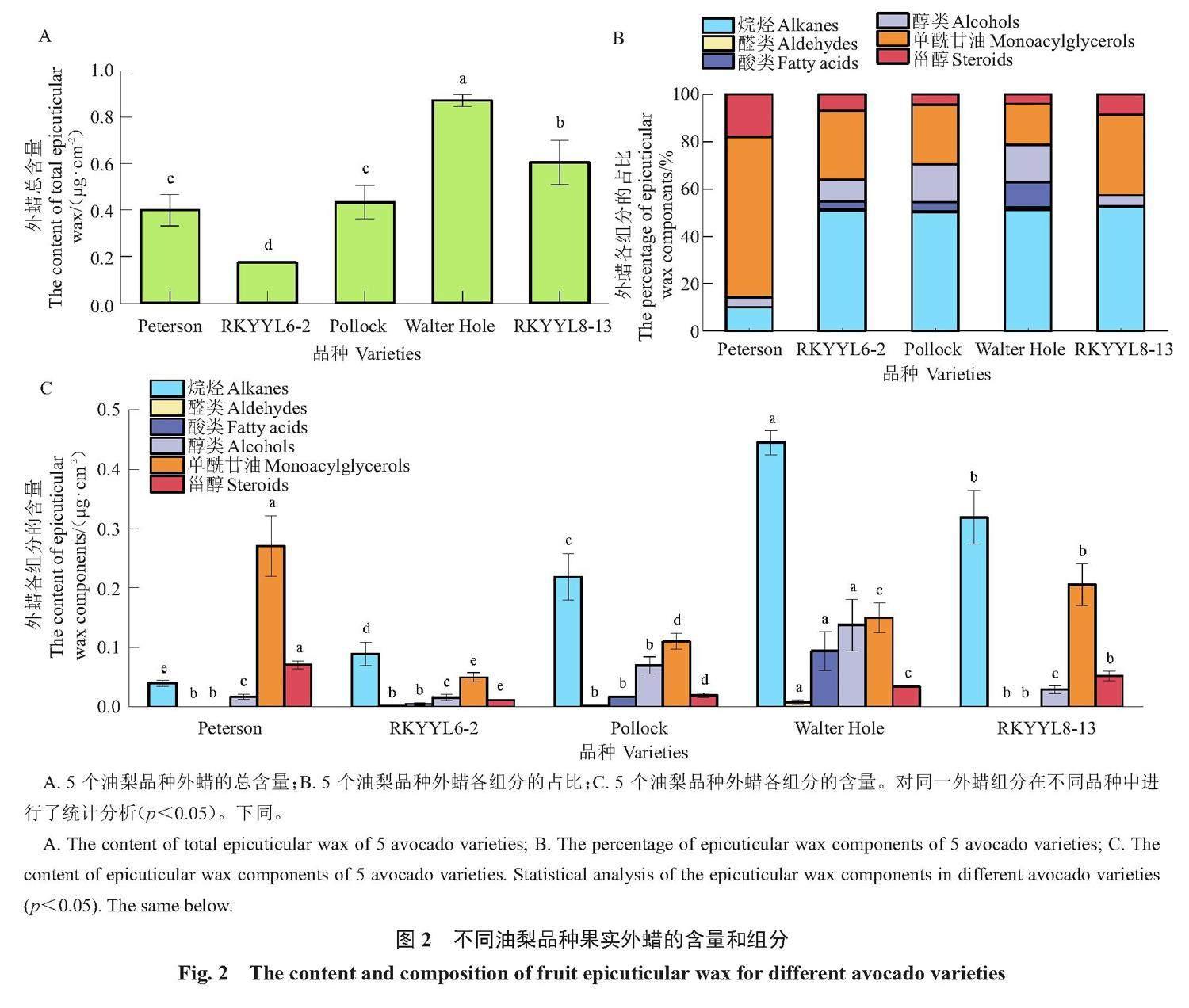
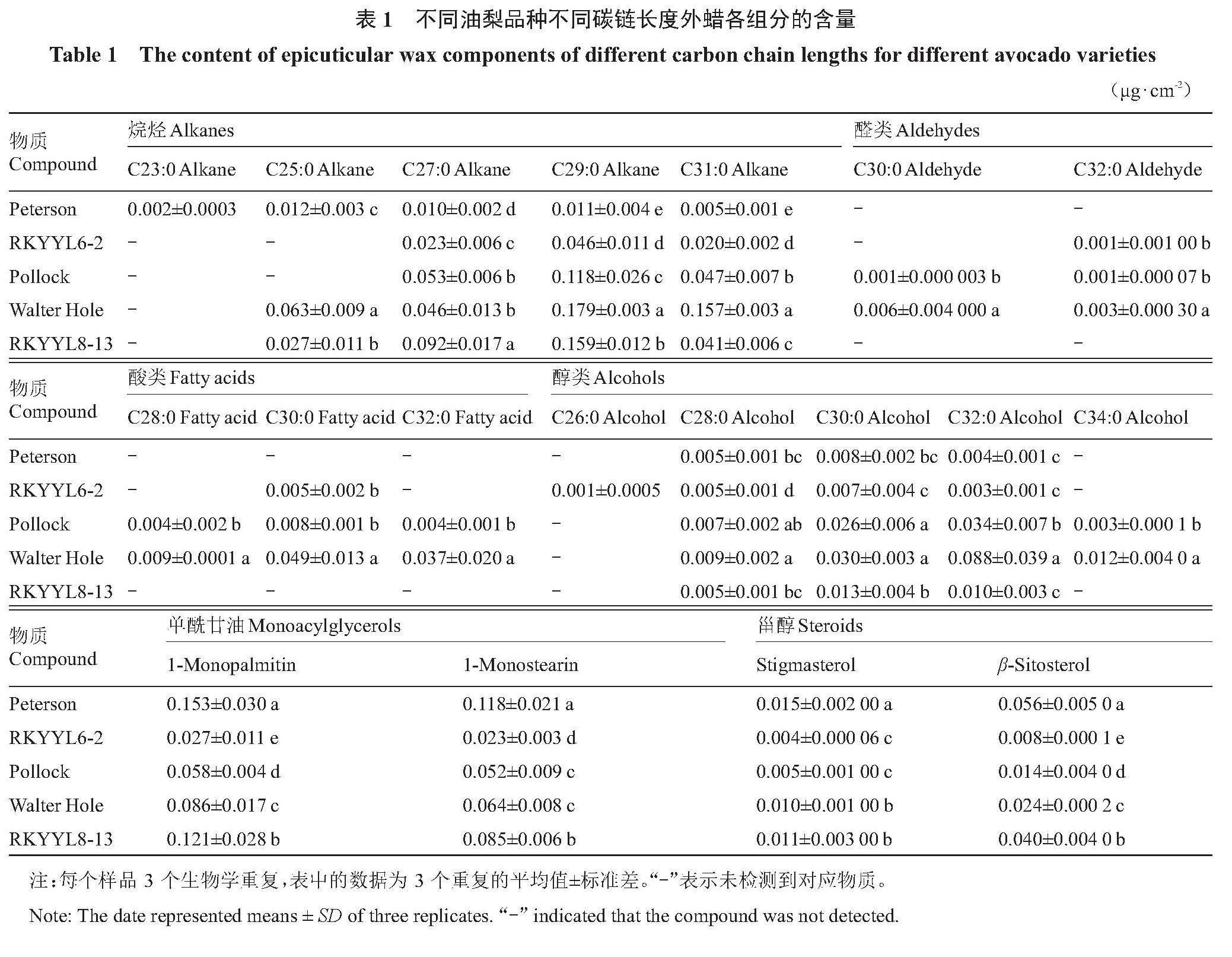
利用阿拉伯树胶,分离5个油梨品种的果实外蜡,并通过GC-MS和GC-FID对外蜡进行定性和定量分析。结果表明,5个油梨品种的外蜡含量在0.17~0.87 μg·cm-2,通过统计分析发现,Walter Hole的外蜡含量最高,RKYYL8-13的外蜡含量显著高于Peterson和Pollock,Peterson、Pollock两者的外蜡含量无显著差异,RKYYL6-2外蜡含量显著低于其他品种(图2-A)。外蜡的化学组分有六大类物质,分别为烷烃、醛类、酸类、醇类、甾醇和单酰甘油(图2-B~C)。烷烃的碳链数包括C23、C25、C27、C29和C31,醛类的碳链数为C30和C32,酸类的碳链数为C28、C30和C32,醇类的碳链数为C26、C28、C30、C32和C34,甾醇包括豆甾醇(stigmasterol)和谷甾醇(β-sitosterol),单酰甘油包括单软脂酸甘油酯(1-monopalmitin)和单硬脂酸甘油酯(1-monostearin)(表1)。
各品种外蜡含量和组分的具体信息如下:Peterson的外蜡含量为0.40 μg·cm-2(图2-A),外蜡中未检测到酸类和醛类,仅有烷烃、甾醇、单酰甘油、醇类,其中单酰甘油占该品种总外蜡含量的67.66%(图2-B);另外,在5个油梨品种的外蜡中,只有Peterson检测到了C23烷烃(表1)。RKYYL6-2的外蜡含量为0.17 μg·cm-2(图2-A),是外蜡含量最低的一个品种,该品种外蜡的主要组分为烷烃和单酰甘油,两者占比接近80%,而甾醇、醇类、酸类、醛类四大类物质的总占比仅为20%左右(图2-B);此外,该品种的外蜡仅检测到1种酸类(C30),在5个品种中脂肪酸种类最少(表1)。Pollock的外蜡含量为0.44 μg·cm-2(图2-A),其中烷烃和单酰甘油为Pollock外蜡的主要成分,占比分别为50.23%和25.31%(图2-B)。Walter Hole的外蜡含量为0.87 μg·cm-2(图2-A),在5个品种中外蜡含量最高,其外蜡主要成分为烷烃、单酰甘油、醇类和酸类,以上物质占该品种总外蜡含量的95.09%(图2-B)。RKYYL8-13的外蜡含量为0.61 μg·cm-2(图2-A),外蜡主要成分为烷烃、单酰甘油、醇类和甾醇,该品种中未检测到醛类和酸类(图2-B和表1)。
进一步对同一外蜡组分在5个油梨品种间的差异进行了统计分析(图2-C)。通过方差分析和多重比较发现,外蜡中的烷烃含量在5个品种间均有显著差异,从高到低依次为Walter Hole、RKYYL8-13、Pollock、RKYYL6-2和Peterson;对于醇类物质,Walter Hole中的含量为0.14 μg·cm-2,显著高于其他4个品种,Pollock外蜡中醇类含量显著高于Peterson、RKYYL6-2和RKYYL8-13,且Peterson、RKYYL6-2和RKYYL8-13三者间醇类含量无显著差异。Peterson的甾醇和单酰甘油含量均显著高于其他品种,RKYYL6-2中甾醇和单酰甘油物质含量显著低于其他4个品种;对于酸类和醛类物质,Walter Hole的含量显著高于其他品种,而Peterson、RKYYL6-2、Pollock和RKYYL8-13的酸类和醛类含量很低,且经统计分析发现,这4个品种间醛类和酸类含量均无显著差异。
同时对不同碳链长度外蜡各组分的含量在5个油梨品种间进行了比较分析(表1)。结果表明,烷烃中只有C27、C29和C31在所有油梨品种中能够检测到,其中C27烷烃在RKYYL8-13中含量显著高于其他4个品种,为0.092 μg·cm-2,Peterson中C27烷烃的含量显著低于其他品种,仅有0.010 μg·cm-2,Pollock、Walter Hole的C27烷烃含量没有显著差异;对于C29和C31烷烃,Walter Hole显著高于其他品种,含量分别为0.179 μg·cm-2和0.157 μg·cm-2,Peterson中C29和C31烷烃含量显著低于其他品种。醇类物质的主要成分为C30、C32,Walter Hole和Pollock中C30醇、C32醇的含量显著高于其他3个品种。对于醛类(C30和C32)和酸类(C28、C30和C32),Walter Hole中的含量最高,显著高于其他品种。对于甾醇和单酰甘油物质,Peterson的豆甾醇、谷甾醇、单软脂酸甘油酯和单硬脂酸甘油酯物质含量均显著高于其他品种,而RKYYL6-2中上述物质的含量在所有品种中最低。
2.3 不同油梨品种果实内蜡化学成分和含量的比较分析
对除去外蜡的果实用三氯甲烷进行浸泡,进一步提取并分析了油梨果实内蜡的化学组分和含量。结果表明,5个油梨品种的内蜡含量在2.00~8.22 μg·cm-2。通过统计分析发现,RKYYL6-2的内蜡含量最低,Walter Hole的内蜡含量最高,Peterson、Pollock和RKYYL8-13的内蜡含量接近,且三者间无显著差异(图3-A)。内蜡的化学组分有七大类物质,分别为烷烃、醛类、酸类、醇类、甾醇、单酰甘油和生育酚(图3-B~C)。与外蜡组分相比,油梨内蜡中含有3种生育酚,分别为δ-tocopherol、γ-tocopherol、α-tocopherol;其余六大类物质各组分的碳链长度分布与外蜡组分基本一致(表2)。
各品种内蜡含量和组分的具体信息如下:Peterson和Pollock的内蜡含量接近,分别为3.73 μg·cm-2和3.85 μg·cm-2(图3-A),但两者内蜡各组分的含量和比例有所不同,Peterson内蜡中烷烃的含量和比例低于Pollock,但甾醇和单酰甘油的含量和比例高于Pollock(图3-B~C);Pollock内蜡中的醛类包括C30和C32,而Peterson仅有C32(表2)。RKYYL6-2的内蜡含量为2.00 μg·cm-2(图3-A),在5个品种中内蜡含量最低,其内蜡的主要组分为烷烃、生育酚和甾醇,三者总占比为80.83%(图3-B);RKYYL6-2的内蜡中酸类只检测到C28和C30两种(表2)。在5个油梨品种中,Walter Hole的内蜡含量最高(8.22 μg·cm-2)(图3-A),其内蜡的主要成分为烷烃和单酰甘油,两者占比分别为31.46%和31.53%(图3-B),Walter Hole内蜡中单酰甘油的占比在5个品种中最高。RKYYL8-13的内蜡含量为4.13 μg·cm-2(图3-A),其内蜡组成中烷烃的占比高达48.64%(图3-B),在5个品种中烷烃占比最高(图3-B);另外,该品种中的醛类也仅含有C32(表2)。
进一步对同一内蜡组分在5个油梨品种间的差异进行了统计分析(图3-C)。通过方差分析和多重比较发现,对于内蜡中的烷烃含量,Walter Hole和RKYYL8-13两者无显著差异,且显著高于其他3个品种,RKYYL6-2中烷烃含量低于其他4个品种,Peterson和Pollock的烷烃含量无显著差异;对于醛类、酸类、醇类、单酰甘油和生育酚物质,Walter Hole中的含量均显著高于其他品种;对于甾醇物质,RKYYL6-2的含量仅为0.51 μg·cm-2,低于其他品种,Peterson、Pollock、Walter Hole和RKYYL8-13四者间甾醇含量无显著差异。
同时对不同碳链长度内蜡各组分的含量在5个油梨品种间进行了比较分析(表2)。结果表明,烷烃物质主要成分为C27和C29,其中C27烷烃在RKYYL8-13中的含量显著高于其他品种,为0.812 μg·cm-2,RKYYL6-2的含量为0.114 μg·cm-2,在所有品种中含量最低;对于C29烷烃,Walter Hole的含量为1.392 μg·cm-2,显著高于其他4个品种,Pollock和RKYYL8-13两者间无显著差异,但显著高于Peterson和RKYYL6-2。对于醛类(C30和C32)、酸类(C26、C28、C30和C32)、醇类(C30和C32)和单酰甘油(单软脂酸甘油酯和单硬脂酸甘油酯物质),Walter Hole中的含量在所有品种中最高;经统计分析发现,除C28酸外,其余物质在Walter Hole中的含量均显著高于其他品种。对于甾醇物质,Peterson和Pollock中豆甾醇的含量无显著差异,但显著高于RKYYL6-2、Walter Hole和RKYYL8-13这3个品种;对于谷甾醇(β-Sitosterol)物质,5个品种间均无显著差异。对于生育酚物质,δ-Tocopherol和α-Tocopherol物质在Walter Hole中的含量显著高于其他品种,其余4个品种无显著差异;γ-Tocopherol物质含量在Peterson、RKYYL6-2和Pollock中无显著差异,但RKYYL6-2和Pollock的γ-Tocopherol含量显著高于Walter Hole和RKYYL8-13。
2.4 不同油梨品种果实总蜡质含量、外蜡内蜡比例的比较分析
嵌入角质的内蜡和覆盖在最外层的外蜡共同构成植物表皮的蜡质层。图4-A展示了5个油梨品种的果实总蜡质含量(外蜡和内蜡相加得到)。对5个油梨总蜡含量进行统计学分析发现,Walter Hole的总蜡质含量为9.09 μg·cm-2,显著高于其他4个品种,RKYYL6-2含量仅为2.17 μg·cm-2,显著低于其他品种,Peterson、Pollock和RKYYL8-13三者的总蜡含量没有显著差异,其含量分别为4.13、4.29和4.73 μg·cm-2。图4-B展示了5个油梨品种果实外蜡和内蜡在总蜡含量中的占比,油梨外蜡仅占总蜡含量的8.02%~12.81%,而内蜡占总蜡含量的87.19%~91.99%。总之,油梨果实的外蜡、内蜡比例在不同品种间相差不大,且内蜡在总蜡含量中的占比远高于外蜡。
3 讨 论
表皮蜡质层由外蜡和内蜡组成,其中外蜡附着于植物表面,内蜡嵌于角质中,两者是植物应对环境胁迫、保障自身生长发育的关键物理屏障[23]。果、蔬等园艺作物的表皮蜡质与环境直接接触,是抵御外界不利胁迫的第一道屏障,对生长发育和采后贮藏至关重要[24-25]。不同果蔬表皮蜡质的晶体结构、化学成分和含量差异较大[24-25]。目前,研究人员已经对柑橘、苹果、梨、枸杞、李、黄瓜、西瓜等众多果蔬的蜡质开展了研究[5],但关于油梨果面蜡质的描述鲜有报道。笔者在本研究中,首先利用扫描电子显微镜对5个油梨品种果面蜡质的超微结构进行了观察,发现油梨蜡质晶体主要为片状和颗粒状,且相互堆叠。果皮蜡质的超微结构形态与蜡质化学成分的组成密切相关。蓝莓果实的蜡质晶体呈现为管状,这与其蜡质的主要成分为β-二酮有关[9]。油梨果面蜡质呈不规则片状,可能是因为烷烃物质为其主要成分,这与梨[26]和柑橘[27]中的研究一致。笔者进一步对5个不同油梨品种的果面蜡质进行了测定和分析,发现油梨果实的总蜡质含量在2.17~9.09 μg·cm-2,远低于苹果(366.00~2 185.00 μg·cm-2)、梨(653.00~1 431.00 μg·cm-2)等果实的蜡质含量,与柑橘(3.80~8.20 μg·cm-2)和番茄(14.60~17.90 μg·cm-2)的蜡质含量接近[5]。同时测定了油梨果面蜡质的化学成分,发现其蜡质由脂肪族化合物和脂环族化合物构成;其中,脂肪族蜡质组分与番茄[14]、苹果[8]、梨[28]、桃[29]等果实类似,均由烷烃、醛类、酸类、醇类等物质组成,且烷烃的含量最高;而脂环族蜡质的组成与其他果实差别较大。大多数果实的脂环族蜡质以香树脂醇、羽扇豆醇、熊果酸、齐墩果酸等三萜类物质为主[5],而油梨果实的脂环族物质主要是甾醇(豆甾醇和谷甾醇)和生育酚(α、γ、δ三种构型)两大类物质,未检测到三萜类物质。这暗示油梨脂环族蜡质的代谢途径与其他果实有较大差别,代谢通路差异的原因以及油梨蜡质中甾醇和生育酚的生物学功能有待进一步研究。
前人在试验中对果面蜡质提取主要采用三氯甲烷、正己烷等有机溶剂直接浸泡的方式[5],但这一方法不能区分外蜡和内蜡。笔者在本研究中,首先使用物理方式将果实外蜡剥离,然后再使用三氯甲烷对果实内蜡进行提取,分别得到了油梨果实的外蜡和内蜡。对油梨外蜡和内蜡的化学组成进行比较分析,发现两者的脂肪族化合物成分相近,但脂环族物质的组成成分不同。油梨外蜡中的脂环族物质仅有甾醇类物质,其含量占外蜡总量的3.93%~17.91%;而油梨内蜡的化学成分中,甾醇和生育酚均可检测到,两者占比高达18.65%~51.01%。在柑橘果实的蜡质中,也存在类似现象。王金秋等[5]报道了柑橘果面外蜡、内蜡的化学组成,发现三萜和甾醇类物质仅存在于总蜡中,外蜡中未检测到。根据已有的研究和报道,蜡质的化学组成、外蜡和内蜡的比例等因素直接影响表皮蜡质的水分渗透性和抗病性等生物学功能[30-31]。油梨外蜡和内蜡的化学成分存在差异,由此引起的两者生物学功能上的差异值得进一步研究。
4 结 论
通过对5个油梨品种的果面蜡质进行观察和分析,发现油梨的蜡质晶体以片状和颗粒状为主,5个品种的总蜡质含量在2.17~9.09 μg·cm-2,蜡质的化学成分主要为烷烃、醛类、酸类、醇类、单酰甘油、甾醇和生育酚。笔者在本研究中对油梨蜡质的超微结构、化学成分和含量进行了初步分析,为后续油梨蜡质生物学功能及合成代谢的研究提供了参考和基础数据。
参考文献 References:
[1] YEATS T H,ROSE J K C. The formation and function of plant cuticles[J]. Plant Physiology,2013,163(1):5-20.
[2] SAMUELS L,KUNST L,JETTER R. Sealing plant surfaces:Cuticular wax formation by epidermal cells[J]. Annual Review of Plant Biology,2008,59:683-707.
[3] BARTHLOTT W,MAIL M,BHUSHAN B,KOCH K. Plant surfaces:Structures and functions for biomimetic innovations[J]. Nano-Micro Letters,2017,9(2):23.
[4] KOCH K,ENSIKAT H J. The hydrophobic coatings of plant surfaces:Epicuticular wax crystals and their morphologies,crystallinity and molecular self-assembly[J]. Micron,2008,39(7):759-772.
[5] WU W J,JIANG B,LIU R L,HAN Y C,FANG X J,MU H L,FARAG M A,SIMAL-GANDARA J,PRIETO M A,CHEN H J,XIAO J B,GAO H Y. Structures and functions of cuticular wax in postharvest fruit and its regulation:A comprehensive review with future perspectives[J]. Engineering,2023,23:118-129.
[6] 王金秋,何义仲,徐坤洋,罗怿,盛玲,罗焘,刘欢,程运江. 三种类型柑橘成熟果实表面蜡质分析[J]. 中国农业科学,2016,49(10):1936-1945.
WANG Jinqiu,HE Yizhong,XU Kunyang,LUO Yi,SHENG Ling,LUO Tao,LIU Huan,CHENG Yunjiang. Characterization of mature fruit surface waxes of three cultivated citrus species[J]. Scientia Agricultura Sinica,2016,49(10):1936-1945.
[7] YANG H B,ZHU Z F,ZHANG M F,LI X,XU R W,ZHU F,XU J,DENG X X,CHENG Y J. QTL analysis reveals reduction of fruit water loss by NAC042 through regulation of cuticular wax synthesis in citrus fruit[J]. Horticultural Plant Journal,2022,8(6):737-746.
[8] CHAI Y F,LI A,WAI S C,SONG C C,ZHAO Y Y,DUAN Y Q,ZHANG B Q,LIN Q. Cuticular wax composition changes of 10 apple cultivars during postharvest storage[J]. Food Chemistry,2020,324:126903.
[9] CHU W J,GAO H Y,CAO S F,FANG X J,CHEN H J,XIAO S Y. Composition and morphology of cuticular wax in blueberry (Vaccinium spp.) fruits[J]. Food Chemistry,2017,219:436-442.
[10] KONG Q,LIU R L,WU W J,FANG X J,CHEN H J,HAN Y C,CHEN J Y. Cuticular wax triterpenes maintain storage quality of blueberries by reducing water loss[J]. Foods,2023,12(14):2643.
[11] WU J B,YOU Y Q,WU X,LIU F,LI G P,YIN H,GU C,QI K J,WEI Q,WANG S B,YAO Q S,ZHAN R L,ZHANG S L. The dynamic changes of mango (Mangifera indica L.) epicuticular wax during fruit development and effect of epicuticular wax on Colletotrichum gloeosporioides invasion[J]. Frontiers in Plant Science,2023,14:1264660.
[12] CROTEAU R,FAGERSON I S. The chemical composition of the cuticular wax of cranberry[J]. Phytochemistry,1971,10(12):3239-3245.
[13] ERNDWEIN L,KAWASH J,KNOWLES S,VORSA N,POLASHOCK J. Cranberry fruit epicuticular wax benefits and identification of a wax-associated molecular marker[J]. BMC Plant Biology,2023,23(1):181.
[14] LEIDE J,HILDEBRANDT U,VOGG G,RIEDERER M. The positional sterile (ps) mutation affects cuticular transpiration and wax biosynthesis of tomato fruits[J]. Journal of Plant Physiology,2011,168(9):871-877.
[15] WU H Q,LIU L,CHEN Y F,LIU T X,JIANG Q Q,WEI Z Y,LI C L,WANG Z H. Tomato SlCER1–1 catalyzes the synthesis of wax alkanes,increasing drought tolerance and fruit storability[J]. Horticulture Research,2022,9:uhac004.
[16] YANG M Y,LUO Z S,GAO S N,BELWAL T,WANG L,QI M,BAN Z J,WU B,WANG F Z,LI L. The chemical composition and potential role of epicuticular and intracuticular wax in four cultivars of table grapes[J]. Postharvest Biology and Technology,2021,173:111430.
[17] YANG M Y,LUO Z S,LI D,MA C,LI L. Role of epicuticular wax involved in quality maintenance of table grapes:Evidence from transcriptomic data[J]. Postharvest Biology and Technology,2023,196:112155.
[18] ARA?JO R G,RODRIGUEZ-JASSO R M,RUIZ H A,PINTADO M M E,AGUILAR C N. Avocado by-products:Nutritional and functional properties[J]. Trends in Food Science & Technology,2018,80:51-60.
[19] 王莹,黄烈健,黄雪梅,张昭其,陈祖旭. 油梨贮藏保鲜技术研究进展[J]. 广东农业科学,2010,37(8):167-169.
WANG Ying,HUANG Liejian,HUANG Xuemei,ZHANG Zhaoqi,CHEN Zuxu. Research progress on the storage of avocado fruit[J]. Guangdong Agricultural Sciences,2010,37(8):167-169.
[20] SAUCEDO-POMPA S,ROJAS-MOLINA R,AGUILERA-CARB? A F,SAENZ-GALINDO A,DE LA GARZA H,JASSO-CANT? D,AGUILAR C N. Edible film based on candelilla wax to improve the shelf life and quality of avocado[J]. Food Research International,2009,42(4):511-515.
[21] 潘永贵. 果实表皮组织对采后失水影响研究进展[J]. 广东农业科学,2023,50(10):1-10.
PAN Yonggui. Research progress in the effects of epidermal tissue on postharvest fruit water loss[J]. Guangdong Agricultural Sciences,2023,50(10):1-10.
[22] LIU G S,LI H L,PENG Z Z,LIU R L,HAN Y C,WANG Y X,ZHAO X D,FU D Q. Composition,metabolism and postharvest function and regulation of fruit cuticle:A review[J]. Food Chemistry,2023,411:135449.
[23] LEWANDOWSKA M,KEYL A,FEUSSNER I. Wax biosynthesis in response to danger:Its regulation upon abiotic and biotic stress[J]. The New Phytologist,2020,227(3):698-713.
[24] 龚成胜,刘文革. 蔬菜作物果实和叶片表皮蜡质研究进展[J]. 中国瓜菜,2019,32(5):1-6.
GONG Chengsheng,LIU Wenge. Research progress on epidermis wax in fruits and leaves of vegetable crops[J]. China Cucurbits and Vegetables,2019,32(5):1-6.
[25] TRIVEDI P,NGUYEN N,HYKKERUD A L,H?GGMAN H,MARTINUSSEN I,JAAKOLA L,KARPPINEN K. Developmental and environmental regulation of cuticular wax biosynthesis in fleshy fruits[J]. Frontiers in Plant Science,2019,10:431.
[26] WU X,YIN H,CHEN Y Y,LI L,WANG Y Z,HAO P P,CAO P,QI K J,ZHANG S L. Chemical composition,crystal morphology and key gene expression of cuticular waxes of Asian pears at harvest and after storage[J]. Postharvest Biology and Technology,2017,132:71-80.
[27] WANG J Q,HAO H H,LIU R S,MA Q L,XU J,CHEN F,CHENG Y J,DENG X X. Comparative analysis of surface wax in mature fruits between Satsuma mandarin (Citrus unshiu) and ‘Newhall navel orange (Citrus sinensis) from the perspective of crystal morphology,chemical composition and key gene expression[J]. Food Chemistry,2014,153:177-185.
[28] WU X,YIN H,SHI Z B,CHEN Y Y,QI K J,QIAO X,WANG G M,CAO P,ZHANG S L. Chemical composition and crystal morphology of epicuticular wax in mature fruits of 35 pear (Pyrus spp.) cultivars[J]. Frontiers in Plant Science,2018,9:679.
[29] BELGE B,LLOVERA M,COMABELLA E,GRAELL J,LARA I. Fruit cuticle composition of a melting and a nonmelting peach cultivar[J]. Journal of Agricultural and Food Chemistry,2014,62(15):3488-3495.
[30] WANG X Y,KONG L Y,ZHI P F,CHANG C. Update on cuticular wax biosynthesis and its roles in plant disease resistance[J]. International Journal of Molecular Sciences,2020,21(15):5514.
[31] JETTER R,RIEDERER M. Localization of the transpiration barrier in the epi- and intracuticular waxes of eight plant species:Water transport resistances are associated with fatty acyl rather than alicyclic components[J]. Plant Physiology,2016,170(2):921-934.

