原发性肝癌患者高强度聚焦超声治疗前后HSP70、PTN、PIVKA-Ⅱ水平变化及对早期复发的预测效能
刘红涛,王冬冬,陈 英
原发性肝癌(PHC)是消化系统常见的恶性肿瘤之一[1-4]。高强度聚焦超声(HIFU)是一种非侵入性局部消融术,通过将高强度超声聚焦于癌组织形成的热效应使得癌细胞瞬间凝固性坏死,达到“热切除”的治疗目的,能有效提高PHC远期生存率[5-6]。但也有研究证实,HIFU治疗PHC后有部分患者会在术后6个月出现早期复发现象,需及早识别,及时干预[7]。热休克蛋白70(HSP70)具有调控炎症反应和免疫应答作用,在癌症患者中异常升高[8]。多效生长因子(PTN)是一种在肿瘤细胞生长增殖、血管生成过程中发挥重要作用的分泌生长因子[9]。异常凝血酶原Ⅱ(PIVKA-Ⅱ)水平与PHC发生有关,其水平增高可提示PHC风险[10]。但关于三者与HIFU治疗PHC患者早期复发的关系报道较少。本研究探讨PHC患者HIFU治疗前后HSP70、PTN、PIVKA-Ⅱ水平变化与早期复发的关系,旨在为临床提供佐证,现报告如下。
1 资料与方法
1.1 一般资料
选取石家庄市人民医院2021年1月—2023年1月收治的PHC 120例作为研究对象。纳入标准:经影像学检查、病理活检证实为PHC;符合PHC诊断标准[11];首次确诊;单发肿瘤;CNLC分期为Ⅰa或Ⅰb期。排除标准:存在认知障碍、沟通障碍患者;合并其他恶性肿瘤患者;伴有严重免疫性、感染性疾病患者;出现肝肿瘤转移患者;Child-Pugh分级C级患者;新型冠状病毒感染及受疫情影响无法配合研究及随访患者。120例PHC中,男81例,女39例;年龄34~73(59.06±5.03)岁;体质量指数(BMI)16~25(21.49±1.46)kg/m2;肿瘤直径2.0~8.0(4.51±0.67)cm;病理类型:肝细胞癌96例,胆管细胞癌24例;Child-Pugh分级:A级85例,B级35例;CNLC分期:Ⅰa期64例,Ⅰb期56例;分化程度:中高分化89例,低分化31例。本研究经石家庄市人民医院医学伦理委员会审批(2021第146号),患者均知情自身病情及研究方案并签订知情同意书。
1.2 治疗方法
应用NIT9000型HIFU消融治疗系统(上海爱申科技发展股份有限公司),以脱气自来水作为治疗介质,设置治疗参数:输入频率0.3~1.0 MHz,有效治疗深度2~15 cm,探焦距42.5~151.2 mm,焦域直径3 mm,发射时间0.20~0.30 s,间歇时间0.16~0.24 s,单次治疗发射60次,每次16 s,每次间隔14 s。根据超声检查结果于体表定位肿瘤位置,于超声引导下调节系统,使得术中靶区充分显现,将整体肿瘤病灶划分为若干个平面,按照由点到线、由面至体的原则逐层深入消融。每日1次,每次30~60 min,间隔24 h再行下一次治疗,根据肿瘤情况共治疗10~30次。治疗期间均未接受其他治疗。治疗结束后随访6个月,随访期间经影像学检查提示肝内新发恶性肿瘤病灶判定为复发。据随访结果分为复发组26例,未复发组94例。
1.3 血清HSP70、PTN、PIVKA-Ⅱ检测方法
于治疗前1 d、治疗结束后1 d清晨采集空腹静脉血3 mL,以4 000 r/min的速率离心处理5 min,取血清。采用酶联免疫吸附试验检测血清HSP70、PTN水平,Multiskan SkyHigh全自动酶标仪及试剂盒购自赛默飞公司;采用ADVIA2400全自动生化分析仪及配套试剂盒(西门子公司)检测PIVKA-Ⅱ水平。所有操作严格遵循试剂盒说明书。
1.4 观察指标
1)比较2组临床资料,包括年龄、性别、BMI、病理类型、Child-Pugh分级、肿瘤直径、CNLC分期、分化程度。2)比较2组治疗前后血清HSP70、PTN、PIVKA-Ⅱ水平。3)比较2组血清ΔHSP70、ΔPTN、ΔPIVKA-Ⅱ值,血清ΔHSP70、ΔPTN、ΔPIVKA-Ⅱ值=治疗前值-治疗后值。4)分析治疗前血清HSP70、PTN、PIVKA-Ⅱ与病理特征的相关性。5)分析血清ΔHSP70、ΔPTN、ΔPIVKA-Ⅱ值与早期复发的关系。6)评估血清ΔHSP70、ΔPTN、ΔPIVKA-Ⅱ值对早期复发的预测效能。
1.5 统计学方法
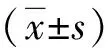
2 结果
2.1 临床资料
2组性别、年龄、BMI、病理类型、Child-Pugh分级差异无统计学意义(P>0.05),肿瘤直径、CNLC分期、分化程度差异有统计学意义(P<0.05),见表1。

表1 2组原发性肝癌患者临床资料
2.2 治疗前后血清HSP70、PTN、PIVKA-Ⅱ水平
2组治疗后血清HSP70、PTN、PIVKA-Ⅱ水平较治疗前下降(P<0.05);复发组治疗前、治疗后血清HSP70、PTN、PIVKA-Ⅱ水平高于未复发组(P<0.01)。见表2。

表2 2组原发性肝癌患者治疗前后血清HSP70、PTN、PIVKA-Ⅱ水平
2.3 血清ΔHSP70、ΔPTN、ΔPIVKA-Ⅱ值
复发组血清ΔHSP70、ΔPTN、ΔPIVKA-Ⅱ值低于未复发组(P<0.01),见表3。

表3 2组原发性肝癌患者血清ΔHSP70、ΔPTN、ΔPIVKA-Ⅱ值比较
2.4 治疗前血清HSP70、PTN、PIVKA-Ⅱ与病理特征的相关性
Spearman相关性分析显示,治疗前血清HSP70、PTN、PIVKA-Ⅱ与肿瘤直径、CNLC分期呈正相关,与分化程度呈负相关(P<0.01),见表4。

表4 原发性肝癌患者治疗前血清HSP70、PTN、PIVKA-Ⅱ与病理特征的相关性
2.5 血清ΔHSP70、ΔPTN、ΔPIVKA-Ⅱ值与HIFU治疗后早期复发的关系
以PHC患者HIFU治疗后是否早期复发作为因变量,校正前以肿瘤直径、CNLC分期、分化程度及血清ΔHSP70、ΔPTN、ΔPIVKA-Ⅱ值作为因变量,行多因素Logistic回归分析,结果显示:肿瘤直径、CNLC分期、分化程度及血清ΔHSP70、ΔPTN、ΔPIVKA-Ⅱ值与PHC患者HIFU治疗后早期复发独立相关(P<0.01);校正后以血清ΔHSP70、ΔPTN、ΔPIVKA-Ⅱ值作为因变量,行多因素Logistic回归分析,结果显示:血清ΔHSP70、ΔPTN、ΔPIVKA-Ⅱ值仍与PHC患者HIFU治疗后早期复发独立相关(P<0.01)。见表5。

表5 原发性肝癌患者血清ΔHSP70、ΔPTN、ΔPIVKA-Ⅱ值与HIFU治疗后早期复发的关系
2.6 血清ΔHSP70、ΔPTN、ΔPIVKA-Ⅱ值对HIFU治疗后早期复发的预测效能
ROC曲线分析显示,血清ΔHSP70、ΔPTN、ΔPIVKA-Ⅱ值预测PHC患者HIFU治疗后早期复发的曲线下面积(AUC)分别为0.793(95%CI:0.710,0.862)、0.726(95%CI:0.637,0.804)、0.794(95%CI:0.710,0.862),敏感度分别为0.808、0.692、0.731,特异度分别为0.723、0.670、0.745;三者联合预测PHC患者HIFU治疗后早期复发的AUC为0.916(95%CI:0.851,0.958),敏感度为0.923,特异度为0.872,优于三者单独预测。见图1。

HSP70为热休克蛋白70,PTN为多效生长因子,PIVKA-Ⅱ为异常凝血酶原Ⅱ,HIFU为高强度聚焦超声,ROC为受试者工作特征。
3 讨论
HSP70是一种高度保守的应激蛋白,参与多种细胞的进化过程,生物学作用多样,其中最重要的作用为维持细胞蛋白稳定,调控细胞增殖[12]。WANG等[13]研究显示,与正常健康人群相比,血清HSP70在肝癌患者中的水平较高。丁莉利等[14]报道指出,HSP70在高分化肝细胞癌患者中的表达率达83.3%。本研究发现,PHC患者治疗前血清HSP70水平与患者肿瘤直径、CNLC分期呈正相关,与分化程度呈负相关,可见HSP70高表达会促进肝癌细胞生长、增殖、分化和侵袭。相关报道证实,细胞外HSP70肽复合物可经由P13K/AKT信号通路调控缺氧诱导因子(HIF)表达,加快肝癌HepG2细胞上皮-间充质转化,加速肝癌发生发展[15]。对比HIFU治疗前后HSP70变化情况发现,2组治疗后血清HSP70水平较治疗前下降,复发组高于未复发组,ΔHSP70低于未复发组。表明HSP70水平变化会对PHC患者HIFU治疗后早期复发产生明显影响,原因在于:HSP70对抑癌基因与原癌基因均有明显影响,正常情况下HSP70处于低水平状态,一旦出现癌细胞异常增殖现象,便会导致HSP70高表达,而HSP70高表达会调控癌细胞基因表达[16-17]。进一步分析显示,校正其他因素前后,血清ΔHSP70值均与PHC患者HIFU治疗后早期复发独立相关,且具有一定预测效能,可为临床及早期识别HIFU治疗后早期复发的高危患者提供有效的指导信息。
PTN是一种对肝素具有高亲和力的分泌生长因子。既往报道发现,PTN与肺癌、胰腺癌、乳腺癌等多种癌症密切相关[18-20]。本研究结果显示,治疗前血清PTN与PHC肿瘤直径、CNLC分期呈正相关,与分化程度呈负相关,与赵景曼等[21]报道中结果一致,提示PTN具有加速PHC发生发展作用。PTN能够经神经毛蛋白-1在癌变组织内部产生侵袭作用,能抑制转化因子,促进癌细胞增殖,避免癌细胞衰老凋亡,从而加快PHC发展[22]。同时,有学者指出,PTN高表达可改变高尔基体组织结构,强化癌细胞迁移能力,加速正常肝细胞死亡,导致癌组织范围不断扩大,促进肝癌细胞侵袭转移[23-24]。本研究还发现,PHC患者血清PTN水平在经HIFU治疗后呈明显下降趋势,但与未复发组相比,复发组ΔPTN值较小,且ΔPTN值在校正其他因素前后均与PHC患者HIFU治疗后早期复发独立相关。分析原因为,PTN治疗前后下降幅度一定程度说明了癌细胞的衰老和凋亡程度,其下降幅度较小提示HIFU治疗后癌细胞的衰老和凋亡并不明显,因此早期复发的风险较高。另外,ROC曲线分析,ΔPTN值预测PHC患者HIFU治疗后早期复发AUC>0.7,提示其可作为临床早期预测HIFU治疗后早期复发重要因子。
PIVKA-Ⅱ属于不具备凝血酶生物学活性的异常凝血酶原,是近年来发现的在PHC患者中特异性升高的血清学因子[25]。KIM等[26]研究证实,血清PIVKA-Ⅱ水平与PHC患者肿瘤直径、临床分期、分化程度有关,这与本研究结果相符。正常情况下,机体凝血酶原前体需在肝脏内完成向γ-羧基谷氨酸的转变,形成正常的凝血酶原,一旦其在羧化过程中缺乏维生素K的辅酶作用,便无法完成正常的转变,不能参与凝血过程,进而转化为异常凝血酶原进入血液[27]。国内外报道均表明,PIVKA-Ⅱ在肝癌发生发展过程中促进了血管生成及肿瘤转移[28-29]。本研究结果显示,PHC患者经HIFU治疗后血清PIVKA-Ⅱ水平较治疗前下降,且ΔPIVKA-Ⅱ与HIFU治疗后早期复发独立相关,可见PIVKA-Ⅱ不仅参与PHC发生发展过程,还会增加HIFU治疗后早期复发风险。进一步研究发现,ΔPIVKA-Ⅱ值对PHC患者HIFU治疗后早期复发风险也具有一定预测效能。
此外,本研究在上述结果基础上分析血清ΔHSP70、ΔPTN、ΔPIVKA-Ⅱ值联合预测PHC患者HIFU治疗后早期复发的效能,结果显示,三者联合预测的AUC高达0.916,明显优于三者单独预测,提示三者联合可作为临床预测PHC患者HIFU治疗后早期复发的优选方式。不足之处是本研究未详细探讨HSP70、PTN、PIVKA-Ⅱ水平与PHC患者HIFU治疗后远期生存率间的关系,今后需继续收集病例,做进一步研究,以获取更为全面的数据支持。
综上,HSP70、PTN、PIVKA-Ⅱ水平与PHC肿瘤直径、CNLC分期、分化程度密切相关,接受HIFU治疗前后的变化值与早期复发独立相关,且联合预测效能较高。

