乳酸菌生物膜的形成、特性及应用研究
姚尚杰 金垚 黄钧 周荣清 吴重德


摘要:大多数乳酸菌作为益生菌被人们熟知并广泛应用于食品领域。生物膜是细菌应对不利环境的自然生长状态。而近些年的相关研究揭示了乳酸菌生物膜的成膜规律和优良特性,也初步探究了乳酸菌生物膜在生产中的应用。为进一步调控和利用乳酸菌生物膜,对乳酸菌生物膜的深入研究和理解十分必要。文章综述了乳酸菌生物膜的形成、细胞黏附胞外聚合物在生物膜形成中的作用,以及乳酸菌与酵母菌的混菌生物膜形成和酵母-乳酸菌相互作用,介绍了乳酸菌生物膜在抗逆、抑菌、食品生产、人体健康等方面的应用,以期为人们了解乳酸菌生物膜和对其进行更深入的研究和应用提供帮助。
关键词:乳酸菌;生物膜;混菌生物膜;抗逆;抗菌;应用
中图分类号:TS201.3 文献标志码:A 文章编号:1000-9973(2024)04-0212-09
Study on Formation, Characteristics and Application of Lactic
Acid Bacteria Biofilms
YAO Shang-jie1,2, JIN Yao1, HUANG Jun1, ZHOU Rong-qing1, WU Chong-de1*
(1.College of Biomass Science and Engineering, Sichuan University, Chengdu 610065,
China;2.Guizhou Xijiu Co., Ltd., Zunyi 636600, China)
Abstract: Most lactic acid bacteria are well known as probiotics and widely used in the field of food. Biofilms are the natural growth state of bacteria in response to adverse environments. In recent years, relevant studies have revealed the formation regulation and excellent characteristics of lactic acid bacteria biofilms, and the application of lactic acid bacteria biofilms in production has been preliminarily explored. In order to further regulate and utilize lactic acid bacteria biofilms, it is necessary to study and understand lactic acid bacteria biofilms in depth. In this paper, the formation of lactic acid bacteria biofilms, the roles of cell adhesion extracellular polymer in the biofilm formation, as well as the formation of mixed-bacteria biofilms of lactic acid bacteria and yeast and the interactions between yeast and lactic acid bacteria are reviewed, and the application of lactic acid bacteria biofilms in stress resistance, bacteriostat, food production, human health and other aspects is introdiced, so as to provide assistance for people to understand lactic acid bacteria biofilms and further research and apply them.
Key words: lactic acid bacteria; biofilm; mixed-bacteria biofilm; stress resistance; bacteriostat; application
收稿日期:2023-10-07
基金項目:国家自然科学基金项目(31871787,32272280)
作者简介:姚尚杰(1995—),男,博士研究生,研究方向:食品微生物。
*通信作者:吴重德(1982—),男,教授,博士,研究方向:传统发酵食品。
细菌往往以悬浮或聚集状态存在于自然环境中,而聚集状态的细胞和胞外基质的聚集体又被称为生物膜[1]。特别是在不良环境中,细菌倾向于以生物膜的形式生长,生物膜则为细菌提供保护屏障[2]。细菌生物膜的形成和构成在环境、医疗和口腔等领域已有很多研究,而食品生产和加工过程中的生物膜研究在近几年才有较多报道。大多数乳酸菌可以作为有益菌参与到以发酵食品为主的食品加工过程中,也可以通过调节肠道微生物、抑制致病菌等方式保护人体健康[3—4]。乳酸菌生物膜的形成被认为有利于乳酸菌的环境适应能力和益生特性[5-6]。因此,了解乳酸菌的形成,特别是在发酵食品中生物膜的形成及生物膜的特性有利于进一步发挥乳酸菌对发酵产业和人类健康的积极作用。
1 乳酸菌生物膜的形成过程
乳酸菌是一类革兰氏阳性菌,主要包括Lactococcus spp.、Lactobacillus spp.、Pediococcus spp.、Enterococcus spp.、Streptococcus spp.、Bifidobacterium spp.、Leuconostoc spp.、Weissella spp.、Carnobacterium spp.和Tetragenococcus spp.。目前在奶酪、酸奶、啤酒、泡菜、大曲、醋、发酵橄榄、发酵鱼和发酵鸡肉等食品或生产环境中均有乳酸菌生物膜的报道,见表1。
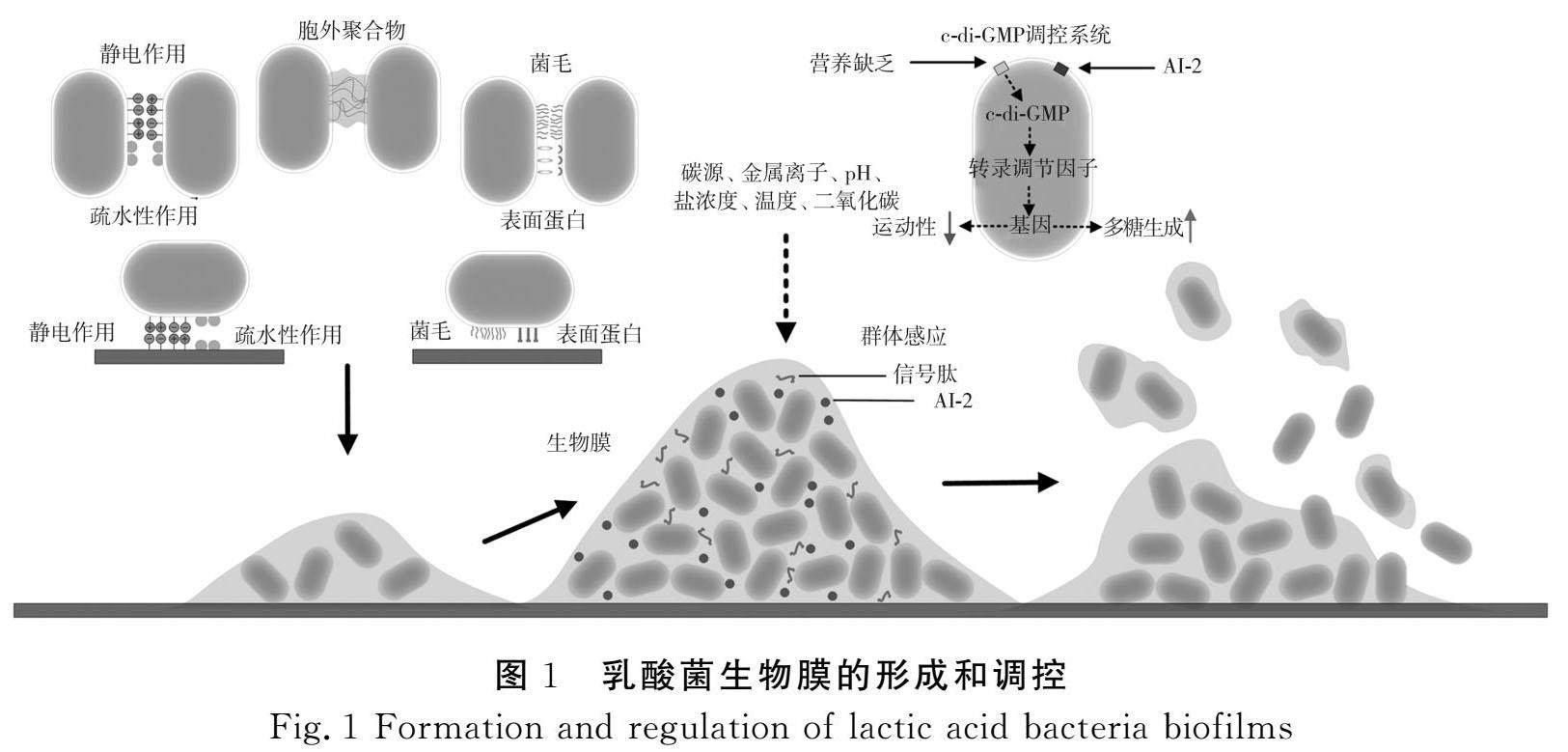
但目前对乳酸菌生物膜的形成过程鲜有研究,一般采用细菌生物膜的成膜规律来解释乳酸菌的生物膜形成,主要包括细胞团的形成和细胞对物体表面的初步黏附、细胞簇的形成和发展、胞外聚合物的产生、生物膜成熟和生物膜分散等步骤[7]。乳酸菌的初步黏附被普遍认为是可逆黏附,可以在非生物体表面如生产设备的不锈钢表面,也可以在生物表面[8-9]。朱寒剑等[10]认为缺乏乳酸菌参与运动的鞭毛无法聚集在一起,以沉降等被动固定方式聚集并黏附于物体表面。乳酸菌细胞表面间或细胞表面和物体表面间的疏水性作用和静电作用在非特异性黏附过程中起到了主导作用。龚虹等[11]对包括德氏乳杆菌、罗伊氏乳杆菌和戊糖片球菌在内的5株乳酸菌的黏附力与生物膜、疏水性和自凝集特性进行了研究,发现具有较好疏水性和自聚集能力的乳酸菌成膜能力也较好。Giaouris等[12]在对天然乳酸乳球菌的表面理化分析的研究中,发现了处于低离子强度悬浮介质中乳酸菌的黏附性、疏水性和低电负性之间有显著相关性,黏附菌株多为疏水或低电荷菌株,同时静电相互作用的存在会引起带负电荷最多的亲水菌株的黏附性下降。因此,对物体材料表面理化改性可以提高乳酸菌对物体的黏附,如通过酸酐基团将具有正电荷和亲水性壳聚糖结合到聚丙烯表面,成功实现较高的乳酸菌生物量在表面沉积,随后形成生物膜[13]。包括菌毛在内的乳酸菌细胞表面蛋白被证明在黏附和聚集中起至关重要的作用[14]。Drame等[15]的研究表明一些能够表达菌毛的乳酸菌能够形成更复杂的、高异质性的、粗糙的生物膜。另一项研究揭示了菌毛与其他表面蛋白相互作用的能力,表明菌毛参与了乳酸菌间同质相互作用,从而影响生物膜的结构[16]。一些表面蛋白可以促进戊糖乳杆菌对橄榄表皮的黏附,如戊糖乳杆菌基因enoA1 和 gpi编码的定位于细胞表面并能与橄榄表皮某些特定成分黏附的胞质酶,由基因obaC编码的可以结合表皮蜡的一些脂质的脂肪酸结合蛋白[17]。AggLb是副干酪乳杆菌中聚集促进蛋白,其N端的6个连续的胶原结合结构域的存在被认为决定了AggLb上某些结构的形成,这些结构在胶原蛋白与纤维连接蛋白的结合中发挥作用,同时促进了细胞自聚集[18]。
乳酸菌增殖和胞外聚合物的生成积累是生物膜形成的重要步骤,并推动生物膜逐步走向成熟[19]。对于成熟的乳酸菌生物膜,其厚度达到整个生物膜形成过程的顶峰,细胞和胞外聚合物的量达到最高。同时成熟生物膜中细胞运动能力也远低于悬浮细胞[20]。在一些研究中,成熟的乳酸菌生物膜表现出多层复杂的结构,Yao等[21]的研究中嗜盐四联球菌形成了12 μm厚的生物膜,在生物膜的表层中活细胞数量多于死细胞,而底层中死细胞数量较多。Ambulkar等[22]也利用激光共聚焦技术观察到了培养24 h后植物乳桿菌和发酵乳杆菌成熟生物膜,相比于培养4 h后的生物膜,成熟生物膜的厚度较大且平坦均匀,同时可观察到中空孔道,这些孔道可为成熟生物膜中的细胞提供必需的营养物质。得益于坚固的三维结构和胞外聚合物的存在,相比于新生的生物膜,成熟生物膜对抗生素、消毒剂等有更强的抗性[23]。
2 乳酸菌生物膜的组成
目前在食品领域依然缺乏对乳酸菌生物膜胞外聚合物组成的系统性研究,多数学者以细菌生物膜胞外聚合物的组成来解释乳酸菌生物膜胞外聚合物的组成。少数研究间接地探究了乳酸菌生物膜胞外聚合物的组成,Yunda等[31]利用傅里叶变换红外光谱观察到了鼠李糖乳杆菌生物膜中核酸、磷脂和多糖在不同培养基中随着培养时间的变化而变化。Yao等[21]和丹彤等[32]通过使用DNase I和蛋白酶K处理植物乳杆菌生物膜,表明了胞外DNA(eDNA)和生物膜基质蛋白是生物膜的重要组成部分。
胞外聚合物中多糖可分为单一单糖构成的同多糖和两种或两种以上的单糖构成的杂多糖。杂多糖通常由3~8种类型的单糖构成的重复单元组成,其中单糖包括葡萄糖、甘露糖、鼠李糖、半乳糖等,除单糖外还可能含有葡糖胺、半乳糖胺、葡萄糖醛酸等[32]。Zhang等[33]利用阴离子交换色谱和脉冲安培检测器鉴定出嗜盐四联球菌两种胞外多糖(exopoly sacharides substances,EPS)的单糖组成,其中一种EPS的单糖组成为半乳糖、葡萄糖、甘露糖、葡萄糖醛酸,另一种EPS的单糖组成为甘露糖和葡萄糖。一些研究表明乳酸菌生物膜的形成与胞外多糖的产量无相关性,而胞外多糖的黏度可以影响乳酸菌生物膜的形成活性[34]。目前,多糖对乳酸菌细胞黏附的影响仍不确定,如研究表明胞外多糖的产生能够掩盖约翰逊乳杆菌表面负责细胞间相互作用的结构,同时使细胞表面的负电荷减小,亲水性增强,从而降低了细胞黏附和自聚集[35]。而在另一些报道中,胞外多糖的存在提高了乳酸菌细胞黏附和在肠道环境中定植繁殖的持久性。胞外多糖这种对细胞黏附水平影响的差异被认为与多糖的组成、大小、浓度和残基位置有关[36]。
eDNA也是生物膜的重要组成部分,多个研究通过DNA酶处理证明了eDNA在乳酸菌生物膜中的存在和作用[23]。生物膜胞外聚合物中的eDNA被认为来自细胞活性分泌和裂解释放,后者在肠球菌和植物乳杆菌中有报道[37]。不同菌株的裂解行为会造成生物膜中eDNA水平的差异[38]。一些理化应激如亚致死热和氧化应激暴露可能促进乳酸菌释放eDNA进而提高生物膜对应激的抵抗能力[39]。eDNA可以和N-乙酰氨基葡萄糖协同形成生物膜,通过共价附着的膜脂蛋白与细胞表面相互作用促进细胞的聚集和生物膜的形成,也可以通过阳离子如Ca2+桥接介导细菌的聚集和生物膜的形成[40-41]。除有助于生物膜基质的内聚性外,eDNA的存在还有利于生物膜的黏弹性和机械稳定性。
直接参与生物膜形成的蛋白质除黏附相关的表面蛋白外,还包括由乳酸菌细胞经分泌系统分泌到胞外聚合物中的基质蛋白。如植物乳杆菌(Lactiplantibacillus plantarum WCFS1)的223个胞外蛋白中166个蛋白通过锚定或共价结合的方式存在于细胞表面,57个蛋白被预测会被分泌到基质中[42]。目前人们对基质蛋白的结构、功能的认识仍较少。基质蛋白被认为可以促进细菌黏附和早期生物膜的积累,以及在胞外聚合物网络中起支架作用,有利于生物膜的稳定性[43]。此外,胞外聚合物中蛋白质和碳水化合物的比例关系到生物膜的疏水性、表面活性、表面张力和附着效率等[44]。
3 乳酸菌生物膜形成的调控机制
細菌生物膜的形成离不开包括群体感应、环二腺苷酸(cyclic-di-adenylate monophosphate,c-di-AMP)信号系统、环磷酸腺苷酸-受体蛋白(cAMP-CRP)信号系统等在内的信号系统的调控[45](见图1)。在目前已有的报道中,群体感应信号系统被发现参与了乳酸菌生物膜的形成和调控。乳酸菌作为革兰氏阳性菌一般以自诱导肽和LuxS 蛋白催化合成的呋喃酮酰硼酸二酯(autoinducer-2,AI-2)作为信号分子[46]。在明串珠菌中,LuxS/AI-2群体感应中pfs和luxS基因的表达与AI-2产量一致,且两种基因的表达量和AI-2产量在生物膜细胞中均高于悬浮细胞的量[47]。在Gu等[48]的研究中,人工合成的AI-2提高了弗朗西斯乳杆菌的细胞密度,增强了细菌的凝聚力,并促进了生物膜的形成和对胆盐的抗性[49]。外源添加的AI-2能够改变植物乳杆菌细菌生长、形态表征、生物膜发育、EPS含量及相关基因表达,进而影响生物膜形成和环境耐受性。群体系统还被认为能够调节乳酸菌的初始黏附能力,有益于提高乳酸菌的益生效果[50]。环二鸟苷酸(c-di-GMP)为存在于细胞质中的第二信使,被发现参与调控细菌生物膜的形成。一方面,当细胞质c-di-GMP浓度增加时,细菌的运动性受到抑制,转变为低运动性或无活性,细菌的低运动性不仅有利于细胞对物料表面的附着,而且对生物膜的成熟也有重要作用[20]。另一方面,c-di-GMP的增加可导致胞外多糖合成基因的转录增加,进而促进生物膜的形成[51]。而c-di-GMP在乳酸菌生物膜形成中的作用的报道目前仍较少。Liu等[52]通过比较基因组和靶基因验证的方法鉴定出假小链双歧杆菌胞外多糖基因和c-di-GMP基因的产生和降解,表明c-di-GMP可以通过调节胞外多糖的产生来促进该菌生物膜的形成。He等[53]确认了嗜酸乳杆菌中c-di-GMP代谢的相关基因包括dgcA、pdeA、pdeB、nrnA、gtsA和gtsB,同时通过生物信息学和生化分析试验证明了这些相关基因共同参与调节了嗜酸乳杆菌胞外聚合物的形成和共聚集。乳酸菌培养环境中的多个因素包括培养基中的碳源、金属离子、pH、盐浓度、温度、二氧化碳浓度等也同样会影响乳酸菌生物膜的形成[10,54-55]。此外,一些非信号系统相关的化学物质也能够改变乳酸菌生物膜的形成。如白藜芦醇可以改变副干酪乳杆菌表面的理化性质,从而增强细胞的聚集,进而促进黏附和生物膜的形成[56]。5-羟色胺能够促进屎肠球菌中群体感应信号肽转运,提高了一些黏附相关的蛋白丰度,提升了细胞自聚集能力和生物膜形成能力[57]。
4 乳酸菌与酵母菌的混菌生物膜形成及微生物间相互作用
在自然环境中,不同微生物多以群落形式共同生活在一起。在传统发酵食品如白酒、酱油、食醋、豆瓣酱、奶酪等的生产过程中,丰富的营养和自然接种的开放式或半开放式的发酵方式为微生物复杂的群落结构的形成和演变提供了基础。同时,这些微生物群落总是以多物种生物膜的形式存在并发挥作用。混菌生物膜中可能存在物质共享、营养交叉喂养、解毒作用、交叉呼吸、细胞外电子转移和基因转移等微生物间合作,以及剥削竞争和干扰竞争等竞争[58]。微生物间的竞争使得生物膜保持短暂的稳定,随着生物膜的发展,强竞争者占据生物膜的优势生态位,而弱竞争者将存活于一隅或被完全排除,或生物膜解体。在高细胞密度条件下,细胞间的合作有利于生物膜的形成,同时,一些混菌生物膜比单菌生物膜表现出对不利环境更高的适应度[59]。乳酸菌同样被发现能够与酵母菌等真菌和细菌共同形成混菌生物膜。对乳酸菌与其他微生物的混菌生物膜形成、发展、特性和微生物间的相互作用的研究有利于加深人们对乳酸菌在食品发酵、人体健康中的作用的认识和控制有害微生物生物膜的形成。
酵母菌和乳酸菌均是被人们熟知且广泛利用的微生物,在包括白酒大曲、辣椒酱、酱油、发酵鱼等在内的多种传统发酵食品中,酵母菌和乳酸菌被发现同时存在,并在驱动发酵的进行和风味形成中发挥着重要作用[60]。此外,酵母菌与乳酸菌被报道能够通过营养代谢产物交换(包括糖类、氨基酸、丙酮酸、维生素等)、群体感应及生物膜包被等模式进行相互作用[61]。任晓镤等[62]研究了5株酿酒酵母对6株乳杆菌(包括植物乳杆菌、类植物乳杆菌、戊糖乳杆菌、副干酪乳杆菌(2株)和开菲尔乳杆菌)生物膜形成的影响,结果表明酿酒酵母菌对乳杆菌成膜有促进和抑制作用,具有菌株特异性。此外,酿酒酵母培养后无细胞上清液,被发现有益于乳酸乳球菌和植物乳杆菌聚集并形成生物膜的能力,促进益生菌生产乳酸,表明酵母的代谢物对乳酸菌成膜有积极影响[63]。早期的一些研究已经表明酵母菌和乳酸菌可以形成混菌生物膜,而酵母菌和乳酸菌细胞间的直接接触和聚集是混菌生物膜形成前期的关键[64]。如对于从福山壶醋中分离得到的植物乳杆菌和酿酒酵母,植物乳杆菌细胞通过细胞-细胞直接接触黏附在酵母细胞上是混合物种生物膜形成过程中必要的一步[65]。而乳酸菌表面某种甘露糖特异性黏附蛋白与酵母菌表面的甘露聚糖结合被认为是黏附的主要促成因素。如Fu等[66]发现开菲尔乳杆菌的表面蛋白在与酿酒酵母的稳定生物膜结合中起着重要作用,同时分子对接研究表明酿酒酵母表面的甘露聚糖与开菲尔乳杆菌表面的蛋白的疏水残基结合。在Wada等[67]的研究中,显微观察结果表明含有甘露糖的酵母和含有甘露糖结合蛋白的乳酸菌形成了亚毫米大小的共聚集体,而缺乏相应组成的酵母和/或乳酸菌菌株则彼此分散。相对而言,一些酵母菌细胞表面蛋白,如一种在清酒酿造过程中参与泡沫形成的糖基磷脂酰肌醇(glycosyl phosphatidyl inositol,GPI)锚定蛋白Awa1p会抑制酵母细胞与植物乳杆菌之间的黏附,进而阻碍混菌生物膜的形成[68]。在非特异性黏附方面,较强的疏水性和较弱的Zeta电位贡献了开菲尔中马氏克鲁维酵母较强的聚集能力,进而促进了马氏克鲁维酵母与开菲尔中乳酸菌的聚集和生物膜的形成,该过程被认为导致了开菲尔颗粒的初始形成[69]。一些乳酸菌产生的胞外多糖参与到乳酸菌诱导酵母在亲水材料表面的聚集,如开菲尔中霍氏乳杆菌生成的葡聚糖,其大小和结构不同于其他乳酸菌生成的葡聚糖[70]。在一些发酵过程中,乳酸菌和酵母菌混菌生物膜的形成也依赖于其他微生物,如在大曲发酵的前期阶段,低淀粉酶活性的乳酸菌和酿酒酵母难以以浮游细胞的形式在富淀粉环境中存活,从而形成了一个混合物种的生物膜,并与强大的淀粉酶生产者如芽孢杆菌和根霉共存。在生物膜结构方面,Hirayama等[71]对植物乳杆菌ML11-11和酿酒酵母的混菌生物膜进行观察,发现混菌生物膜呈双层结构,植物乳杆菌ML11-11附着于培养基中的载物玻璃片表面构成生物膜的底层,并通过直接接触与酿酒酵母黏附实现酵母菌的固着,生物膜的上层则由ML11-11和酵母细胞以混合种群的形式占据。乳酸菌和酵母菌混菌生物膜的形成除有利于提高微生物在不利环境中的适应度外,生物膜的高细胞密度能够促进乳酸菌和酵母菌间的相互作用,如酵母的高酶活可为乳酸菌提供更丰富的养分,有利于乳酸菌生物量的提高[72]。此外,酵母有氧呼吸消耗发酵系统中的氧气,缺氧环境促进乳酸菌产生胞外聚合物,进一步促进生物膜的形成[73]。
5 乳酸菌生物膜的特性
5.1 抗逆
与大多数细菌相同,当面对不利环境胁迫时,乳酸菌也倾向于以生物膜的形式生存。如在Aoudia等[74]的研究中,植物乳杆菌和发酵乳杆菌能够在高浓度的胆汁和黏液中形成生物膜。乳酸菌生物膜被报道对乳酸菌耐受消毒剂(如乙醇、次氯酸钠)、酸(如乙酸、柠檬酸、乳酸和苹果酸)、碱、胆盐、模拟人工胃肠液、抗生素(如恩诺沙星、磺胺嘧啶、四环素和土霉素)胁迫均有一定的保护作用[5,28,75]。这种保护作用被认为主要归功于生物膜胞外聚合物屏蔽了有毒化合物、抗生素和酶等对被包埋细胞的侵害,有害物质的扩散可被胞外聚合物阻碍,因此,位于生物膜深层的菌株可能获得更好的保护。胞外聚合物的生物活性和数量被证实直接关系到乳酸菌的生存[55]。胞外多糖作为胞外聚合物重要组分之一,能够在细胞周围形成胞外网络结构,提供保护屏障[76]。eDNA的存在被发现也可以保护生物膜内乳酸菌细胞免受一些有害化学物质如次氯酸钠的损伤[77]。一些基因的表达关系到乳酸菌生物膜的形成及抗逆能力,如基因ftsH编码AAA(ATPase associated with different cellular activities)家族中的FtsH蛋白,一种普遍存在的膜结合、ATP依赖性金属蛋白酶,基因ftsH的表达缺乏使植物乳杆菌对升高的温度和盐浓度表现出显著的敏感性,还降低了植物乳杆菌非生物表面形成生物膜的能力[78]。另有luxS基因在LuxS/AI-2群体感应系统中负责信号分子AI-2的合成,该基因的缺失降低了发酵乳杆菌生物膜中脂肪酸、胞外多糖、蛋白质和eDNA的水平,降低了发酵乳杆菌生物膜的形成,并降低了发酵乳杆菌对酸、胆盐、高温和高渗环境的抵抗力[79]。在E等[80]的研究中,钾离子增加了植物乳杆菌LIP-1中luxS基因的表达,增加了群体感应信号AI-2的合成,促进了生物膜的形成,提高了冻干成活率。此外,在嗜热链球菌分别与保加利亚杆菌、瑞士乳杆菌、马乳酒样乳杆菌和副干酪乳杆菌混合培养中,混菌生物膜的形成量明显多于单一菌株生物膜[81],更多的生物膜量有利于其对微生物的保护。而混菌生物膜内菌株之间相互作用也有助于细菌抵抗升高的温度、不适当的pH值、渗透压、金属离子、抗生素和其他微生物。
5.2 抑菌
多数乳酸菌作为益生菌表现出对致病微生物和食品腐败菌的抑菌活性,而这种抑菌活性大多建立在其生长代谢过程中产生的抗菌化合物如乳酸、H2O2、细菌素等的基础上[82]。如Hossain等[83]收集并利用弯曲乳杆菌和植物乳杆菌的后生元抑制单核增生李斯特菌悬浮细胞的生长及其生物膜在食品表面上的污染,后生元中有机酸和细菌素发挥着抗菌作用。一些乳酸菌如鼠李糖乳杆菌和短乳杆菌可产生的糖脂类生物表面活性剂,其对有害菌的生长无抑制性,但可通過抑制细菌在物体表面的附着表现出强大的抗黏附和抗被膜能力[84]。植物乳杆菌、嗜酸乳杆菌、干酪乳杆菌和鼠李糖乳杆菌等产生的脂磷壁酸能抑制粪肠杆菌生物膜的形成和破坏预先形成的生物膜[85]。近些年对乳酸菌生物膜的研究表明乳酸菌生物膜在抗菌方面的应用同样有较好的前景。如从巴西风干牛肉上分离的乳酸乳球菌、米酒乳杆菌、弯曲乳杆菌等能够生成保护性生物膜,并防止单核增生李斯特菌、大肠杆菌和鼠伤寒沙门氏菌生物膜的形成[86]。从发酵鱼和发酵鸡肉中分离得到的戊球菌和屎肠球菌能够聚集形成生物膜,防止蜡样芽孢杆菌、大肠杆菌和肠道沙门氏菌形成生物膜,同时自聚集率高的乳酸菌表现出更强的抑菌能力[27]。相比于乳酸菌悬浮细胞,生物膜的形成能够增强乳酸菌的抑菌能力[87]。生物膜的形成可以阻止有害菌在表面的黏附和生物膜的形成,而一些乳酸菌生物膜可以捕获有害菌悬浮细胞或成膜细胞进而控制或杀死有害菌[88]。在复杂的发酵环境中,生物膜的抗逆性能和稳定性有利于乳酸菌持续性地发挥抑菌性能。此外,一些乳酸菌如嗜酸乳杆菌的细菌素产生与该菌生物膜形成有较强的相关性[89]。
6 乳酸菌生物膜在食品工业中的作用
长久以来,乳酸菌在食品发酵剂、口服菌剂、家畜养殖、细菌代谢产物生产等方面的应用大多不涉及生物膜的形成。而目前乳酸菌生物膜在抗菌、抗逆等方面的优势日益受到人们的重视,其在食品生产、人体健康中的潜力逐步被开发和利用。在复杂的发酵环境中生物膜的形成有利于乳酸菌对食品发酵进程的推动。乳酸菌生物膜在食品生产中的应用见表2。由表2可知,乳酸菌生物膜的高胁迫耐受性被用于提高乳酸菌在食品发酵中的环境适应性,保证乳酸菌在复杂环境中较优的生物量并发挥益生功能;乳酸菌生物膜的抗菌能力被用于减少或排除食品生产中的有害菌,保障食品的安全,也有助于延长食品的贮藏期,提高食品的安全性并延长其保质期;乳酸菌生物膜被用作食品起始发酵剂,有利于延长微生物作为发酵剂的使用时间,也可能推动特征口感和风味的形成。除了在食品发酵中的应用外,乳酸菌生物膜在其他行业也发挥着积极作用。在食品安全方面,鼠李糖乳杆菌生物膜被发现能够通过结合的方式去除牛奶中的黄曲霉毒素M1[90]。在疾病防治方面,罗伊氏乳杆菌生物膜在降低坏死性小肠结肠炎的发生率中发挥着抗菌和抗炎作用[91]。在污染防治方面,乳酸菌生物膜能够去除镉、铅、钴等重金属[92]。
7 展望
目前,人们对乳酸菌的研究和应用依然主要基于悬浮细胞的形式。而对乳酸菌生物膜有限的研究和了解使得部分学者借用细菌生物膜的形成和调控规律解析乳酸菌生物膜的形成机理和调控方法,这不利于人们认识和利用乳酸菌生物膜。同时,悬浮细胞的低细胞活力、表层细胞的脱离、生物膜成熟后的细胞释放、不完全明了的调控机制和生物膜内部受限的物质扩散等限制了乳酸菌生物膜的应用。而乳酸菌生物膜仍在优化发酵食品生产、改善产品质量和风味、抑制有害微生物、生产高价值产物等方面有着重要的应用前景。
参考文献:
[1]GROSSOVA M, RYSAVKA P, MAROVA I. Probiotic biofilm on carrier surface: a novel promising application for food industry[J].Acta Alimentaria,2017,46(4):439-448.
[2]COSTERTON J W, STEWART P S, GREENBERG E P. Bacterial biofilms: a common cause of persistent infections[J].Science,1999,284(5418):1318-1322.
[3]边瑞玲.乳酸菌发酵在食品加工中的应用[J].科研,2016(8):6.
[4]DE FILIPPIS F, PASOLLI E, ERCOLINI D. The food-gut axis: lactic acid bacteria and their link to food, the gut microbiome and human health[J].FEMS Microbiology Reviews,2020,44(4):454-489.
[5]KUBOTA H, SENDA S, NOMURA N, et al. Biofilm formation by lactic acid bacteria and resistance to environmental stress[J].Journal of Bioscience and Bioengineering,2008,106(4):381-386.
[6]Al-HADIDI A,NAVARRO J,GOODMAN S D,et al. Lactobacillus reuteri in its biofilm state improves protection from experimental necrotizing enterocolitis[J].Nutrients,2021,13(3):918.
[7]SALAS-JARA M J, ILABACA A, VEGA M, et al.Biofilm forming Lactobacillus: new challenges for the development of probiotics[J].Microorganisms,2016,4(3):35.
[8]PREZ-IBARRECHE M, MENDOZA L M, VIGNOLO G, et al. Proteomic and genetics insights on the response of the bacteriocinogenic Lactobacillus sakei CRL1862 during biofilm formation on stainless steel surface at 10 ℃[J].International Journal of Food Microbiology,2017,258:18-27.
[9]WALLIS J K, KRMKER V, PADUCH J H. Biofilm formation and adhesion to bovine udder epithelium of potentially probiotic lactic acid bacteria[J].AIMS Microbiology,2018,4(2):209-224.
[10]朱寒劍,李雷兵,郑心,等.乳酸菌生物膜形成调控及在食品中的应用研究进展[J].食品科学,2021,42(5):296-304.
[11]龚虹,王海霞,马征途,等.乳酸菌粘附力与生物膜、疏水性和自凝集特性的研究[J].种国微生态学杂志,2016,28(9):1026-1028,1033.
[12]GIAOURIS E, CHAPOT-CHARTIER M P, BRIANDET R. Surface physicochemical analysis of natural Lactococcus lactis strains reveals the existence of hydrophobic and low charged strains with altered adhesive properties[J].International Journal of Food Microbiology,2009,131(1):2-9.
[13]BASTARRACHEA L J, BRITT D W, DEMIRCI A. Development of bioactive solid support for immobilized Lactococcus lactis biofilms in bioreactors for the production of nisin[J].Food and Bioprocess Technology,2022,15(1):132-143.
[14]MERCIER-BONIN M, CHAPOT-CHARTIER M P. Surface proteins of Lactococcus lactis: bacterial resources for muco-adhesion in the gastrointestinal tract[J].Frontiers in Microbiology,2017,8(8):2247.
[15]DRAME I, LAFFORGUE C, FORMOSA-DAGUE C, et al. Pili and other surface proteins influence the structure and the nanomechanical properties of Lactococcus lactis biofilms[J]. Scientific Reports,2021,11(1):4846.
[16]DRAM I, FORMOSA-DAGUE C, LAFFORGUE C, et al. Analysis of homotypic interactions of Lactococcus lactis pili using single-cell force spectroscopy[J].ACS Applied Materials and Interfaces,2020,12(19):21411-21423.
[17]PERPETUINI G, PHAM-HOANG B N, SCORNEC H, et al. In Lactobacillus pentosus, the olive brine adaptation genes are required for biofilm formation[J].International Journal of Food Microbiology,2016,216:104-109.
[18]MILJKOVIC M, BERTANI I, FIRA D, et al. Shortening of the Lactobacillus paracasei subsp. paracasei BGNJ1-64 AggLb protein switches its activity from auto-aggregation to biofilm formation[J].Frontiers in Microbiology,2016,7:1422.
[19]CAPPITELLI F, POLO A, VILLA F. Biofilm formation in food processing environments is still poorly understood and controlled[J].Food Engineering Reviews,2014,6(1):29-42.
[20]SAMROT A V, ABUBAKAR M A, FARADJEVA E, et al. Mechanisms and impact of biofilms and targeting of biofilms using bioactive compounds—a review[J].Medicina,2021,57(8):839.
[21]YAO S, HAO L, ZHOU R, et al. Formation of biofilm by Tetragenococcus halophilus benefited stress tolerance and anti-biofilm activity against S. aureus and S. typhimurium[J].Frontiers in Microbiology,2022,13:819302.
[22]AMBULKAR S K, TALE V, JADHAV A, et al. Biofilm forming ability of bacteria isolated from dental caries: with reference to Streptococcus species[J].Future Dental Journal,2019,5(1):2.
[23]GEORGE J, HALAMI P M. Presence of extracellular DNA & protein in biofilm formation by gentamicin-resistant Lactobacillus plantarum[J].The Indian Journal of Medical Research,2019,149(2):257-262.
[24]MURUZOVIC' M , MLADENOVIC' K G, Cˇ OMIC' L R. In vitro evaluation of resistance to environmental stress by planktonic and biofilm form of lactic acid bacteria isolated from traditionally made cheese from Serbia[J].Food Bioscience,2018,23:54-59.
[25]RIEDL R, GODERBAUER P, BRANDL A, et al. Bavarian wheat beer, an example of a special microbe habitat—cultivation, detection, biofilm formation, characterization of selected lactic acid bacteria hygiene indicators and spoilers[J].Brewing Science,2017,70(1):39.
[26]RIEDL R, DNZER N, MICHEL M, et al. Beer enemy number one: genetic diversity, physiology and biofilm formation of Lactobacillus brevis[J].Journal of the Institute of Brewing,2019,125(2):250-260.
[27]TATSAPORN T, KORNKANOK K.Using potential lactic acid bacteria biofilms and their compounds to control biofilms of foodborne pathogens[J].Biotechnology Reports,2020,26:477.
[28]REZAEI Z, KHANZADI S, SALARI A. A survey on biofilm formation of Lactobacillus rhamnosus (PTCC 1637) and Lactobacillus plantarum (PTCC 1745) as a survival strategy of probiotics against antibiotic in vitro and yogurt[J].Journal of Food Processing and Preservation,2022,46(9):15991.
[29]FAN Y, HUANG X, CHEN J, et al. Formation of a mixed-species biofilm is a survival strategy for unculturable lactic acid bacteria and Saccharomyces cerevisiae in Daqu, a Chinese traditional fermentation starter[J].Frontiers in Microbiology,2020,11:138.
[30]ARROYO-LPEZ F N, BAUTISTA-GALLEGO J, DOMNGUEZ-MANZANO J, et al. Formation of lactic acid bacteria—yeasts communities on the olive surface during Spanish-style Manzanilla fermentations[J].Food Microbiology,2012,32(2):295-301.
[31]YUNDA E, QUIL S F. In situ spectroscopic analysis of Lactobacillus rhamnosus GG flow on an abiotic surface reveals a role for nutrients in biofilm development[J].Biofouling,2019,35(5):494-507.
[32]丹彤,王俊國,张和平.乳酸菌胞外多糖的结构、生物合成及其应用[J].食品科学,2013,34(7):335-339.
[33]ZHANG M, ZENG S, HAO L, et al. Structural characterization and bioactivity of novel exopolysaccharides produced by Tetragenococcus halophilus[J].Food Research International,2022,155:111083.
[34]ABDELLAH M, AHC NE H, BENALIA Y, et al. Evaluation of biofilm formation by exopolysaccharide-producer strains of thermophilic lactic acid bacteria isolated from Algerian camel milk[J].Emirates Journal of Food and Agriculture,2015,27(6):513-521.
[35]DERTLI E, MAYER M J, NARBAD A. Impact of the exopolysaccharide layer on biofilms, adhesion and resistance to stress in Lactobacillus johnsonii FI9785[J].BMC Microbiology,2015,15(1):8.
[36]IVKOVIC' M, MILJKOVIC' M S, RUAS-MADIEDO P, et al. EPS-SJ exopolisaccharide produced by the strain Lactobacillus paracasei subsp.paracasei BGSJ2-8 is involved in adhesion to epithelial intestinal cells and decrease on E. coli association to Caco-2 cells[J].Frontiers in Microbiology,2016,9(7):286.
[37]FERN NDEZ R M D, NIEROP G M N, SMID E J, et al. Role of cell surface composition and lysis in static biofilm formation by Lactobacillus plantarum WCFS1[J].International Journal of Food Microbiology,2018,271:15-23.
[38]FERN NDEZ R M D, SMID E J, ABEE T, et al. Characterisation of biofilms formed by Lactobacillus plantarum WCFS1 and food spoilage isolates[J].International Journal of Food Microbiology,2015,207:23-29.
[39]OLWAL C O, ANG'IENDA P O, ONYANGO D M, et al. Susceptibility patterns and the role of extracellular DNA in Staphylococcus epidermidis biofilm resistance to physico-chemical stress exposure[J].BMC Microbiology,2018,18(1):40.
[40]MLYNEK K D, BULOCK L L, STONE C J, et al. Genetic and biochemical analysis of CodY-mediated cell aggregation in Staphylococcus aureus reveals an interaction between extracellular DNA and polysaccharide in the extracellular matrix[J].Journal of Bacteriology,2020,202(8):00593-19.
[41]DAS T, SEHAR S, KOOP L, et al. Influence of calcium in extracellular DNA mediated bacterial aggregation and biofilm formation[J].PLoS One,2014,9(3):91935.
[42]BOEKHORST J, WELS M, KLEEREBEZEM M, et al. The predicted secretome of Lactobacillus plantarum WCFS1 sheds light on interactions with its environment[J].Microbiology,2006,152(11):3175-3183.
[43]FU J, ZHANG Y, LIN S, et al. Strategies for interfering with bacterial early stage biofilms[J].Frontiers in Microbiology,2021,12:1339.
[44]SANTSCHI P H, XU C, SCHWEHR K A, et al. Can the protein/carbohydrate(P/C)ratio of exopolymeric substances (EPS) be used as a proxy for their 'stickiness' and aggregation propensity?[J].Marine Chemistry,2020,218:103734.
[45]LIU C, SUN D, ZHU J, et al. The regulation of bacterial biofilm formation by cAMP-CRP: a mini-review[J].Frontiers in Microbiology,2020,11:802.
[46]鄧曌曦,音建华,汪海峰.乳酸菌群体感应与其肠道生物膜形成的研究进展[J].微生物学报,2018,58(11):1970-1978.
[47]YANG Q, WANG Y, AN Q, et al. Research on the role of LuxS/AI-2 quorum sensing in biofilm of Leuconostoc citreum 37 based on complete genome sequencing[J].3 Biotech,2021,11(4):189.
[48]GU Y, TIAN J, ZHANG Y, et al. Dissecting signal molecule AI-2 mediated biofilm formation and environmental tolerance in Lactobacillus plantarum[J].Journal of Bioscience and Bioengineering,2021,131(2):153-160.
[49]ZHANG Y, GU Y, WU R, et al.Exploring the relationship between the signal molecule AI-2 and the biofilm formation of Lactobacillus sanfranciscensis[J].LWT-Food Science and Technology,2022,154:112704.
[50]YU Y, ZONG M, LAO L, et al.Adhesion properties of cell surface proteins in Lactobacillus strains in the GIT environment[J].Food and Function,2022,13(6):3098-3109.
[51]DIAL C N, SPEARE L, SHARPE G C, et al. Para-aminobenzoic acid, calcium, and c-di-GMP induce formation of cohesive, Syp-polysaccharide-dependent biofilms in Vibrio fischeri[J].mBio,2021,12(5):203421.
[52]LIU Z, LI H, LI L, et al.Gene-trait matching analysis reveals putative genes involved in Bifidobacterium spp. biofilm formation[J].Gene,2022,826:146449.
[53]HE J, RUAN W, SUN J, et al. Functional characterization of c-di-GMP signaling-related genes in the probiotic Lactobacillus acidophilus[J].Frontiers in Microbiology,2018,9:1935.
[54]王星,张华,张淼,等.乳酸菌生物膜的形成及其影响因素[J].中国乳品工业,2020,48(3):38-40,46.
[55]NGUYEN P T, NGUYEN T T, NGUYEN T T U, et al. Improve the viability and extracellular polymeric substances bioactivity of Lactiplantibacillus plantarum VAL6 using the environmental adaptation[J].Food and Bioproducts Processing,2022,131:149-155.
[56]AL AZZAZ J, AL TARRAF A, HEUMANN A, et al. Resveratrol favors adhesion and biofilm formation of Lacticaseibacillus paracasei subsp. paracasei strain ATCC334[J].International Journal of Molecular Sciences,2020,21(15):5423.
[57]SCARDACI R, MANFREDI M, BARBERIS E, et al. Serotonin exposure improves stress resistance, aggregation, and biofilm formation in the probiotic Enterococcus faecium NCIMB10415[J].Microbiolres,2021,12(3):606-625.
[58]YAO S, HAO L, ZHOU R, et al. Multispecies biofilms in fermentation: biofilm formation, microbial interactions, and communication[J].Comprehensive Reviews in Food Science and Food Safety,2022,21(4):3346-3375.
[59]LEN-ROMERO , DOMNGUEZ-MANZANO J, GARRIDO-FERN NDEZ A, et al. Formation of in vitro mixed-species biofilms by Lactobacillus pentosus and yeasts isolated from spanish-style green table olive fermentations[J].Applied and Environmental Microbiology,2016,82(2):689-695.
[60]高紅娟.探讨传统发酵食品中微生物间相互作用及应用[J].食品安全导刊,2021(28):132,134.
[61]刘豪栋,杨昳津,林高节,等.酵母与乳酸菌的相互作用模式及其在发酵食品中的应用研究进展[J].食品科学,2022,43(9):268-274.
[62]任晓镤,许倩,李明杨,等.酿酒酵母对乳杆菌生长与生物膜形成的影响[J].农业机械学报,2016,47(2):264-269,287.
[63]GU Y, TIAN J, ZHANG Y, et al. Effect of Saccharomyces cerevisiae cell-free supernatant on the physiology, quorum sensing, and protein synthesis of lactic acid bacteria[J].LWT-Food Science and Technology,2022,165:113732.
[64]FURUKAWA S, NOJIMA N, NOZAKA S, et al. Mutants of Lactobacillus plantarum ML11-11 deficient in co-aggregation with yeast exhibited reduced activities of mixed-species biofilm formation[J].Bioscience, Biotechnology, and Biochemistry,2012,76(2):326-330.
[65]FURUKAWA S, ISOMAE R, TSUCHIYA N, et al. Screening of lactic acid bacteria that can form mixed-species biofilm with Saccharomyces cerevisiae[J].Bioscience, Biotechnology, and Biochemistry,2015,79(4):681-686.
[66]FU M, MAO K, GAO J, et al. Characteristics of surface layer protein from Lactobacillus kefiri HBA20 and the role in mediating interactions with Saccharomyces cerevisiae Y8[J].International Journal of Biological Macromolecules,2022,201:254-261.
[67]WADA M, NOMURA T. Direct measurement of adhesion force between a yeast cell and a lactic acid bacterium cell with atomic force microscopy[J].Journal of Bioscience and Bioengineering,2022,133(2):155-160.
[68]HIRAYAMA S, SHIMIZU M, TSUCHIYA N, et al. Awa1p on the cell surface of sake yeast inhibits biofilm formation and the co-aggregation between sake yeasts and Lactobacillus plantarum ML11-11[J].Journal of Bioscience and Bioengineering,2015,119(5):532-537.
[69]HAN X, ZHANG L J, WU H Y, et al. Investigation of microorganisms involved in kefir biofilm formation[J].Antonie Van Leeuwenhoek,2018,111(12):2361-2370.
[70]XU D, FELS L, WEFERS D, et al. Lactobacillus hordei dextrans induce Saccharomyces cerevisiae aggregation and network formation on hydrophilic surfaces[J].International Journal of Biological Macromolecules,2018,115:236-242.
[71]HIRAYAMA S, NOJIMA N, FURUKAWA S, et al. Steric microstructure of mixed-species biofilm formed by interaction between Lactobacillus plantarum ML11-11 and Saccharomyces cerevisiae[J].Bioscience, Biotechnology, and Biochemistry,2019,83(12):2386-2389.
[72]李晏蝶,李珊,高云云,等.副干酪乳桿菌和马克斯克鲁维酵母混合发酵条件优化[J].中国乳品工业,2020,48(10):8-12.
[73]GONG C, HE Y, TANG Y, et al. Biofilms in plant-based fermented foods: formation mechanisms, benefits and drawbacks on quality and safety, and functionalization strategies[J].Trends in Food Science and Technology,2021,116:940-953.
[74]AOUDIA N, RIEU A, BRIANDET R, et al. Biofilms of Lactobacillus plantarum and Lactobacillus fermentum: effect on stress responses, antagonistic effects on pathogen growth and immunomodulatory properties[J].Food Microbiology,2016,53:51-59.
[75]张悦,贺银凤,顾悦,等.高产生物膜乳酸菌抗逆性及其抗氧化特性[J].农业工程学报,2021,37(6):282-288.
[76]ZHAO J, SHEN Y, HAAPASALO M, et al. A 3D numerical study of antimicrobial persistence in heterogeneous multi-species biofilms[J].Journal of Theoretical Biology,2016,392:83-98.
[77]YU M K, KIM M A, ROSA V, et al. Role of extracellular DNA in Enterococcus faecalis biofilm formation and its susceptibility to sodium hypochlorite[J].Journal of Applied Oral Science,2019,12(27):20180699.
[78]BOVE P, CAPOZZI V, GAROFALO C, et al. Inactivation of the ftsH gene of Lactobacillus plantarum WCFS1: effects on growth, stress tolerance, cell surface properties and biofilm formation[J].Microbiological Research,2012,167(4):187-193.
[79]ZHANG Y, GU Y, ZHENG Y, et al.Deletion of luxS gene mediated by λRed gene recombination technology reduces biofilm formation and stress resistance of Lactobacillus fermentum[J].Food Bioscience,2022,49:101892.
[80]E J J, MA R Z, CHEN Z C, et al. Improving the freeze-drying survival rate of Lactobacillus plantarum LIP-1 by increasing biofilm formation based on adjusting the composition of buffer salts in medium[J].Food Chemistry,2021,338:128134.
[81]YAO C Q, LI J, E J J, et al.The symbiosis among, and the storage stabilities of, starter lactic acid bacterial strains in biofilms[J].LWT-Food Science and Technology,2022,155:112896.
[82]HA T Q, HOA T M T. Selection of lactic acid bacteria producing bacteriocin[J].Journal of Vietnammese Environment,2016,8(5):271-276.
[83]HOSSAIN M I, MIZAN M F R, ROY P K, et al. Listeria monocytogenes biofilm inhibition on food contact surfaces by application of postbiotics from Lactobacillus curvatus B.67 and Lactobacillus plantarum M.2[J].Food Research International,2021,148:110595.
[84]PATEL M, SIDDIQUI A J, HAMADOU W S, et al. Inhibition of bacterial adhesion and antibiofilm activities of a glycolipid biosurfactant from Lactobacillus rhamnosus with its physicochemical and functional properties[J].Antibiotics,2021,10(12):1546.
[85]JUNG S, PARK O J, KIM A R, et al. Lipoteichoic acids of lactobacilli inhibit Enterococcus faecalis biofilm formation and disrupt the preformed biofilm[J].Journal of Microbiology,2019,57(4):310-315.
[86]GMEZ N C, RAMIRO J M P, QUECAN B X V, et al. Use of potential probiotic lactic acid bacteria (LAB) biofilms for the control of Listeria monocytogenes, Salmonella typhimurium, and Escherichia coli O157∶H7 biofilms form4ation[J].Frontiers in Microbiology,2016(7):863.
[87]NGUYEN T K N, DUONG H V, NGUYEN T T, et al. Characteristic of co-culture biofilm formed by Lactobacillus plantarum and Pediococcus acidilactici, and antagonistic effects of this biofilm on pathogen growth[J].Japan Journal of Food Engineering,2020,21(2):81-87.
[88]JARA J, PREZ-RAMOS A, DEL SOLAR G, et al. Role of Lactobacillus biofilms in Listeria monocytogenes adhesion to glass surfaces[J].International Journal of Food Microbiology,2020,334:108804.
[89]JNAN J B, AMAL A K. Correlation between biofilm formation and bacteriocin production by Lactobacillus acidophilus[J].Pakistan Journal of Biotechnology,2018,15(2):553-560.
[90]ASSAF J C, KHOURY A E, CHOKR A, et al. A novel method for elimination of aflatoxin M1 in milk using Lactobacillus rhamnosus GG biofilm[J].International Journal of Dairy Technology,2019,72(2):248-256.
[91]SHELBY R D, MAR P, JANZOW G E, et al. Antibacterial and anti-inflammatory effects of Lactobacillus reuteri in its biofilm state contribute to its beneficial effects in a rat model of experimental necrotizing enterocolitis[J].Journal of Pediatric Surgery,2022,57(7):1382-1390.
[92]SAHEH S K, AHMAED A S. Removal of some heavy metal from aqueous solutions by lactic acid bacteria (whole bacteria and biofilm)[J].Plant Archives,2020,20(2):4105-4108.
[93]PANNELLA G, LOMBARDI S J, COPPOLA F, et al. Effect of biofilm formation by Lactobacillus plantarum on the malolactic fermentation in model wine[J].Foods,2020,9(6):797.
[94]CHEOW W S, KIEW T Y, HADINOTO K. Effects of adding resistant and waxy starches on cell density and survival of encapsulated biofilm of Lactobacillus rhamnosus GG probiotics[J].LWT-Food Science and Technology,2016,69:497-505.
[95]LI X, LIU D. Effects of wheat bran co-fermentation on the quality and bacterial community succession during radish fermentation[J].Food Research International,2022,157:111229.
[96]FATEN K, HAMIDA K, SOUMYA E A, et al. Lactobacillus plantarum: effect of a protective biofilm on the surface of olives during storage[J].Brazilian Journal of Microbiology,2016,47:202-209.
[97]MECHMECHE M, KSONTINI H, SETTI K, et al. Dried tomato slices: an approach to increase safety and shelf-life of by the use of Lactobacillus plantarum[J].Dates,2022(2):1-13.
[98]CARPINO S, RANDAZZO C L, PINO A, et al. Influence of PDO Ragusano cheese biofilm microbiota on flavour compounds formation[J].Food Microbiology,2017,61:126-135.

