小鼠角膜上皮细胞永生化细胞系的建立及表型鉴定
白莹 王一卉 葛欢欢 卞雯晗 陈鹏
[摘要] 目的 探討小鼠角膜上皮细胞永生化细胞系的建立方法,并鉴定其表型的稳定性。
方法提取小鼠角膜上皮原代细胞,以猴空泡病毒40大T抗原(SV40-LT)慢病毒感染小鼠角膜上皮原代细胞建立永生化细胞系。通过HE染色与免疫荧光染色对角膜上皮组织表型和标记物(K12、Pax6、Ki-67)进行鉴定。提取原代角膜上皮细胞并对其角膜上皮细胞分层蛋白K14进行鉴定,观察细胞明场视野评估细胞形态学特征。对转染后的P1和P8代细胞的部分标志物(K12、Pax6、Ki-67、ABCG2、K14)进行鉴定。采用结晶紫染色法观察转染后的P1和P8代细胞克隆的形成能力。
结果小鼠角膜上皮组织中K12、Pax6、Ki-67染色阳性;P1、P8代小鼠角膜上皮细胞中K12、Pax6、Ki-67、K14和ABCG2染色阳性,上述标志物阳性率比较,差异均无显著性(P>0.05),P1与P8代小鼠角膜上皮细胞克隆能力无明显差异(P>0.05)。
结论使用SV40-LT慢病毒转染小鼠角膜上皮,成功建立永生化小鼠角膜上皮细胞系,表型稳定且稳定增殖。
[关键词] 细胞系;上皮细胞;角膜;转染;遗传标记;小鼠,近交C57BL
[中图分类号] R329.24;R394
[文献标志码] A
Establishment and phenotypic identification of an immortalized mouse corneal epithelial cell line
BAI Ying, WANG Yihui, GE Huanhuan, BIAN Wenhan, CHEN Peng
(Department of Human Anatomy, Histology and Embryology, School of Basic Medicine, Qingdao University, Qingdao 266071, China)
;[ABSTRACT] Objective To investigate the method for establishing an immortalized mouse corneal epithelial cell line, and to identify the stability of its phenotype.
Methods Primary mouse corneal epithelial cells were extracted and transfected with Simian Vacuolating Virus 40 Large T Antigen (SV40-LT) lentivirus to establish an immortalized cell line. HE staining and immunofluorescent staining were used to identify the phenotypes and markers (K12, Pax6, Ki-67) of corneal epithelium. Primary cor-
neal epithelial cells were extracted to identify K14 protein in corneal epithelial cell layer, and bright field observation was performed to evaluate cell morphological characteristics. Several markers (K12, Pax6, Ki-67, ABCG2, K14) were identified for P1 and P8 cells after transfection. Crystal violet staining was used to observe the colony-formation ability of P1 and P8 cells after transfection.
Results Mouse corneal epithelium was stained positive for K12, Pax6 and Ki-67, while the P1 and P8 generations of mouse cor-
neal epithelial cells were stained positive for K12, Pax6, Ki-67, K14, and ABCG2; there were no significant differences in the positive rates of the above markers (P>0.05). There was no significant difference in colony-formation ability between P1 and P8 cells (P>0.05).
Conclusion The immortalized mouse corneal epithelial cell line is successfully established by transfection with SV40-LT lentivirus, which has stable phenotype and proliferation.
[KEY WORDS] Cell line; Epithelial cells; Cornea; Transfection; Genetic markers; Mice, inbred C57BL
角膜上皮位于角膜前表面,由非角化上皮细胞有序排列而成,在视觉系统中发挥着重要的作用。角膜上皮细胞(CECs)不断从角膜缘干细胞或祖细胞(LSCs)中更新而来,LSCs或CECs缺乏会引起角膜表面缺损、角膜炎等,最终可能导致失明[1-2]。
原代角膜上皮细胞通常在培养3~4代后即停止生长,导致每次实验中产生的细胞数量很少,这也是影响角膜上皮疾病相关实验研究深入开展的瓶颈问题。因此,建立可以无限增殖,并且表型稳定的角膜上皮细胞系十分必要[3]。目前,相关研究报道了原代小鼠角膜上皮细胞的提取方法与应用情况,但在细胞传代增殖过程中出现的细胞衰老和形态改变等问题仍然难以解决[4]。海弗利克极限理论提出体细胞的增殖能力是有限的,不能进行无限的增殖复制,但在一些特殊条件干预下,细胞也可以实现无限增殖,且无恶化的表征,即处于正常细胞与癌细胞之间的一种永生化细胞状态[5]。研究显示,猴空泡病毒40大T抗原(SV40-LT)片段能与细胞内的p53及其他相关蛋白结合,所形成的复合体可导致p53蛋白失活,进一步使抑癌基因失效无法表达,从而防止细胞出现分裂停滞,达到调整宿主细胞周期使细胞处于永生化状态的目的[6-8]。研究显示,将SV40-LT慢病毒转染原代赫特维希上皮根鞘细胞后,能成功建立棕色脂肪永生化细胞系和上皮根鞘永生化细胞系[9]。本研究通过将SV40-LT慢病毒转染小鼠角膜上皮细胞以构建其永生化细胞系,旨在為角膜上皮疾病的实验研究提供足够细胞来源,减少实验动物成本。
1 材料与方法
1.1 动物和材料
8~10周龄雄性C57BL/6小鼠10只,购买于北京维通利华实验动物技术有限公司。免疫荧光K12、Ki-67、K14兔单克隆抗体购自美国Abcam公司;兔单克隆抗体ABCG2购买于武汉爱博泰克生物科技有限公司;鼠单克隆抗体Pax6购买于美国Biolegend公司。SV40-LT(pGMLV-SV40T-PURO Lentivirus,启动子为EF1SymbolaA@,载体类型为慢病毒,组成型表达方式,嘌呤毒素真核抗性,荧光标记)购自上海吉满生物科技有限公司。
1.2 角膜组织切片HE染色
10只小鼠适应性喂养3 d,异氟烷气体麻醉后脱颈处死,取出左侧眼球,其中5颗眼球以石蜡包埋后切片。将切片脱蜡后依次用苏木精、伊红染色,中性树胶封片后,显微镜明场视野观察角膜组织形态。剩余5颗眼球置于冰冻组织包埋剂中,-80 ℃冷冻后切片。
1.3 角膜上皮原代细胞的提取及培养
剥离出10只小鼠的右侧眼球,置于4 ℃含有1 500 U/L dispase Ⅱ的KSFM培养基中,第2天剥离出角膜,置于48孔板中,加入含1% ITS、1%青霉素/链霉素和2% B-27补充剂的KSFM培养基(完全培养基),置于含体积分数0.05 CO2的培养箱中进行培养,为原代小鼠的角膜上皮细胞。在培养48 h时使用倒置显微镜明场视野观察原代角膜上皮细胞的形态。
1.4 永生化细胞系的建立及细胞传代
1.4.1嘌呤毒素的最低致死浓度测定 将嘌呤霉素加入完全培养基中,以1 mg/L为一个浓度梯度,配制成0~10 mg/L不同浓度的培养基。将原代小鼠角膜上皮细胞以1×104个/孔接种于48孔板中,置于培养箱中,当细胞融合度达50%~60%时,将原培养基替换为含不同浓度嘌呤霉素的培养基继续培养4 d,随时通过显微镜观察,以全部细胞为漂浮状态且未见贴壁细胞为细胞全部死亡的判断标准,实验共重复3次。测得嘌呤霉素的最低致死浓度为2 mg/L。
1.4.2细胞的转染 将原代小鼠角膜上皮细胞以1×104个/孔接种于48孔板中,待融合度达60%~70%时,通过细胞计数板计算细胞数目,每孔约为2.0×105个细胞,按照公式(病毒量=MOI值×细胞数目÷病毒滴度)计算培养基中需加入SV40-LT的病毒量,其中病毒滴度为5×108 PFU/mL(由上海吉满生物科技有限公司提供),以MOI值分别为20、10、5进行摸索实验。加入按照上面方法计算出的不同SV40-LT病毒量后再培养48 h,更换为完全培养基,通过荧光显微镜观察,发现当MOI值为5时,角膜上皮细胞会出现慢病毒自带的红色荧光,表示细胞转染成功。将转染成功细胞的培养基更换为筛选培养基(完全培养基中加入2 mg/L的嘌呤霉素),每48 h更换1次。当细胞融合度达85%以上时,将细胞移至培养瓶中使用完全培养基继续培养。
1.4.3细胞传代 取培养瓶中的小鼠角膜上皮细胞,吸出原培养基,PBS清洗细胞后加入2.5 g/L胰蛋白酶500 μL消化细胞,后置于含体积分数0.05 CO2的培养箱中观察5 min,待细胞呈分散漂浮状态时,吸出胰蛋白酶,加入完全培养基终止消化。将细胞收集到15 mL离心管当中,以1 000 r/min离心5 min,吸除上清液,按照吸除上清液的2倍体积重新加入完全培养基,混匀后置于培养箱中继续培养,得到P1代小鼠角膜上皮细胞。重复上述步骤,得到P8代小鼠角膜上皮细胞。
1.5 小鼠角膜上皮细胞和组织的免疫荧光染色
将原代、P1和P8代小鼠角膜上皮细胞分别接种于24孔板中,待融合度达60%时,吸出原培养基,PBS洗涤2次后,使用4%多聚甲醛固定20~25 min,以PBS洗涤10 min后,正常山羊血清封闭1 h。原代小鼠角膜上皮细胞中加入兔抗K12,P1、P8代小鼠角膜上皮细胞中均分别加入兔抗K12、鼠抗Pax6、兔抗K14、兔抗Ki-67和兔抗ABCG2一抗,4 ℃条件下过夜,第2天使用PBS洗涤3次后,避光条件下每孔加入二抗,室温孵育1 h,PBS洗涤3次。以DAPI室温染色5 min,PBS洗涤后,于倒置荧光显微镜下观察原代细胞中K12及P1、P8代细胞中K12、Pax6、Ki-67、K14和ABCG2的表达情况,并计算阳性率。取1.2中制备的小鼠角膜组织切片,按照上述步骤进行免疫荧光染色,荧光显微镜下观察角膜组织中K12、Pax6、Ki-67的表达情况。
1.6 克隆形成实验
将P1和P8代小鼠角膜上皮细胞分别接种于6孔板中,待融合度达80%时,吸除培养基,加入4%多聚甲醛固定细胞20 min,PBS清洗5 min后,加入结晶紫溶液染色25 min后吸出,以PBS清洗细胞3次后,记录克隆形成数,计算克隆形成率。
1.7 统计学处理
使用GraphPad Prism 9软件进行数据的统计分析,符合正态分布的计量资料以 ±s表示,两组间比较采用非配对t检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 小鼠角膜上皮组织表型及标志物鉴定
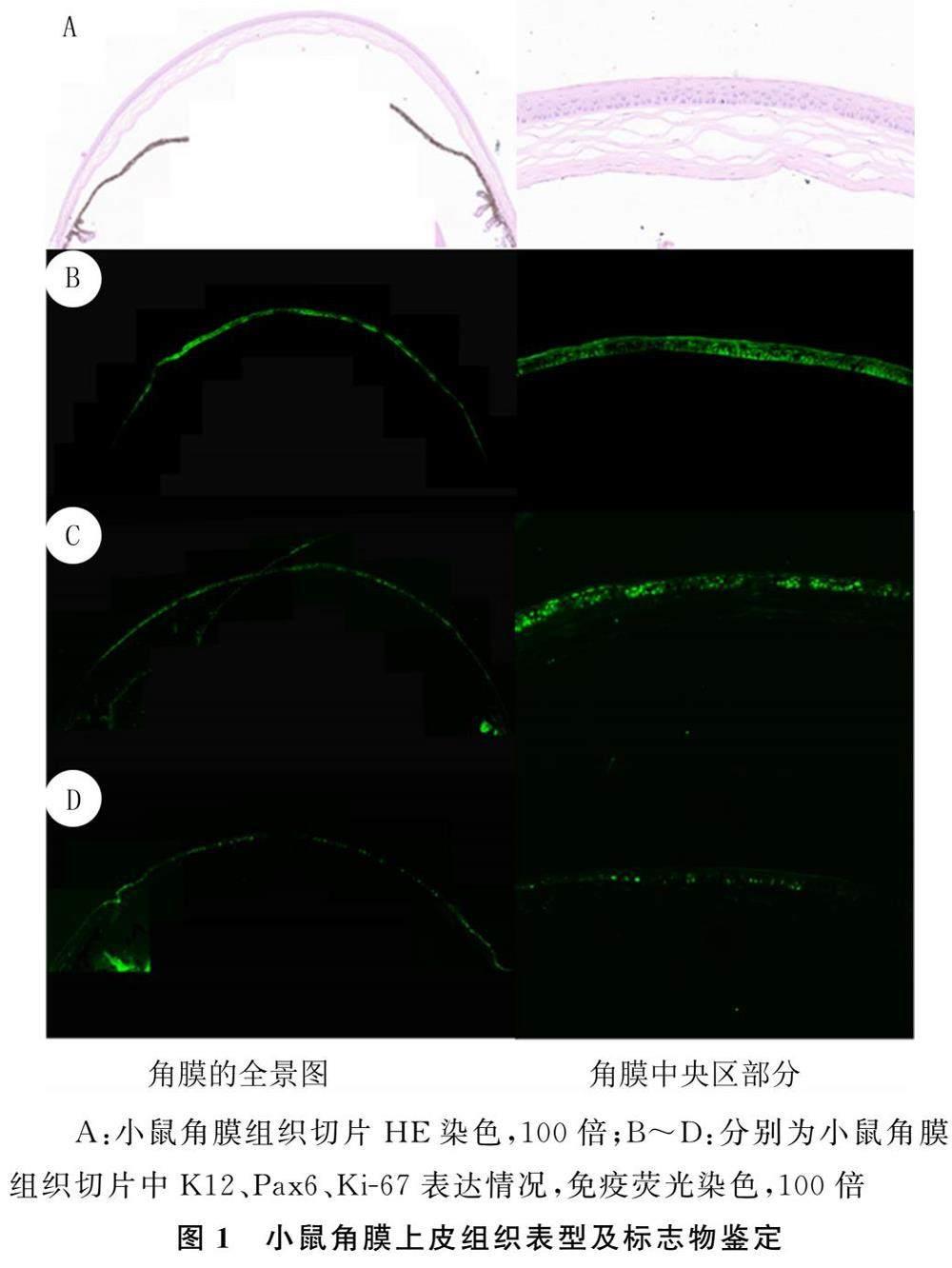
小鼠角膜组织切片HE染色结果显示,其角膜上皮由3~5层细胞构成,角膜上皮复层正常,角膜基质胶原纤维呈矩形规则排列(图1A)。角膜组织切片免疫荧光染色显示,K12在整个角膜上皮中的染色均呈阳性,但在邻近结膜的角膜缘基底上皮中的染色呈阴性(图1B);Pax6和Ki-67在角膜上皮中的染色均呈阳性(图1C、D)。
2.2 原代小鼠角膜上皮细胞的表型及明场视野
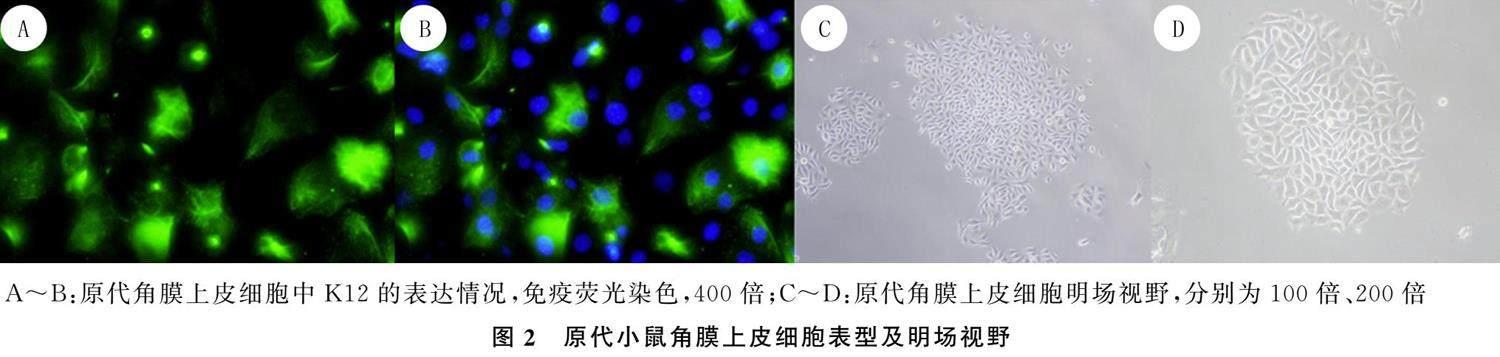
免疫荧光染色显示,原代小鼠角膜上皮细胞中K12显著表达,见图2A~B;图2B中绿色为K12,蓝色为DAPI。明场视野观察显示,角膜组织碎片周围有向外增殖的角膜上皮细胞,呈鹅卵石状,见图2C~D。
2.3P1和P8代小鼠角膜上皮细胞表型及标志物鉴定
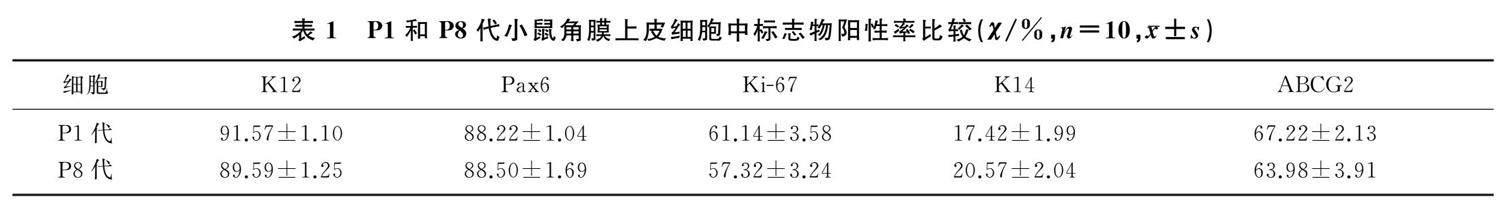
免疫荧光染色显示,P1、P8代小鼠角膜上皮细胞中K12、Pax6、Ki-67、K14以及ABCG2染色陽性(图3)。P1和P8代细胞的上述标志物阳性率比较,差异均无显著性(P>0.05),见表1。P1和P8代细胞的明场视野观察显示,角膜上皮细胞形态正常,呈鹅卵石状,且分布均匀(图4)。
2.4 克隆形成实验
P1、P8代细胞的克隆形成率分别为(375.70±10.02)%、(357.30±11.93)%,两者比较差异无显著性(P>0.05)。
3 讨 论
目前全世界约有1 000万人由于眼外伤、严重的感染、神经营养性角膜病变、病原体侵入等原因致角膜盲[1,10-12]。角膜移植手术与自体或异体角膜缘移植是治疗角膜盲的最有效手段,但受到全球供体角膜短缺以及免疫排斥反应发生率过高的限制,导致目前角膜病治疗依然是一大难题[13-14]。角膜上皮细胞对于角膜病理学、分子生物学、免疫学相关的实验研究至关重要,但体外培养的原代小鼠角膜上皮细胞传代次数有限,并且容易衰老,因此实验时需要大量的实验小鼠,增加了实验成本[15]。
SV40-LT是具有广谱转化效应的细胞永生化基因,可以与多种蛋白结合以延长细胞周期,为临床细胞学研究提供了基础。有研究表明SV40-LT转染肝细胞后,与肝细胞内的p53和磷酸化视网膜母细胞瘤蛋白(pRB)结合,致p53和pRB功能丧失,肿瘤抑制通路失活,促进肝细胞增殖[6-8]。国内外研究者不断尝试应用永生化技术体外建立角膜上皮细胞系[16-18],如通过重组的SV40腺病毒载体或编码端粒酶的逆转录病毒载体转染人角膜上皮细胞成功构建了永生化人角膜细胞系[19-20]。但是人角膜样本来源少,目前市场上销售的永生化细胞系价格昂贵,因此如果能成功培养小鼠角膜上皮永生化细胞系,将会极大促进角膜病相关研究的开展。
研究显示,K12是角膜上皮细胞的标志物[21],在整个角膜上皮组织和角膜基底层上缘组织中均有表达,在永生化角膜上皮细胞中也广泛表达;Pax6是角膜发育的主要调控基因,可直接与K12启动子结合[22-23],在永生化角膜上皮细胞系中广泛表达;Ki-67是细胞增殖的标志物[24]。本研究首先对小鼠角膜组织切片进行了HE染色,显示其角膜上皮由3~5层细胞构成,角膜基质胶原纤维呈矩形规则排列。免疫荧光染色显示,在整个角膜上皮中均可见染色阳性的K12、Pax6和Ki-67,提示在小鼠角膜上皮中均有K12、Pax6和Ki-67表达。然后本研究又对从角膜组织中提取出来的原代小鼠角膜上皮细胞进行培养,免疫荧光染色结果显示,原代小鼠角膜上皮细胞中K12显著表达,显微镜明场视野观察显示角膜组织碎片周围有向外增殖的呈鹅卵石状角膜上皮细胞,提示原代小鼠角膜上皮细胞提取成功。本研究又对原代小鼠角膜上皮细胞通过梯度摸索实验,得到其转染SV40-LT的最适MOI为5,计算加入培养板中的病毒量;为了让细胞能够稳定转染,又在培养液中加入最低致死浓度(2 mg/L)的嘌呤霉素,再将细胞进行传代,获得P1、P8代小鼠角膜上皮细胞。免疫荧光染色结果显示,P8代与P1代细胞中K12、Pax6、Ki-67、K14和ABCG2均染色阳性,且K12、Pax6、Ki-67、K14和ABCG2阳性率比较,差异均无显著性。K14是上皮细胞分化的标志物,仅仅表达于角膜缘基底细胞以及角膜上皮基底层[25-26]。ABCG2又称乳腺癌抵抗蛋白1(BCRP1),是ABC家族的一员,是许多组织中干细胞的通用标志物[27],在角膜缘干细胞中也显著表达。最后为了评估传代细胞的增殖能力,又进行了细胞克隆形成实验,结果显示P8和P1代细胞的克隆形成率无显著差异。上述结果表明,转染SV40-LT的原代小鼠角膜上皮细胞在传代后稳定表达K12、Pax6、Ki-67、K14和ABCG2,且没有发生衰老或停止增殖等现象,说明永生化小鼠角膜上皮细胞系建立成功。但因为SV40-LT介导的细胞转染会改变染色体的结构和数量,与原代细胞相比,获得的永生化细胞会随着多次传代出现异常核型,这也是本方法构建的细胞系局限性的一个方面。
综上所述,本研究通过转染SV40-LT成功建立了小鼠角膜上皮永生化细胞系,保留了原代小鼠角膜上皮细胞的特性,并且细胞的克隆能力良好。该方法获得的小鼠角膜上皮细胞易于培养,稳定增殖,为解决一直以来实验用原代小鼠角膜上皮细胞数量少、易衰老等问题提供了可行方法,为角膜致病机制、药物开发等方面的研究提供了可方便获得的细胞系。
倫理批准和动物权利声明: 本研究涉及的所有动物实验均已通过青岛大学医学部伦理委员会审核批准(文件号QDU-AEC-2022296)。所有实验过程均遵照《实验动物管理条例》的规定进行。
作者声明: 白莹、王一卉、陈鹏参与了研究设计;白莹、王一卉、葛欢欢、卞雯晗参与了实验操作、数据整理分析和论文写作与修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
[参考文献]
[1]PORTH J M, DEIOTTE E, DUNN M, et al. A review of the literature on the global epidemiology of corneal blindness[J]. Cornea, 2019,38(12):1602-1609.
[2] YING P X, FU M, HUANG C, et al. Profile of biological characterizations and clinical application of corneal stem/progenitor cells[J]. World J Stem Cells, 2022,14(11):777-797.
[3] KIM C W, GO R E, LEE G A, et al. Immortalization of human corneal epithelial cells using Simian virus 40 large T antigen and cell characterization[J]. J Pharmacol Toxicol Me-
thods, 2016,78:52-57.
[4] AHUJA D, SENZ-ROBLES M T, PIPAS J M. SV40 large T antigen targets multiple cellular pathways to elicit cellular transformation[J]. Oncogene, 2005,24(52):7729-7745.
[5] YOKONISHI T, MCKEY J, IDE S, et al. Sertoli cell ablation and replacement of the spermatogonial niche in mouse[J]. Nat Commun, 2020,11(1):40.
[6] KANG H Y, CHOI Y K, JEONG Y I, et al. Immortalization of porcine 11β-hydroxysteroid dehydrogenase type 1-transgenic liver cells using SV40 large T antigen[J]. Int J Mol Sci, 2017,18(12):2625.
[7] OSHIKAWA K, MATSUMOTO M, KODAMA M, et al. A fail-safe system to prevent oncogenesis by senescence is targeted by SV40 small T antigen[J]. Oncogene, 2020,39(10):2170-2186.
[8] XIE F, GONG K R, LI K, et al. Reversible immortalization enables seamless transdifferentiation of primary fibroblasts into other lineage cells[J]. Stem Cells Dev, 2016,25(16):1243-1248.
[9] LI X B, ZHANG S C, ZHANG Z R, et al. Development of immortalized Hertwigs epithelial root sheath cell lines for cementum and dentin regeneration[J]. Stem Cell Res Ther, 2019,10(1):3.
[10] TIDU A, SCHANNE-KLEIN M C, BORDERIE V M. Deve-
lopment, structure, and bioengineering of the human corneal stroma: A review of collagen-based implants[J]. Exp Eye Res, 2020,200:108256.
[11] JONAS J B, ANG M, CHO P, et al. IMI prevention of myopia and its progression[J]. Invest Ophthalmol Vis Sci, 2021,62(5):6.
[12] BROWN L, LECK A K, GICHANGI M, et al. The global incidence and diagnosis of fungal keratitis[J]. Lancet Infect Dis, 2021,21(3):e49-e57.
[13] GAIN P, JULLIENNE R, HE Z G, et al. Global survey of corneal transplantation and eye banking[J]. JAMA Ophthalmol, 2016,134(2):167-173.
[14] SALZ A K, KLEINHOFF K, HOFMANN N, et al. P24-A114 Bringing together the eye banking community throug-
hout Europe and beyond-promoting eye donation in Africa[J]. BMJ Open Ophthalmol, 2023,8(Suppl 2):A10.
[15] CASTRO-MUOZLEDO F. Corneal epithelial cell cultures as a tool for research, drug screening and testing[J]. Exp Eye Res, 2008,86(3):459-469.
[16]COLLIN J, QUEEN R, ZERTI D, et al. A single cell atlas of human cornea that defines its development, limbal progenitor cells and their interactions with the immune cells[J]. Ocul Surf, 2021,21:279-298.
[17] GURIN L P, LE-BEL G, DESJARDINS P, et al. The human tissue-engineered cornea (hTEC):Recent progress[J]. Int J Mol Sci, 2021,22(3):1291.
[18] SAMOILA O, SAMOILA L. Stem cells in the path of light, from corneal to retinal reconstruction[J]. Biomedicines, 2021,9(8):873.
[19] ARAKI-SASAKI K, OHASHI Y, SASABE T, et al. AnSV40-immortalized human corneal epithelial cell line and its characterization[J]. Invest Ophthalmol Vis Sci, 1995,36(3):614-621.
[20] ROBERTSON D M, LI L, FISHER S, et al. Characterization of growth and differentiation in a telomerase-immortalized human corneal epithelial cell line[J]. Invest Ophthalmol Vis Sci, 2005,46(2):470-478.
[21] SUN C C, LEE S Y, KAO C H, et al. Cisd2 plays an essential role in corneal epithelial regeneration[J]. EBioMedicine, 2021,73:103654.
[22] LI G, XU F, ZHU J, et al. Transcription factor PAX6 (paired box 6) controls limbal stem cell lineage in development and disease[J]. J Biol Chem, 2015,290(33):20448-20454.
[23] KITAZAWA K, HIKICHI T, NAKAMURA T, et al. PAX6 regulates human corneal epithelium cell identity[J]. Exp Eye Res, 2017,154:30-38.
[24] SUN X M, KAUFMAN P D. Ki-67: More than a proliferation marker[J]. Chromosoma, 2018,127(2):175-186.
[25] VAUCLAIR S, MAJO F, DURHAM A D, et al. Corneal epithelial cell fate is maintained during repair by Notch1 signaling via the regulation of vitamin A metabolism[J]. Dev Cell, 2007,13(2):242-253.
[26] KAO W W. Keratin expression by corneal and limbal stem cells during development[J]. Exp Eye Res, 2020,200:108206.
[27] CHEN J L, LAN J, LIU D L, et al. Ascorbic acid promotes the stemness of corneal epithelial stem/progenitor cells and accelerates epithelial wound healing in the cornea[J]. Stem Cells Transl Med, 2017,6(5):1356-1365.
(本文編辑 耿波 厉建强)

