miR-454-3p 通过靶向STAT3 调控CNE-2 人鼻咽癌细胞上皮-间质转化
胡玉琳,农丰靖,林世童,罗丽霞,陈荣彬,刘 津
(1.右江民族医学院研究生院,广西 百色 533000;2.右江民族医学院附属医院耳鼻咽喉头颈外科,广西 百色 533000)
鼻咽癌(nasopharyngeal carcinoma, NPC)是源于鼻咽上皮的鳞状细胞癌,种族和地理分布不均,主要发生于中国南部及东南亚地区[1,2]。其特征表现为早期广泛的局部浸润、高转移率以及高死亡率[3]。目前临床多采用放化疗结合并辅以分子靶向治疗的方法,可以一定程度上减轻患者不良反应,但远处转移和复发导致患者预后仍然很差[4,5]。因此探索鼻咽癌更多的发病机制,为患者确定可靠的早期诊断生物标志物和新的治疗靶点十分必要[6]。
微小核糖核酸(microRNAs, miRNAs)是一类非编码单链小RNA 分子,全长约22 个核苷酸[7],通过结合靶mRNA 的3'-非翻译区导致翻译阻断和mRNA 降解,在肿瘤进展中起到关键调节作用[8,9]。miR-454-3p 是miR-130-3p/301-3p/454 的miRNA簇的成员。研究发现,在鼻咽癌中miR-454-3p 呈低表达,靶向E 盒结合锌指蛋白2 有效促进鼻咽癌细胞的增殖和转移[10]。非小细胞肺癌中miR-454-3p表达下调,靶向转化生长因子-β2 促进肿瘤细胞增殖、迁移和侵袭[11]。而宫颈癌中miR-454-3p 靶向负调控含三联基元蛋白3,通过激活p-P38 MAPK 信号通路,抑制细胞凋亡[12]。然而,miR-454-3p 其他靶基因的存在及其在鼻咽癌中的作用尚不清楚。
信号转导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)是一种胞质蛋白,在70%左右的肿瘤中呈高表达[13]。STAT3通常不具有生物学活性,一旦被激活后可参与调控肿瘤的上皮-间质转化(epithelial-mesenchymal transition, EMT),这使得STAT3 可作为肿瘤治疗的潜在靶点[14]。研究发现长链非编码RNA 同源盒A11反义RNA(HOXA11-AS)通过螯合miR-454-3p 来调节STAT3,促进人类肺腺癌细胞的顺铂耐药性[15]。然而关于miR-454-3p 与STAT3 的靶向关系及其在鼻咽癌中的作用研究甚少,故本研究以人鼻咽癌CNE-2 细胞为研究对象,探讨miR-454-3p 与STAT3 的靶向关系及其对鼻咽癌细胞EMT 的影响及作用机制。
1 材料与方法
1.1 细胞与主要试剂
人鼻咽癌细胞系CNE-2 购自上海奥陆生物科技有限公司。1640 培养基、opti-MEM 培养基购自美国Gibco 公司;LipofectamineTM3000 购自上海赛默飞世尔科技有限公司;胎牛血清购自内蒙古奥普赛生物科技有限公司;BCA 蛋白浓度测定试剂盒、彩色预染蛋白marker、Trizol、基质胶购自上海碧云天生物技术有限公司;miRNA 第一条链合成试剂盒购自上海生工生物工程股份有限公司;逆转录试剂购自莫纳生物科技有限公司;SYBR Green 荧光染料购自上海翌圣生物科技股份有限公司;miR-454-3p mimics 及对照序列(mimics NC)、miR-454-3p inhibitor 及对照序列(inhibitor NC)由上海吉玛制药技术有限公司合成;PCR 引物由南宁捷尼斯生物科技有限公司和上海生工生物工程股份有限公司合成;草酸铵结晶紫染色液、胰蛋白酶-EDTA 消化液购自北京索莱宝科技有限公司;STAT3 抗体购自美国CST 公司;N-cadherin、E-cadherin、Vimentin 抗体及HRP 标记的山羊抗兔二抗购自武汉三鹰生物技术有限公司;GAPDH 抗体、ECL 化学发光试剂盒购自美国Affinity 公司。
1.2 组织标本
收集2023 年6 月~8 月右江民族医学院附属医院和百色市人民医院的鼻咽癌患者共5 例,全部患者均未接受放疗和化疗,并经本院病理科确诊为鼻咽未分化型非角化性癌,另外还选取了同期的5 名健康志愿者正常的鼻咽部组织作为对照组。所有患者在活检前均签署了知情同意书。所有组织离体置于液氮中快速冷冻,后存放于-80 ℃冰箱保存。本研究由右江民族医学院伦理委员会进行审查,伦理审查编号为2023052001。
1.3 细胞培养
将鼻咽癌CNE-2 细胞株接种于T25 细胞培养瓶,使用1640 培养基、10%胎牛血清和1%双抗,在37 ℃、5% CO2的细胞培养箱中培养,定期换液,细胞生长至90%以后可以按照1:4 进行传代。
1.4 细胞分组及转染
实验分组:空白对照组、miR-454-3p mimics 组、mimics NC 组、miR-454-3p inhibitor 组、inhibitor NC组。细胞转染:首先将鼻咽癌CNE-2 细胞接种于6孔板上,大约24 h 后细胞密度达到70%~80%时开始转染,分别配制A 液(用Opti-MEM 稀释LipofectamineTM3000)和B 液(用Opti-MEM 分 别 稀 释miR-454-3p mimics/mimics negative control/miR-454-3p inhibitor/inhibitor negative control 溶液) ,在室温下静置5 min,将A 液与B 液1∶1 混合均匀,在室温下静置15~20 min,根据实验分组向6 孔板中加入配制好的miR-454-3p mimics/mimics NC/miR-454-3p inhibitor/inhibitor NC 溶液,以未转染的CNE-2 细胞作为空白对照组,培养6~8 h 后观察细胞状态,换液后再继续培养24~48 h 即可进行后续实验。
1.5 实时荧光定量PCR 实验
按照Trizol 试剂说明书从组织标本和转染24h后的CNE-2 细胞中抽提总RNA,使用生工公司的miRNA 第一链合成试剂盒和莫纳生物公司的逆转录预混液进行逆转录,最后使用翊圣的SYBR Green 对鼻咽癌和正常鼻咽部组织标本、鼻咽癌细胞株CNE-2 的miR-454-3p 和STAT3 表达水平进行检测,按照说明书设定反应体系。引物序列见表1。
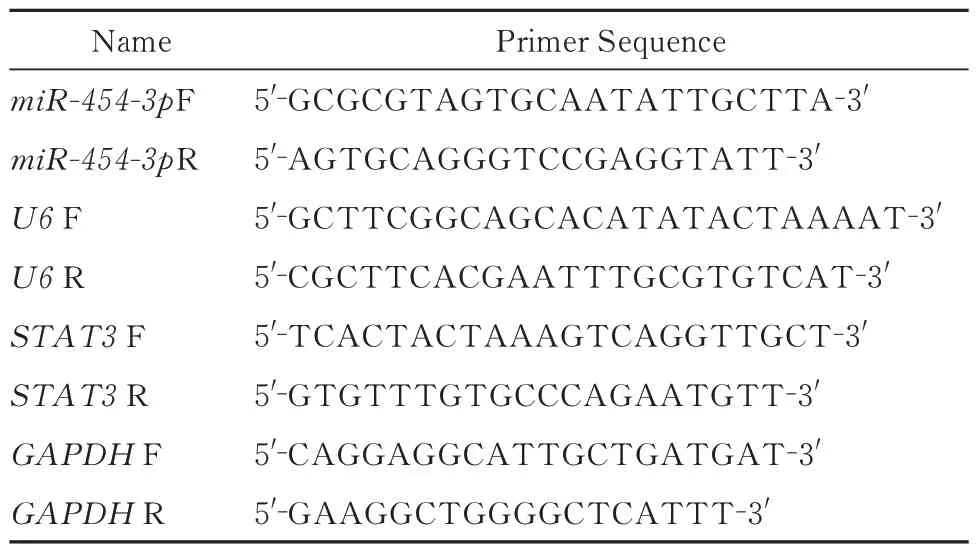
表1 qRT-PCR 引物序列Tab 1 Sequences of qRT-PCR primers
1.6 双荧光素酶报告实验
通过在线生物信息学预测网站(Targetscan)对miR-454-3p 与其下游靶基因STAT3之间可能存在的结合位点进行预测并筛选;以STAT3 质粒为载体,分别构建野生型3′UTR(STAT3 3′UTR-WT)和突变型3′UTR(STAT3 3′UTR-MUT)质粒。将两种质粒分别与miR-454-3p 和negative control(NC)充分混匀,通过LipofectamineTM3000 转染至细胞中,培养48 h 后用双荧光素酶检测系统检测转染细胞的发光信号和海肾荧光信号。
1.7 划痕愈合实验
将CNE-2 细胞接种于6 孔板中,等到汇合度达70%~80%时给予转染,继续培养24~48 h,待细胞长满后用200 μL 无菌枪头垂直于6 孔板板底均匀地划痕,用PBS 洗涤至无漂浮的细胞碎片后在每孔中加入2 mL 无血清的培养基,在划痕后0 h 和24 h时使用显微镜观察划痕的愈合情况,拍照记录,计算划痕愈合率。
1.8 Transwell 实验
侵袭实验:将基质胶与RPMI 1640 培养基按比例混匀加入Transwell 上室,37 ℃恒温箱中凝固3 h。取转染48 h 后的细胞,用无血清培养基重悬细胞沉淀,在上室加入200 μL 单细胞悬液;在下室加入600 μL 含20%胎牛血清的培养基,培养24 h 后弃去上室培养液,PBS 洗涤干净,将小室先置于组织细胞固定液中固定20 min,用PBS 洗净后在甲醇中固定20 min,再用PBS 洗净后在0.1%结晶紫溶液中染色20 min,最后将小室洗净在显微镜下观察透膜细胞数。迁移实验:使用未铺基质胶的Transwell 小室,后续步骤同上。
1.9 Western blot 实验
取转染48 h 后的细胞,用PBS 洗涤后加入细胞裂解液在冰上裂解20 min,然后用细胞刮板将细胞收集于EP 管内在冰上继续裂解20 min,离心后收集上清液,使用BCA 法测定蛋白浓度。首先对蛋白进行电泳分离,上层胶恒压80 V,下层胶恒压120 V;湿转法将胶上的蛋白转移至PVDF 膜上,250 mA 恒流,转膜时长根据实际情况调整,膜在使用前需用甲醇激活;封闭液封闭2 h,在一抗溶液中4 ℃孵育过夜,TBST 洗涤后在二抗溶液中4 ℃孵育2 h,将清洗后的PVDF 膜用显影液浸润放置在成像仪中曝光显影。
1.10 统计学处理
实验结果均使用SPSS 19.0 进行数据分析,Graphpad Prism 8 进行统计图制作。计量资料以(±s)表示。组间两两比较采用独立样本t检验分析,多组间比较采用单因素方差分析,满足方差齐性检验使用LSD 检验,不满足方差齐性检验则使用Welch 检验和Tamhane's 检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 鼻咽癌组织标本和CNE-2 细胞株中miR-454-3p 和STAT3 的 表 达
qRT-PCR 结果(图1)显示,鼻咽部正常组织和鼻咽癌组织中miR-454-3p 的相对表达量分别为1.00±0.06,0.33±0.04(图1A,t=27.78,P<0.001),STAT3 的 相 对 表 达 量 分 别 为1.00±0.06,1.56±0.21(图1B,t=-7.65,P<0.001),与鼻咽部正常组织相比,鼻咽癌组织中miR-454-3p 表达量降低,而STAT3 表达量升高。将人鼻咽癌细胞CNE-2 进行转染后,qRT-PCR 结果(表2)显示,miR-454-3p mimics 组细胞的miR-454-3p 表达水平显著提升(图2A,P<0.001),STAT3 的mRNA 表达水平有所降低(图2B,P<0.001);而miR-454-3p inhibitor 组细胞的miR-454-3p 表达水平显著降低(图2A,P<0.001),STAT3 的mRNA 表达水平有所升高(图2B,P<0.01)。

图1 鼻咽癌组织和正常组织中miR-454-3p 和STAT3 的表达水平Fig 1 Expression levels of miR-454-3p and STAT3 in nasopharyngeal carcinoma tissues and healthy tissues

图2 qRT-PCR 检测CNE-2 细胞转染后miR-454-3p 和STAT3 的表达水平Fig 2 Expression levels of miR-454-3p and STAT3 in CNE-2 cells post-transfection assessed by qRTPCR
表2 CNE-2 细胞转染后各组miR-454-3p 和STAT3 的相对表达量(±s)Tab 2 Relative expression levels of miR-454-3p and STAT3 in each group after transfection of CNE-2 cells(±s)

表2 CNE-2 细胞转染后各组miR-454-3p 和STAT3 的相对表达量(±s)Tab 2 Relative expression levels of miR-454-3p and STAT3 in each group after transfection of CNE-2 cells(±s)
注:与inhibitor NC、blank group 相比,aP<0.001;与mimics NC、blank group 相比,bP<0.001;与inhibitor NC、blank group 相比,cP<0.01。
STAT3 1.63±0.25c 1.01±0.16 1.00±0.03 1.07±0.15 0.56±0.14b组别miR-454-3p inhibitor 组inhibitor NC 组blank group 组mimics NC 组miR-454-3p mimics 组miR-454-3p 0.03±0.00a 0.95±0.05 1.00±0.02 0.98±0.08 942.65±135.10b
2.2 miR-454-3p 的靶基因分析
根据Targetscan 软件预测结果(图3)显示,hsamiR-454-3p 与h-STAT3-3'UTR 之间存在可能结合的位点。双荧光素酶结果(图4)显示,与mimics NC组相比,miR-454-3p mimics 组的STAT3-3'UTRWT 质粒荧光强度可见明显下降(t=20.79,P<0.001),而STAT3-3'UTR-MUT 质粒荧光强度没有明显改变(t=-0.16,P=0.89),提示miR-454-3p与STAT3 之间存在靶向结合关系。

图3 hsa-miR-454-3p与h-STAT3-3'UTR结合位点Fig 3 hsa-miR-454-3p and h-STAT3-3'UTR binding site

图4 双荧光素酶报告基因检测hsa-miR-454-3p 与h-STAT3-3'UTR 相互作用Fig 4 Interaction between hsa-miR-454-3p and h-STAT3-3'UTR detected by dual-luciferase assay
2.3 miR-454-3p 表达水平改变对细胞迁移能力的影响
细胞划痕实验(表3)显示,与空白组和NC 组对比,当过表达miR-454-3p 时,CNE-2 细胞迁移速率有所降低(P<0.05),空白组和mimics NC 组细胞迁移速率没有很大差异(P>0.05);当抑制miR-454-3p 时,CNE-2 细胞的迁移速率有所提高(P<0.01),空白组和inhibitor NC 组细胞迁移速率没有很大差异(P>0.05)(图5)。

图5 划痕愈合实验检测CNE-2 细胞转染后对细胞体外迁移能力的影响Fig 5 Effect of CNE-2 cell transfection on cell migration ability in vitro detected by Wound healing assay
表3 CNE-2 细胞转染后各组的划痕愈合率对比(±s)Tab 3 Comparison of scratch healing rate in each group after transfection of CNE-2 cells(±s)

表3 CNE-2 细胞转染后各组的划痕愈合率对比(±s)Tab 3 Comparison of scratch healing rate in each group after transfection of CNE-2 cells(±s)
注:与inhibitor NC、Blank group 相比,aP<0.01;与mimics NC、blank group 相比,bP<0.05。
划痕愈合率0.47±0.04a 0.32±0.02 0.34±0.05 0.33±0.04 0.24±0.03b组别miR-454-3p inhibitor 组inhibitor NC 组blank group 组mimics NC 组miR-454-3p mimics 组
Transwell 迁移实验(表4)显示,同空白组和NC 组比 较,当过表达miR-454-3p 后CNE-2 细胞的穿膜细胞数量出现减少(P<0.001),而空白组和mimics NC 组之间的穿膜细胞数量无明显差异(P>0.05);当抑制miR-454-3p 后CNE-2 细胞的穿膜细胞数量可见有所增加(P<0.001),而空白组和inhibitor NC 组之间的穿膜细胞数量无明显差异(P>0.05)(图6)。
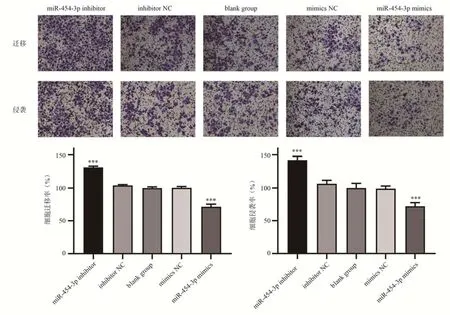
图6 Transwell 实验检测CNE-2 细胞转染后对细胞迁移和侵袭能力的影响(结晶紫染色)Fig 6 Effect of CNE-2 cell transfection on cell migratory and invasive abilities detected by transwell assay(crystal violet staining)
表4 CNE-2 细胞转染后各组的迁移/侵袭率对比(±s)Tab 4 Comparison of migration / invasion rates in each group after transfection of CNE-2 cells(±s)
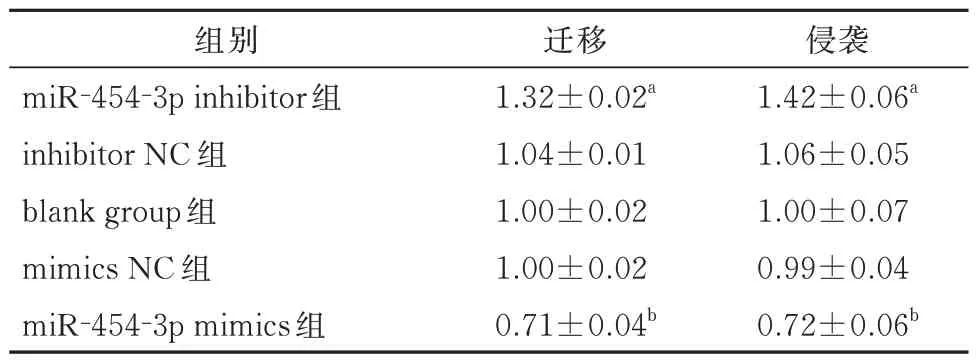
表4 CNE-2 细胞转染后各组的迁移/侵袭率对比(±s)Tab 4 Comparison of migration / invasion rates in each group after transfection of CNE-2 cells(±s)
注:与inhibitor NC、blank group 相比,aP<0.001;与mimics NC、blank group 相比,bP<0.001。
侵袭1.42±0.06a 1.06±0.05 1.00±0.07 0.99±0.04 0.72±0.06b组别miR-454-3p inhibitor 组inhibitor NC 组blank group 组mimics NC 组miR-454-3p mimics 组迁移1.32±0.02a 1.04±0.01 1.00±0.02 1.00±0.02 0.71±0.04b
2.4 miR-454-3p 表达水平改变对细胞侵袭能力的影响
Transwell 侵袭实验(表4)显示,同空白组和NC 组比较,当过表达miR-454-3p 时细胞穿膜细胞数量可见减少(P<0.001),空白组和mimics NC 组之间的穿膜细胞数几乎没有变化(P>0.05);当抑制miR-454-3p 时细胞穿膜细胞数量可见增加(P<0.001),空白组和inhibitor NC 组之间的穿膜细胞数几乎没有变化(P>0.05)(图6)。
2.5 Western blot 检 测STAT3、EMT 相 关 蛋 白 的表达
Western blot结果(表5)显示,鼻咽癌细胞CNE-2转染之后,miR-454-3p mimics 组细胞的N-cadherin、STAT3和Vimentin的蛋白表达量减少,而E-cadherin蛋白表达量却增多(均<0.01);空白组和mimics NC组之间各蛋白的表达变化差异不大(P>0.05)(图7)。miR-454-3p inhibitor组细胞的N-cadherin、STAT3和Vimentin 的蛋白表达量升高,而E-cadherin 蛋白表达量降低(均P<0.05);inhibitor NC 组和空白组之间各蛋白的表达变化差异不大(P>0.05)(图7)。

图7 CNE-2 细胞转染后对STAT3 以及EMT 相关蛋白表达的影响Fig 7 Impact of CNE-2 cell transfection on the expression of STAT3 as well as EMT-related proteins
表5 CNE-2 细胞转染后各组的STAT3 以及EMT 相关蛋白相对表达量(±s)Tab 5 Relative expression levels of STAT3 and EMT-related proteins of each group after transfection of CNE-2 cells(±s)
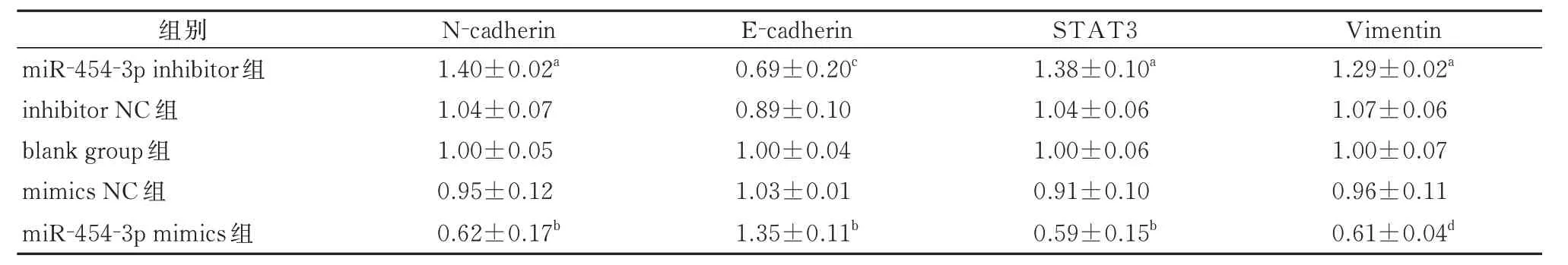
表5 CNE-2 细胞转染后各组的STAT3 以及EMT 相关蛋白相对表达量(±s)Tab 5 Relative expression levels of STAT3 and EMT-related proteins of each group after transfection of CNE-2 cells(±s)
注:与inhibitor NC、blank group 相比,aP<0.01;与mimics NC、blank group 相比,bP<0.01;与inhibitor NC、blank group 相比,cP<0.05;与mimics NC、Blank group 相比,dP<0.001。
Vimentin组别N-cadherin E-cadherin STAT3 1.29±0.02a 1.07±0.06 1.00±0.07 0.96±0.11 0.61±0.04d miR-454-3p inhibitor 组inhibitor NC 组blank group 组mimics NC 组miR-454-3p mimics 组1.40±0.02a 1.04±0.07 1.00±0.05 0.95±0.12 0.62±0.17b 0.69±0.20c 0.89±0.10 1.00±0.04 1.03±0.01 1.35±0.11b 1.38±0.10a 1.04±0.06 1.00±0.06 0.91±0.10 0.59±0.15b
3 讨论
miR-454-3p 在不同肿瘤中发挥特定作用参与调控肿瘤的生长与增殖、侵袭与转移、凋亡与自噬、药物敏感性等[16-23],在结直肠癌[16]、肝细胞癌[17]、乳腺癌[18]中作为致癌因子促进肿瘤发生发展,而在胶质母 细 胞 瘤[19]、食 管 癌[20]、膀 胱 癌[21]、急 性 髓 系 白 血病[22]中则作为抑癌因子抑制肿瘤进展。miR-454-3p在肿瘤中的不同作用可能与其不同靶点的功能有关,在神经母细胞瘤中miR-454-3p 作为抑癌基因,通过靶向负调控神经分化因子1 促进肿瘤侵袭迁移,并且可以逆转长链非编码RNA(Long noncoding RNA, lncRNA)00839 敲低时对肿瘤的抑制作用[24]。在非小细胞肺癌中,沙利度胺可以通过抑制含5 个PH 结构域的反义RNA 1 促进miR-454-3p 表达,miR-454-3p 再通过靶向E 盒结合锌指蛋白1 抑制血管生成和免疫逃逸[25]。在喉癌中lncRNA HOTAIR 可以作为miR-454-3p 的竞争性内源RNA,miR-454-3p 的减少靶向促进人E2F 转录因子2 表达,从而使肿瘤细胞凋亡受到抑制且放射敏感性降低[26]。而在鼻咽癌中,miR-454-3p 通过靶向细胞间充质-上皮转化因子(cellular-mesenchymal epithelial transition factor ,c-Met)抑制鼻咽癌细胞的增殖、侵袭和EMT,lncRNA 00839 可以竞争性结合miR-454-3p 位点,逆转miR-454-3p 的抑制作用[27]。在顺铂耐药的鼻咽癌细胞中miR-454-3p 表达量进一步降低,沉默lncRNA HOXA11-AS 可以通过上调miR-454-3p 抑制c-Met/Akt/mTOR 通路的活性,从而促进细胞凋亡并增加细胞的顺铂敏感性[28]。为了验证miR-454-3p 在鼻咽癌组织中的异常表达,使用PCR 检测了鼻咽癌组织和正常组织中miR-454-3p 的表达差异,miR-454-3p在鼻咽癌患者组织中表达有所降低,提示miR-454-3p 有可能是鼻咽癌进展中的一个调控因素。
为明确miR-454-3p 参与鼻咽癌进展的具体机制,本研究运用Targetscan 网站预测miR-454-3p 潜在的靶基因,发现STAT3 与miR-454-3p 存在结合区域。 STAT 家族是一大类转录因子,包含STAT1、STAT2、STAT3、STAT4、STAT5、STAT6,在细胞信号传导中发挥重要作用[29-31],其中,STAT1、STAT3 和STAT5 被认为是影响肿瘤进展的关键因子[32]。STAT1 参与抗肿瘤免疫反应,而STAT3 和STAT5 则 促 进 肿 瘤 的 发 生 发 展[33]。STAT3 在正常生理条件下受到严格调控,而在多种肿瘤中可被激活,不仅参与肿瘤细胞增殖、侵袭和转移,还可通过表观遗传修饰影响基因的表达、诱导细胞发生上皮-间质转化、调节微环境等促进肿瘤发展进程[34]。本研究着重讨论miR-454-3p 与STAT3 的靶向关系及其对肿瘤上皮-间质转化的影响,EMT是一个复杂的过程,当细胞失去其上皮细胞身份并获得间充质细胞的特征时,不仅对发育和伤口愈合至关重要,而且代表了原发性肿瘤的形成和转移[35]。EMT 诱导过程中发生最明显的分子变化是E-钙粘蛋白(E-cadherin)下调,以及N-钙粘蛋白(N-cadherin)和波形蛋白(Vimentin)上调,这一过程中上皮标志物水平显著降低,迫使细胞获得间充质标志物,促进其运动[36]。研究发现在乳腺癌中SIX 同源盒蛋白4(Sine oculis homeobox homolog 4,SIX4)表达显著增加,诱导STAT3 信号触发EMT,明显促进了乳腺癌症细胞的迁移和侵袭,SIX4/STAT3 轴还可增强Snail1 的 表 达,以 刺 激 癌 症 体 外EMT[37]。STAT3 是神经胶质瘤的致癌因子,应用短发夹RNA 下调STAT3 的表达可以阻止EMT 机制,并显著减少神经胶质瘤细胞的迁移和侵袭[38]。在非小细胞肺癌中,泛素样小蛋白4 抑制后能通过JAK2/STAT3 信号传导抑制肿瘤的侵袭和迁移[39]。而在鼻咽癌组织中STAT3 表达升高,并且其升高程度与肿瘤的临床分期、转移能力以及预后密切相关[40,41]。
目前已发现miR-454-3p 可影响鼻咽癌EMT 进程,STAT3 也与鼻咽癌的侵袭迁移密切相关,但是miR-454-3p 是否通过靶向STAT3 影响鼻咽癌EMT 仍未见报道。在软骨肉瘤中曾证实过miR-454-3p 与STAT3 的直接靶向关系,lncRNA HOTAIR 敲低后miR-454-3p 表达上调并通过靶向STAT3 和自噬相关基因12 来抑制软骨肉瘤细胞生长[42]。但是在鼻咽癌相关研究中只证明了miR-454-3p 与STAT3 二者之间存在间接调控关系,miR-454-3p 靶向调控D 型蛋白酪氨酸磷酸酶受体(protein tyrosine phosphatase receptor type D,PTPRD),PTPRD 过表达又可直接靶向STAT3 调节自噬相关细胞死亡,使NPC 细胞对放疗敏感[43]。为明确miR-454-3p 与STAT3 的直接靶向关系及对鼻咽癌发生、发展的影响,本研究通过双荧光素酶实验证实STAT3 是miR-454-3p 的直接靶基因,miR-454-3p 能够有效地抑制STAT3 的表达,人鼻咽癌CNE-2 细胞的miR-454-3p 受到抑制后可以上调STAT3、N-cadherin 和Vimentin 蛋白表达,下调E-cadherin 蛋白表达,并且增强细胞侵袭和迁移的能力,而miR-454-3p 过表达时则完全相反,提示miR-454-3p 可能通过靶向负调控STAT3 影响CNE-2 细胞的侵袭迁移能力及EMT 过程。本研究探讨了miR-454-3p 调控鼻咽癌发生发展的机制,可为鼻咽癌靶向治疗提供靶点及参考,但是还缺乏部分回复实验验证miR-454-3p 对鼻咽癌上皮-间质转化的影响是否是通过靶向调控STAT3 实现的,后续还需继续完善实验设计。目前研究已经发现存在多种lncRNA 可以竞争性结合miR-454-3p 位点来影响下游靶基因的表达,而miR-454-3p 也能通过调控多种靶基因影响肿瘤进展,但是癌基因调控网络错综复杂,miR-454-3p及其相关的lncRNA、下游靶基因在鼻咽癌进展中的作用仍值得进一步深入探索。
综上,miR-454-3p 在鼻咽癌组织中呈低表达,miR-454-3p 可能通过靶向负调控STAT3 抑制鼻咽癌细胞CNE-2 上皮-间质转化。miR-454-3p 有望成为鼻咽癌靶向治疗新的靶点,成为放化疗的有效辅助治疗,提高患者生存率。
作者贡献度说明:
胡玉琳:实验设计,实验操作,数据整理及分析,论文撰写;农丰靖:收集临床标本;林世童、罗丽霞:辅助实验操作;陈荣彬:收集部分临床标本;刘津:指导实验设计,修改手稿,提供经费支持。
所有作者声明不存在利益冲突关系。

