雷帕霉素对光诱导下视网膜色素上皮细胞自噬的影响
师若迪,徐 晨,俞 洋
(宁夏医科大学中医学院,宁夏 银川750004)
年龄相关性黄斑变性(age-related macular degeneration,AMD)是影响视网膜黄斑区的一种进行性疾病,多见于50 岁以上人群,是世界上主要致盲疾病之一,预计到2040 年,约有2.9 亿人受到AMD的影响,其中1.1 亿人在亚洲[1]。AMD 是一种多因素疾病,其中光感受器-视网膜色素上皮(retinal pigment epithelium, RPE )复合体退化是导致AMD 发病的机制之一,而导致其退化的风险之一便是日光照射[2]。由于AMD 发病率高,对视力的严重影响,且现阶段的治疗方法有限,近年来已成为眼科学研究的热点。
细胞自噬是一种保守的细胞生存途径,它可以分解受损的蛋白质和细胞器,并维持体内的平衡[3],是细胞生长、分化、存活和自我平衡的重要途径,有研究表明自噬参与了AMD 发病机制中所有细胞死亡途径的调节[4]。目前,自噬与视网膜光损伤的关系尚不明确。为探讨光损伤中自噬的变化,本研究采用mTOR 抑制剂雷帕霉素预处理人视网膜色素上皮细胞(ARPE-19),观察光照对ARPE-19 细胞的影响,对光损伤中RPE 细胞自噬的变化进行研究,探讨雷帕霉素对光诱导下视网膜色素上皮细胞自噬的影响。
1 材料和方法
1.1 细胞株
原 代ARPE-19,购 买 于BNCC(BNCC3377 13)。将ARPE-19 细胞放入37 ℃、5%的CO2培养箱中培养,每隔1 d 换液1 次,细胞生长密度到90%时消化细胞,以1∶3 进行传代,选取3~5 代细胞进行实验。
1.2 主要试剂和仪器
胎牛血清、DMEM/F12(美国Gibco 公司);mRFP-eGFP-LC3 双荧光质粒(生工生物工程上海股份有限公司);MTT 细胞增殖及细胞毒性检测试剂盒(碧云天生物技术,C0009S)Annexin V-FITC/PI 双染细胞凋亡检测试剂盒(上海贝博生物科技有限公司,BB-4101);BCA 蛋白定量试剂盒、全蛋白提取试剂盒(赛默飞世尔科技有限公司,P0100、89900)、;Rapamycin(MCE,HY-10219);Mouse Anti-LC3A antibody、LC3B antibody、Beclin 1 antibody(北京博奥森生物技术有限公司,bsm-33309M、bs-4843R、bsm - 33323M); SQSTM1/p62 Antibody(Affinity 公司,AF5384)山羊抗兔lgG、山羊抗小鼠lgG(中杉金桥,ZB-2301、ZB-2305)。TES-1332A数位式照度计(台北泰仕电子工业):奥林巴斯激光共聚焦显微镜(FV3000,日本Olympus 公司);透射电子显微镜(JEM-1400Flash,日本电子);凝胶成像分析仪(Gel DocXR)(美国 BIORAD 公司)。
1.3 细胞分组
稳定表达mRFP-eGFP-LC3 的ARPE-19 细胞随机分为6 h 对照组、6 h 模型组、6 h 雷帕霉素组;12 h 对 照 组、12 h 模 型 组、12 h 雷 帕 霉 素 组 以 及24 h对照组、24 h 模型组、24 h 雷帕霉素组。对照组避光培养,用锡纸包裹;模型组进行光照刺激,雷帕霉素组中加入10 μmol/L 雷帕霉素(查阅文献结合预实验反复筛选比较后确定的浓度)后接受光照刺激。
1.4 稳定表达 mRFP-eGFP-LC3 的ARPE-19 细胞株构建
取对数生长期ARPE-19 细胞,以2×105个/孔细胞数接种于12 孔板,放于培养箱过夜,第2 天细胞数约50%后将表达mRFP-eGFP-LC3 慢病毒质粒加入ARPE-19 细胞中,24 h 后用新鲜的培养基代替含有病毒的培养基。经由嘌呤霉素(0.5 μg/mL)筛选,直到鉴定出耐受稳转细胞株。饥饿处理稳定转染细胞,使用激光共聚焦显微镜观察 mRFPeGFP-LC3 斑点,观察转染效率。
1.5 构建ARPE-19 细胞光损伤模型
选生长状态良好的3~5 代ARPE-19 细胞培养在6 孔板中,放置于培养箱内进行光照,防止自然光干扰。将LED 冷光灯悬挂于培养箱顶部,调整细胞光照强度在(16 500±500) lx 范围内, 垂直照射细胞6、12、24 h。光照时孔板表面的温度控制在36.5~37.5 ℃之间,以此排除由于温度升高而造成细胞光热损伤的可能[5]。
1.6 MTT 检测光照对ARPE-19 细胞增殖活性
MTT 分组:对照组、模型组、雷帕霉素组。取稳转后的ARPE-19 细胞,经含EDTA 胰酶消化后按每孔6 000 个细胞铺于96 孔板,放于培养箱中培养24 h,待细胞贴壁后分组处理,每组设3 个复孔。各组于光照结束后每孔加10 μL MTT 溶液,在培养箱孵育4 h 取出吸出上清,每孔加100 μL Formazan溶解液,放培养箱孵育3 h,使用酶标仪在570 nm 测定OD 值。实验重复3 次。
1.7 观察双荧光mRFP-eGFP-LC3 体系测定ARPE-19 细胞自噬流变化
将稳转成功的ARPE-19 细胞系放在37 ℃、5%CO2培养箱中,用含10%胎牛血清和1%双抗(100 U/ mL 青 霉 素 和100 μg/mL 链 霉 素)高 糖DMEM 培养48 h(密度80%),按照1∶3 比例传代。各组于光照处理后使用激光扫描共聚焦显微镜通过观察一个视野下所有细胞中红色和黄色LC3 亮点变化来判断自噬流的变化。
1.8 透射电镜观察各组ARPE-19 细胞自噬囊泡形成
吸出各组ARPE-19 细胞中培养基,冷PBS 洗2遍后收集细胞,1 200 r/min离心5 min弃上清,向管中加入2.5%戊二醛500 μL 固定,室温1 h,4 ℃放3 h,加入PBS 漂洗3 次,于4 ℃冰箱30 min。加1%锇酸固定1 h,PBS 清洗2 次,梯度乙醇脱水;使用环氧树脂包埋处理后的样品,超薄切片机切片,经铅盐和醋酸铀染色后于透射电子显微镜下观察细胞并拍照。
1.9 蛋白免疫印迹法检测Beclin l、LC3、P62 蛋白表达情况
各组于光照结束后收集细胞,使用细胞裂解液提取全蛋白,BCA 法进行蛋白定量。以每孔50 μg蛋白为标准上样,随后进行SDS-PAGE 电泳,用PVDF 转膜,5%脱脂奶粉封闭2 h,随后与Beclin 1、LC3A/LC3B、P62(1∶1 000)一抗在4 ℃封闭过夜,第二天用TBST 洗涤3 次,每次10 min,随后加入HRP 标记的山羊抗小鼠IgG、山羊抗兔IgG 二抗(1∶1 000),暗室中加ECL 发光液并曝光。采用Image-J软件对蛋白条带进行灰度值分析。实验重复3 次。
1.10 统计学处理
采用Graphpad Prism 9.0 软件进行统计学分析处理,计量资料用(±s)表示。多个样本均数间的两两比较采用SNK-q 法检验;显著性水平α=0.05。
2 结果
2.1 自噬双标慢病毒(mRFP-eGFP-LC3)转染效率的检测
mRFP-eGFP-LC3 慢病毒质粒在与ARPE-19细胞共孵育48 h 后可观察到被荧光标记的mRFPeGFP-LC3 的表达水平最高。因此,后续相关分组实验将以此为标准进行。图1 中暗场显示转染mRFP-eGFP-LC3 后用荧光显微镜观察到的带有红色和绿色荧光蛋白的ARPE-19 细胞。明视场显示通过透射光学显微镜下观察到的总细胞。经观察转染效率约80%以上,可以用于下一步的相关实验。见图1。

图1 自噬双标慢病毒(mRFP-eGFP-LC3)转染效率的检测结果(×200)Fig 1 Transfection efficiency of autophagy double-labeled lentivirus(mRFP-eGFP-LC3) (×200)
2.2 光照对各组ARPE-19 细胞存活率
与对照组对比,模型组经光照6、12、24 h 后,细胞存活率显著下降(P<0.001);雷帕霉素组经光照后细胞存活率高于模型组(光照6 h,P<0.05;光照12、24 h,P<0.001)。见表1。
表1 光照对各组ARPE-19 细胞存活率[%,n=3,(±s)]Tab 1 Effect of light on the survival rate of ARPE-19 cells in each group [%,n=3,(±s)]
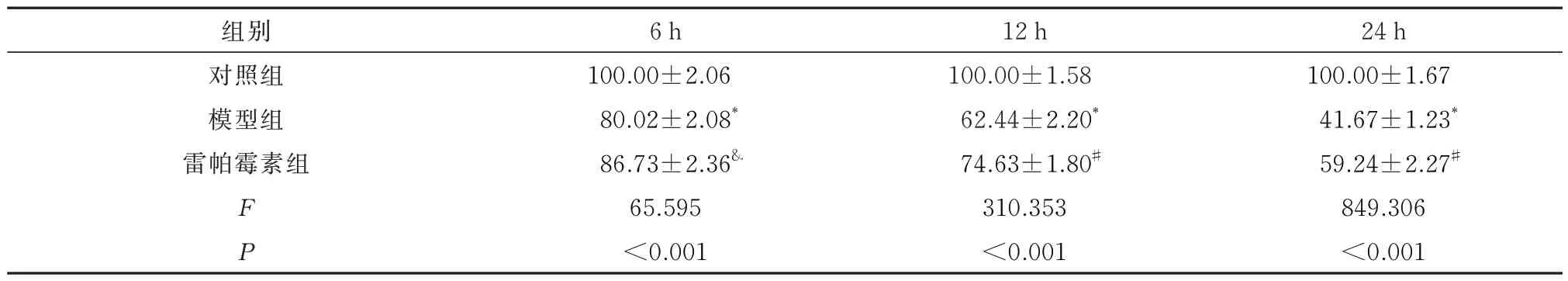
表1 光照对各组ARPE-19 细胞存活率[%,n=3,(±s)]Tab 1 Effect of light on the survival rate of ARPE-19 cells in each group [%,n=3,(±s)]
注:与对照组比,*P<0.001;与模型组比,#P<0.001;与模型组比,&P<0.05。
24 h 100.00±1.67 41.67±1.23*59.24±2.27#849.306<0.001组别对照组模型组雷帕霉素组FP 6 h 100.00±2.06 80.02±2.08*86.73±2.36&65.595<0.001 12 h 100.00±1.58 62.44±2.20*74.63±1.80#310.353<0.001
2.3 光诱导下ARPE-19 细胞自噬流的变化
如图2 所示,图中6、12、24 h 对照组红色荧光斑点弱,且少见自噬小体(黄色斑点);模型组分别光照6、12、24 h 后,红色荧光斑点较对照组逐渐增多,绿色荧光斑点也随之增加,Merge 图中从光照12 h开始黄色斑点数量增多明显,显示随着光照时间的延长,ARPE-19 细胞的自噬流有所增强,但逐渐受阻。而雷帕霉素组在光照6、12、24 h 时红色荧光斑点较模型组加强,绿色荧光较模型组弱,说明雷帕霉素组细胞自噬流增强且通畅。

图2 光诱导下ARPE-19 自噬流变化(×400)Fig 2 Changes of autophagic flow in ARPE-19 induced by light(×400)
2.4 透射电镜观察细胞自噬囊泡形成
透射电镜观察光照24 h 后的各组ARPE-19 细胞,可见对照组中少见自噬囊泡,模型组较对照组自噬囊泡增多,且有空泡形成,细胞核有皱缩,雷帕霉素组细胞内见大量聚集分布的自噬囊泡。见图3。
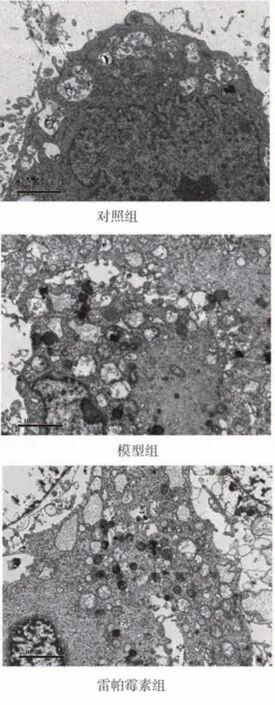
图3 各组ARPE-19 细胞超微结构(×15 000;标尺:2 μm)Fig 3 Ultrastructure of ARPE-19 cells in each group(×15 000;scale bar:2 μm)
2.5 雷帕霉素干预对光诱导ARPE-19 细胞Beclin1、LC3、P62 蛋白表达的影响
经光照6、12、24 h 后,与对照组比较,模型组和雷帕霉素组的Beclin 1 蛋白表达水平升高(P<0.001)、LC3 Ⅱ/LC3 Ⅰ的 比 值 升 高(P<0.001),P62 蛋白低表达(P<0.001)。与模型组比,雷帕霉素组在光照6 h 时Beclin 1 蛋白表达量差异不明显、在12、24 h 时Beclin 1 蛋白表达量逐渐升高(P<0.001);LC3 Ⅱ/LC3 Ⅰ的比值较模型组均升高(6、24 hP<0.05;12 hP<0.001);P62 蛋白表达量比模型组低,差异无统计学意义(P>0.05)。见图4。

图4 雷帕霉素对光诱导ARPE-19 细胞自噬相关蛋白表达的影响Fig 4 Effect of rapamycin on the expression of autophagy-related proteins induced by light in ARPE-19 cells
3 讨论
视网膜是位于眼球后壁内侧的透明中枢神经系统组织,由色素上皮层和视网膜感觉层组成,对视力至关重要[6]。光在视觉过程中起着重要作用,但过度暴露在光下会对视网膜色素上皮层和感光细胞造成不同程度的损害[7],临床上可表现为视力下降或视力缺失。视力缺陷对生活质量有很大的负面影响,研究表明,视网膜色素上皮细胞过度暴露于可见光可促进脂褐素的自发荧光色素的积累,而脂褐素是视网膜色素上皮细胞吞噬构成感光细胞外节的脂类并积聚在溶酶体中的副产物,自身荧光脂褐素的过量积聚可能预示着细胞的老化,并增加视网膜退行性疾病发生的风险[8]。
AMD 是一种影响黄斑区的复杂眼病,黄斑区是视力敏感区,负责视觉和色觉。在AMD 中可发现绒毛膜、布鲁氏膜、RPE 和光感受器发生病理变化。其中RPE 在 AMD 的发病机制中起着关键作用,因为其位于布鲁氏膜和光感受器之间的中心位置,是视网膜外层和绒毛膜之间运输氧气、营养物质和废物的通道[9]。随着疾病的进展,视网膜色素上皮细胞的变性和功能障碍会导致光感受器的进行性丢失,最终可能导致永久性失明[10]。视网膜色素上皮被认为是最早在人类AMD 中受到影响的细胞之一[11]。自噬是将细胞质成分运输和溶解到溶酶体中的过程,其与年龄相关的功能障碍可能导致AMD[12]。自噬对细胞稳态至关重要,其在应对各种应激源时会迅速上调,比如饥饿、细胞器或DNA 损伤、缺氧、内质网应激或感染[13]。有研究表明,自噬参与了许多与年龄相关的神经退行性疾病的发病过程,揭示自噬在这些疾病中的参与至关重要[14]。为检测光照下ARPE-19 细胞自噬的发生情况,使用串联mRFP-eGFP-LC3 双荧光自噬指示体系进行检测,对LC3 进行标记及追踪并观察自噬流的变化,LC3 双荧光体系最大的优点是可以直观地判断细胞自噬流的变化[15]。在未发生自噬的细胞中,LC3 散在分布细胞质中,当自噬发生时,LC3 集中富集在自噬小体上,自噬小体需要和溶酶体融合才会具有自噬功能,但溶酶体为酸性的,所以eGFP 绿色荧光在酸性环境下可以发生淬灭,而红色的RFP 荧光不会受到影响,因此自噬溶酶体会呈现红色斑点,而没有与溶酶体融合的自噬小体则呈现黄色斑点[16]。由此,采用双荧光体系可以直观且定性的判断细胞内自噬流的改变。本研究通过共聚焦荧光显微镜观察不同时间的光诱导下ARPE-19 细胞自噬流的变化,结果显示,光照射能够诱导ARPE-19细胞发生自噬,且雷帕霉素会上调自噬活性。
除了通过双荧光体系观察自噬流的变化,选取自噬相关蛋白Beclin 1、LC3 以及P62 进行定量检测。Beclin 1 是自噬过程中的关键步骤,也是自噬的正调控因子[17]。LC3 是自噬体形成的特异性标志物,在自噬过程中,自噬泡的形成会导致LC3Ⅰ通过脂质化转化为LC3Ⅱ,而LC3Ⅱ/LC3Ⅰ比值可以估计自噬的功能状态[18]。目前免疫印迹检测LC3 已成为监测自噬和自噬相关过程的可靠方法[19]。P62 是另一种广泛使用的自噬标记,它通过一个短的LC3 相互作用区(LIR)直接与LC3 和Atg8 直系物家族蛋白结合。通过这种机制,使得其通过自噬提供选择性的自噬货物进行降解。当自噬受到抑制时,p62 积聚,而当自噬被诱导时,p62 数量 减 少[20]。本 研 究Western Blot 结 果 显 示,光 照6 h、12 h 和24 h 后,与对照组对比,模型组自噬相关蛋白Beclin1、LC3 Ⅱ/Ⅰ的表达量均增高,P62 蛋白呈低表达。表明模型组在光诱导下自噬被激活。
Rapamycin 是一种来源于潮霉素链霉菌的亲脂性抗生素,是一种众所周知的通过抑制mTOR 作用的自噬特异性诱导剂。它存在于两种不同的功能复合体中:mTOR 复合体1(mTORC1)和mTOR 复合体2(mTORC2),这两种复合体对雷帕霉素的敏感度是有区别的,mTORC1 对雷帕霉素有高度敏感性,并能调节自噬[21]。自噬参与了AMD 的发病机制,AMD 的发生可因受损细胞器无法清除而促进疾病的进展。由此,上调自噬可能为减缓或阻止AMD 进展提供一种可选择的治疗策略[22]。近些年,雷帕霉素被发现在抗衰老、治疗心脏病、中枢神经、免疫系统等方面有一定的作用[23]。Gao 等[24]发现雷帕霉素通过调节mTOR 和ER 应激通路之间的串扰,减少慢性心衰时心肌细胞的凋亡,促进心肌细胞的自噬。Sun 等[25]发现雷帕霉素诱导的自噬可以改善谷胱甘肽耗竭诱导的RPE 细胞的早衰。本研究采用自噬诱导剂雷帕霉素对人RPE 细胞进行处理,使用透射电子显微镜发现经雷帕霉素处理的细胞可见大量聚集分布的自噬囊泡;此外通过蛋白免疫印迹法检测自噬通量,发现使用雷帕霉素干预后,与对照组相比,雷帕霉素组的Beclin1 与LC3Ⅱ/LC3 Ⅰ比值均增加,P62 蛋白表达量均减少;与模型组相比,雷帕霉素组在光照6 h 时Beclin 1 蛋白表达量差异不明显、在12 h、24 h 时Beclin 1 蛋白表达量逐渐升高;LC3 Ⅱ/LC3 Ⅰ的比值较模型组均升高。这说明,雷帕霉素干预激活了光诱导下的ARPE-19 细胞自噬通量,并上调自噬活性。
综上,本实验通过观察视网膜色素上皮细胞在光损伤中的自噬变化,探讨了雷帕霉素对光诱导下视网膜色素上皮细胞自噬的影响,目的是为了预防年龄相关性黄斑变性的发生、降低患该病的风险以及为开发天然药物来治疗AMD 提供新的研发思路。本研究不足之处是只观察了人视网膜色素上皮细胞在光诱导下自噬及其动态性情况,同时进一步验证了雷帕霉素促进自噬的特性,但自噬与细胞损伤之间的关系尚未涉及,需要接下来进一步研究和验证。
作者贡献度说明:
师若迪:实施研究,论文撰写,数据统计分析;徐晨:数据整理,论文审校;俞洋:课题设计,论文指导。
所有作者声明不存在利益冲突关系。
——雷帕霉素

