不同品种白芸豆α-淀粉酶抑制剂的活性和含量差异分析
张思璐 汤冰璇 耿智德 吕宏斌 钟毓 李思宇 朱梓芸 夏龙飞


张思璐,汤冰璇,耿智德,等. 不同品种白芸豆α-淀粉酶抑制剂的活性和含量差异分析[J]. 江苏农业科学,2024,52(7):179-183.
doi:10.15889/j.issn.1002-1302.2024.07.024
(1.深圳保时健生物工程有限公司,广东深圳 518116; 2.云南省农业科学院粮食作物研究所,云南昆明 650205; 3.云南天保桦生物资源开发有限公司,云南昆明 650106; 4.广州曼蒂生物科技有限公司,广东广州 510000)
摘要:探究不同品种白芸豆α-淀粉酶抑制剂(α-AI)的活性和含量差异,为α-AI专用型白芸豆的品种选育和加工生产提供指导。以大白芸豆(YWL1、YWL2)、中白芸豆(Tbh1、Tbh2)、小白芸豆(云白1、云白2)品种为材料,对其营养成分、α-AI的活性和含量进行测定分析,并采用超滤膜进行不同分子量α-AI1(6~20 ku)、α-AI2(21~40 ku)、α-AI3(41~60 ku)的分离,测定不同分子量α-AI的活性差异。结果表明,不同品种白芸豆的蛋白质、脂肪、淀粉和灰分含量差异明显,含量分别为17.5%~26.9%、1.1%~2.3%、32.9%~43.5%、3.8%~4.6%。云白1蛋白质含量最高(26.9%);YWL2灰分含量最高(4.6%),Tbh2脂肪含量最高(2.3%);α-AI的活性依次排序为YWL1>YWL2>云白1>Tbh1>Tbh2>云白2;α-AI的含量依次为云白1>YWL1>Tbh1>YWL2>Tbh2>云白2;将α-AI提取液进行膜分离得到3种不同分子量結构的α-AI1(6~20 ku)、α-AI2(21~40 ku)、α-AI3(41~60 ku),活性平均值分别为(2 315±313)、(1 1491±1 226)、(45 683±1 914) U/g,依次是α-AI3>α-AI2>α-AI1。综合比较发现,YWL1具有较高的α-AI活性和含量,分别为23 156 U/g和7.04%,更适于α-AI的生产。
关键词:α-淀粉酶抑制剂;白芸豆;品种筛选;膜分离
中图分类号:S643.101 文献标志码:A 文章编号:1002-1302(2024)07-0179-05
白芸豆生物学名多花菜豆(Phaseolus coccineus Linn.),原产于南美洲,我国16世纪引种栽培[1]。目前云南白芸豆的种植面积大、产量高、籽粒饱满、品质优,畅销海内外,主要分布于大理、丽江、楚雄等 1 800 m 海拔以上的高寒冷凉山区[2]。该地区远离工业污染,很少使用农药及化肥,是天然的绿色、有机种植区,早在2000年,丽江等地的白芸豆就已获得国家AA级绿色食品认证[3]。随着白芸豆营养与保健作用研究深入,国内外市场需求量逐年增加,出口数量也日益增大[4],已成为云南高寒山区出口创汇和乡村振兴的优势特色农产品。
白芸豆药食同源,营养价值丰富,具有高蛋白、低脂肪、高钾、低钠等特性,还含有多种有益的生物活性物质[5],是一种极具加工利用前景的优质资源。迄今为止,国内外学者对白芸豆开展了较为深入的研究,已经从白芸豆中分离出近百种化合物,其中,以α-淀粉酶抑制剂(α-AI)最受关注[6],α-AI的商品名为“白芸豆提取物”,国外又被称为“starch blocker/淀粉阻断剂”。因其能特异性抑制人体唾液和肠道内α-淀粉酶活力[7],阻碍或延缓食物中淀粉的水解和消化,起到控制体重[8]、调节餐后血糖[9]、改善肠道微生态等功效[10],目前已广泛应用于压片糖果、固体饮料、酸奶、代餐粉、低血糖生成指数(GI)主食等功能食品和保健品中,并且通过大量临床研究证实,α-AI具有较高的安全性和功效性[11-13],在肥胖、糖尿病等疾病治疗中有着较高的研究价值和广阔的市场前景。
由于白芸豆中α-AI含量普遍较低,提取率仅有3%~5%[14],致使其生产成本高,市场价格昂贵。此外,α-AI的活性反映了抑制α-淀粉酶将淀粉水解为还原糖的能力,是重要的评价指标,其活性的高低直接影响产品的功效作用和市场售价。因此,在研究α-AI提取技术[15]、理化特性[16]、功效应用的同时[17],也应重点考虑不同品种白芸豆间α-AI的活性和含量,这将对白芸豆品种选育和α-AI加工生产起到重要指导意义。但迄今为止,有关高α-AI含量和高活性的白芸豆品种研究未见报道;现阶段研究主要侧重于不同品种间蛋白质、脂肪、矿物质和膳食纤维等营养成分的差异对比[18]。此外,α-AI具有α和β 2种亚基[19],以不同分子量结构的亚基α-AI1(α/β)、二聚体α-AI2(α+β)和四聚体α-AI3(2α+2β)存在[20-22],但目前不同品种白芸豆中各分子量α-AI占比尚不清晰,尚待进一步研究。
近年来,随着白芸豆在健康中国和乡村振兴中作用凸显,引起了政府、相关科研院所和企业的高度重视,云南省农业科学院作为国内最早研究白芸豆的单位之一,已开展了大量相关研究[23-25]。课题组前期已进行优质高产多抗白芸豆品种选育和种植推广示范基地建设。本研究在上述工作基础上,以主栽6种白芸豆为材料,对其营养成分、α-AI含量和活性进行测定分析,并采用超滤膜进行不同分子量α-AI的分离和活性差异研究,以期为α-AI专用型白芸豆的品种筛选和加工生产提供理论指导。
1 材料与方法
1.1 试验材料
供试大白芸豆(YWL1、YWL2)、中白芸豆(Tbh1、Tbh2)、小白芸豆(云白1、云白2)品种共6个,2022年5月10日播种于云南省昆明市盘龙区云南省农业科学院粮食作物研究所试验基地,且均于2022年10月27日采集;胰α-淀粉酶,购自美国Sigma-Aldrich公司;可溶性淀粉,购自天津市化学试剂三厂;硫酸、氢氧化钠、盐酸、硫酸铜、硫酸钾、硼酸,均为国产分析纯试剂。
1.2 仪器与设备
ME55型电子分析天平,梅特勒-托利多;722可见分光光度计,上海光谱奥普勒仪器有限公司;FW4000A型高速万能粉碎机,北京科伟永兴仪器有限公司;SK9201型超声波处理器,北京千百叶电子科技有限公司;RE-1002旋转蒸发仪,上海科兴仪器有限公司;HC-3618R高速冷冻离心机,安徽中科中佳科学仪器有限公司;BONA-GM-18型有机膜分离试验机,0.2 μm微滤膜,截留分子量60、40、20、5 ku的PES膜元件各1支,山东博纳生物科技集团有限公司。
1.3 试验方法
试验于2022年11月至2023年2月,于云南天保桦生物资源开发有限公司实验室完成。
1.3.1 α-AI的提取
参照迟永楠等的方法[26],称取清洗干燥后的白芸豆300 g,粉碎过80目筛,豆粉与去离子水按照1 g ∶[KG-*3]8 mL比例,搅拌均匀放入超声波处理器中,在超声功率50 W、50 ℃条件下浸提 90 min 后,取出于4 ℃、5 000 r/min条件下离心15 min,收集上清液,沉淀物按上述工艺再提取1次,合并上清液,采用0.2 μm微滤膜过滤后,先采用截留分子量60 ku的超滤膜超滤,滤出液再用截留分子量 5 ku 的超滤膜超滤,收集截留液,旋转浓缩后干燥即得α-AI。不同品种白芸豆α-AI含量的计算如下:
含量=(mα/m豆)×100%。(1)
式中:mα为α-AI质量(干基),g;m豆为白芸豆粉质量(干基),g。
1.3.2 不同分子量α-AI的膜分离
根据目前的研究报道,α-AI具有α和β 2种亚基,可形成α-AI1(α/β亞基,α分子量为7.8~15.5 ku,β分子量为14.0~18.6 ku)、α-AI2(α+β的二聚体,分子量约22.0~28.8 ku)和α-AI3(2α+2β的四聚体,分子量约50 ku)的3种结构[19-22],基于不同结构间α-AI分子量的差异,可采用不同分子量有机膜进行分离。具体分离方法如下:将“1.3.1”节中α-AI提取液依次通过截留分子质量为60、40、20、5 ku的超滤膜分离,收集各段截留液,分别进行浓缩、冻干,即可得到α-AI3(41~60 ku)、α-AI2(21~40 ku)、α-AI1(6~20 ku),并分别计算其质量比例:
质量比例=(mn/m总) × 100%。(2)
式中:mn为不同分子量α-AI的质量,g;m总为α-AI的总质量,g。
1.3.3 营养成分的测定
采用国标方法测定样品蛋白质(GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》)、[JP2]淀粉(GB 5009.9—2016《食品安全国家标准 食品中淀粉的测定》)、脂肪(GB 5009.6—[JP]2016《食品安全国家标准 食品中脂肪的测定》)、灰分(GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》)。
1.3.4 α-AI活性的测定
淀粉与碘结合后显蓝色,并且在一定浓度范围内,吸光度和淀粉浓度呈线性正相关,以淀粉溶液浓度为横坐标,吸光度为纵坐标绘制标准曲线,可得到回归方程为:y=0.044 0x+0.003 2,r2=0.999 2,见图1。根据加入α-AI前后α-淀粉酶分解淀粉量的差值,即可计算出α-AI的活性,具体检测步骤按照中国医药保健品进出口商会团体标准T/CCCMHPIE 1.26—2018《植物提取物 白芸豆提取物》中α-AI活性测定。α-AI活性的定义为1 g的α-AI,于37 ℃、pH=6.0条件下,1 min内抑制α-淀粉酶将淀粉链切断成麦芽糖的微摩尔量,即为α-AI的活性,以U/g表示。
2 结果与分析
2.1 营养成分的对比分析
由表1可知,不同品种间白芸豆的蛋白质、脂肪、淀粉和灰分含量存在明显差异。6种白芸豆的蛋白质含量由高到低依次为云白1>YWL1>云白2>Tbh1>YWL2>Tbh2,且均有较高的蛋白质含量,在 17.5%~26.9%范围,远高于小麦、大米、荞麦和燕麦,是优质的蛋白质原料;同时,6种白芸豆的脂肪含量均相对较低,在1.1%~2.3%范围,表明白芸豆具有高蛋白和低脂肪的特性,非常有益于饮食健康。不同品种白芸豆的淀粉和灰分含量分别为32.9%~43.5%、3.8%~4.6%。其中,云白1的蛋白质含量最高,淀粉含量最低,分别为26.9%和32.9%;Tbh2的脂肪和淀粉最高,分别为2.3%和43.5%,YWL2的灰分含量最高,达4.6%。
2.2 α-AI活性的对比分析
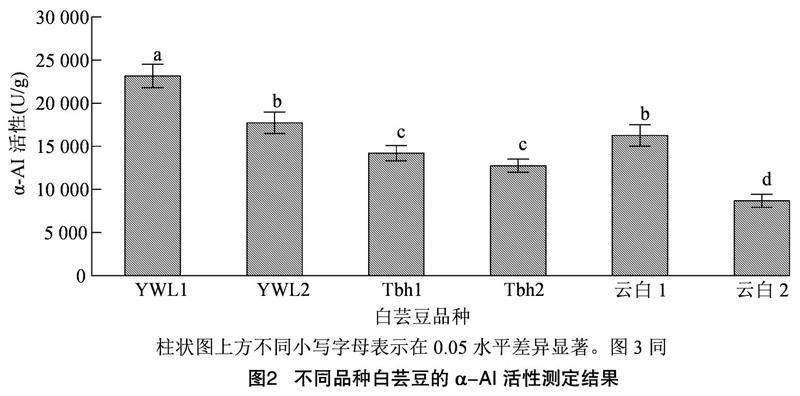
α-AI的活性反映了抑制α-淀粉酶将淀粉水解为还原糖的能力,是重要的评价指标。由图2可知,供试6种白芸豆的α-AI活性值在8 673~23 156 U/g 范围,不同品种间α-AI活性存在较大差异,[JP3]籽粒较大的大白芸豆活性较高,α-AI活性从高到低依次为YWL1>YWL2>云白1>Tbh1>Tbh2>云白2,其中,YWL1的α-AI活性高达23 156 U/g,显著高于其他品种,是最低活性云白2的2.7倍,具有较高的活性。
2.3 α-AI含量的对比分析
白芸豆中α-AI的含量决定了生产成本,是原料评价的关键指标。不同品种白芸豆的α-AI含量测定结果见图3。
由图3可知,供试6种白芸豆的α-AI含量差异明显,从高到低依次排列为云白1>YWL1>Tbh1>YWL2>Tbh2>云白2, α-AI含量分别为7.25%、7.04%、6.12%、4.83%、4.63%和3.27%。其中,云白1和YWL1的α-AI含量均超过7%,两者间无显著性差异(P>0.05),均显著高于其他品种,较目前大多研究报道的3%~5%有更高的含量,结合“2.2”节中α-AI活性测定结果,YWL1具有更高的α-AI活性,因此YWL1更适于用作α-AI生产的原料品种。
2.4 α-AI膜分离结果
α-AI提取液经不同分子量超滤膜分离后,得到不同分子量的α-AI1(6~20 ku)、α-AI2(21~40 ku)、α-AI3(41~60 ku),6种不同品种白芸豆的α-AI膜分离结果见表2。
由表2可知,不同分子量的α-AI活性存在明显差异,[JP3]四聚体结构的α-AI3活性远高于二聚体 α-AI2和单聚体α-AI1,活性由高到低依次为α-AI3>α-AI2>α-AI1。6种不同品种白芸豆的α-AI1、α-AI2和α-AI3活性分别为1 868~2 731、9 836~13 286、42 186~48 258 U/g范围,平均值分别为(2 315±313)、(11 491±1 226)、(45 683±1 914) U/g,相同分子量下的活性差异不大。但由于6种白芸豆中α-AI1、α-AI2和α-AI3的质量比例存在明显差异,导致不同品种间α-AI活性大相迳庭。其中,YWL1的四聚体的比例较高,总活性高达23 156 U/g,优于其他品种,该结果与Yang等的研究报道[27-28]相一致:Yang等认为α-AI2在结构上较α-AI3少了2个拓展环,分别含有15个残基与6个残基的拓展环,单独的糖链与蛋白链对 α-淀粉酶无抑制活力,仅有两者结合在一起时才具有抑制活力[27]。Kasahara等认为具有α-AI3(α2β2)是一种四聚体糖蛋白,对α-淀粉酶具有更强的抑制效果[28]。
3 结论
本研究以主栽6种白芸豆品种为材料,对其营养成分、α-AI含量和活性进行测定分析,并采用超滤膜进行不同分子量α-AI的分离和活性差异对比,研究结果表明:(1)不同品种白芸豆的蛋白质、脂肪、淀粉和灰分含量差异明显,含量分别为17.5%~26.9%、1.1%~2.3%、32.9%~43.5%、3.8%~4.6%。其中云白1蛋白质含量最高,YWL2灰分含量最高,Tbh2脂肪含量最高。(2)6种白芸豆的α-AI活性和含量均存于较大差异,其中α-AI活性值在8 673~23 156 U/g范围,从高到低依次为YWL1>YWL2>云白1>Tbh1>Tbh2>云白2;α-AI含量依次为云白1>YWL1>Tbh1>YWL2>Tbh2>云白2。(3)6种白芸豆的α-AI经膜分离后,得到不同分子量α-AI1、α-AI2、α-AI3的活性平均值分别为(2 315±313)、(11 491±1 226)、(45 683±1 914) U/g,α-AI3>α-AI2>α-AI1。综合比较发现,YWL1具有较高α-AI活性和含量,分别为 23 156 U/g 和7.04%,优于其他品种,更适于α-AI的生产。本研究为α-AI专用型白芸豆的品种筛选和栽培技术提供数据参考,同时也给予α-AI加工应用的相关企业提供理论指导。
参考文献:
[1]王述民. 普通菜豆生产技术[M]. 北京:北京教育出版社,2016:18.
[2]王绍林,和立宣,和 忠. 利用云南资源优势 大力发展小杂粮[J]. 云南农业科技,2009(增刊2):131-132.
[3]张建华,肖植文,杨晓洪,等. 小杂粮在云南农业产业化中的作用探讨[J]. 云南农业大学学报,2005,20(4):513-517.
[4]訾 艳. 白芸豆中活性蛋白及多肽的制备与研究[D]. 太原:山西大学,2015:1-2.
[5]Kan L J,Nie S P,Hu J L,et al. Nutrients,phytochemicals and antioxidant activities of 26 kidney bean cultivars[J]. Food and Chemical Toxicology,2017,108:467-477.
[6]郑虹君,朱叙丞,李耀基,等. 白芸豆功能成分、生物活性及其產品开发研究进展[J]. 中国粮油学报,2022,37(12):277-285.
[7]Bowman D E. Amylase inhibitor of navy beans[J]. Science,1945,102(2649):358-359.
[8]陈一昆,李 钦,赵 琎,等. 芸豆提取物α-淀粉酶抑制剂对SD大鼠的减肥效果研究[J]. 食品科技,2012,37(10):207-210.
[9]张晓琦,杨明琰,马 瑜,等. 白豆α-淀粉酶抑制剂糖蛋白的提取纯化及降血糖活性研究[J]. 药物生物技术,2007,14(6):406-410.
[10]Wang S L,Guo C Y,Xing Z K,et al. Dietary intervention with α-amylase inhibitor in white kidney beans added yogurt modulated gut microbiota to adjust blood glucose in mice[J]. Frontiers in Nutrition,2021,8:664976.
[11]Wang S L,Chen L S,Yang H Y,et al. Regular intake of white kidney beans extract (Phaseolus vulgaris L.) induces weight loss compared to placebo in obese human subjects[J]. Food Science & Nutrition,2020,8(3):1315-1324.
[12]Nolan R,Shannon O M,Robinson N,et al. Its no has bean:a review of the effects of white kidney bean extract on body composition and metabolic health[J]. Nutrients,2020,12(5):1398.
[13]Qin G Q,Wang F,Liang H L,et al. Subchronic study of a white kidney bean (Phaseolus vulgaris) extract with α-amylase inhibitory activity[J]. BioMed Research International,2019,2019:9272345.
[14]何绍凯,迟永楠,钟 毓,等. 白芸豆中α-淀粉酶抑制剂的超声波辅助提取及膜分离纯化研究[J]. 食品科技,2023,48(1):181-187.
[15]钟 毓,陈一昆,王 雷,等. 淀粉酶抑制蛋白提取工艺:CN101514227A[P]. 2009-08-26.
[16]何绍凯,迟永楠,钟 毓,等. 微囊化白芸豆α-淀粉酶抑制剂的制备及其稳定性研究[J]. 食品科技,2022,47(10):245-251.
[17]刘蕊莉,刘 娟,余孝云. 白芸豆组合物对体质量管理的功效探究[J]. 中医学报,2017,32(4):673-676.
[18]叶夕苗,李 俊,毛堂芬,等. 贵州不同品种芸豆营养品质差异分析[J]. 食品工业科技,2021,42(18):73-80.
[19]Yamaguchi H. Isolation and characterization of the subunits of Phaseolus vulgaris α-amylase inhibitor[J]. The Journal of Biochemistry,1991,110(5):785-789.
[20]Higaki H,Yamaguchi H. Reconstitution of Phaseolus vulgaris α-amylase inhibitor from isolated subunits[J]. Bioscience,Biotechnology,and Biochemistry,1994,58(1):5-8.
[21]Yang M Y,Zhang X Q,Ma Y,et al. Purification and partial characterization of a glycoprotein alpha-amylase inhibitor from white kidney bean (Phaseolus vulgaris L.)[J]. Journal of Food Biochemistry,2008,32(1):72-84.[HJ2mm]
[22]Lee S C,Gepts P L,Whitaker J R. Protein structures of common bean (Phaseolus vulgaris) alpha-amylase inhibitors[J]. Journal of Agricultural and Food Chemistry,2002,50(22):6618-6627.
[23]耿智德,王铁军,保丽萍,等. 云南省多花菜豆的主要生产问题及解决途径[J]. 湖南农业大学学报(自然科学版),2007,33(增刊1):239.
[24]耿智德,杨 雄,保丽萍,等. 多花菜豆异交率的测定及育种策略[J]. 江苏农业科学,2006,34(6):237-238.
[25]耿智德,楊 德,杨 雄,等. 多花菜豆繁育系统的研究进展[J]. 西南农业学报,2006(9):569-571.
[26]迟永楠,孙 艳,钟 毓,等. 白芸豆中α-淀粉酶抑制剂的提取及其性能研究[J]. 食品科技,2017,42(12):225-230.
[27]Yang Y F,He S D,Zhang Y,et al. Comparison of crude prolamins from seven kidney beans (Phaseolus vulgaris L.) based on composition,structure and functionality[J]. Food Chemistry,2021,357:129748.
[28]Kasahara K,Hayashi K,Arakawa T,et al. Complete sequence,subunit structure,and complexes with pancreatic alpha-amylase of an alpha-amylase inhibitor from Phaseolus vulgaris white kidney beans[J]. Journal of Biochemistry,1996,120(1):177-183.
基金项目:云南省重大科技专项计划(编号:202102AE090025);国际(对外)科技合作基地项目(编号:GHJD-2020025)。
作者简介:张思璐(1987—),女,湖南株洲人,硕士,工程师,主要从事功能性食品研究与应用。E-mail:echo.zhang@wonderlab.top。
通信作者:耿智德,硕士,副研究员,主要从事白芸豆遗传与育种。E-mail:gengzd2002@163.com。

