蓝莓叶斑病病原菌分离鉴定及室内药剂筛选
白建波 张晋 杨伟 孔琼 周银丽


白建波,张 晋,杨 伟,等. 蓝莓叶斑病病原菌分离鉴定及室内药剂筛选[J]. 江苏农业科学,2024,52(7):118-123.
doi:10.15889/j.issn.1002-1302.2024.07.016
(1.红河学院云南省高校滇南特色生物资源研究与利用重点实验室,云南蒙自 661100; 2.红河学院商学院,云南蒙自 661100)
摘要:为明确云南蒙自蓝莓叶斑病的病原菌种类,筛选出防治蓝莓叶斑病的有效杀菌剂,以采自云南蒙自的蓝莓叶斑病叶片为材料,对致病菌进行分离纯化,并进行致病性测定。采用病原菌形态学结合基因序列分析比对的方法鉴定病原菌,以6种杀菌剂为对象,研究杀菌剂对病原菌菌丝的室内毒力。结果发现,引起云南蒙自蓝莓叶斑病的病原菌Y1为交链格孢(Alternaria alternata);不同类型杀菌剂对菌株Y1的生长抑制存在较大差异;室内毒力测定效果最好的是325 g/L苯甲·嘧菌酯悬浮剂,EC50值为1.152 mg/L;其次为37%苯醚甲环唑水分散粒剂、25%吡唑醚菌酯悬浮剂,EC50值分别为1.624、2.149 mg/L;75%百菌清可湿性粉剂的抑菌效果在6种供试药剂中最差,EC50值为 524.237 mg/L。结果可为交链格孢引起的蓝莓叶斑病防治提供参考。
关键词:蓝莓;叶斑病;链格孢;毒力测定;病原菌分离测定
中图分类号:S436.639 文献标志码:A 文章编号:1002-1302(2024)07-0118-06
蓝莓是杜鹃花科越橘属(Vaccinium spp.)植物[1],果肉细腻口感较好,营养成分丰富,所含的花青素与花色苷、黄酮及其糖苷衍生物、酚酸与糖类物质等均有多种生理保健功能[2]。云南省地理、气候独特,地处低纬度高原,具有昼夜温差大、光照时间长等优势,目前蒙自、曲靖、大理、文山、玉溪等地区已大规模种植蓝莓。近年来,由于市场需求量的不断增加,蓝莓种植面积和产量不断扩大,蓝莓病害的种类也不断增加。蓝莓叶斑病是常见且危害严重的病害之一。在蓝莓的营养生长期,叶斑病首先危害蓝莓叶片,叶片呈现大小不等的褐色圆斑。发病后期叶片呈现泛黄、卷曲等趋势,最终叶片脱落,导致花芽减少,从而影响蓝莓的产量和质量。蓝莓叶斑病的病原菌种类复杂多样,明确引起叶斑病的病原菌是有效防治该病害的前提和基础。关于蓝莓叶斑病前人进行了大量研究,张国辉等发现,黔东南苗族侗族自治州流行的蓝莓叶斑病是由巨腔茎点霉(Phoma macrostoma)引起的[3]。薛德胜等对山东省蓝莓叶斑病进行分离纯化,鉴定其病原菌为棒状拟盘多毛孢(Pestalotiopsis clavispora)[4]。余磊等将云南蓝莓叶斑病的致病菌最终鉴定为细极链格孢(Alternaria tenuissima)[5]。杨秀梅等研究发现,云南地区蓝莓叶斑病是由柯氏丽赤壳菌(Calonectria colhounii)引起的[6]。薛德胜等对山东半岛蓝莓叶斑病进行室内毒力测定,其中福美双和苯醚甲环唑抑菌效果强于其他药剂[7]。凌丹燕研究了6种杀菌剂对浙江金华蓝莓试验基地蓝莓叶斑病的抑菌效果,结果发现,甲基硫菌灵、苯醚甲环唑及异菌脲效果最佳,EC50值都小于3.0 mg/L[8]。杨丽娜等通过室内药剂筛选试验发现,60%乙霉·多菌灵可湿性粉剂对蓝莓叶斑病的抑制作用最好;田间防治效果表明,甲基硫菌灵对蓝莓叶斑病防治效果最佳,乙霉·多菌灵的防治效果次之[9]。蓝莓叶斑病严重降低了蓝莓的质量和经济价值,亟需明确叶斑病病原菌种类,进而制定有效的防控措施。本研究对云南蓝莓叶斑病病原菌进行分离,并采用形态学观察结合基因序列(rDNA-ITS、Alta1、EF-1α)分析比对的方法鉴定病原菌,选择6种杀菌剂进行室内药剂毒力测定,筛选能够防治蓝莓叶斑病的有效杀菌药剂,以期为云南蓝莓叶斑病的有效防控提供参考依据。
1 材料与方法
1.1 试验材料
1.1.1 供试植株
于2022年3—5月在云南蒙自蓝莓种植基地采集叶斑病病害蓝莓叶片样品,试验地点为红河学院生物科学与农学学院。
1.1.2 供试药剂
所有供试药剂均于农药市场购买(表1)。
1.2 试验方法
1.2.1 病原菌分离纯化
采用组织分离法[10]将采集到的蓝莓叶斑病病葉冲洗干净后,取蓝莓叶片病健交界组织[11]进行病原菌分离、纯化。
1.2.2 病原菌致病性测定
采用离体和活体叶片接种法[12]对分离的病原菌进行回接试验,并进行致病性测定。用打孔器在纯化后的病原菌菌落边缘整齐打取菌饼,直径为5 mm。随后将菌丝面轻轻按压在经酒精消毒和无菌刺伤后的健康蓝莓叶片的刺伤部位,3次重复,以刺伤但不接种菌块为空白对照。将离体接种的叶片放置在28 ℃恒温箱进行保湿培养,每天按时观察并仔细记录其发病情况。当叶片出现明显症状时,对蓝莓叶片刺伤处发病部位取样,病原菌进行再次分离纯化,并与原始病原菌进行菌落和分生孢子形态对比。
1.2.3 病原菌形态学鉴定
将纯化后的供试菌株接种至马铃薯葡萄糖琼脂(PDA)培养基平板上,每天观察菌落的颜色和形态,并借助显微镜观察记录其菌丝的颜色、有无隔膜以及分生孢子形态大小、产孢结构等特征,结合文献[13]对病原菌进行形态鉴定。
1.2.4 病原菌分子生物学鉴定
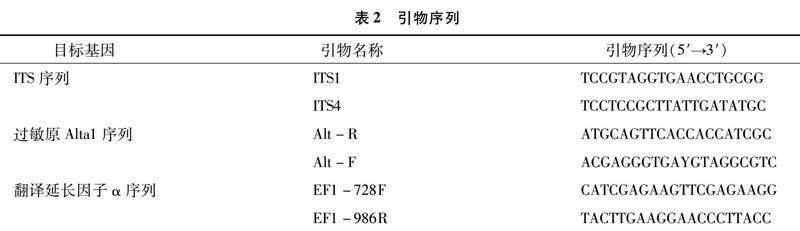
用美国 (Omega Bio-Tek)真菌DNA提取试剂盒,提取蓝莓叶斑病病原真菌DNA。将所提取到的病原菌DNA用核糖体rDNA-ITS序列[14]、翻译延长因子α(EF-1α)[15]、过敏原基因(Alta1)[16]进行扩增,引物序列如表2所示,反应体系参照刘俏等的方法[17]。将扩增产物送至北京擎科生物科技股份有限公司昆明分公司进行序列测定,根据测序结果采用邻接(neighbor joining,NJ)法构建系统发育树。
1.2.5 室内杀菌剂毒力测定
采用菌丝生长速率法测定蓝莓叶斑病病菌对杀菌剂的敏感性[18]。450 g/L咪鲜胺水乳剂的试验浓度分别为90.00、45.00、18.00、4.50、0.45 mg/L,37%苯醚甲环唑水分散粒剂的试验浓度分别为74.00、37.00、14.80、3.70、0.37 mg/L,50%异菌脲可湿性粉剂的试验浓度分别为100.0、50.0、20.0、5.0、0.5 mg/L,75%百菌清可湿性粉剂的试验浓度分别为1 500.0、750.0、375.0、187.5、75.0 mg/L,25%吡唑醚菌酯悬浮剂的试验浓度分别为108.00、54.00、21.60、5.40、0.54 mg/L, 325 g/L苯甲·嘧菌酯悬浮剂的试验浓度分别为65.000、32500、13.000、3.250、0.325 mg/L。
药剂浓度配制完成后,与PDA培养基充分混合,制作成不同浓度的含药平板。随后将纯化后的菌落边缘打取直径为5 mm的菌饼小心转移至平板中央,每个药剂浓度设3次重复。置于28 ℃恒温培养箱内倒置培养7 d后,测量菌落直径(cm),根据菌落直径计算菌丝生长抑制率并进行回归分析,比较其差异性。运用SPSS数据处理软件得出毒力回归方程(Y=aX+b)、抑菌率中浓度(EC50值)和相关系数(r)。
2 结果与分析
2.1 蓝莓叶斑病田间症状
叶斑病主要危害叶片,发病初期叶片呈现大小不一致的棕褐色圆斑,随着病害逐渐严重,病斑面积开始慢慢扩大,最终呈现直径较大的圆斑或连片不规则形状的红褐色病斑。发病后期,叶片泛黄、卷曲、甚至脱落,最终导致整个叶片枯萎死亡(图1)。
2.2 病原菌的分离与致病性测定
从云南蒙自采集得到的蓝莓叶斑病叶片样品中分离、纯化得到菌株Y1。采用离体和活体2种接种方式,于健康蓝莓叶片上接种菌株Y1。结果(图2)表明,接种菌株Y1的叶片开始出现发病症状的时间为接种后2 d,其症状与叶斑病相似,比对后对致病性叶片进行病原菌再次分离、纯化,得到与接种菌Y1形态学特征相同的病原菌,由此确定菌株Y1为蓝莓叶斑病的致病菌。
2.3 病原菌形态学特征观察
菌株Y1培养初期气生菌丝发达,菌丝颜色为灰白色,培养3 d后变为墨绿色绒状,最外围菌丝呈灰白色。菌落背面颜色为黑色,菌落边缘呈现整齐形态,具灰白色与墨绿色相间的同心轮纹,颜色逐渐向内加深,培养7 d后菌落直径达(7.60±0.17) cm。培养10 d时,菌落背面为青灰色,菌丝为灰白色絮状。显微镜观察发现,分生孢子呈浅褐色,长椭圆形、卵形、倒梨形,单生,具0~3个纵膈膜,1~5个横膈膜,大小为(22.5~69.0)μm×(3.2~4.6)μm。分生孢子具喙,喙为柱状形,直立或略弯曲。分生孢子弯曲或直立,梗浅褐色,簇生或单生,具明显分隔(图3)。综合分生孢子和菌落形态特征描述,初步确认致病菌Y1为交链格孢(Alternaria alternata)。
2.4 病原菌分子生物学鉴定
对蓝莓叶斑病病原真菌DNA的过敏原Alt_a1、翻译延长因子EF-1α[WTBZ][STBZ]和ITS进行扩增和测序,基因片段序列长度分别为478、251、537 bp, 将序列在NCBI中进行BLAST比对。
从GenBank中下载同属的标准菌株序列,基于ITS、EF-1α和Alta1基因构建系统发育树。结果(图4至图6)表明,Y1的ITS基因与已登录的Alternaria alternata(登录号为OQ026848.1)相似性达到100%;Y1的Alta1基因和EF-1α基因分别与已登录的Alternaria alternata(登录号分别为MH377243.1和OM991445.1)相似性较高,相似性达到100%。结合菌株的形态特征,最终鉴定 A. alternata 为引起云南蒙自蓝莓叶斑病的病原菌。
2.5 杀菌剂对蓝莓叶斑病病原菌的抑制作用
为寻找控制蓝莓叶斑病的杀菌剂,初步筛选了6种杀菌剂对病原菌Y1进行毒力测定,结果(表3)表明,不同的药剂对A. alternata的菌丝生长均有抑制效果。其中,325 g/L苯甲·嘧菌酯悬浮剂的毒力最强,EC50值为1.152 mg/L;其次为37%苯醚甲环唑水分散粒剂和25%吡唑醚菌酯悬浮剂,EC50值分别为1.624、2.149 mg/L;75%百菌清可湿性粉剂效果最差,EC50值为524.237 mg/L。
3 讨论
叶斑病是蓝莓种植过程中危害较为严重且经常发生的一种真菌病害,其病原种类数目繁多,大部分病原菌会导致果实受害,从而影响蓝莓的产量和质量[19]。本研究调查发现,云南蒙自的蓝莓叶斑病主要危害叶片,易形成大小不一致的棕褐色小圆斑,严重时叶片泛黄、反卷、脱落,最终整个叶片枯萎死亡。本研究通过分离鉴定发现,该病由 A. alternata 危害造成。
链格孢菌根据其分生孢子形态特征可轻松鉴定到属,但由于分生孢子形态易受培养条件影响而导致种间的变异性较大, 难以鉴定到种。 因而采用ITS序列分析方法只可以鉴定到属的分类水平,但不适用于链格孢小孢子種的复核鉴定[20]。目前,链格孢菌的鉴定大多采用形态学与多基因系统分析结合的方法,杨丽萍等采用形态学与Alta1、钙调蛋白基因(CAL)和ATPase基因序列结合的方法对甘肃省的樱桃黑斑病进行研究,认为樱桃黑斑病由 A. tenuissima 和A. alternata引起[21]。本研究采用真菌通用引物和特异性引物rDNA-ITS、Alta1和EF-1α基因序列分析对病原菌进行鉴定,明确了蓝莓叶斑病的致病菌为A. alternata。
在我国,已报道交链格孢能引起番茄[22]、魔芋[23]、柑橘[24]、八角[25]、芹菜[26]等发生叶斑病或褐斑病,目前关于该种病害化学防治药剂的相关报道较少,蒋晶晶等对将从黄芩上分离得到的链格孢进行室内毒力测定,结果表明,0.3%丁子香酚可溶液剂、98.5%腐霉利原药、97%咯菌腈原药、0.4%蛇床子素可溶液剂均对链格孢有抑制作用,其中抑菌效果最好的是97%咯菌腈,对A.tenuissima和茄链格孢(A.solani)均有抑菌作用,EC50值分别为0.04、0.06 mg/L[27]。王荣波等选用98%异菌脲、95%嘧霉胺、96%啶菌噁唑、96.4%菌丹清、96%啶酰菌胺、99%腐霉利6种杀菌剂进行室内毒力测定,结果显示,96%啶菌噁唑的效果最好,EC50值为 0.621 μg/mL[28]。本研究选用6种不同类型杀菌剂进行毒力测定,结果显示,(1)复配杀菌剂的抑菌活性强于单剂杀菌剂;(2)三唑类杀菌剂和甲氧基丙烯类杀菌剂的杀菌效果均高于咪唑类杀菌剂;(3)取代苯类杀菌剂的抑菌效果最差,其EC50值为524.237 mg/L。综上,复配杀菌剂、三唑类、甲氧基丙烯类杀菌剂效果较好,咪唑类一般,取代苯类杀菌剂较差。因此,在叶斑病防治过程中,复配杀菌剂、三唑类、甲氧基丙烯类杀菌剂可作为蓝莓叶斑病田间防治的参考用药。
4 结论
本研究对云南省蒙自市蓝莓叶斑病病原菌进行分离鉴定,结合形态学及基因序列分析比对的方法确定引起蓝莓叶斑病的病原菌为A.alternata。[JP2]6种杀菌剂对菌株Y1的菌丝生长均有抑制作用,室内毒力效果最好的是325 g/L[JP]苯甲·嘧菌酯悬浮剂,EC50值为1.152 mg/L;其次为37%苯醚甲环唑水分散粒剂和25%吡唑醚菌酯悬浮剂,EC50值分别为1.624、2.149 mg/L,可为蓝莓叶斑病田间防治提供参考。
参考文献:
[1]王永鹏. 蓝莓果醋的制备及其保健功能的研究[J]. 中國调味品,2020,45(12):194-196,200.
[2]潘美华,程哲灏. 蓝莓的营养成分及其保健功能的研究进展[J]. 食品安全导刊,2022(22):107-109.
[3]张国辉,刘德波,宋盛英,等. 黔东南州蓝莓叶部病害的种类调查和病原鉴定[J]. 中国森林病虫,2017,36(2):42-46.
[4]薛德胜,李保华,练 森,等. 蓝莓叶斑病病原菌鉴定及其生物学特性[J]. 植物保护学报,2019,46(2):323-329.
[5]余 磊,赵建荣,徐胜光,等. 云南蓝莓叶斑病的病原菌鉴定[J]. 植物病理学报,2015,45(2):216-219.
[6]杨秀梅,王丽花,张艺萍,等. 蓝莓叶斑病病原菌鉴定及其生物学特性[J]. 西南大学学报(自然科学版),2022,44(10):48-55.
[7]薛德胜,李保华,王彩霞. 棒状拟盘多毛孢菌室内化学药剂的筛选[C]//中国植物病理学会.中国植物病理学会2018年学术年会论文集.北京:中国农业科学技术出版社,2018:486-490.
[8]凌丹燕. 蓝莓主要真菌病害的分离鉴定与防治研究[D]. 金华:浙江师范大学,2016.
[9]杨丽娜,马千里,张 博,等. 越橘叶斑病的药剂筛选[J]. 吉林农业大学学报,2013,35(4):463-466.
[10]何琴恩,白露超,侯 璐,等. 青海省同仁市黄果梨黑斑病病原菌鉴定[J]. 现代园艺,2023,46(5):53-55,58.
[11]周悦妍,张 玮,李兴红,等. 引起我国甜樱桃叶斑病的间座壳菌种类鉴定[J]. 植物保护学报,2022,49(4):1077-1084.
[12]张徐玥,宋蕴哲,李悦悦,等. 艳锦竹芋叶枯病病原菌的分离与鉴定[J]. 亚热带农业研究,2022,18(4):274-278.
[13]张天宇. 中国真菌志 第十六卷 链格孢属[M]. 北京:科学出版社,2003.
[14]White T J,Bruns T,Lee S,et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//PCR Protocols. Amsterdam:Elsevier,1990:315-322.
[15]王国荣,沈伟东,孙 超,等. 铁皮石斛茎基部2种主要病害病原菌的分离与鉴定[J]. 植物保护,2017,43(1):168-172.
[16]Hong S G,Cramer R A,Lawrence C B,et al. Alta1 allergen homologs from Alternaria and related taxa:analysis of phylogenetic content and secondary structure[J]. Fungal Genetics and Biology,2005,42(2):119-129.
[17]刘 俏,宁楠楠,马永强,等. 青海省樱桃叶斑病病原菌的分离与鉴定[J]. 植物保护,2020,46(2):48-55,71.
[18]姜莉莉,田中一久,孙瑞红,等. 草莓灰霉病病原菌的分离鉴定及室内毒力测定[J]. 山东农业科学,2021,53(8):102-106.
[19]罗其鑫,杨 莹,李 思,等. 蓝莓叶斑病病原菌鉴定及生物学特性[J]. 江苏农业科学,2023,51(5):146-154.
[20]李 永,岳志强,朴春根,等. 链格孢属真菌的分子复核鉴定及系统发育研究[J]. 中国农学通报,2013,29(27):165-169.
[21]杨丽萍,金梦军,崔凌霄,等. 甘肃省樱桃黑斑病病原菌的分离及鉴定[J]. 果树学报,2020,37(6):891-899.
[22]乔镜澄,刘 宇,马敬昊,等. 番茄黑斑病病原菌的鉴定及生物学特性研究[J]. 江苏农业科学,2017,45(10):94-97.
[23]王启宇,杨 敏,魏环宇,等. 引起云南省珠芽魔芋叶斑病的链格孢菌种类鉴定[J]. 植物保护,2022,48(4):240-244.[HJ2mm]
[24]李红叶,梅秀凤,符雨诗,等. 柑橘链格孢褐斑病的发生危害风险和治理对策[J]. 果树学报,2015,32(5):969-976.
[25]张晓勇,邹东霞,张 凤,等. 贵州八角叶枯病病原菌鉴定及生物学特性研究[J]. 植物保护,2022,48(5):183-189.
[26]张建强,吴康莉,张晓梦,等. 芹菜叶斑病病原菌的分离鉴定、生物学特性及其生防菌筛选[J]. 西北农业学报,2021,30(7):1089-1099.
[27]蒋晶晶,赵娇娇,陈爱昌,等. 黄芩叶斑病病原菌鉴定和药剂室内毒力测定[J]. 核农学报,2022,36(11):2166-2174.
[28]王荣波,陈姝樽,李本金,等. 福建省彩叶草叶斑病病原菌的分离鉴定与室内药剂筛选[J]. 福建农业学报,2021,36(12):1471-1477.
基金项目:云南省地方高校基础研究联合专项(编号:2018FH001-034);红河学院科研基金博士专项(编号:XJ17B10)。
作者简介:白建波(1980—),女,云南个旧人,硕士,副教授,主要从事园艺植物栽培研究。E-mail:bjb_biology2@126.com。
通信作者:周银丽,博士,副教授,主要从事植物线虫病害及植物病害复合侵染研究。E-mail:zyl_biology2@126.com。

