基于深度学习重建技术的头部增强T1WI序列在垂体神经内分泌肿瘤病变成像中的应用
吴慧芳,陈绪珠,张明宇,郑凤莲,汪晓鹏,范亦龙,丁金立
作者单位 首都医科大学附属北京天坛医院放射科,北京 100070
0 引言
垂体神经内分泌肿瘤是一种临床常见的神经内分泌肿瘤,其发病率占中枢神经系统肿瘤的10%~15%[1],通常需手术治疗,如开颅手术、经蝶垂体瘤切除手术等[2]。MRI 是临床筛查和诊断垂体神经内分泌肿瘤的重要影像学手段,MRI 不仅可以检出垂体神经内分泌肿瘤、确定疾病的各种性质及侵犯范围、程度,而且在疗效评估和预后预测方面具有很大价值[3]。由于MRI信号采集过程相对较长,诸多因素会影响图像质量,包括环境因素(如噪声、射频干扰等)、设备因素(如磁场强度、线圈等)、序列参数(如照射野、层间距、扫描平均次数、重复时间、回波时间等)等[4]。如何权衡扫描时间、图像对比和空间分辨率一直是MRI领域的重点和难点。垂体神经内分泌肿瘤所在的鞍区位置解剖结构复杂,临床实际扫描中,MRI 由于采集时间较长、患者配合度差、序列参数设置不合适等原因,往往会造成鞍区成像的图像质量下降,如组织结构对比较差、解剖细节显示不清等,而高分辨率的MR图像对于垂体瘤手术入路的预测,手术风险的评估以及手术效果的预期是至关重要的[5-7]。加速技术的发展,如并行采集(parallel imaging, PI)技术[8]、压缩感知(compressed sensing,CS)技术[9]等,其原理均是通过K 空间的欠采样来缩短时间,在有效缩短MRI 采集时间的同时会伴随着图像信噪比的下降[10-11]。因此,在不降低或提升图像质量的前提下,有效缩短鞍区MR扫描时间是临床迫切需要的。
基于深度学习的重建(deep learning reconstruction,DL Recon)是近几年得以快速发展的MRI 图像后处理重建方式,是利用有监督的卷积神经网络对近乎完美(层内高分辨和无噪声)的医学图像和原始重建图像进行学习,对传统重建图像进行噪声处理,使图像更加自然,去除截断伪影,提高图像锐利度[12-13]。目前DL Recon 已用于神经系统[14]、肌骨系统[15-16]、体部[17]及心脏[18-19]等多部位的扫描研究,证实了其在缩短成像时间、提升信噪比和提高分辨率方面表现卓越[20],但是DL Recon 在垂体神经内分泌肿瘤T1WI 增强成像方面的应用研究鲜有报道。本研究拟通过与常规T1WI 增强序列对比,探索基于DL Recon 的T1WI 增强序列在垂体神经内分泌肿瘤MR 成像方面的可行性,验证DL Recon 技术对图像质量提升的能力,以期从缩短扫描时间和保证图像质量两方面促进垂体神经内分泌肿瘤MRI 的成功率,为手术入路的选择和手术的风险评估提供准确依据[7]。
1 材料与方法
1.1 一般资料
本研究遵守《赫尔辛基宣言》,经首都医科大学附属北京天坛医院伦理委员会批准,全体受试者均签署了知情同意书,批准文号:KY2022-078-04。前瞻性纳入首都医科大学附属北京天坛医院2022 年7 月至2023 年2 月行MRI 增强扫描的50 例患者。纳入标准:(1)临床医生根据病史、临床症状及相关检查怀疑为垂体神经内分泌肿瘤的患者;(2)有完整的颅内常规T1WI 增强序列和应用DL Recon T1WI 增强序列图像;(3)无MRI扫描禁忌。排除标准:(1)最终无病理结果者;(2)病灶最大直径在1 cm 以内的垂体神经内分泌肿瘤;(3)图像质量差,无法进行评估。
1.2 检查方法
所有受试者均采用 3.0 T MR 扫描仪(Signa Architect, GE Healthcare, America)进行检查,使用线圈为48通道头部专用线圈(GE Healthcare, America)。受检者取仰卧位,以听眦线为定位线扫描。平扫序列包括矢状位T1WI、轴位T1WI 和轴位T2WI,依据病灶大小层厚取3~5 mm,层间距10%~20%;增强扫描序列包括常规轴位T1WI、矢状位T1WI、冠状位T1WI 和定制轴位T1WI,对比剂采用钆喷酸葡胺注射液(Gadopentetate Dimeglumine Injection, Beilu,Beijing, China),用量为0.2 mL/kg,以1.5~2 mL/s 的速率行静脉注射。一次注射对比剂后,先扫描矢状位T1WI、冠状位T1WI再扫描定制轴位T1WI和常规轴位T1WI 序列。扫描所得增强图像中的试验组出两组图像,其中定制序列经DL 处理所得的图像记作A组,定制序列未经DL处理的原始图像记作B组,将常规扫描的T1WI 增强图像作为对照,记作C 组。其中定制T1WI增强序列和常规扫描的T1WI增强序列的参数如表1所示。

表1 定制T1WI增强序列和常规扫描的T1WI增强序列参数Tab.1 Customize the parameters of the T1WI enhancement sequence and the conventionally scanned T1WI enhancement sequence
1.3 图像分析
所有图像传输至后处理工作站(GE ADW4.7)进行图像分析。首先对三组图像进行匿名处理;然后进行客观评价和主观评价。
客观评价:通过勾画感兴趣区(region of interest,ROI)分别对图像的灰质、白质和病灶区域进行信噪比(signal-to-noise ratio, SNR)及对比噪声比(contrastto-noise ratio, CNR)的测定,SNR 及CNR 测定方法参考KIM等[21]的研究,计算方式如下:
其中μWM和μCSF分别表示脑白质和脑脊液的平均信号强度,σWM和σCSF分别表示脑白质和脑脊液的信号标准差[22]。勾画ROI 方式如下:在一名具有10 年工作经验的主治医师指导下,对于同一受试者的不同序列的图像分别选取同一层面、同一位置的灰质、白质和病灶区,脑白质信号取自信号相对均匀的胼胝体压部(优选胼胝体压部显示面积较大的层面),脑脊液信号取自侧脑室内信号均匀的脑脊液部分(优选侧脑室三角区)[22],每个ROI 测量三次,取平均值。
主观评价:由2 名诊断医师(分别具有超过20 年的影像诊断经验的主任医师及副主任医师)共同对三组的图像整体质量、图像诊断置信度进行评分(采用双盲法评估),评分结果由每位医师独立评分。图像整体质量评分采用5 级评分法:5 分表示图像质量优,灰白质分界清晰,无伪影,无明显噪声;4 分表示图像质量较好,灰白质分界较好,有少量伪影或噪声;3 分表示图像质量一般,灰白质分界尚可,但是有明显伪影或噪声;2 分表示图像质量较差,灰白质分界不清晰,且图像有明显伪影或噪声;1 分表示图像质量很差,结构显示不清或具有较重伪影或噪声。病灶诊断置信度采用4 级评分法:4 分表示病灶显示优,边界清晰,无明显伪影或噪声,可明确诊断;3 分表示病灶显示较好,边界尚可,但存在少量伪影或噪声,诊断价值较高;2 分表示病灶显示一般,边界模棱两可,且存在明显伪影或噪声,诊断价值有限;1 分表示病灶显示差,无诊断价值[23-25]。
1.4 统计学分析
使用SPSS 22.0 软件(Version 22.0, Armonk)进行统计学分析。图像客观评价指标和主观评价指标均采用Wilcoxon 秩和检验(经Kolmogorov-Smirnov 检验和Levene 检验,所有数据不符合正态分布,方差不齐),主观评价与客观评价指标以中位数(上下四分位数)表示。采用组内相关系数(intra-class correlation coefficient, ICC)评估两名阅片医师主观评分的一致性:ICC 值为0.81~1.00时,表示较完美的一致性;ICC值为0.61~0.80 时,表示一致性较好;ICC 值为0.41~0.60 时,表示一致性中等;ICC 值为0.21~0.40 时,表示低度一致性;ICC值低于0.20时,表示一致性较差。P<0.05认为差异具有统计学意义。
2 结果
2.1 入组人群与序列扫描时间
共纳入垂体神经内分泌肿瘤患者MRI影像资料58例,排除患者放射治疗后病灶太小,无法在MRI图像上有效显示者2 例、严重运动伪影者2 例、垂体神经内分泌肿瘤术后患者4 例,本研究最终入组50 例。其中,男18例、女32例,年龄8~81(44.4±16.4)岁。本研究中,定制T1WI增强序列(试验组)的扫描时间为(42 s)比常规T1WI增强扫描时间短(76 s)。
2.2 客观评价结果
A 组图像的SNR灰质为32.10(25.43,43.04)、SNR白质为78.31(60.03,93.46)、SNR病灶为14.89(8.32,23.53);B 组图像的SNR灰质为24.40(19.88,29.12)、SNR白质为39.63(34.03,46.68)、SNR病灶为13.55(9.04,19.87);C 组图像的SNR灰质为27.46(21.66,36.74)、SNR白质为46.89(40.56,58.17)、SNR病灶为14.70(9.11,20.72)。A 组图像的CNR灰质/白质为10.74(7.50,12.96);B组图像的CNR灰质/白质为7.41(5.41,8.43);C组图像的CNR灰质/白质为7.50(6.23,9.52)。其中A 组图像的病变区、灰质区及白质区的SNR、CNR 均高于B 组和C 组(P<0.001),见表2。

表2 A组、B组和C组图像客观比较Tab.2 Objective comparison of group A, Group B and group C images
2.3 主观评价结果
所有患者的三组图像清晰,图像质量均能满足诊断要求。两位医师对图像总体质量和诊断置信度的主观评价一致性较好(ICC=0.891,P<0.001;ICC=1,P>0.05)。A 组图像总体质量评分最高,为5;C 组图像总体质量评分次之,为4;B 组图像总体质量评分最低,为3。A、B、C三组的图像总体质量评分差异有统计学意义(P<0.001),但是诊断置信度方面无明显差异(P>0.05),见表3。图1~图3 分别为三位垂体神经内分泌肿瘤患者的T1WI增强图像,从中可见使用DL 重建的A 组图像在病灶对比度、病灶边缘、灰质及白质的显示均优于未使用DL重建的常规图像C组和原始图像B 组,其中常规图像C 组次之,原始图像B组最差。
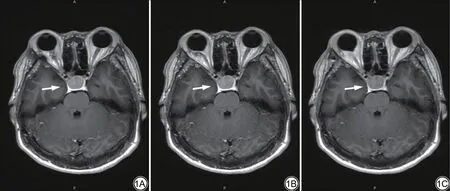
图1 女,30 岁,病理证实为垂体神经内分泌肿瘤(实性病变)。三组轴位T1WI 增强图像垂体神经内分泌肿瘤(箭)显示对比图,可看到1A 整体图像质量最优,1C 次之,1B 最差。1A 为深度学习重建的定制T1WI增强图像;1B为未应用深度学习重建的定制T1WI增强原始图像;1C 为未应用深度学习重建的常规T1WI增强图像。Fig.1 Female, 30 years old, pathologically confirmed pituitary neuroendocrine tumor(solid lesion).The three groups of axial T1WI enhanced images of pituitary neuroendocrine tumor (arrow) show the comparison.It can be seen that the overall image quality of 1A is the best,followed by 1C, and 1B is the worst.1A custom T1WI enhanced image reconstructed for deep learning; 1B enhances the original image for custom T1WI reconstruction without deep learning application;1C is a conventional T1WI enhanced image reconstructed without deep learning.

表3 A组、B组和C组图像主观评分比较Tab.3 Comparison of the subjective scores of group A, Group B and group C
3 讨论
本研究入组了行头部常规T1WI 增强序列和定制T1WI 增强序列扫描的50 例垂体神经内分泌肿瘤患者,定制序列获得了原始图像以及经DL 重建后的图像,对比分析了三组T1WI增强图像的SNR、CNR、图像总体质量和诊断置信度,研究发现使用DL 重建技术的定制T1WI 增强序列在缩短扫描时间的情况下,其图像在灰质、白质和病灶区域的SNR、CNR 以及图像总体质量评分方面最优,诊断置信度等同于常规T1WI增强序列图像。
3.1 图像SNR与CNR
SNR是影响MR图像质量的关键因素之一,为了提升SNR,临床实际扫描往往采取增加扫描激励次数的方式,其主要缺点是延长了扫描时间[10]。本研究中定制T1WI 增强序列扫描时间短,且B 组图像的SNR灰质、SNR白质和SNR病灶均显著低于C 组,其原因是定制序列相比于常规T1WI 增强而言激励次数减少了,图像采集时间缩短的同时牺牲了图像SNR。但是经DL 重建处理的A 组图像,其灰质、白质和病灶的SNR 显著提升,甚至优于C 组图像,可见DL 重建技术在降低MR图像噪声方面优势显著,这与武夏夏等[26]在应用DL Recon 技术的膝关节MR 扫描研究、腰椎MR[27]扫描研究、肩关节MR[28]扫描研究、前列腺MR[29]扫描研究等的结果一致。同样,虽然B 组图像的CNR灰质/白质显著低于C 组图像,但是经DL 重建处理后,其图像的CNR灰质/白质显著提升,可见DL 重建技术在提升图像CNR方面具有显著优势。值得注意的是,定制序列虽然应用了DL 重建技术,但是其图像重建时间并不长,这主要得益于先进的计算机硬件计算能力。从图像客观评估方面可见,定制的T1WI增强序列不仅扫描时间短,由于施加了DL Recon,其图像的SNR与CNR显著提升。
3.2 图像总体质量与病灶诊断置信度
本研究的主观评分由两名具有20多年的阅片经验的医师进行。三组图像的总体质量评分与图像SNR 和CNR 的表现一致,虽然B 组图像的总体质量弱于C 组,但是经DL 重建处理后的图像总体质量提升,且显著优于B和C组。这与GASSENMAIER[30]等在“有无使用DL Recon 技术的前列腺T2WI 序列的整体图像质量上的差异”研究,以及PARK 等[31]在应用DL Recon 技术可以提高图像质量,并在前列腺肿瘤范围和薄膜侵犯方面的评估效能与常规扫描序列相仿上的研究结果一致。
另一方面,MRI 的原始重建法主要通过滤波来降低噪声,但同时会损失部分组织细节,容易导致图像模糊而产生伪影[32]。本研究的T1WI 增强序列中,B 组原始图像可见明显伪影,C 组常规图像次之,而在相同条件下,应用DL Recon 技术的A 组图像伪影最轻,图像质量最优(如图1、图2、图3)。本研究应用的DL Recon技术是基于数千万次的拟合进代计算深度优化后的深度卷积神经网络模型,可减少图像噪声,去除截断伪影,并提高图像清晰度[12]。SUN[33]等也探讨了有无使用DL 技术对传统T2WI、加速T2WI高分辨率及加速T2WI低分辨率图像质量的研究,结果显示使用DL的T2WI图像噪声及伪影均较不使用DL 明显降低[34],这与本研究结果一致。但值得注意的是,虽然B 组图像的总体质量最低,但是经评估,A、B、C 三组在诊断置信度方面无显著差异,表明三组图像均可以用于垂体神经内分泌肿瘤病变的诊断,侧面证明,施加DL 重建技术后其图像的诊断能力并未减弱,但是能否实现诊断置信度的有效提升,尚待进一步研究。
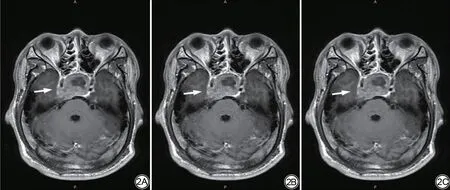
图2 男,33 岁,病理证实为垂体神经内分泌肿瘤病变(该病变以实性为主)。三组轴位T1WI 增强图像垂体神经内分泌肿瘤(箭)显示对比图,可以看到2A 组整体图像质量最优,2C 组次之,2B 组最差。2A 为深度学习重建的定制T1WI增强图像;2B为未应用深度学习重建的定制T1WI 增强原始图像;2C 为未应用深度学习重建的常规T1WI增强图像。Fig.2 Male, 33 years old, pathologically confirmed pituitary neuroendocrine tumor lesions (mainly solid lesions).The three groups of axial T1WI enhanced images of pituitary neuroendocrine tumor (arrow)are shown in comparison.It can be seen that the overall image quality of group 2A is the best, followed by group 2C, and group 2B is the worst.2A custom T1WI enhanced image reconstructed for deep learning; 2B enhances the original image for custom T1WI reconstruction without deep learning application; 2C is a conventional T1WI enhanced image reconstructed without deep learning application.

图3 男,32 岁,病理证实为垂体神经内分泌肿瘤病变(该病变以囊性为主)。三组轴位T1WI 增强图像神经内分泌肿瘤(箭)显示对比图,可以看到3A 组整体图像质量最优,3C 组次之,3B 组最差。3A 为深度学习重建的定制T1WI增强图像;3B为未应用深度学习重建的定制T1WI增强原始图像;3C为未应用深度学习重建的常规T1WI增强图像。Fig.3 A 32-year-old man with a pathologically confirmed pituitary neuroendocrine neoplasm (mostly cystic).The three groups of axial T1WI enhanced images of neuroendocrine tumors(arrow) show the comparison diagram, and it can be seen that the overall image quality of group 3A is the best, followed by group 3C, and group 3B is the worst.3A custom T1WI enhanced image reconstructed for deep learning; 3B enhances the original image for custom T1WI reconstruction without deep learning application; 3C is a conventional T1WI enhanced image reconstructed without deep learning application.
3.3 本研究的局限性
本研究存在以下不足:(1)本研究入组样本量较少,后续研究将纳入更多样本量;(2)因排除部分病灶较小的病例,因此研究结果的价值存在一定偏倚;(3)因本研究中垂体神经内分泌肿瘤的大小、形态不同,导致采集时不同患者之间T1WI增强序列的层厚不统一,但是对于同一患者而言其两个T1WI增强序列的层厚一致;(4)本研究鞍区结构没有考虑垂体的边缘细节显示等评价指标,未来研究中将重点纳入体积较小的垂体瘤,并采用薄层扫描的方式关注垂体柄、垂体边缘及细节显示;(5)本研究病种单一,未来研究将纳入更多鞍区病变,同时也将纳入垂体神经内分泌肿瘤术后复发的情况;(6)本研究中定制序列与常规序列的差异主要在于激励次数不同,未来将尝试修改其他参数以达到缩短扫描时间的目的,验证DL Recon技术在提升图像质量和诊断能力方面的价值。
4 结论
综上所述,应用DL Recon 技术可显著提升头部增强T1WI 增强序列的SNR、CNR、图像整体质量以及对垂体神经内分泌肿瘤的诊断置信,并且改善因缩短扫描时间所致的图像质量下降情况,有助于临床上在缩短扫描时间的同时,保持甚至提升T1WI增强图像质量和诊断置信度[35]。
致谢:感谢中国通用电气医疗有限公司宋海工程师对本文提供技术支持。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:丁金立设计本研究的方案,对稿件的重要内容进行了修改;吴慧芳起草和撰写稿件,获取、分析和解释本研究的数据,陈绪珠、张明宇、郑凤莲、汪晓鹏、范亦龙获取、分析或解释本研究的数据,对稿件重要内容进行了修改;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

