马乳酒样乳杆菌马乳酒样亚种real-time PCR检测方法的建立与应用
吕厚姣,李欣媛,白小佳,贾龙刚,耿伟涛,王艳萍
(天津科技大学食品科学与工程学院,天津 300457)
马乳酒样乳杆菌在伯杰氏细菌分类鉴定中属于乳杆菌科、乳杆菌属,马乳酒样乳杆菌马乳酒样亚种(Lactobacilluskefiranofacienssubsp.kefiranofaciens)是其中一个亚种[1]。马乳酒样乳杆菌具有抗菌[2-3]、抗肿瘤[4-5]、免疫调节[6-7]、抗过敏[8]、肠道微生物群[9-10]等益生作用。2021年中国卫健委发布通知,将马乳酒样乳杆菌马乳酒样亚种列为新食品原料。因此,未来该菌株有望在食品药品等领域得到广泛应用。由于采用目前常规检验方法不能有效地检出该菌种,因此,需要建立特异性、灵敏度和重复性高的快速检测方法。
目前根据GB 4789.35—2016《食品微生物学检验 乳酸菌检验》,乳酸菌检测方法为平板计数法[11],其中乳杆菌采用平板倾注法[12]。但是该方法对有些混合体系中多种乳杆菌或亚种不能进行区分,而且操作时间长,并且显著低估细菌丰度[13-16]。随着生物学技术的发展,一些现代分子生物学的方法已经广泛应用于乳酸菌的定性和定量检测[17-19],比如流式细胞术[20]、荧光原位杂交技术[21]及实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)[22]等。相比于传统的技术方法,现代分子生物学方法方便、快捷、精确度及灵敏度高[23-25]。其中real-time PCR方法将PCR方法和荧光报告化学相结合,监测模板扩增,根据由具有已知浓度或拷贝数的连续稀释标准样品(通常是10 倍稀释液)构建的校准曲线确定样品中靶DNA的绝对量[26]。
本研究以马乳酒样乳杆菌的模式菌株马乳酒样乳杆菌亚种ZW3菌株为研究对象,通过对马乳酒样乳杆菌ZW3的16S rDNA序列和全基因组序列进行分析,以期获得马乳酒样乳杆菌马乳酒样亚种的特异性引物序列信息,确定特异性引物,建立PCR和real-time PCR的检测方法,并对该方法的特异性、灵敏度和重复性进行验证。
1 材料与方法
1.1 材料与试剂
实验所用菌株见表1。

表1 实验菌株Table 1 Strains used in this study
细菌基因组DNA快速抽提试剂盒、溶菌酶 生工生物工程(上海)股份有限公司;2×SYBR Green Fast qPCR Mix 北京百迈客生物科技有限公司;DNA Marker III、Trans2K Plus II DNA Marker 北京全式金生物技术有限公司;琼脂糖、核酸染料 美国Genview公司;M17培养基 青岛海博生物科技有限公司;异丙醇、无水乙醇 天津江天化工技术有限公司。
1.2 仪器与设备
PCR仪、5415D型离心机 德国Eppendorf公司;DYY-III-6B型稳压稳流电泳仪、DYCZ-24D型电泳槽北京六一仪器厂;超微量分光光度计 英国BioDrop公司;全自动凝胶成像仪、C1000TMreal-time PCR仪 美国Bio-Rad公司。
1.3 方法
1.3.1 基因组DNA的提取
取过夜培养的细菌菌液,加入离心管中,室温8 000 r/min离心1 min,弃上清液,收集菌体。按照DNA提取试剂盒说明提取细菌基因组DNA。
将提取好的细菌基因组DNA用超微量分光光度计检测浓度和纯度。
1.3.2 马乳酒样乳杆菌马乳酒样亚种的特异性引物设计
从NCBI数据库下载马乳酒样乳杆菌马乳酒样亚种和在发酵食品中经常食用的常见益生菌,如发酵黏液乳杆菌(Limosilactobacillusfermentum)、德氏乳杆菌保加利亚亚种(L.delbrueckiisubsp.bulgaricus)、唾液链球菌嗜热亚种(S.salivariussubsp.thermophilus)、植物乳植杆菌(L.plantarum)、罗伊氏黏液乳杆菌(L.reuteri)、嗜酸乳杆菌(L.acidophilus)等的16S rDNA序列和其他基因DNA序列,利用DNAMAN软件进行序列对比,找寻序列差异性较大的片段,用Primer 5.0软件进行数据分析得到初步引物,将得到的引物序列通过NCBI数据库进行BLAST查询验证,比对结果与马乳酒样乳杆菌马乳酒样亚种的DNA序列匹配,将此引物作为候选应用到下一步实验中。
1.3.3 引物初筛实验
以提取的马乳酒样乳杆菌马乳酒样亚种、德氏乳杆菌保加利亚亚种和唾液链球菌嗜热亚种的全基因组DNA为模板,用所设计的引物进行目标基因PCR扩增后,经凝胶电泳实验进行筛选。
1.3.4 引物验证实验
将提取的植物乳植杆菌MA2、植物乳植杆菌BC 299、马乳酒样乳杆菌1207等的全基因组DNA利用筛选的特异性引物进行PCR扩增,然后进行电泳实验,对特异性引物进行验证。
1.3.5 PCR条件与检验
PCR体系共20 μL,其中10 μL 2×RapidTaqMaster mix,上、下游引物各1 μL,模板DNA 1 μL,ddH2O补齐至体积20 μL。
PCR条件:95 ℃预变性8 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,共进行35 个循环;最后72 ℃延伸10 min。
凝胶电泳:PCR结束后取1 μL的反应产物经0.8%琼脂糖凝胶电泳检测,采用凝胶成像仪分析结果并照相收集数据。
1.3.6 real-time PCR
real-time PCR体系共20 μL,其中SYBR Green qPCR Mix 10 μL,上、下游引物各0.5 μL,模板DNA 1 μL,ddH2O补齐至体积20 μL。real-time PCR条件:95 ℃预变性3 min;95 ℃变性5 s、60 ℃退火30 s,共40 个循环,在每个循环末收集荧光信号。
1.3.7 方法特异性、灵敏度和重复性检测
特异性验证:以马乳酒样乳杆菌、植物乳植杆菌、德氏乳杆菌保加利亚亚种和唾液链球菌嗜热亚种的基因组DNA为模板,采用筛选出的马乳酒样乳杆菌马乳酒样亚种的特异性引物对,以灭菌ddH2O作为阴性对照(NTC),进行real-time PCR扩增,测试方法的特异性。
灵敏度验证:将马乳酒样乳杆菌马乳酒样亚种的DNA原液进行10 倍梯度稀释,以稀释至10、1、0.1、0.01、0.001、0.000 5、0.000 1 μg/mL的DNA为模板,利用马乳酒样乳杆菌马乳酒样亚种的特异性引物,以灭菌ddH2O作为阴性对照(NTC),每个质量浓度设置3 个平行,进行real-time PCR,找出检测为阳性时的最低浓度。
重复性验证:采用马乳酒样乳杆菌马乳酒样亚种的5 个不同的质量浓度,每个样本重复3 次,计算循环阈值(Cq)的标准偏差(standard deviation,SD)和相对标准偏差(relative standard deviation,RSD)。
1.3.8 标准曲线的建立
从马乳酒样乳杆菌马乳酒样亚种菌株菌液10 倍稀释液中提取DNA进行real-time PCR扩增,以标准菌株已知量的不同菌株对数值(lg(CFU/mL))为横坐标,采用马乳酒样乳杆菌马乳酒样亚种特异性基因引物扩增,以反应过程中出现荧光信号的Cq为纵坐标绘制标准曲线,得到回归方程。
1.3.9 real-time PCR检测方法的应用
依照1.3.1节的方法对需要检测的不同菌株及混合体系的DNA进行提取,应用特异性引物进行PCR验证,然后进行real-time PCR验证,判断本方法的检测特异性。
1.4 数据分析
应用软件LightCycler®96 SW对实验所得数据进行分析;real-time PCR图为软件自动生成。利用Excel 2021软件进行数据处理及表格绘制。
2 结果与分析
2.1 细菌基因组DNA的浓度和纯度检测结果
通过DNA提取试剂盒提取细菌基因组DNA后,经超微量分光光度计检测所有细菌基因组DNA质量浓度均在200~2 000 μg/mL之间,A260nm/A280nm的值均在1.8~2.0之间(表2),说明DNA提取浓度较高,其他杂质污染较少、纯度较高,满足后续实验要求。

表2 细菌基因组DNA提取结果Table 2 Results of bacterial genomic DNA extraction
2.2 马乳酒样乳杆菌马乳酒样亚种特异性引物设计结果
通过马乳酒样乳杆菌马乳酒样亚种与德氏乳杆菌保加利亚亚种、唾液链球菌嗜热亚种、嗜酸乳杆菌、植物乳植杆菌、发酵黏液乳杆菌、罗伊氏黏液乳杆菌和干酪乳杆菌的16S rDNA序列及其他基因序列对比,找出序列相差较大的片段,通过Primer 5.0软件进行数据分析后得到4 组引物(表3)。

表3 ZW3的引物序列Table 3 Primer sequences from ZW3
2.3 特异性引物的初筛结果
将提取的德氏乳杆菌保加利亚亚种、唾液链球菌嗜热亚种和马乳酒样乳杆菌马乳酒样亚种的DNA用所设计的4 对引物进行PCR扩增,然后进行琼脂糖凝胶电泳,观察条带,结果见图1。根据16S rDNA设计的引物ZW3-引物-1和根据基因WANG_1283设计的引物ZW3-引物-2对各个细菌及负对照均有扩增条带,可能原因是引物特异性差;根据基因WANG_1287设计的引物ZW3-引物-3对马乳酒样乳杆菌马乳酒样亚种、德氏乳杆菌保加利亚亚种和唾液链球菌嗜热亚种出现扩增条带,而引物ZW3-引物-4除了对马乳酒样乳杆菌马乳酒样亚种有明显扩增条带,对其他细菌的扩增条带均不太明显,因此可以得出引物ZW3-引物-4的特异性强,可进行下一步实验。

图1 不同特异性引物扩增目的片段的PCR结果Fig.1 Agarose gel electropherogram of PCR amplified fragments with different specific primers
2.4 特异性引物验证结果
根据上述PCR结果,选择引物ZW3-引物-4进一步验证其特异性。将植物乳植杆菌MA2、植物乳植杆菌BC 299、马乳酒样乳杆菌XL 10、马乳酒样乳杆菌1207和马乳酒样乳杆菌ZW3提取的基因组DNA使用该引物进行PCR扩增后进行琼脂糖凝胶电泳,结果见图2。可以看出,除了马乳酒样乳杆菌马乳酒样亚种外,其余菌株均在224 bp处无明显条带,可知该引物的特异性较好,可进行real-time PCR。

图2 ZW3-引物-4特异性验证琼脂糖凝胶电泳图Fig.2 Agarose gel electropherogram showing the specificity of primer 4 from ZW3
特异性引物ZW3-引物-4来自基因WANG_1287,该基因被注释为糖基转移酶(glycosyltransferase,GT)2。GTs介导来自各种糖供体的糖的区域特异性和立体特异性转移到各种重要的生物分子,包括聚糖、脂质、肽和小分子[19-20]。GT2酶类与蔗糖等二糖、脂多糖、壳聚糖的合成相关,在发酵乳中,这些物质尤其是多糖类化合物可能会影响发酵乳最终的黏度、持水性等特性。而ZW3的特点是高产胞外多糖,且根据王鑫磊等[21]的研究可知,添加ZW3可以增加发酵酸奶的黏度,因此该基因是一个关键特异性基因。
2.5 real-time PCR的建立
2.5.1 特异性检测结果
根据普通PCR结果可得ZW3-引物-4具有较强的特异性,因此使用该引物进行real-time PCR验证。将植物乳植杆菌MA2、植物乳植杆菌BC 299、马乳酒样乳杆菌XL 10、马乳酒样乳杆菌1207和马乳酒样乳杆菌ZW3提取的基因组DNA使用该引物在同一条件下同时进行real-time PCR,结果如图3所示,除马乳酒样乳杆菌马乳酒样亚种出现标准的“S”形曲线,且Cq约为17,说明扩增效率高,其余菌株均未出现扩增,说明该引物特异性好,只对马乳酒样乳杆菌马乳酒样亚种有特异性扩增。
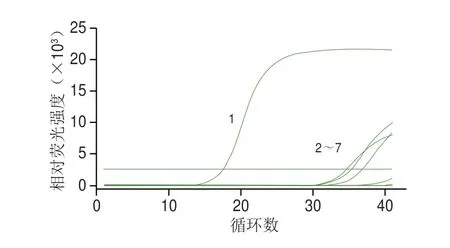
图3 特异性引物验证曲线Fig.3 Specific primer validation curves
2.5.2 灵敏度验证结果
将ZW3的DNA质量浓度稀释至10、1、0.1、0.01、0.001、0.000 5、0.000 1 μg/mL共7 个梯度进行real-time PCR,检测反应体系的灵敏度,扩增曲线如图4所示,0.000 5 μg/mL和0.000 1 μg/mL的扩增曲线与NTC组相重合,并根据表4可知,NTC组的Cq平均值为31.74,为了保证实验数据的可信度,选择Cq≤30时为阳性检出。在质量浓度为0.001 μg/mL时,Cq为29.87,因此本实验方法最低可以检测质量浓度为0.001 μg/mL。

图4 特异性引物灵敏度的扩增曲线Fig.4 Amplification curves of specific primers sensitivity

表4 灵敏度测试结果Table 4 Sensitivity test results
2.5.3 重复性验证结果
以20、2、0.2、0.02、0.002 μg/mL 5 个马乳酒样乳杆菌马乳酒样亚种的DNA质量浓度进行重复性实验,结果见表5,对所得的Cq进行统计学分析。马乳酒样乳杆菌马乳酒样亚种的5 个质量浓度样品Cq的SD在0.05~0.23之间,RSD在0.26%~0.95%之间,小于1%,在可接受范围内,因此,建立的real-time PCR检测体系具有较好的重复性。

表5 重复性实验结果Table 5 Repeatability test results
2.5.4 标准曲线的建立
以马乳酒样乳杆菌马乳酒样亚种107、106、105、104、103、102、101、100CFU/mL的10 倍连续稀释液作为反应模板,建立标准曲线,其中不同梯度稀释液的扩增曲线见图5,建立的标准曲线如图6所示。回归方程为y=-2.671x+30.719,决定系数R2为0.965,该曲线具有良好的线性关系。

图5 不同浓度基因模板扩增目的基因扩增曲线Fig.5 Amplification curves of target genes amplified with gene templates at different concentrations

图6 标准曲线的建立Fig.6 Establishment of standard curve
2.6 real-time PCR方法的应用
2.6.1 在马乳酒样乳杆菌马乳酒样亚种其他菌株纯培养物检测中的应用
real-time PCR方法建立后,为了检测方法的实用性,使用本实验室保藏的已知亚种的菌株进行验证。马乳酒样乳杆菌马乳酒样亚种ZW18、LK180和W182是本实验室在中国科学院微生物研究所鉴定的已知亚种的3 种菌株。首先通过DNA提取试剂盒提取这3 株菌的DNA进行质量浓度和纯度的检测,3 株菌的DNA质量浓度均大于200 μg/mL,表明DNA浓度较好,且1.8<A260nm/A280nm<2.0,可用于后续特异性PCR和real-time PCR的检测。
使用特异性引物对3 株菌进行real-time PCR检测,结果如图7所示,3 株菌均有明显的“S”型扩增曲线,且Cq均在20左右,表明该特异性引物具有马乳酒样乳杆菌马乳酒样亚种特异性,且建立的real-time PCR方法可以特异性地检测该亚种。
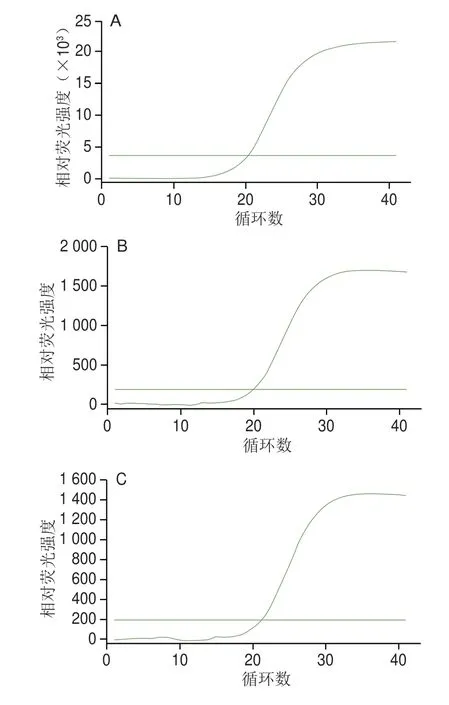
图7 特异性引物对马乳酒样乳杆菌不同菌株的目标基因扩增曲线Fig.7 Amplification curves of target genes in different strains of L.kefiranofaciens with specific primers
2.6.2 在含有马乳酒样乳杆菌马乳酒样亚种及其他乳酸菌混合体系检测中的应用
在实际应用中,益生菌通常都不是单独使用,而是和其他益生菌共同使用[27],因此从纯培养物水平和纯基因组DNA水平分别检验所建立的real-time PCR方法的抗干扰能力。纯培养物水平检验结果如表6所示,添加德氏乳杆菌保加利亚亚种和唾液链球菌嗜热亚种不影响该方法对马乳酒样乳杆菌马乳酒样亚种的检测。基因组DNA水平检验结果如表7所示,混合DNA体系中含有德氏乳杆菌保加利亚亚种和唾液链球菌嗜热亚种的DNA不影响马乳酒样乳杆菌马乳酒样亚种的检测,且至少能检出0.02 μg/mL的DNA。

表6 培养物水平混合体系的检测结果Table 6 Resistance of real-time PCR to interferences from other lactic acid bacteria

表7 纯基因组DNA水平混合体系的检测结果Table 7 Resistance of real-time PCR to interferences from pure genomic DNA from other lactic acid bacteria
2.6.3 在含有马乳酒样乳杆菌马乳酒样亚种复合益生菌菌粉样品检测中的应用
本实验使用含有德氏乳杆菌保加利亚亚种菌粉、唾液链球菌嗜热亚种菌粉和马乳酒样乳杆菌马乳酒样亚种ZW3菌粉(3 株菌的添加比例为1∶1∶1)的复合益生菌菌粉混合体系进行验证,以纯马乳酒样乳杆菌马乳酒样亚种ZW3菌粉为对照,两个体系的real-time PCR验证结果如图8所示,两个体系均有明显的扩增曲线,且两个体系的扩增曲线距离较近,Cq差距也较小,表明添加其他菌粉不影响目标菌株的检出,所建立的real-time PCR方法可以特异性地检测该亚种。

图8 混合菌粉的验证Fig.8 Verification of real-time PCR using pure ZW3 and its mixture with other probiotics
3 讨论与结论
马乳酒样乳杆菌马乳酒样亚种作为一种新资源食品原料,具有广阔的应用前景,因此建立能够简单快速地检测这种益生菌的方法至关重要。Kim等[28]通过将马乳酒样乳杆菌与其相似菌株的16S rDNA序列进行对比设计引物和探针,第一次应用real-time PCR法检测对比了开菲尔粒和开菲尔牛奶中马乳酒样乳杆菌。但是目前检测马乳酒样乳杆菌马乳酒样亚种的方法鲜见报道。因此,本实验通过real-time PCR方法特异性定性、定量马乳酒样乳杆菌马乳酒样亚种具有一定的现实意义。
本研究根据马乳酒样乳杆菌马乳酒样亚种ZW3的16S rDNA序列和全基因组序列设计引物,通过PCR扩增及琼脂糖凝胶电泳实验进行验证,证明特异性引物ZW3-引物-4的特异性较强。通过该特异性引物建立了马乳酒样乳杆菌马乳酒样亚种的real-time PCR方法,特异性强、灵敏度高,检出限为0.001 μg/mL,重复性好,建立realtime PCR的标准曲线,其决定系数R2为0.965,具有良好的线性关系,且在纯培养物和混合体系中均能特异性检出马乳酒样乳杆菌马乳酒样亚种。综上,本研究为马乳酒样乳杆菌马乳酒样亚种检测提供了一种特异、快速、灵敏的检测方法。
——和田盘羊

