DCN基因多态性对大白猪繁殖性能影响
符彬彬 李清春 和军飞 卢世豪 陈鑫 何凡 祁梦凡 张化鹏 鲁慧文 黄涛

摘要:目的 為探究核心蛋白聚糖(DCN)基因单核苷酸多态性对大白母猪繁殖性能的影响。方法 利用DNA混池测序,确定DCN基因的SNPs,采用GenoPlexs基因分型技术对316头大白母猪群进行基因分型,并与大白母猪的繁殖性能进行关联分析。结果 在DCN基因内含子4和外显子4分别鉴定到rs346372784(C/T)和rs55618082(C/A)突变位点。其中,rs55618082(C/A)发生同义突变后导致DCN基因mRNA二级结构和自由能发生变化。rs346372784(C/T)位点对大白母猪母系指数、繁殖指数、初生重、总仔数EBV、活仔数EBV有极显著影响(P<0.01),对乳头数、死胎数、活仔数有显著影响(P<0.05)。rs55618082(C/A)位点对母系指数、繁殖指数、乳头数、妊娠期、初生重、总仔数EBV、活仔数EBV有极显著影响(P<0.01)。结论 DCN基因rs346372784(C/T)和rs55618082(C/A)突变影响大白猪的繁殖性能,可用于大白猪的标记辅助选育。
关键词:大白猪;DCN基因;多态性;繁殖性状
中图分类号:S828.2文献标志码:A文献标识码
Effects of DCN gene polymorphisms on the reproductive performance of Yorkshire
Pigs
FU Binbin1,LI Qingchun1,HE Junfei1, 2,LU Shihao1,CHEN Xin1,HE Fan1,QI Mengfan1,ZHANG Huapeng1,LU Huiwen2,HUANG Tao1,2*
(1 College of Animal Science and Technology, Shihezi University,Shihezi, Xinjiang 832000, China; 2 Xinjiang Pig Breeding
Engineering and Technology Research Center,Changji, Xinjiang 831100, China)
Abstract: Objectives To investigate the influence of single nucleotide polymorphisms (SNPs) within the Decorin (DCN) gene on the reproductive traits of Yorkshire sows. Methods The SNPs of DCN gene was determined by sequencing PCR product of mixed-pool DNA, and GenoPlexs genotyping technology was utilized to genotype a population of 316 Yorkshire sows
and to analyze the association with reproductive performance of Yorkshire sows.
Results Two mutation sites, rs346372784(C/T) in intron 4 and rs55618082(C/A) in exon 4 of the DCN gene, were identified in this study. rs55618082(C/A) exhibited a synonymous mutation, leading to changes in the secondary structure and free energy of the DCN gene mRNA. The rs346372784(C/T) locus exhibited highly significant effects on maternal index, reproductive index, teat number, birth weight, EBV of total litter size (P<0.01), and EBV of numberborn alive in Yorkshire sows, as well as significant effects on stillbirths, and live piglet numbers (P<0.05). The rs55618082(C/A) locus showed highly significant effects on with maternal index, reproductive index, teat number, gestation length, birth weight, EBV of total number born, and EBV of number born alive (P<0.01). Conclusion The mutations at rs346372784(C/T) and rs55618082(C/A) in the DCN gene impact the reproductive performance of Yorkshire sows, indicating their potential as genetic markers for assisted breeding in the Yorkshire population.
Key words: Yorkshire sows;DCN gene;polymorphism;reproductive traits
核心蛋白聚糖(decorin,DCN)最早是从牛胎盘中分离得到的富含亮氨酸的小蛋白多糖,包含一个糖胺聚糖(GAG)链和一个核心蛋白,具有12个富含亮氨酸的重复序列[1-2]。DCN通过与多种蛋白质相互作用,包括生长因子、酪氨酸激酶受体、细胞外基质成分和酶,发挥多效性功能[3]。近年来,研究发现DCN可通过抑制TGF-β通路,参与细胞增殖、迁移、侵袭等生物学功能[4-5],及哺乳动物卵泡发育生长发育[6]的过程。目前研究表明,DCN基因广泛参与不同物种中卵泡发育和生长调控。在山羊中,Peng[7]发现DCN基因可显著增加卵泡颗粒细胞的凋亡并阻断细胞G0/G1期周期进程。在湖羊中,Yao[8]发现在颗粒细胞中lnc FDNCR作为海绵吸附miR-543-3p,反式激活miR-543-3p的靶基因的DCN基因并抑制TGF-β通路,从而促进颗粒细胞凋亡。本课题组前期研究发现DCN基因可通过TGF-β通路调控猪颗粒细胞的增殖,促进凋亡过程[9]。以上研究均表明DCN参与调控卵泡的功能。由于卵巢是承担哺乳动物繁殖的重要生殖器官,表明DCN基因可能是影响猪繁殖性状的候选基因,但目前尚未见该基因单核苷酸多态性(single nucleotide polymorphism,SNP)对大白母猪繁殖性状影响的相关报道。鉴于此,本研究将DCN基因多态性与大白母猪繁殖性状进行关联分析,旨在为大白母猪的繁殖性能的分子标记辅助选育提供参考。
1 材料与方法
1.1 样品采集
选取新疆某猪场同一批次,生长表现良好、饲养条件一致且表型记录完整的大白母猪316头,用剪刀剪取约1cm2大小耳组织样,放入含75%乙醇的离心管中,于冰盒中带回实验室-20℃冰箱保存。
1.2 主要仪器、试剂
1.2.1 主要仪器
PCR仪(德国,SensoQuest)、恒温水浴锅(中国,上海精宏实验设备有限公司)、台式高速离心机(美国,ThermoFisher Scientific)、GelDoc XR+蛋白凝胶成像分析仪(美国,Bio-Rad)等。
1.2.2 主要试剂
血液、细胞和组织DNA提取试剂盒(中国,天根生化科技有限公司)、核酸染料(中国,北京索莱宝科技有限公司)、TAE缓冲液(中国,生工生物工程股份有限公司)、2×Rapid Taq Master Mix(中国,诺唯赞生物科技股份有限公司)等。
1.3 试验方法
1.3.1 DNA提取
取200 mg猪耳组织样于离心管中剪碎,参照血液、细胞和组织DNA提取试剂盒说明书进行DNA提取。
1.3.2 引物设计
根据Ensembl数据库提供的猪DCN基因序列(Ensembl号:ENSSSCG00000000915),采用Primier 5.0软件进行引物设计,引物由上海生工生物工程股份有限公司合成,引物序列见表1。
1.3.3 PCR扩增
随机选取检测合格的DNA样品10个,每个样品取7 μL构建DNA混池并进行PCR扩增。PCR反应体系:上、下游引物浓度为10 μmol·L-1,0.8 μL;2x Taq Master Mix 15 μL;ddH2O 12.4 μL;DNA体积为1.0 μL,PCR总体积为30 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72℃延伸30 s,共35个循环;72 ℃延伸10 min。
1.3.4 PCR产物凝胶电泳及测序
利用琼脂糖凝胶电泳对PCR扩增产物进行验证,将与预期长度一致的PCR产物送至上海生工生物工程股份有限公司进行测序,测序结果通过chromas软件进行分析,将正反向测序序列与Ensembl所得序列通过chromas软件进行比对,检测基因的SNPs位点。
1.3.5 多态位点分型
DNA样本委托石家庄博瑞迪公司利用基于多重PCR的靶向基因捕获技术Geno Plexs对目标SNPs进行基因分型。
1.3.6 数据统计与分析
使用Excel 2021对1-3胎次的产仔数据进行整理,参照张琰芳等[10]的方法分析各SNPs位点的基因频率、基因型频率、遗传杂合度(expected heterozygosity,He)、遗传纯合度(heterozygosity observed,Ho)等,并進行卡方适合性检验。根据SNPs在参考基因组的位置信息,通过Ensembl数据库查找突变的rs号。
利用在线软件(RNA fold web server http://rna.tbi.univie.ac.at/cgi-bin/RNAWebSuite/RNAfold.cgi)对外显子区突变前后的mRNA二级结构进行预测。
采用SPSS 26.0的一般线性模型(General Linear Model, GLM)分析各繁殖性状在不同基因型之间的差异(公式1),不同基因型对应的性状用“平均值±标准差”的形式表示,P<0.05表示差异显著,P<0.01表示差异极显著。
Yij=μ+Gi+Pj+eij.(1)
在式中Yij为产仔数性状表型值,μ为群体均值,Gi表示基因型效应,Pj表示胎次效应,eij表示随机残差效应。
2 结果与分析
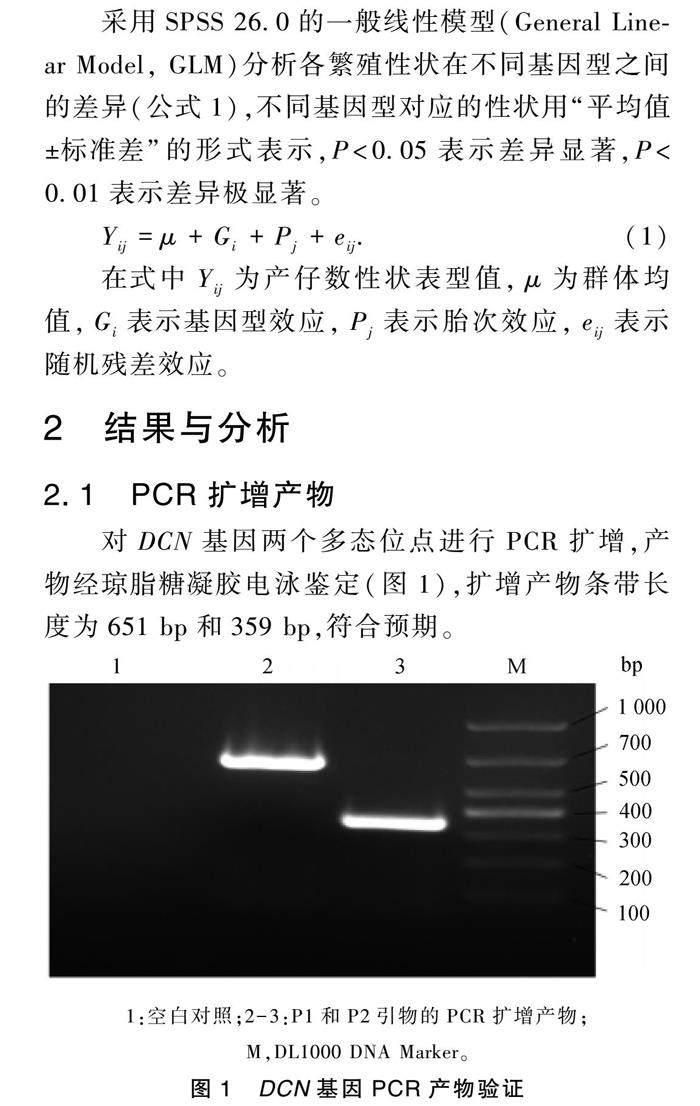
2.1 PCR扩增产物
对DCN基因两个多态位点进行PCR扩增,产物经琼脂糖凝胶电泳鉴定(图1),扩增产物条带长度为651 bp和359 bp,符合预期。
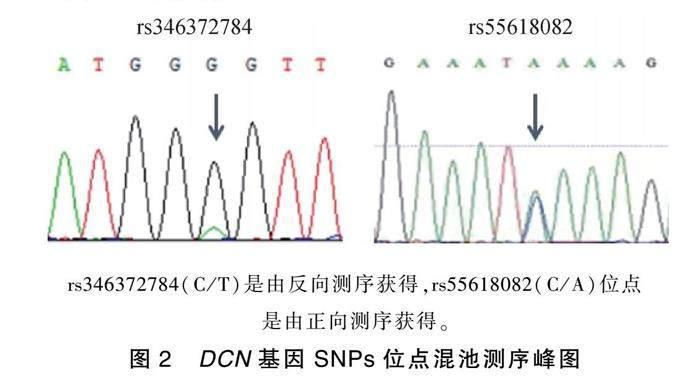
2.2 DCN基因SNPs位点筛选
利用chromas软件对基因测序峰图进行分析 发现2个SNPs位点(图2,表2),经Ensembl数据库查找比对,发现2个突变位点分别为:rs346372784(C/T)、rs55618082(C/A),均为已知突变位点,其中rs55618082(C/A)为同义突变,rs346372784(C/T)为内含子突变。
2.3 DCN基因型频率、等位基因频率分布及遗传多样性分析
由表3可知,316个DNA样品中有2个样品因分型失败。2个SNP位点中,rs346372784(C/T)位点的优势基因型为TT型;rs55618082(C/A)位点的优势基因型为AC型。基因遗传多样性分析结果见表3,2个SNPs位点均处于哈代-温伯格平衡状态(P>0.05),其中,rs55618082(C/A)位点多态信息含量(PIC)为0.35属于中度多态(0.25 2.4 DCN基因CDS区突变前后二级结构预测 由图3可知,DCN基因rs55618082(C/A)发生A>C突变后导致DCN基因mRNA二级结构发生了变化,突变后的最小自由能为-381.10 kcal·mol-1,高于突变前的-381.70 kcal·mol-1,提示DCN基因rs55618082(C/A)发生A>C突变可能会影响其mRNA稳定性。 2.5 DCN基因多态位点对大白母猪妊娠期和乳头数的影响 rs346372784(C/T)位点TT型、CC型个体总乳头数显著高于CT型个体(P<0.05)。rs55618082(C/A)位点AA型个体和AC型个体总乳头数分别极显著(P<0.01)和显著(P<0.05)高于CC型个体;CC型个体妊娠期分别极显著(P<0.01)和显著(P<0.05)高于AC型个体和AA型个体。其他性能在各基因型个体间均无显著差异(P>0.05,表4)。 2.6 DCN基因多态位点对大白猪产仔性状的影响 rs346372784(C/T)位点CT型个体死胎数显著高于TT型个体(P<0.05),CC型个体活仔数显著高于CT、TT型个体(P<0.05),CC型个体初生重极显著高于CT型个体(P<0.01)、显著高于TT型个体(P<0.05),CT型个体初生重显著低于TT型个体(P<0.05)。rs55618082(C/A)位点CC型个体初生重极显著高于AA和AC型个体(P<0.01)。其他性能在各基因型个体间均无显著差异(P>0.05,表5)。 2.7 DCN基因多态位点对大白猪繁殖性状EBV的影响 rs346372784(C/T)位点CC型母系指数、活仔数EBV、繁殖指数极显著高于CT型和TT型个体(P<0.01),CC型个体的总仔数EBV显著高于CT型个体(P<0.05)、极显著高于TT型个体(P<0.01)。rs55618082(C/A)位点AA型个体总仔数EBV、活仔数EBV、母系指数显著高于CC型个体(P<0.05),AC型个体总仔数EBV、活仔数EBV、母系指数极显著高于CC型个体(P<0.01),CC型个体繁殖指数极显著低于AA和AC型个体(P<0.01)。其他性能在各基因型个体间均无显著差异(P>0.05,表6)。 3 讨论 3.1 DCN基因的遗传多样性分析 为深入探究DCN基因与大白母猪繁殖性状的相关性,本研究通过DNA混池测序技术,在DCN基因中筛查到2个已知的SNPs位点,分别为rs55618082(C/A)、rs346372784(C/T)。通过基因分型技术在大白母猪群中对这两个SNPs进行基因分型。结果发现,2个SNPs位点均处于哈代-温伯格平衡状态,说明该群体未受人工干预选育。rs55618082(C/A)、rs346372784(C/T)位点纯合度均高于杂合度。rs55618082(C/A)位点属于中度多态,rs346372784(C/T)位点属于低度多态。研究报道与微卫星标记相比,SNP的多态性较低,但因为SNP标记丰富且在整个基因组中分布广泛[11],可在一定程度上弥补其相较于微卫星等其他分子标记方法中多态性较低的问题,所以与性状联系密切的SNP可作为重要性状标记辅助选择的标记。 3.2 rs55618082(C/A)位点对大白母猪繁殖性能的影响 研究表明同义突变可以通过改变剪切位点以及mRNA的二级结构等多种机制影响基因的转录和翻译,进而影響其蛋白质的功能,最终引起个体表型发生变化[12-13]。如王思霁[14]发现MYO15A基因c.9861C>T同义突变会导致其mRNA的剪接异常进而引起人耳聋。小鼠IGF-1基因发生c.258A>G同义突变导致其血清中IGF-1分泌水平显著降低[15]。此外,研究发现同义突变可影响RNA二级结构并发生等位基因特异的RNA编辑,从而引起表型的变化[16]。如Sharma[17]发现KRAS基因发生c.30A>C同义突变后KRAS基因mRNA的二级结构从野生型的“Y”状变为突变型的“l”状并增强其mRNA的表达。对此,本研究对DCN基因rs55618082(C/A)位点同义突变前后的mRNA二级结构进行预测,发现突变前后基因mRNA二级结构和自由能均发生改变。通过与大白母猪繁殖性能的进一步关联分析发现rs55618082(C/A)位点对大白母猪的母系指数、繁殖指数、乳头数、妊娠期长、初生重、总仔数EBV、活仔数EBV呈极显著相关(P<0.01)。提示DCN基因rs55618082(C/A)位点对大白母猪繁殖性能相关的影响可能与DCN基因发生同义突变后影响其mRNA稳定性或蛋白翻译效率等相关,但具体的机制有待进一步研究。 3.3 rs346372784(C/T)位点对大白母猪繁殖性能的影响 在人类基因组中,有98%为非编码序列,其中一部分以内含子形式存在[18]。前期研究者认为基因内含子区的序列不编码蛋白质,因此不具备生物学功能,并且不会对生物体造成影响[19]。随着研究的深入,研究工作者逐渐发现基因内含子区域的部分序列也会参与一些生物学进程的调控,使得位于其中的突变会对生物体表型产生影响。如陈君霖[20]发现SLC25A13基因IVS6-11A> G内含子突变可以通过改变剪接方式导致Citrin缺陷病致病突变。王玲芳等[21]发现大白猪TGF-β1基因g.8666_8667delAC位点的内含子突变可以影响母猪的总产仔数。徐梦思等[22]研究表明TGFβRI基因内含子多态性与猪产活仔数显著相关。本研究中发现的rs346372784(C/T)位点位于DCN基因第4内含子区,通过与大白猪群体的繁殖性能的关联分析發现,rs346372784(C/T)位点CC型个体活仔数、繁殖指数、总仔数EBV、活仔数EBV、母系指数与CT型个体或TT型个体呈现显著或极显著相关。合适的样本数量有利于增加获取的遗传标记的可靠性[23],本研究发现大白猪群体中rs346372784(C/T)位点CC基因型频率较小,仅有11头,这可能导致结果存在一定的差异,需要在后期扩大样本容量进行研究。 4 结论 本研究在大白母猪DCN基因中筛查到的2个SNPs(rs346372784(C/T)和rs55618082(C/A))均对大白母猪繁殖性能有显著或极显著影响,有望作为大白母猪繁殖性能的潜在分子遗传标记,为大白母猪分子辅助育种提供参考依据。 参考文献(References) [1] BATBAYAR T, NOMURA Y, ISHII Y, et al. Affinity of placental decorin for collagen[J]. Bioscience Biotechnology And Biochemistry, 2000, 64(11): 2478-2481. [2] CIANFARANI F, DE DOMENICO E, NYSTRM A, et al. Decorin counteracts disease progression in mice with recessive dystrophic epidermolysis bullosa[J]. Matrix Biology, 2019, 81: 3-16. [3] GUBBIOTTI M A, VALLET S D, RICARD-BLUM S,et al. Decorin interacting network: A comprehensive analysis of decorin-binding partners and their versatile functions[J]. Matrix Biology, 2016, 55: 7-21. [4] GOETSCG K P, NIESLER C U. The extracellular matrix regulates the effect of decorin and transforming growth factor beta-2 (TGF-β2) on myoblast migration[J]. Biochemical And Biophysical Research Communications, 2016, 479(2): 351-357. [5] CHUI A, MURTHI P, GUNATILLAKE T,et al.Altered decorin leads to disrupted endothelial cell function: a possible mechanism in the pathogenesis of fetal growth restrictio[J]. Placenta, 2014, 35(8): 596-605. [6] ADAM M, SALLER S, STRBL S, et al.Decorin is a part of the ovarian extracellular matrix in primates and may act as a signaling molecule[J]. Human Reproduction, 2012, 27(11): 3249-3258. [7] PENG J Y, GAO K X, XIN H Y, et al.Molecular cloning, expression analysis, and function of decorin in goat ovarian granulosa cell[J]. Domestic Animal Endocrinology, 2016, 57: 108-116. [8] YAO X, GAO X, BAO Y, et al.lncRNA FDNCR promotes apoptosis of granulosa cells by targeting the miR-543-3p/DCN/TGF-β signaling pathway in Hu sheep[J]. Molecular Therapy-nucleic Acids, 2021, 24: 223-240. [9] 杨菲菲,杨飞,孙义姗,等.饰胶蛋白聚糖对猪卵泡颗粒细胞表型和功能的影响[J].黑龙江畜牧兽医,2021,616(4):35-42,153. YANG F F, YANG F, SUN Y S, et al. Effects of decorin on the phenotype and function of porcine follicular granulosa cells[J]. Heilongjiang Animal Science and Veterinary,2021,616(4):35-42,153. [10] 张琰芳. 母猪繁殖性状相关候选基因多态性及其与产仔数和乳头数的关联分析[D].南宁:广西大学,2020. [11] VIGNAL A, MILAN D, SANCRISTOBAL,et al. A review on SNP and other types of molecular markers and their use in animal genetics[J]. Genetics Selection Evolution, 2002, 34(3): 275-305. [11] YUE G H. Recent advances of genome mapping and marker-assisted selection in aquaculture[J]. Fish Fish, 2014, 15: 376-396. [12] SIMHADRI V L, HAMASAKI K N, LIN BC, et al.Single synonymous mutation in factor IX alters protein properties and underlies haemophilia B[J]. Journal of Medical Genetics, 2017, 54(5): 338-345. [13] NACKLEY A G, SHABALINA S A, TCHIVILEVA I E, et al. Human catechol-O-methyltransferase haplotypes modulate protein expression by altering mRNA secondary structure[J]. Science, 2006, 314(5807): 1930-1933. [14] 王思霁,郭亿莲,钟鸣骏,等.中国人群MYO15A基因同义突变引起剪接异常导致的非综合征型耳聋分析[J].中国临床新医学,2023,16(5):421-426. WANG S J, GUO Y L, ZHONG M J, et al. Analysis of non-syndromic hearing loss caused by splicing abnormalities due to synonymous mutations of MYO15A gene in a Chinese population[J]. Chinese Journal of New Clinical Medicine, 2023,16(5):421-426. [15] 王思瑶. IGF-1 c.258A>G同义突变小鼠模型的构建及其功能解析[D].吉林:吉林大学,2021. WANG S Y. A mouse model construction of IGF-1 c.258A>G synonymous mutantion and its function analysis[D]. Jilin University,2021. [16] ZHOU Z Y, HU Y, LI A,et al. Genome wide analyses uncover allele-specific RNA editing in human and mouse[J]. Nucleic Acids Research, 2018, 46(17): 8888-8897. [17] SHARMA Y, MILADI M, DUKARE S, et al. A pan-cancer analysis of synonymous mutations[J]. Nature Communications, 2019, 10(1): 2569-2582. [18] XU J,XU W,YANG X,et al. LncRNA HCG11/miR-579-3p/MDM2 axis modulates malignant biological properties in pancreatic carcinoma via Notch/Hes1 signaling pathway[J]. Aging-us, 2021,13 (12):16471-16484. [19] 唐馨,茍萍.内含子的功能[J].生命的化学,2019,39(4):772-777. TANG X, GOU P. The introns function[J]. Chemistry of Life,2019,39(4):772-777. [20] 陈君霖,李海清,刘妍霖,等.人SLC25A13基因内含子突变IVS6-11A>G导致转录子剪接异常[J].暨南大学学报(自然科学与医学版),2018,39(5):369-375. CHEN J L, LI H Q, LIU Y L, et al. The mutation of IVS6-11A>G within human SLC25A13 gene leads to abnormal transcriptional splicing[J]. Journal of Jinan University (Natural Science and Medicine Edition),2018,39(5):369-375. [21] 王玲芳,李尚来,李琦琦,等.TGF-β1基因g.8666_8667delAC位点突变与大白猪繁殖性能的关系[J].南京农业大学学报,2022,45(2):351-358. WANG L F, LI S L, LI Q Q, et al. Relationship between mutation g.8666_8667delAC of TGF-β1 gene and reproductive performances in the large white pig population[J]. Journal of Nanjing Agricultural University,2022,45(2):351-358. [22] 徐梦思,黄涛,马亮,等.猪TGFβ1和TGFβRⅠ基因多态性与产活仔数的关联分析[J].江苏农业科学,2016,44(2):38-41. XU M S, HUANG T A, MA L, et al. Analysis of the association between polymorphisms of porcine TGFβ1 and TGFβRⅠ genes and the number of live piglets produced. Jiangsu Agricultural Science,2016,44(2):38-41. [23] 白莹,张清阳,韩海银,等.猪PPARGC1A基因多态性与生长性状的关联分析及其表达[J].畜牧与兽医,2020,52(11):1-6. BAI Y, ZHANG Q H, HAN H Y, et al.Association of polymorphisms of PPARGC1A with growth traits and its expression in pig breeds[J].Animal Husbandry and Veterinary Medicine,2020,52(11):1-6.(责任编辑:编辑唐慧)

