组蛋白乙酰化/甲基化在口腔疾病中的研究进展
罗煜川, 李飞飞, 余钒源, 尹贝, 叶玲
口腔疾病防治全国重点实验室 国家口腔医学中心 国家口腔疾病临床医学研究中心 四川大学华西口腔医院牙体牙髓科,四川 成都(610041)
在真核细胞中,DNA 常以染色质的形式存在。染色质的基本单位为核小体,由147 bp 的DNA 分子包绕四种核心组蛋白(H2A、H2B、H3、H4)组成的八聚体而构成。染色质的结构并非一成不变,而是会响应相应的信号进行动态调节。组蛋白乙酰化和甲基化修饰在这种调节中起关键作用。组蛋白的乙酰化和甲基化修饰依赖于各种酶及蛋白复合体对组蛋白进行翻译后修饰(posttranslational modifications,PTMs),而这些修饰能够影响染色质结构,进而在不改变DNA 序列的情况下调控DNA转录和细胞生物学活动。伴随着高通量蛋白组学的发展,对于组蛋白修饰的研究逐渐深入,组蛋白修饰与多种疾病的关系也逐渐被揭晓[1]。本文将聚焦组蛋白乙酰化修饰与甲基化修饰与口腔多种疾病的关系,以及目前针对这两种组蛋白修饰开发的药物在口腔颌面部疾病中的应用进行综述,为后续口腔疾病的病因探索与治疗提供新思路。
1 组蛋白乙酰化与甲基化修饰
1.1 组蛋白乙酰化修饰
组蛋白乙酰化是由组蛋白乙酰转移酶(histone acetyltransferases,HATs)和组蛋白去乙酰化酶(histone deacetylases,HDACs)动态调控的组蛋白PTM。HATs 以乙酰辅酶A(CoA)为供体,在组蛋白的赖氨酸残基加上乙酰基,能够改变染色质构象,有助于转录调节蛋白接近DNA。组蛋白乙酰化主要通过两种方式促进转录,一是能直接或间接地改变染色质构象,增加转录子的可及性;二是乙酰化的组蛋白能募集多种效应蛋白以促进转录,包括含溴结构域蛋白(BRD)和转录起始因子TFIID 亚基1(TAF1)等[2]。根据HATs 的功能域结构,又可以将其分为五种,包括GCN5 相关N-乙酰基转移酶家族、MYST 家族、p300/CBP、TAF250、类固醇受体辅激活蛋白家族[2-3]。HDACs 能够将组蛋白去乙酰化,发挥着与HATs 相反的作用。HDAC1 是最早发现,也是研究最多的组蛋白去乙酰化酶。与HDAC1 序列同源性最高的称为Ⅰ类HDAC,包括HDAC1、2、3、8;Ⅱ类包括HDAC4、5、6、7、9 和10;Ⅳ类HDAC 目前仅发现了一种,即HDAC11。Ⅰ类、Ⅱ类和Ⅳ类都是锌依赖性的[4]。Ⅲ类HDACs 又称Sirtuins,与锌依赖的HDACs 不同,其只能在NAD+存在的情况下发挥作用[5]。除了HDACs 和HATs,组蛋白的乙酰化还受到代谢的影响。例如HATs的乙酰基供体乙酰CoA 的水平升高,组蛋白乙酰化水平也将随之上升[6]。Sirtuins(SIRTs)蛋白的活性需要NAD+的参与,NAD+及相关代谢物的细胞生物利用度会影响SIRTs 活性,进而影响组蛋白去乙酰化[7]。
1.2 组蛋白甲基化修饰
组蛋白不同位点的不同程度甲基化将对染色质结构和DNA 转录产生不同的影响。H3K4,H3K36 和H3K79 的双、三甲基化与基因激活有关,H3K9 和H3K27 甲基化则通常与抑制基因有关[8]。基因转录的激活或抑制有赖于组蛋白修饰的“阅读器”,即效应蛋白的参与。效应蛋白能识别组蛋白甲基化并将相关信息传递到下游事件,以调控基因表达的关键因素。例如,ATP 依赖的染色质域解旋酶DNA 结合蛋白1(CHD1)通过其两个N 端染色质结构域识别H3K4me2 和H3K4me3 响应组蛋白甲基化,改变染色质构象,打开局部染色质结构,促进DNA 转录[9]。
组蛋白的赖氨酸甲基化是一个动态变化的过程,由组蛋白赖氨酸甲基转移酶(histone lysine methyltransferases,HKMTs)催化,并被赖氨酸去甲基化酶(lysine demethylases,KDM)去除[10]。目前发现的HKMTs 中,可以根据其甲基转移酶活性的结构域分为两大类:一类是含SET 结构域HKMTs,包括EZH2(Enhancer of zeste homolog 2),SET 和MYND 结构域蛋白3(SMYD3),SETD1B(SET domain containing 1B)等,另一类是不含SET 结构域的DOT1L 组蛋白甲基转移酶,仅负责H3K79 的甲基化修饰[11]。组蛋白赖氨酸去甲基化酶根据其结构也可以分为两大类,一类是赖氨酸特异性去甲基化酶(lysine-specific demethylase ,LSD,包括LSD1和2),其仅能使单、双甲基化的赖氨酸去甲基化;另一类是含jumonji结构域的去甲基化酶,如KDM2B(Lysine demethylase 2B),KDM6B(Lysine demethylase 6B)等[11]。另外,组蛋白甲基转移酶的甲基供体S-腺苷甲硫氨酸的水平也可以影响组蛋白甲基化的水平[12]。
2 组蛋白乙酰化/甲基化修饰与口腔颌面部疾病
2.1 组蛋白乙酰化/甲基化修饰与口腔颌面部发育相关疾病
组蛋白乙酰化/甲基化修饰参与调控口腔颌面部重要器官——牙的发育。在成牙本质细胞分化的过程中,HDAC3 降低,而p300 升高,相应位点的H3K9ac 和H3K27ac 升 高[13]。有 研 究 发 现,使 用HDAC 抑制剂能够促进牙髓干细胞(dental pulp stem cell,DPSCs)相关成骨基质的表达[14]。此外,在DPSCs 分化过程中起关键调控作用的转录因子也有可能与组蛋白乙酰化相互作用,调控DPSCs分化。例如KLF4(Krüppel-like factor 4)可以通过与牙本质基质蛋白1(dentin matrix protein 1,DMP1)和Sp7 的启动子结合以及在成牙本质细胞分化的不同阶段在DMP1 和Sp7 的启动子处募集P300 或HDAC3,参与牙本质形成[15]。在成釉细胞系中,氟化物能够增强p300 的活性,使P53 基因处发生组蛋白乙酰化,造成成釉细胞的生长抑制[16]。而在牙囊细胞中条件性的敲除HDAC4,将会影响小鼠牙根发育,使小鼠牙根明显变短[17]。
定向为成牙谱系的神经嵴细胞在牙本质涎磷蛋白(dentin sialophosphoprotein,DSPP)基因和牙本质基质蛋白1(dentin matrix protein 1,DMP1)基因启动子上有H3K27 三甲基化修饰,而当成牙谱系的细胞向牙髓祖细胞定向时,H3K27me3 下降,DSPP 与DMP1 表达[18]。EZH2 通过调控β-catenin启动子上的H3K27me3 水平,下调Wnt/β-catenin 信号通路,在人牙髓细胞矿化过程中起负向调控作用[19]。将人骨肉瘤细胞系暴露于氟会导致EZH2升高,在转换生长因子β 受体2(transforming growth factor beta receptor Ⅱ,TGFBR2)和SMAD3 启动子处H3K9 三甲基化水平异常升高,进而使一系列成骨、成软骨、胶原相关的基因表达下调,这提示氟牙症可能是由于氟影响了牙齿发育过程中正常的组蛋白修饰[20]。在小鼠磨牙牙胚的发育过程中也出现了KMT2D 的有序表达,且研究发现KMT2D可能通过经典Wnt/β-catenin 信号通路影响成牙本质细胞的增殖和分化[21]。KMT2D 突变导致的歌舞伎综合征所伴随的牙数目、形态异常可能与此相关[22]。KDM5A 则能够下调成牙本质分化相关基因处的H3K4me3,抑制DPSCs 牙源性分化[23]。牙根的发育也与组蛋白甲基化相关,在小鼠中敲除EZH2 将导致小鼠上皮根鞘发育受损,无法正常地形成磨牙牙根[24]。
2.2 组蛋白乙酰化/甲基化修饰与口腔颌面部炎症性疾病
大量研究表明组蛋白乙酰化/甲基化在多种炎症相关的疾病中参与调控[25]。在口腔颌面部的炎症性疾病——牙周炎中,有研究表明,相较于正常的牙龈组织,牙周炎患者的牙龈组织中HADC1 的表达上升,这种上升与聚集组织内表达肿瘤坏死因子的细胞有关[26]。牙龈假单胞菌的脂多糖(lipopolysaccharide,LPS)可导致人牙龈上皮细胞中p300/CBP 的激活和核因子-κB(NF-κB)的积累进而导致H3K9 乙酰化水平的快速升高[26]。炎症微环境下,组蛋白乙酰转移酶GCN5 表达下降,在DKK1(Dickkopf-1)启动子处H3K9 和H3K14 乙酰化降低,DKK1 表达下降,从而激活Wnt/β-catenin 通路,最终抑制PDLSCs 的成骨分化[27]。在LPS 刺激下,牙周膜细胞中能观察到成骨相关基因启动子处的H3K27 发生三甲基化修饰以及炎症介质启动子处H3K4 发生三甲基化修饰[28]。LPS 诱导牙周膜细胞中SETD1B 表达上调,增加IL6 和IL1B 基因的启动子处H3K4me3 水平,促进IL6 和IL1B 基因转录[29]。在牙髓炎的相关研究中,SIRT6 可能是牙髓炎的负调控因子,能够通过抑制TRPV1 活性抑制牙髓细胞的促炎因子的表达,负性调控牙髓炎[30]。EZH2与H3K27me3 在炎症牙髓组织和牙髓细胞中减少而KDM6B 表达增加,抑制EZH2 可抑制炎症刺激导致的人牙髓细胞中IL-1b,IL-6 和IL-8 的表达[31]。
2.3 组蛋白乙酰化和甲基化修饰与口腔颌面部肿瘤
口腔颌面部肿瘤的发生常常会有各种诱因导致多种遗传和表观遗传改变[32],有数据表明相较于正常的口腔角质形成细胞,口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)细胞的HDACs表达上升[33],HDACs 增加或HATs 活性降低而导致的基因表达异常与OSCC 患者的侵袭性和不良预后相关[34]。HDAC1 在OSCC 组织和细胞中过表达,并可以通过调控miR-154-5p/PCNA 信号来促进OSCC 的生长和进展[35],并通过在热休克蛋白β7(HSPβ7)启动子处去乙酰化组蛋白,抑制其表达,进而促进OSCC 增殖[33]。也有研究报道,过表达HDAC2 可增强缺氧诱导因子1α(HIF-1α)蛋白的稳定性,增加OSCC 侵袭和迁移能力[36]。TGF-β1能促进CBP 介导的整合素β6(ITGB6)启动子处的组蛋白H3 和H4 高乙酰化,以及募集RNA 聚合酶Ⅱ到ITGB6 启动子,促进转录因子与ITGB6 启动子的结合,进而增强OSCC 细胞的侵袭性[37]。
同样地,异常的组蛋白甲基化与肿瘤发生发展也有关[38]。研究发现一系列参与调控OSCC 细胞的生长、存活和迁移的基因存在异常组蛋白甲基化[36]。组蛋白甲基转移酶SMYD3 能够通过增加高迁移率族蛋白A2 基因(HMGA2)的启动子H3K4me3 来增强HMGA2 的转录,推动OSCC 的发生[39]。信号转导及转录激活因子3(STAT3)在OSCC 中高表达,有研究发现其能通过信号转导增加组织中EZH2 的表达,而EZH2 表达增加又反过来增加STAT3 的表达,二者相互作用,促进OSCC 的侵袭[40]。长链非编码RNA—MRPL23-AS1 能聚集EZH2,使上皮性钙黏蛋白基因启动子处组蛋白发生H3K27me3,抑制其表达,进而促进腺样囊性癌(adenoid cystic carcinoma,ACC)的肺部转移[41]。抑制LSD1 功能将从表观遗传的途径减弱口腔癌的生长和转移[42]。此外,在唾液腺肿瘤中,组蛋白H3K9 乙酰化和甲基化水平异常升高可能与实体型ACC 预后不良有密切关系,高水平的H3K9 三甲基化可能与黏液表皮样癌(mucoepidermoid carcinoma,MEC)的高度侵袭性特征相关[43]。
3 基于组蛋白乙酰化/甲基化修饰的药物开发
3.1 靶向组蛋白乙酰转移酶/去乙酰化酶的药物
靶向组蛋白去乙酰化酶催化域的去乙酰化酶抑 制 剂(HDAC inhibitor,HDACI)——伏 立 诺 他(Vorinostat,suberoylanilide hydroxamic acid,SAHA)在2006 年被FDA 批准用于治疗皮肤T 细胞淋巴瘤[44]。SAHA 在唾液腺肿瘤ACC 中进行了二期临床试验,但是ACC 对于SAHA 的响应非常有限[45]。虽然单药效果有限,但SAHA 搭配其他抗癌药物一同使用能在OSCC 治疗中发挥更强的抗癌效果[46]。此外,在牙髓炎的相关研究中,SAHA 既能够抑制炎症的相关细胞因子的分泌,还能促进成牙本质细胞分化并形成牙本质相关基质[47]。
曲古抑菌素A(Trichostatin A,TSA)作为HDACI能够通过调节细胞周期调节因子和凋亡调节蛋白的表达来抑制OSCC 细胞生长和诱导细胞凋亡[48],此外研究发现TSA 促进人牙髓干细胞增殖和成牙本质分化,促进成牙本质的形成[13]。
恩替诺特(Entinostat)作为HDACI 展现出了对OSCC 增殖的抑制作用,能触发氧自由基的产生并诱导细胞凋亡[49]。此外,另一种HDACI——Quisinostat 在实验中证明能上调细胞凋亡相关蛋白的表达,下调细胞增殖相关蛋白的表达,抑制舌癌细胞的生长,诱导其凋亡[50]。西达本胺(Chidamide)能阻滞细胞周期在G2/M 期,有效抑制ACC 细胞的生长和增殖[51]。
3.2 靶向组蛋白甲基转移酶/去甲基化酶的药物
针对EZH2 的抑制剂——他泽斯他(Tazemetostat,EPZ6438)已被FDA 批准用于成人和青少年局部晚期或转移性上皮样肉瘤,但其单独在口腔颌面部疾病中的应用尚无报道,与pembrolizumab 联合用于HNSCC 正在进行二期临床试验[52]。另一种靶向EZH2 的小分子抑制剂DZNep,在动物实验中已证明能减缓舌癌异种移植瘤的生长,与组蛋白去乙酰酶抑制剂合用能增强其对OSCC 细胞的毒性[53]。另外有研究发现即使在炎症环境下,DZNep能够通过抑制EZH2 功能促进牙周膜干细胞的成骨向分化,展现出用于牙周炎治疗的潜力[54]。研究者还开发了针对LSD的小分子抑制剂,如GSK-LSD1。在口腔颌面部肿瘤中,有研究表明GSK-LSD1 能抑制OSCC 侵袭相关基因的表达[55]。
3.3 其他
除了上述提到的直接作用于组蛋白乙酰化/甲基化修饰酶的药物外,JQ1 作为BRD4 抑制剂,作用于阅读蛋白BRD4,能够升高MMP2 基因处的H3K27ac,进而抑制OSCC 细胞系在体内的增殖、迁移和侵袭[56]。此外,JQ1 还展现出了抗炎能力,在小鼠牙周炎模型中,全身给予JQ1 显著抑制了病变牙龈组织中炎症细胞因子的表达[57]。烟酰胺属于维生素B族,同时也是Ⅲ类组蛋白去乙酰化酶的抑制剂,能够通过恢复破骨细胞生成,明显改善Runx2+/-颅骨锁骨发育不良综合征小鼠中的延迟出牙[58]。
4 总结与展望
组蛋白乙酰化/甲基化修饰的异常在口腔颌面部疾病的发生发展都发挥着重要作用。随着对组蛋白乙酰化/甲基化修饰研究的深入,靶向组蛋白修饰的药物在口腔颌面部疾病的治疗中展现出了巨大潜能。但是许多生物学过程所涉及的组蛋白修饰并非单一的某种修饰的升高或降低,这给针对组蛋白PTMs 的药物的疗效带来了不确定性以及脱靶效应。因此相较于将基于组蛋白乙酰化/甲基化修饰的药物应用于口腔颌面部疾病临床治疗,研究者们更多的是将各种小分子抑制剂用于实验室研究中,以探明组蛋白乙酰化/甲基化修饰在口腔颌面部疾病发生发展中可能的机制(图1)。高通量测序的运用将大大推进对组蛋白修饰与基因、疾病之间关系的研究,有助于靶向组蛋白乙酰化/甲基化修饰治疗的安全性和有效性提高。
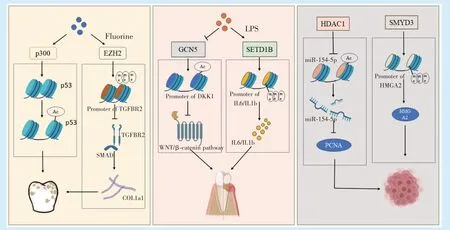
图1 组蛋白乙酰化/甲基化参与口腔疾病发生发展的机制Figure 1 Mechanisms of histone acetylation/methylation involved in oral diseases
【Author contributions】Luo YC conceptualized and wrote the article. Li FF, Yu FY and Yin B collected the references and revised the article. Ye L conceptualized and reviewed the article. All authors read and approved the final manuscript as submitted.

