从物质导电情境看学科融合
邓熠


【摘要】好的微观想象力会帮助学生理解物理和化学中的很多知识.关于物质的导电性,有很多有意思的问题:为什么有的物质能导电,有的物质不能导电,在导电过程中物体为什么会发热,超导体又是什么,化学中的电解过程又是怎么发生的.这些问题理解起来却不简单,因为电的活动看不见摸不着.此时,学生必须发挥对微观世界的想象力,能将微观的运动和变化展现在自己的脑海里,就会对导电有更好的理解.
【关键词】高中物理;导电;带电粒子
1 原子模型
对电的理解要从微观的原子开始.任何物体,无论形态,都是由分子和原子构成的,归根结底都是由原子构成.原子的英文atom出自希腊文“atomos”,意思是不可分割的东西.但通过一系列的实验,人们发现原子也是可以分割的,它由更小的粒子构成[1].
一般认为,原子是由一个原子核和核外运行的数量不等的电子构成(电子在核外不存在一个确定的轨道,它们只是以不同的概率出现在不同的位置,被称为电子云).原子核很小,其直径约为原子直径的100000分之一,原子核相对于原子就如同一个体育场中的小弹珠.1909~1911年,英国物理学家欧内斯特·卢瑟福(Ernest Rutherford)和他的合作者们做了以α粒子(氦核)轰击金箔的实验.他们发现绝大部分α粒子穿过金箔,打到对面的荧光屏上产生闪光,但有极少的氦核被反弹了回去.他们由此认为原子里面大部分是空的,有一小部分有很大的质量,足以把氦核弹回去[2].
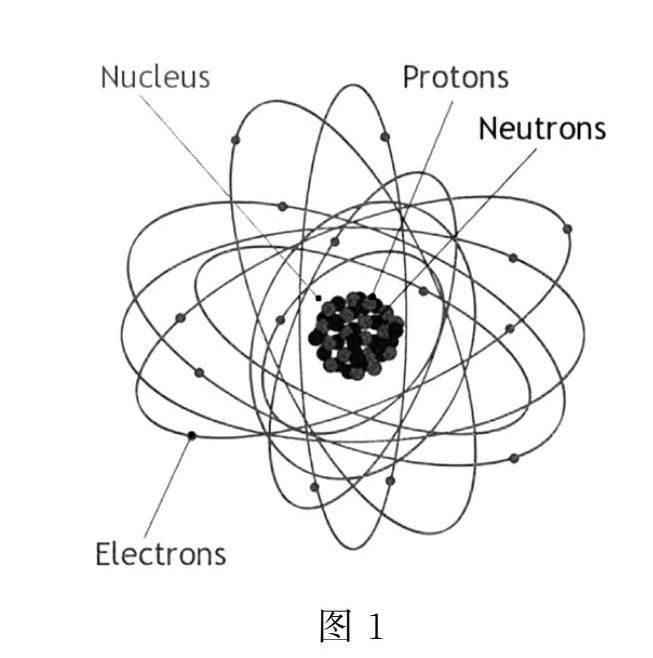
原子核由若干质子和中子构成,它们又称为核子(图1).它们的质量差不多,是一个电子的1800倍,原子的质量几乎都集中在原子核.质子带一个单位正电荷,中子不带电.我们知道,同性电荷相互排斥,在原子核范围内,电荷之间的库仑力要比万有引力强很多,靠万有引力是无法将核子们聚集在一起的,这时候有一个大家可能没有听说的力——强相互作用力,这个力作用范围很小但强度很大,它只在原子核内起作用,能把核子(质子和中子)黏合在一起而不分崩离析[3].原子核中一定有质子,质子的数量很关键,它决定了元素的类型以及相关的化学性质.原子核中是可以没有中子的,例如,氢元素有三种同位素:氕、氘、氚,它们的原子中,质子数都是1,电子数也都是1,但中子数分别为0、1、2.地球上的绝大部分氢元素为氕,约占99.98%.而常用在原子核反应堆中的重水分子中与氧原子结合的是氘原子.
2 电流的形成
质子和电子分别带正电和负电,这是所有电现象的根源.原子含有同样数量的质子和电子,所以表现为电中性.电子带负电,而原子核带正电,异种电荷相互吸引,电子就被核束缚住了.倘若束缚强度不大,电子就可以跑很远,甚至在一些情况下跑到别的核那儿或者四处游荡;倘若核的束缚力很大,不仅自己的电子跑不远,可能连别的原子的电子都要抢过来.失去了电子或者俘获了别的电子后,整体就不是中性的原子了,而是带电的离子.两种不同的物质相互摩擦,接触面的原子核对附近的电子展开抢夺大战,抢赢了,就带负电,如毛皮摩擦过的橡胶棒;抢输了,就丢了电子带正电,如丝绸摩擦过的玻璃棒.当然,摩擦生电的实际原因要复杂很多[4],如此想象一下可以获得粗浅的理解,知道电荷并没有被创生,而只是转移.
有的原子核对自己的电子束缚能力低,如固体金属中,一些电子就能四处游荡成为自由电子,此时金属阳离子通过金属键网络形成一个不能移动的骨架(它们会在平衡位置附近振动).没有电场的时候,电子各个方向乱跑乱碰,不能形成电流[5].加上電场后,自由电子们就像听到并服从一个号令,开始朝一个方向运动而形成电流(因为带负电,电子的运动方向与电流方向相反).这些电子在运动时可能偶然撞上晶格,就把部分能量传递给晶格,使得后者振动加剧,这可以作为通电导线温度升高的一个解释.而温度升高时,电子在电场力的驱动下定向运动的效果变差,一是电子的无规则运动加剧;二是晶格振动加剧更容易碰上电子而阻碍其定向运动,使得导电性能减弱.相反,如果让温度降低,晶格振动减少,自由电子移动起来不易发生碰撞,金属的导电性能会增加.有时,当温度降到一定程度,如水银在-269.03℃时,自由电子通行无阻,产生超导现象.
非金属则不同,这些单质或者化合物中的电子被原子核们看的牢牢的,即使有外电场作用也不容易跑掉,不能形成电流,所以非金属往往是绝缘体.除非电场太强撕碎了原来的原子分子结构,形成可以移动的离子——一定强度的高压电是可以击穿某些绝缘体的.
除了自由电子定向移动导电外,正的带电粒子和带负电的粒子形成大尺度的不一致时,会在宏观上表现为电流.太阳向宇宙抛射出很多有正有负的带电粒子(等离子体),如果正负电荷流量一样,则它们综合起来不表现出电流,但在地球附近受到地磁的作用下,特别是赤道等低纬度部分,不同电荷受到不同方向的力(都是洛伦兹力),带正电的从地球的一边绕行,带负电的另一边绕行,就会形成两股不同的电流(图2).而高纬度部分受洛伦兹力影响小,带电粒子会打到大气层分子发生反应,产生绚烂的极光[6].
熔融的金属能导电吗?通上电的时候,看起来不仅电子可以跑动,金属阳离子似乎也可以跑动(如果能跑,在同一个电场下它们会朝相反的方向跑),但即使那样后者的运动是不可持续的,金属阳离子不能通过导线跑掉,所以导电作用的仍然是自由电子.加上热运动的阻碍作用,熔融金属即使能导电性能一般会下降(大家可以思考一下金属蒸汽会导电吗).
食盐(氯化钠)不一样,常温常压下,氯化钠是晶体,Cl-和Na+按晶格的形式固定,在平衡位置附近振动(热运动),它们不能自由移动,所以不导电.但真空中熔融的氯化钠→晶格被破坏,Cl-和Na+可以移动,若插入两个惰性电极加上电压通上电,在电场力的作用下:Cl-朝正极移动,Na+朝负极移动,就可以导电了.
3 电流下的化学反应
继续讨论真空状态下加热熔化氯化钠通电的情况,这个时候不仅有物理变化,还有化学变化[7].在电场力的作用下:Cl-朝正极移动,在正极失去电子变为氯原子.氯原子是不稳定的,它们觉得自己的电子不够,总想把别人的抢过来,但它周围都是氯原子,怎么办?两个氯原子协商每个原子拿出一个电子作为共享,就会感觉自己周围又多了一个电子.因为共享一对电子,两个氯原子被结合在一起,成为氯分子,形成氯气从熔融的浆体释放出来;Na+朝负极移动,在负极得到电子,得到金属钠.化学反应为2NaCl 熔融,通电 2NaCl2↑.
如果把食盐放到水里溶解再通上电,情况又会不一样.食盐在水里会溶解,晶格被破坏后电离出Cl-和Na+(图3);除了Cl-和Na+,微观的粒子还有大量的水分子和少量的由水分子电离生成的OH-,H+.H2O很稳定不容易电离,而OH-和H+一旦碰上就很容易变成了H2O,这是一个平衡过程H2OH++OH-.标准状态下的水溶液中,无论酸性还是碱性,氢离子的浓度和氢氧根粒子的浓度的乘积是一定的(浓度的乘积对应着碰撞概率,即可能性),为10-14mol/L2.化学反应都是平衡过程,如果生成物不断被排除出系统,例如气体、沉淀,甚至人为地去除,就不容易达到平衡而某个方向的反应不断进行下去.
对氯化钠溶液通上电,溶液中的带电粒子就定向移动了,OH-和Cl-带负电它们往正极跑,H+和Na+例子带正电它们往负极跑.这个定向移动可以持续以维持电流.正极处,Cl-比OH-容易失去电子,就生成氯气从溶液跑了出来(先生成原子,然后两个氯原子共享电子形成氯分子);负极处,H+比Na+容易得到电子,就生成氢气从溶液跑了出来(先生成氢原子,然后两个原子通过共享一对电子结合为氢分子);溶液中剩下的微小粒子是OH-和Na+,停止通电烘干就会得到白色的晶体粉末——氢氧化钠.化学方程式2NaCl+2H2O熔融,通电2NaOH+H2↑+Cl2↑.如果继续电解Cl-消耗殆尽,这个时候在正极就只好OH-来失去电子了,最后变成水和氧气,化学反应4OH-+4e→2H2O+O2↑,负极仍然是会有源源不断的H+来得到电子变成氢气.现在实际上是在电解水2H2O通电2H2↑+O2↑.
4 结语
微观想象力会为学生的物理和化学的学习打开一个有趣有效的大门,即使有些想象比较简单,真实情况要复杂得多,但这可以作为深入讨论那些疑问的开始.
参考文献:
[1]徐敏姬,王伟群.融合科学阅读发展學科素养——以“人类对原子结构的认识”为例[J].化学教与学,2022(07):2-7.
[2]王卫东.纪念卢瑟福提出原子有核模型100周年[J].物理通报,2011(09):110-114.
[3]曲秀荣.在中学物理教学中教师应注意知识的准确性与延伸性[J].中国科教创新导刊,2008(05):169.
[4]李川.多种起电成因的综述与讨论[J].物理教学,2019,41(08):21-23+43.
[5]蒋炜波,赵坚.对与自由电子相关联的一些问题的梳理及教学建议——以金属导体为例[J].物理通报,2021(11):140-145.
[6]杨桦,张艳,孟卫东.太阳风能吹到地球上吗[J].高中数理化,2011(01):27-28+66.
[7]喻俊,沈甸.水参与的电解反应体系中“电极反应式书写形式”再议[J].化学教育,2017,38(01):78-80.

