蓝莓花色苷聚电解质复合物制备及降脂活性比较
尹朝春,李环通,许泽文,陈丹妮,王赛男,肖苏尧*
(1.华南农业大学食品学院,广东省功能食品活性物重点实验室,广东广州 510642)(2.广东茂名农林科技职业学院食品工程系,广东茂名 525024)(3.华润怡宝饮料(中国)有限公司,广东深圳 518055)
蓝莓花色苷(Blueberry Anthocyanin,BBA)具有包括抗氧化、降脂、降血糖、抗炎、促进益生菌增殖、抗肿瘤、保护视网膜等多种生物活性,在保健食品开发、化妆品行业具有广阔的应用前景[1]。然而,花色苷是一类极不稳定的物质,对pH、温度、光照较为敏感[2],易受到氧化剂、酶、金属离子等因素的破坏,而且,花色苷的亲水性极强,在胃肠道的吸收低,从而导致其在机体的生物利用度降低。为了提高花色苷的稳定性,目前的研究采用了多种方法,例如分子改性、添加辅色物质、微胶囊化、生物大分子复合等[3]。
生物大分子复合是指花色苷与蛋白质、多糖等大分子发生相互络合,形成复合物,提高花色苷的稳定性。蛋白质、多糖、多肽等结构复杂的生物大分子,利用带相反电荷的聚电解质之间的静电作用,可以在溶液中缔合形成具有三维大分子结构的复合聚电解质(Polyelectrolyte Complex,PEC),聚电解质复合物因其无毒且具有良好的耐受性而受到广泛关注[4],大量研究表明聚电解质复合物能够达到提升花色苷的稳定性,并且能够实现靶向缓释[5]。
大豆分离蛋白(Soy Protein Isolation,SPI)营养丰富、安全无毒,已广泛用于食品工业中,是潜在的聚阳离子材料。SPI 在等电点以下带正电,能够与阴离子聚电解质相互作用。阿拉伯树胶(Arabic Gum,AG)是一种带负电的无毒的生物大分子,主要作为聚电解质复合物壁材[8]。本文在上述参考文献的理论和技术基础上,通过SPI 和AG 以静电自组装的方式负载蓝莓花色苷,旨在通过聚电解质体系来提升蓝莓花色苷稳定性,并且研究探讨复合物作用于经油酸诱导的HepG2 脂质模型的降脂作用,为聚电解质复合物提高天然活性物功能活性提供理论依据。
1 材料与方法
1.1 材料与试剂
蓝莓花色苷由本实验室提取[9]。
人肝癌细胞株HepG2 购买于生工生物工程(上海)股份有限公司。
大豆分离蛋白(SPI)、阿拉伯树胶粉(AG)、噻唑蓝(MTT)、油红O 试剂盒、油酸,上海源叶生物科技有限公司;PBS、DMEM 高糖培养基、胎牛血清、胰酶、链霉素青霉素,美国Gibco 公司;BCA、TG、TC、SOD、MDA 试剂盒,南京建成生物工程研究所;其他化学试剂均为国产分析纯。
1.2 仪器与设备
Enspire2300 多功能酶标仪,美国PE 公司;Sentinel Gold 生物安全柜、CCL-170B-8 二氧化碳培养箱,新加坡艺思高科技有限公司;BDS 200 倒置显微镜,重庆奥特光学仪器有限公司;JY 92-IID超声波细胞粉碎机,宁波新芝生物科技股份有限公司;Centrifuge 5415 R 通用台式冷冻离心机,德国Eppendorf 公司;EVO MA 15 扫描式电子显微镜,ZEISS 公司;Vertex 70 傅立叶变换红外光谱仪,布鲁克公司;Mastersizer 3000 激光粒度分析仪、Zatasizer Nano ZS 90 纳米粒度及ZETA 电位分析仪,英国Malvern 公司;LS-50HG 立式压力蒸汽灭菌器,江阴滨江医疗设备有限公司。
1.3 实验方法
1.3.1 SPI/AG-BBA 复合物的制备
本文通过研究超声功率、壁芯质量比(SPI:BBA)、壁材质量比(SPI:AG)、包埋时间等4 个因素来筛选出最适聚电解质制备工艺。配制一定质量浓度的预热处理SPI 溶液和AG 溶液,将体系调到pH 值3.0。将10 mL 质量浓度为10 mg/mL的预热处理后SPI 溶液置于烧杯中,调整变幅杆高度直至深入液面以下,加入BBA,不同功率下进行20 min 的超声波处理,总处理时长为20 min(超声设置为工作时间3 s,间歇时间3 s,超声破碎仪总功率为900 W)。取出烧杯,在700 r/min 条件下磁力搅拌,逐滴加入不同体积的质量浓度为10 mg/mL的AG 溶液,继续搅拌一定时间制备得到SPI/AGBBA 复合物(下文简称复合物)。
1.3.2 包埋率测定
吸取适量制备好的复合物装入超滤离心管中,相对离心力15 000×g,4 ℃条件下离心20 min,取下清液采用pH 示差法测花色苷含量。
式中:
X——包埋率,%;
w1——总投入花色苷质量,mg;
w2——离心后下清液中花色苷质量,mg。
1.3.3 SPI/AG-BBA 复合物的表征
1.3.3.1 平均粒径、ζ-电位测定
利用纳米粒径及Zeta 电位分析仪,将样品液稀释到合适倍数后,取适量加入样品池中,用动态光散射法测定复合物的平均粒径和多分散系数。通过电位池测定样品通电后的电泳迁移率,计算聚电解质复合物的表面ζ-电位。室温25 ℃,各样品平行测定3 次。
1.3.3.2 BBA 的荧光淬灭特性
称取1.00 g 大豆分离蛋白粉末于烧杯中,加入100 mL 蒸馏水,水浴磁力搅拌80 ℃、30 min 至完全溶解,得到质量浓度为10 mg/mL 的预热处理的大豆分离蛋白溶液,使用盐酸溶液、氢氧化钠溶液将体系调到pH 值3.0。用pH 值3.0 的蒸馏水将大豆分离蛋白溶液稀释成0.5 mg/mL 的工作液,用蒸馏水配制质量浓度梯度为0、0.25、0.5、1、2 和4 μg/mL 的花色苷工作液。将SPI 工作液与各质量浓度的花色苷工作液按体积比1:1 的比例混合,震荡混合后置于室温孵育30 min,以蒸馏水为空白,记录并扣除响应化合物的荧光值。使用激发光谱,荧光激发波长设置为280 nm,发射波长范围设置为300~450 nm,激发及发射狭缝均设置为5 nm。
1.3.3.3 扫描电镜
使用钨光扫描电子显微镜微胶囊的微观结构观察,表面镀金后用扫描电镜观察微胶囊的外观形态。
1.3.3.4 傅里叶红外
采用傅立叶变换红外光谱仪对SPI/AG/BBA聚电解质复合物冷冻干燥样品进行分析。取样品与KBr 经过研钵研细后用压片机制得透明样品薄片,以空白KBr 薄片来调整基线水平并对差异化光谱进行归一化处理,以空气为参比,测定波段为4 000~500 cm-1,扫描次数设置为16 次。
1.3.4 体外模拟缓释
在体外模拟胃液和模拟肠液中观察花色苷的释放,分别将相同质量浓度花色苷的游离花色苷和SPI/AG-BBA 复合物装入已活化好的3.5 ku 纤维素透析袋中置于烧杯,向烧杯中加入足量的pH 值1.2的0.2% NaCl 模拟胃液和pH 值6.8 的50 mmol/L 的PBS,于37 ℃下恒温磁力搅拌。在0、0.5、1、2、4、6、8、10、12 h 时取样测定花色苷含量,每次取样后向烧杯中补充同等体积的模拟胃液和模拟肠液[10]。
式中:
C——花色苷释放率,%;
wt——t时刻花色苷累计释放量,mg;
w0——花色苷初始质量,mg。
1.3.5 SPI/AG-BBA 复合物体外降脂活性
1.3.5.1 HepG2 细胞培养
细胞培养参考刘畅等[11]的方法,HepG2 细胞用含φ=10%胎牛血清、φ=1%青霉素-链霉素溶液的高糖DMEM 培养基培养,培养在37 ℃、5% CO2的培养箱。
1.3.5.2 复合物的细胞毒性测定
将密度为每毫升5×104个的细胞悬液接种到96孔板中,每孔200 μL,常规培养24 h。取出96 孔板,吸去旧的培养基,PBS 清洗。试验组每孔加入200 μL 含有不同质量浓度花色苷样品和油酸造模剂的完全培养基,设置空白组,每组6 个复孔。培养24 h 后,吸去旧的培养基,PBS 清洗,每孔加入0.5 mg/mL MTT 溶液200 μL,继续培养4 h,吸出旧培养基,每孔加入150 μL DMSO,室温振荡孵育10 min,用酶标仪在490 nm 波长处测定其光吸收值。按照公式3 计算存活率。
式中:
B——为细胞存活率,%;
A试验——为试验组的吸光度;
A对照——为对照组的吸光度。
1.3.5.3 油酸诱导的HepG2 细胞脂质积累模型的建立及鉴定
将密度为每毫升5×104个的细胞悬液接种到12孔板中,每孔1 mL,常规培养24 h。油酸造模剂的制备参照刘畅等[11]的方法,配油酸浓度为10 mmol/L的造模剂溶液,0.22 μm 滤膜过滤除菌,冷冻备用,用完全培养基将造模剂稀释成0、200、400、600 μmol/L。取出12孔板吸取旧的培养基,PBS清洗。加入1 mL 不同浓度的油酸造模剂,继续培养24 h。
1.3.5.4 复合物对脂质HepG2 细胞模型的降脂效果检测
将密度为每毫升2×105个的细胞悬液接种到6孔板中,每孔2 mL,当细胞生长至密度为80%~90%时,使用200 μmol/L 的油酸诱导,设置对照组。24 h 后吸弃旧的培养液,PBS 清洗,对照组和模型组加入完全培养基,阳性对照组加入15 μg/mL 多烯磷脂酰胆碱(Polyene Phosphatidyl Choline,PPC),实验组分别加入花色苷质量浓度为10、30、50 μg/mL的BBA 溶液和SPI/AG-BBA 溶液,每孔培养基为2 mL,继续培养12、24、36、48 和60 h。待细胞给药处理结束后,吸弃6 孔板中的培养基,PBS 洗涤后收集细胞,制成细胞悬液,冰浴状态下进行超声破碎处理。根据试剂盒方法测定细胞样液中的总蛋白、TG、TC、SOD、MDA 的含量。
1.3.6 数据分析
所有样品均设置3 个平行,处理后的数据以平均值±标准差表示。采用Origin 2022 软件作图,采用SPSS 22.0 统计分析软件进行单因素方差分析和独立t检验,P<0.05 表示存在显著性差异,P<0.01 表示有极显著差异。
2 结果与讨论
2.1 SPI/AG-BBA 复合物的制备和优化
2.1.1 超声功率对复合物形成的影响
超声功率对复合物形成的影响结果如图1 所示,在0~180 W 的范围内增加,SPI/AG-BBA 的包埋率随着功率的提高而提高,180 W 时达到最高包埋率为65.36%,但是随着超声功率进一步提高,复合物的包埋率逐渐降低,从功率225 W 时的61.90%降低到了270 W 时的56.20%。分析可能的原因,在于超声处理后的大豆分离蛋白球状结构的构象发生变化,使亲水区域更多地暴露[12],有利于蛋白质与花色苷的结合。但是,当超声功率过高时,空化效应迫使SPI/BBA 进入高温状态,破坏了单个组分的分子结构或复合物的结构,使花色苷泄漏,包埋率降低。超声处理还能够显著减小蛋白的粒径,随着功率增大,复合物的粒径逐渐减小,180 W 功率条件下,平均粒径从3.81 μm 降低至2.54 μm,270 W时降为1.79 μm。ζ-电位则不受超声功率的影响,基本稳定在19 mV 左右。综合考虑,后续实验制备复合物选择超声功率为180 W。

图1 超声功率对复合物包埋率、平均粒径、ζ-电位的影响Fig.1 Effect of ultrasonic power on embedding rate,mean particle size and Zeta-potential of complex
2.1.2 壁芯质量比对复合物形成的影响
由图2可知,SPI:BBA 比例从5:1~20:1 范围内,包埋率呈现先上升后下降的趋势,由开始时的58.62%上升至10:1 时的65.10%,之后包埋率开始出现略微下降。随着SPI 比例增加,包埋率逐渐上升,壁材的结合位点增加,拥有更多的结合机会让包埋率得到提升[13]。继续增大SPI 的量,复合物的包埋率开始下降,这可能是因为壁材乳化稳定性减弱导致的[14],复合物的外壳形成不均匀。可能的原因在于,较大量花色苷的存在会与SPI 发生充分结合,此时花色苷是过量的,蛋白的结构发现较大变化,这可能不利于接下来与AG 的结合,因为这种结合不仅仅是电荷在起作用,还有蛋白和多糖基团上的结合,花色苷占据较多位置使得AG 与SPI 的结合过程受到挤压[15]。由于体系中阴阳离子聚电解质比较稳定,在加入不同质量花色苷后复合物的ζ-电位变化有略微下降,在5:1 时电位为19.31 mV,到20:1 时电位为18.80 mV,但是整体不明显,说明在此范围内的花色苷添加量对体系ζ-电位没有影响。随着花色苷添加量的减小,粒径逐渐增大。综合考虑,后续实验制备复合物选择壁芯质量比(SPI:BBA)为10:1。

图2 不同壁芯比对复合物包埋率、平均粒径、ζ-电位的影响Fig.2 Effects of different wall-core ratio on embedding rate,average particle size and Zeta-potential of complex
2.1.3 壁材比对复合物形成的影响
由图3 可知,在壁材比(SPI:AG)10:2~10:6范围内,包埋率随着壁材比的增加呈现逐渐上升的趋势。壁材比为10:2 时包埋率最低为46.20%,当壁芯比为10:4 时包埋率达到64.10%,随着壁材比继续增加,包埋率增速放缓,10:6 时为67.00%。随着AG 质量增加,与SPI 有效结合,形成较多较密集的复合物。SPI:AG 为10:2 时ζ-电位处于最高水平,达到了28.70 mV,此时的复合物体系中正电荷占据主导,整体比较稳定,不容易发生沉降现象。在Lan 等[16]的研究中提到两种相反电荷聚电解质的比例影响着复合物在水体系中的形态结构和性质,在阳离子聚电解质占据主导时体系呈溶液状态,随着阴离子聚电解质的增加,体系会经过聚电解质小球、颗粒状沉淀和絮凝沉淀等过程,后两者都不是理想状态。随着AG 质量的逐渐增加,体系的粒径开始逐渐变大,粒径在10:4 时2.53 μm,10:6 时粒径增加到8.06 μm,大颗粒的复合物形状不规则并且分布不集中,由于重力作用会快速沉淀在烧杯底部。综合考虑,后续实验制备复合物选择壁材比(SPI:AG)为10:4。
2.1.4 包埋时间对复合物形成的影响
从图4 中可以看出,在包埋时间0.5~2.0 h 范围内随着时间增加出现包埋率先增加后减小的现象,0.5 h 此时的包埋率为57.60%,包埋时间延长到1.0 h时包埋率为66.05%,有明显的上升,随着包埋时间继续延长,包埋率出现明显下降。时间增加而出现的包埋率下降的原因可能是复合物中的花色苷在经过机械作用的情况下开始发生泄漏,这种现象与复合物本身的缓释作用相关[17]。不同包埋时间下,复合物的ζ-电位变化趋势不明显,并且稳定。随着包埋时间的延长,粒径逐渐减小。综合考虑,后续实验制备复合物选择包埋时间为1 h。
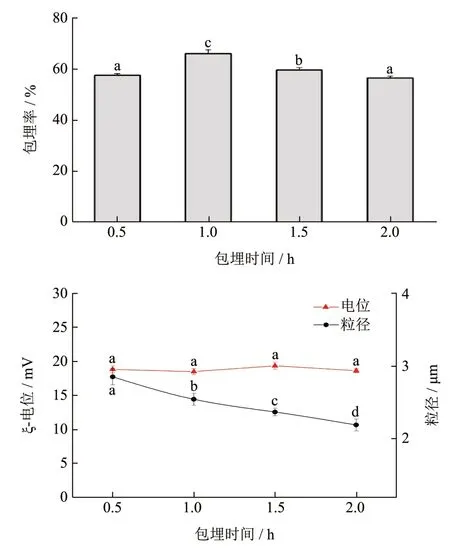
图4 不同包埋时间对复合物包埋率、平均粒径、ζ-电位的影响Fig.4 Effect of different embedding time on embedding rate,average particle size and Zeta-potential of complex
2.2 SPI/AG-BBA 复合物的表征
2.2.1 BBA 对大豆分离蛋白的荧光淬灭特性
大豆分离蛋白的内源荧光主要来自于结构中的色氨酸、酪氨酸和苯丙氨酸基团,激发波长为280 nm 时,蛋白质的荧光光谱取决于色氨酸残基[21]。图5 为大豆分离蛋白的荧光淬灭图谱,由图可知,花色苷质量浓度增加,大豆分离蛋白的荧光强度逐渐降低,最大激发峰逐渐变小。BBA 质量浓度为2.0 μg/mL 和4.0 μg/mL 时,最大荧光强度分别下降了63.67%和83.44%,荧光强度下降可能是由于发生了静态淬灭[21],说明大豆分离蛋白与花色苷之间产生了一定的相互作用;当BBA 质量浓度为4.0 μg/mL 时,最大激发波长由327 nm 变成314 nm,发生蓝移,这说明大豆分离蛋白的三级结构发生变化,花色苷的加入改变了蛋白分子内部氨基酸残基微环境的极性,蛋白质结构松散舒展,使得更多疏水基团和色氨酸暴露,非极性增强[21]。综上所述,BBA 与SPI 紧密结合,形成了SPI-BBA 复合物。
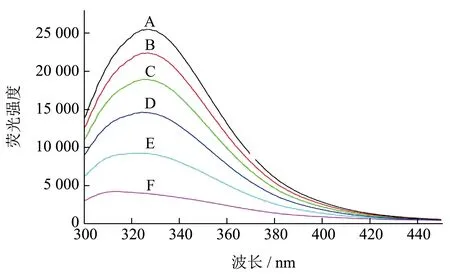
图5 不同质量浓度BBA对大豆分离蛋白荧光强度的影响Fig.5 Effect of different concentrations of BBA on the fluorescence intensity of soybean protein isolates
2.2.2 傅立叶变换红外光谱
对制备的SPI/AG-BBA 复合物进行红外光谱检测,结果如图6 所示。在经过花色苷复合之后,大豆分离蛋白的氨基和羧基带分别从3 407.33、2 972.86 和2 932.98 cm-1迁移到3 405.22、2 961.86和2 931.14 cm-1。蛋白质的主要特征谱带由酰胺Ⅰ带(1 700~1 600 cm-1)、酰胺Ⅱ带(1 560~1 520 cm-1)、酰胺Ⅲ带(1 240~1 430 cm-1)三个强谱峰带组成[21],随着花色苷的加入,酰胺I 带从1 641.05 cm-1迁移到了1 645.26 cm-1出现了略微蓝移;酰胺II 带发生较大红移,从1 544.76 cm-1迁移到1 539.78 cm-1。这可能是由于O-H 键和分子间氢键伸缩震动引起的,表明SPI/AG 与BBA 之间存在氢键作用[21]。红外光谱的变化说明了花色苷引起了大豆分离蛋白二级结构的改变,花色苷与SPI/AG 主要通过氢键结合,形成SPI/AG-BBA 复合物。

图6 SPI/AG及SPI/AG-BBA傅立叶变换红外光谱图Fig.6 SPI/AG and SPI/AG-BBA Fourier transform infrared spectra
2.2.3 复合物扫描电镜检测
对SPI/AG-BBA 复合物进行了扫描电镜检测,由图7 可以看出,SPI/AG-BBA 是粒径为2 μm 左右的不规则球形,形成由数个或数十个团聚在一起的球团。
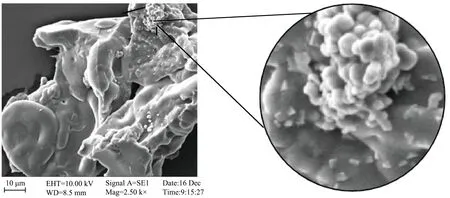
图7 SPI/AG-BBA扫描电镜图Fig.7 SPI/AG-BBA scanning electron microscope image
2.3 SPI/AG-BBA 复合物体外模拟释放
为了检测复合物的缓释效果,对SPI/AGBBA 复合物在体外模拟胃液(pH 值1.2)和肠液(pH 值6.8)中的释放过程进行了检测。结果如图8所示,在pH 值1.2 的模拟胃液环境中,复合物在2 h 时71.05%,随后释放速度放慢,4 h 时释放率为79.20%,而游离花色苷在2 h 和4 h 的释放率分别为87.80%和97.51%,几乎完全释放,比较而言,复合物具备一定的缓释效果。在pH 值6.8 的模拟肠液环境中,在监测区间内释放率开始逐渐下降。在pH 值6.8 条件下复合物的释放率峰值发生在6 h 时,为66.40%,与pH 值1.2 环境下峰值相比有明显降低。而游离BBA 同样具有快速释放的特点,在前两个小时内检测到花色苷释放率的明显跃升,在2 h 时达到了87.80%,随后释放率缓慢升至92.51%,4 h时达到最高点。
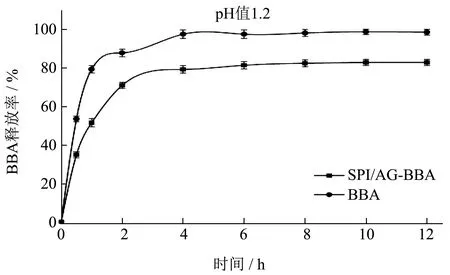
图8 SPI/AG-BBA复合物在体外模拟条件下的释放情况Fig.8 Release of SPI/AG-BBA complex under simulated conditions in vitro
由上述结果来看,在pH 值6.8 的模拟肠液环境中复合物具有更佳的缓释效果,可能的原因是在pH 值6.8 的环境下复合物的电荷下降,溶胀度降低,结构变得致密[23],花色苷的释放进一步受阻;另一方面,花色苷的释放程度不及降解程度,所以在释放率上表现为缓慢下降,这与现有报道结果相近[24]。总体来看,经过复合物负载后的花色苷在模拟胃肠液状态中表现出了优良的缓释效果。
2.4 SPI/AG-BBA 复合物的降脂活性测定
2.4.1 SPI/AG-BBA 复合物的细胞安全浓度检测
为了确定SPI/AG-BBA 复合物对HepG2 肝癌细胞的安全作用浓度,试验选取质量浓度为0~100 μg/L的BBA 及复合物作用于细胞24 h,用MTT 法测定细胞的存活率,结果如图9 所示,在SPI/AG-BBA复合物中花色苷折合质量浓度为10~50 μg/L 时,细胞存活率无明显影响,表明在50 μg/mL 质量浓度以内对细胞无毒副作用;质量浓度为75 μg/L 时,细胞存活率下降至90.05%,而对应的游离花色苷组细胞存活率降低至75.51%,由此,选择0~50 μg/L 的花色苷作为HepG2 细胞的实验质量浓度范围。
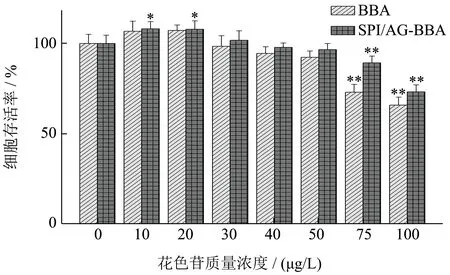
图9 BBA及SPI/AG-BBA复合物对HepG2细胞存活率的影响Fig.9 Effects of BBA and SPI/AG-BBA complex on survival rate of HepG2 cells
从图中还可发现,复合物在低质量浓度时(10~20 μg/L)表现出了显著的细胞促生长作用,这可能是由于复合物中的大豆分离蛋白有一定的促生长作用。在75 μg/mL 时SPI/AG-BBA 复合物的细胞存活率为89.32%,相对游离BBA 组的高出了16.35%,表明SPI/AG-BBA 复合物细胞毒性更低。
2.4.2 HepG2 细胞脂质堆积模型的建立
为了确定油酸造模剂对HepG2 肝癌细胞的安全作用浓度,试验选取不同浓度的油酸造模,用MTT法测定细胞的存活率,结果如图10 所示,当浓度在200~800 μmol/L 范围内,与空白组相比细胞存活率无显著性差异,属于安全浓度范围,后续实验选用200 μmol/L 油酸浓度为造模浓度。

图10 油酸造模剂对HepG2细胞存活率的影响Fig.10 Effect of oleic acid moulding agent on survival rate of HepG2 cells
2.4.3 SPI/AG-BBA 对细胞模型中TG、TC含量的影响
将复合物作用于模型细胞中,通过检测细胞中TG、TC 含量来评价其降脂效果。实验结果如图11,经过油酸诱导24 h 后,细胞内的TG、TC 含量显著高于空白组,建模成功;给药培养48 h 后,当BBA质量浓度10 μg/mL 时,与模型组相比,BBA 及SPI/AG-BBA 组的TC 含量无显著性差异,在BBA质量浓度30~50 μg/mL 下,BBA 组及SPI/AG-BBA组的TG、TC含量显著低于模型组,且存在剂量依赖。当BBA 质量浓度为50 μg/mL 时,复合物组的TG、TC 含量分别为0.21 mmol/g prot、0.19 mmol/g prot,与模型组相比,复合物组的TG、TC 分别下降了41.18%、42.12%,与游离BBA 组相比,复合物组的TG、TC 分别下降了14.21%、9.70%。刘畅等[11]的研究也发现200 μg/mL 的红树莓花色苷提取物能使肝癌细胞内TG 含量降低37.23%,具有清除细胞脂肪堆积的能力。我们还检测了游离BBA 及其复合物不同作用时间对细胞TG 和TC 含量的影响,结果如图12 所示,在作用时间12~60 h 范围内,24 h 前,游离BBA 组和复合物组TG 和TC 含量无显著性差异,36~60 h,复合物组的TG、TC 含量呈下降趋势,且显著低于游离BBA 组,这可能是复合物组中BBA 缓慢释放出来,BBA 没有过早被破坏,持续作用细胞,而游离BBA 组则发生较快降解,与前人的发现一致[25]。综上所述,经过复合物负载的花色苷在降脂活性上有一定提高,且作用效果随作用时间的增加而提高。

图11 BBA及SPI/AG-BBA复合物对细胞中TG、TC含量的影响Fig.11 Effects of BBA and SPI/AG-BBA complex on TG and TC content in cells

图12 不同药物作用时间对细胞中TG、TC含量的影响Fig.12 Effects of different drug duration on the content of TG and TC in cells
2.4.4 SPI/AG-BBA 对细胞模型中SOD、MDA 含量的影响
检测了细胞中SOD 酶活力和MDA 的含量,结果如图13 所示,空白组细胞酶活力最强,而油酸诱导之后的细胞,由于胞内产生氧化应激反应导致酶活力下降。酶活力的提升与BBA 浓度呈正相关,BBA 质量浓度为10 μg/mL 时,BBA 组及复合物组的SOD 酶活分别提升了26.92%、38.23%,MDA 含量下降了14.13%、14.31%。当BBA 质量浓度增加达到50 μg/mL 时,复合物组的MDA 含量为10.58 nmol/mg prot,比模型组下降了34.15%,比游离BBA 组下降了17.12%;SOD 酶活力为25.25 U/mg prot,比模型组提高了63.99%,比游离BBA 组提高了9.54%。我们还检测游离BBA 及其复合物不同作用时间对细胞SOD 酶活力及MDA含量的影响,结果如图14 所示,复合物组在作用时间12~60 h 范围内,SOD 含量出现上升趋势、MDA 含量出现明显下降趋势,而游离BBA 组在这两项指标的表现上比较平稳,没有明显变化。随着作用时间的延长,复合物组与游离BBA 组差距逐渐增大,作用时间为24 h 时,复合物组的SOD、MDA 指标与游离BBA 组相比无显著性差异,当作用时间增加到60 h 时,复合物组的MDA比游离BBA 组降低了12.68%,SOD 酶活力比游离BBA 组提高了6.75%,具有显著性差异。Zhang等[25]发现花色苷能够通过激活SOD 抗氧化物酶系统有效保护肝脏,摄入花色苷可以间接或者直接地清除体内的活性氧和自由基,从而改善机体的血脂异常,这与本实验的研究结果一致。总体来说,游离BBA 和复合物均可通过提高SOD 酶活性,提升抗氧化酶系统,从而改善血脂水平,且复合物的效果强于游离BBA。
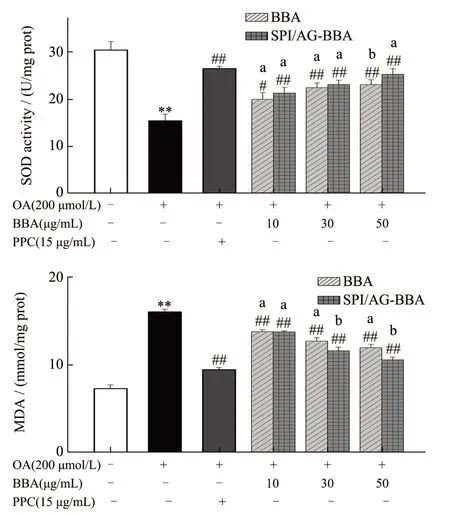
图13 BBA及SPI/AG-BBA复合物对细胞中SOD酶活力和MDA含量的影响Fig.13 Effects of BBA and SPI/AG-BBA complex on SOD activity and MDA content in cells

图14 不同药物作用时间对细胞中SOD酶活力和MDA含量的影响Fig.14 Effects of different drug duration on SOD activity and MDA content in cells
3 结论
本文构建了大豆分离蛋白/阿拉伯胶-花色苷体系的聚电解质复合物,确定超声功率180 W、壁材质量比为10:4、壁芯质量比为10:1、包埋时间为1.0 h,得到包埋率为66.02%,ζ-电位为19.03 mV,平均粒径为2.53 μm 的不规则球状物,提高了花色苷稳定性,并且具有良好的体外缓释效果。最后,对比了游离BBA 和SPI/AG-BBA 复合物的体外降脂活性,发现SPI/AG-BBA 复合物的降脂活性优于游离BBA,作用48 h 后,SPI/AG-BBA 复合物组的TG、TC 含量为0.21 mmol/g prot、0.19 mmol/g prot,比游离BBA 组下降了9.70%,14.21%,具有显著性差异。本实验初步对比了游离BBA 和SPI/AG-BBA复合物对HepG2 细胞脂质积累模型的降脂作用,为后续提高活性物稳定性和降脂方面的研究提供理论依据。

