用泡沫铜与浓、稀硝酸反应的实验改进
罗敏 刘茜 杨丽君
摘要: 为解决铜与稀硝酸反应时装置中氧气对实验的影响及氮氧化物易泄露等问题,利用注射器、三通阀和具支U型管等仪器设计简易的实验装置,并选用泡沫铜与浓、稀硝酸进行反应。改进后的实验具有取材方便、操作简单、安全环保、现象明显等特点,非常适合课堂演示以及学生分组实验。
关键词: 铜与浓、稀硝酸反应; 实验装置改进; 泡沫铜
文章编号: 10056629(2024)04007703
中图分类号: G633.8
文献标识码: B
1 问题的提出
硝酸的性质是学生在高中化学学习中必须掌握的重要内容。《普通高中化学课程标准(2017年版2020年修订)》在“教学提示”栏目中将“浓、稀硝酸的性质”作为实验及探究活动[1]。人教版教材以铜丝、硝酸和NaOH溶液为实验试剂,具支试管和烧杯为实验仪器,装置简单、操作方便,但仍存在以下不足:(1)铜与浓硝酸反应产生大量NO2来不及吸收,逸散到空气中,与没有处理的具支试管中残留的NO2,都会污染环境;(2)铜与稀硝酸反应时,具支试管中的空气会将生成的NO瞬间氧化为NO2,观察不到无色气体NO的生成;(3)若验证NO与氧气反应生成NO2,或进行尾气处理时将NO氧化为NO2,都需取下橡胶塞,此时会有氮氧化物逸出,污染环境;(4)无防倒吸装置,可能导致NaOH溶液被吸入具支试管,使实验失败。为了解决上述问题,笔者提出了新的想法,从实验试剂和装置两个方面对铜与浓、稀硝酸反应进行改进。
2 相关文献简评
查阅大量的文献,发现研究主要集中在以下几个方面:(1)铜与稀硝酸反应时排除氧气的干扰[2,3],利用CO2、在反应仪器中装满稀硝酸或者压缩反应装置排出空气;(2)铜与浓硝酸反应的一体化设计[4,5],但实验仪器不常见;(3)铜与浓、稀硝酸反应实验的连续化设计[6,7],即把铜和浓、稀硝酸两个反应整合在一起,对比鲜明,但操作复杂;(4)实验微型化、绿色化设计[8,9],实验装置常见易得,但功能比较单一。
基于文献,本文对“硝酸的性质”实验进行了改进,利用多孔泡沫铜和注射器,设计了操作简单、现象明显的简易实验装置。铜与稀硝酸反应时,利用注射器压缩多孔泡沫铜,排除装置中的空气。吸入稀硝酸后,观察到溶液变成蓝色的同时,注射器活塞向上移动明显,说明有NO无色气体生成。产物NO氧化为NO2及NaOH吸收尾气都在密闭装置中进行,不会污染教学环境;铜与浓硝酸反应生成NO2, NO2与水反应生成硝酸和NO,以及硝酸的检验和废液处理整合为一体,无需拆卸装置,整个过程没有任何气体逸出。改进后的实验有利于学生理解不同浓度的硝酸与铜反应的产物也不同,并进一步巩固氮氧化物之间的转化。
3 实验部分
3.1 实验仪器及试剂
实验仪器:不同规格注射器(5mL 3个,20mL 2个)、三通阀、具支U型管(15×150mm)1个、气球、橡胶塞
实验药品:泡沫铜、15mol/L浓硝酸、5mol/L稀硝酸、氧气,饱和NaOH溶液、紫色石蕊溶液、蒸馏水
3.2 铜与稀硝酸反应实验
将泡沫铜放入注射器进行压缩,不仅可以排除空气,其多孔性也会增加与稀硝酸的接触面积加快反应。借助三通阀,将一氧化氮的制取、氧化、尾气吸收等实验集于一体。
3.2.1 实验装置
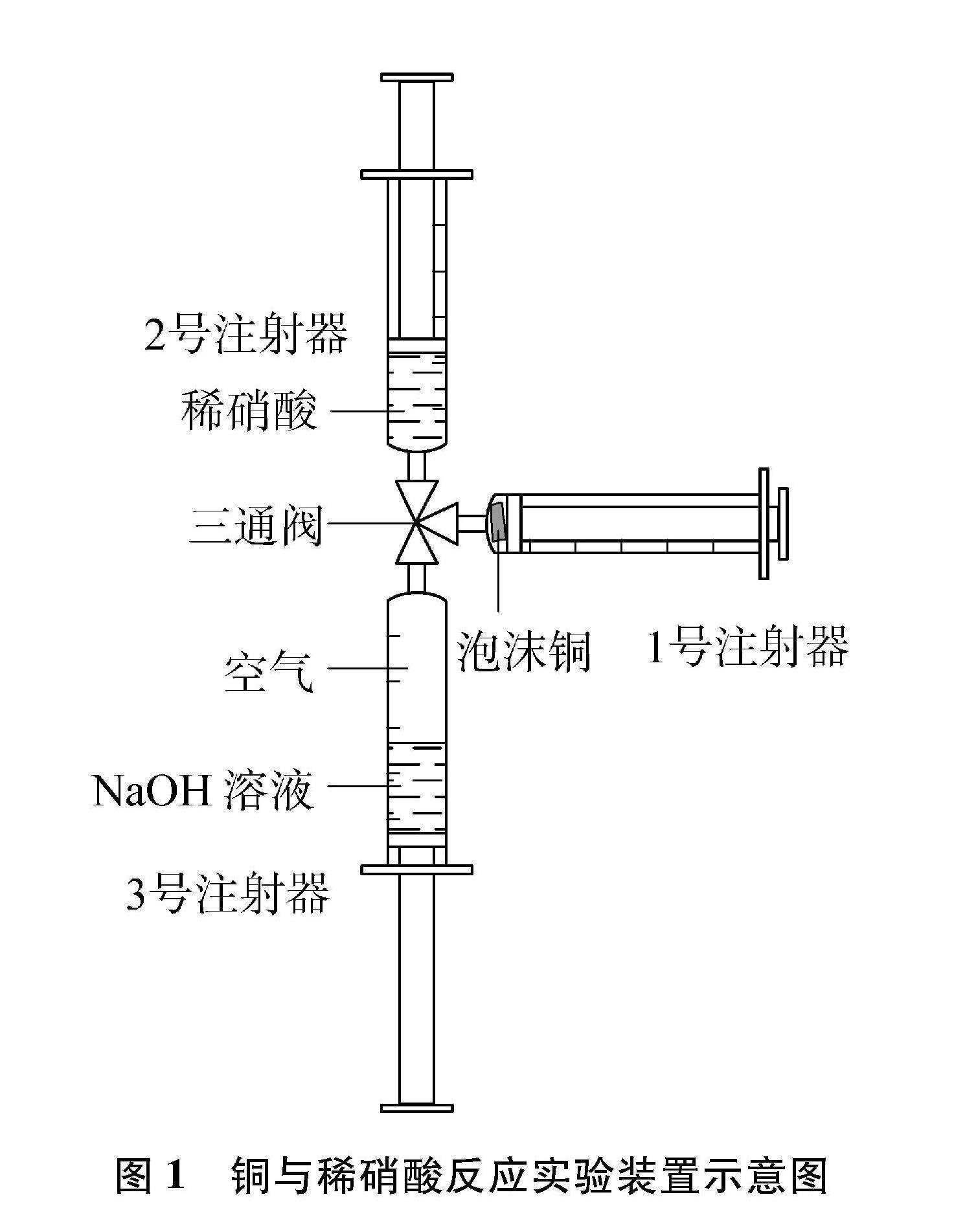
实验装置如图1所示。
3.2.2 实验步骤及现象
(1) 按图1组装实验仪器并检查其气密性,3个注射器均为5mL。
(2) 剪取一小块泡沫铜置于1号注射器,并将注射器活塞推至最底部以完全挤出空气;然后取5mol/L稀硝酸2mL于2号注射器;2mL饱和NaOH溶液于3号注射器,并吸入3mL空气;最后将3只注射器用三通阀连接并固定起来。
(3) 旋转三通阀,使1、 2号注射器连通,缓慢向外拉1号注射器活塞,2号注射器里的稀硝酸进入1号注射器与泡沫铜发生反应,观察到无色溶液变成蓝色[3Cu+8HNO3(稀)2NO↑+3Cu(NO3)2+4H2O]。同时,1号注射器活塞向外移动明显,说明产生了无色气体。反应前后溶液颜色对比鲜明,学生可在较短时间内观察到实验现象。
(4) 再次旋转三通阀,使1、 3号注射器連通,缓慢向外拉1号注射器,
缓慢推进3号注射器,1号注射器内
无色气体立即变成红棕色(2NO+O22NO2)。然后挤入饱和NaOH溶液处理尾气和废液,红棕色消失(2NO2+2NaOHNaNO3+NaNO2+H2O),有蓝色沉淀产生[Cu(NO3)2+2NaOHCu(OH)2↓+2NaNO3]。
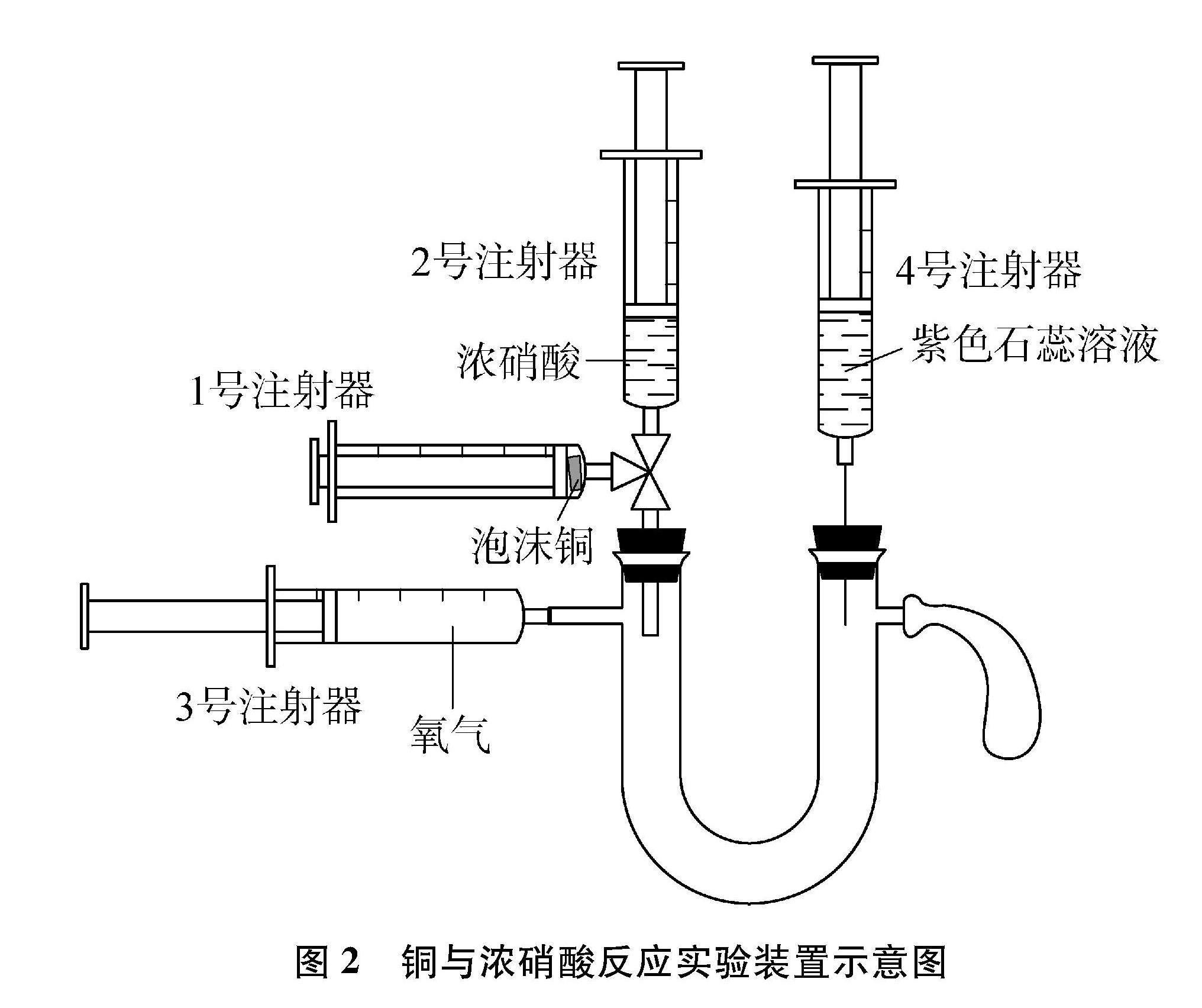
利用上述实验装置完成铜与稀硝酸的反应,通过吸入空气,注射器中出现红棕色,证明前产物是NO,也说明稀硝酸具有氧化性。为进一步说明铜与浓、稀硝酸反应的不同,设计了泡沫铜与浓硝酸反应的实验装置如图2所示。利用该装置可以完成铜与浓硝酸的反应,并借助具支U型管,完成NO2与水反应的实验探究,实现该装置的多功能性。
3.3 铜与浓硝酸反应实验
3.3.1 实验装置
在图1实验装置基础上,无氧条件下,利用注射器探究铜与浓硝酸的反应;借助三通阀将产物硝酸铜和NO2分离,并将NO2挤入具支U型管,探究NO2与水反应的产物以及NO和NO2之间的转换。
3.3.2 实验步骤及现象
(1) 按图2组装实验仪器并检查其气密性。1号和3号注射器为20mL,2号和4号注射器为5mL。
(2) 1号注射器中放入泡沫铜并压缩,取2mL浓硝酸置于2号注射器,连接三通阀。3号注射器吸入事先制备的氧气约20mL,4号注射器吸取3mL紫色石蕊溶液,连接在具支U型管上。接着将气球套在具支U型管的支管口处,平衡气压。
(3) 旋转三通阀,连通1号、2号注射器,缓慢向外拉1号注射器吸入浓硝酸。在无氧条件下吸入的浓硝酸与泡沫铜立即发生反应,活塞向外移动,注射器中出现红棕色,证明产生了NO2,并观察到无色溶液变成绿色[Cu+4HNO3(浓)2NO2↑+Cu(NO3)2+2H2O]。
(4) 将绿色溶液压回2号注射器后,旋转三通阀,使1号注射器与具支U型管相通,将1号注射器中的红棕色气体压入具支U型管。将4号注射器中的紫色石蕊溶液滴入具支U型管中,溶液变红,红棕色消失,说明NO2与水发生反应生成HNO3和NO(3NO2+H2O2HNO3+NO)。利用3号注射器向具支U型管中注入约10mL氧气,具支U型管中红棕色复现,说明NO与O2反应重新生成NO2(2NO+O22NO2)。
(5) 最后注入过量氧气,使生成的NO全部氧化为NO2。并将2号注射器里的绿色溶液全部注入具支U型管,再通过2号注射器加入适量饱和NaOH溶液,红棕色消失(2NO2+2NaOHNaNO3+NaNO2+H2O),出现蓝色沉淀[Cu(NO3)2+2NaOHCu(OH)2↓+2NaNO3],紅色石蕊重新变成紫色,完成尾气吸收和废液处理。
3.4 注意事项
(1) 实验前要进行装置的气密性检查,防止铜与浓、稀硝酸反应产物氮氧化物的泄漏,对环境造成污染。铜与稀硝酸反应实验还要防止空气对实验造成干扰。
(2) 浓硝酸具有腐蚀性和挥发性,实验过程中戴好手套和口罩。
3.5 实验总结
(1) 选择注射器、三通阀搭建实验装置,使操作简单快速。泡沫铜代替铜丝或铜片,增大稀硝酸与铜的接触面积,无需预热也能加快反应速率。
(2) 铜与浓、稀硝酸各步反应的实验都整合为一体,在密闭体系中进行,无需拆卸装置,没有气体泄漏危险,体现了环保理念。
(3) 在短时间内既能完成硝酸的氧化性实验,探究铜与浓、稀硝酸反应产物的不同,又能巩固氮氧化物之间的转化:NO氧化为NO2, NO2与水反应生成硝酸和NO。用紫色石蕊溶液检验硝酸的生成、NaOH溶液进行尾气吸收和废液处理,有利于培养学生良好的科学探究核心素养。
(4) 可改变注射器大小以适应各类实验的需要,可用于教师演示实验,又可用于学生分组实验。
(5) 实验装置简单,泡沫铜也易于购置,仪器和未反应完的泡沫铜都可以重复使用。操作步骤合理简洁,现象明显,重现性好,颜色变化鲜明,有利于激发学生兴趣。
参考文献:
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版2020年修订)[S]. 北京: 人民教育出版社, 2020: 16.
[2]李德前, 魏海, 张羿. “铜与稀硝酸反应”一体化实验设计[J]. 化学教学, 2020, (9): 70~72.
[3]魏海, 李德前. “双注射器组合装置”的制作与应用——以铜与硝酸反应的系列实验为例[J]. 化学教学, 2020, (11): 69~71.
[4]贺紫柠, 李忠恒. 铜与浓硝酸反应实验装置的新设计[J]. 化学教学, 2023, (8): 67~69, 76.
[5]杨頔, 靳红旗, 于善亮. 铜与浓硝酸反应的装置设计及现象研究[J]. 化学教育, 2014, 35(11): 77~78.
[6]刘江, 赵宁东, 刘俊等. 基于智能手机的铜和硝酸反应实验过程可视化设计[J]. 化学教学, 2020, (6): 72~74.
[7]杨香涛, 阮方来. 铜与浓、稀硝酸反应实验的整合设计[J]. 化学教学, 2019, (10): 70~72.
[8]谭文生. 铜与浓、稀硝酸反应实验的绿色化设计[J]. 化学教学, 2012, (11): 45~46.
[9]张正飞, 柏书梅. 利用胶头滴管演示铜与硝酸的反应[J]. 化学教学, 2010, (2): 8.

