基于高通量测序山西老陈醋和怀仁醋酒精发酵初期酒醅真菌菌群研究
杨 玲,彭佳伟,郭旭凯,段 冰,邵 强,郭 睿,温贤将,王 琪*
(1.山西农业大学 高粱研究所,山西 晋中 030600;2.山西大学 生命科学学院,山西 太原 030006)
山西老陈醋是“四大名醋”之一,以特定产区的高粱、麸皮为主要原料,以稻壳和谷壳为辅料,以大麦、豌豆制作的大曲作为糖化发酵剂,经酒精发酵后采用固态醋酸发酵,再经熏醅、陈酿等工艺酿制而成,具有绵、酸、甜、香、鲜等特点而备受消费者青睐[1]。但是山西老陈醋工艺(GB/T19777—2013《地理标志产品山西老陈醋》)的生产周期较长,因此,探索降低成本的工艺改进是企业生存发展的方向。而怀仁醋酿造工艺(T/SXMYT 0601—2020《怀仁醋酿造工艺规程》)将生产周期缩短了7 d,有效节省了企业的时间成本。怀仁醋酿造工艺在酒精发酵阶段进行了改动,大曲种类是灯山井大曲,且用量缩减了近50%,另外还加入了淀粉酶、糖化酶和酵母菌;而且在发酵初期使用的是淀粉酶和糖化酶,后期再加大曲和酵母菌。
迄今为止,对山西食醋发酵过程中真菌菌群的研究对象主要为山西老陈醋,而针对改进的其他食醋工艺酿造过程中的真菌菌群的报道则很少[2]。传统的纯培养法由于耗时、耗力、结果不准确等缺点而限制了其在环境微生物样品中的应用。近些年,基于免培养方法的分子生物学技术在酿造微生物研究中的应用越来越多,如温度梯度凝胶电泳技术、单链构象多态性分析(single strand conformation polymorphism,SSCP)、变性梯度凝胶电泳技术(denatured gradient gel electrophoresis,DGGE)、荧光原位杂交技术(fluorescence in situ hybridization,FISH)和基因文库法等[3-5]。高通量测序技术具有效率高、成本低、准确率高等优点[6],因此被广泛用于食醋领域的研究[7-10]。
本研究以山西老陈醋工艺和怀仁醋酿造工艺酒精发酵初期的酒醅为研究对象,采用高通量测序技术,对比分析两种工艺酒醅中真菌群落结构的差异,以期从真菌组成的角度为山西陈醋工艺的改进提供理论支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 酒醅样品
酒醅样品采集自山西省晋中市某醋厂。分别对山西老陈醋工艺和怀仁醋酿造工艺过程的酒精发酵第3天酒醅样品进行采集,分别编号为S和X,各3个重复,采集后迅速置于液氮保存。
1.1.2 主要试剂
DP812土壤/粪便基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;TransStart FastPfu Fly DNA Polymerase:北京全式金生物技术有限公司;超保真酶试剂盒:北京百灵克生物科技有限责任公司;e.Z.N.A.TM Cycle-Pure Kit:美国Omega公司;Monarch DNA Gel Extractionn:北京鸿跃创新科技有限公司;琼脂糖(西班牙):北京博美富鑫科技有限公司;Invitrogen Collibri NGS文库制备试剂盒:赛默飞世尔科技(中国)有限公司。
1.2 仪器与设备
ALS 1296聚合酶链式反应(polymerase chain reaction,PCR)仪、GelDoc 2000 UV凝胶成像系统:美国Bio-Rad公司;5417R高速冷冻离心机:德国Eppendorf公司;DYY-6C型电泳仪:北京六一仪器厂;Nova-Seq6000测序仪:美国Illumina公司。
1.3 方法
1.3.1 酒醅真菌菌群基因组DNA的提取
用0.1 mol/L磷酸缓冲液(pH 7.0)洗涤样品3次,4 ℃离心(8 000×g,10 min)收集菌体。采用DP812土壤/粪便基因组DNA提取试剂盒提取真菌菌群基因组DNA,用0.7%琼脂糖凝胶电泳检测提取效果。
1.3.2 酒醅真菌菌群ITS1区基因序列的PCR扩增及测序
以提取的基因组DNA为模板,采用引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2(5'-GCTGCGTTCTTCATCGATGC-3')对真菌菌群的ITS1区基因序列进行PCR扩增。PCR扩增体系(30 μL):2×Mix 15 μL;上下游引物(2 mol/L)各3 L;基因组DNA 10 μL(5~10 ng);双蒸水(ddH2O)补至30 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,共35个循环;72 ℃再延伸10 min。PCR扩增产物经1.8%琼脂糖凝胶电泳检测。将检测合格的PCR扩增产物使用建库试剂盒构建文库,经Nova-Seq6000测序仪上机测序,委托百迈客生物工程有限公司完成。
1.3.3 酒醅真菌菌群序列分析
利用FLASH(version 1.2.11)对原始数据进行拼接[11],再用Trimmomatic(version 0.33)进行质量过滤[12],并采用UCHIME(version 8.1)去除嵌合体[11],得到有效序列。利用USEARCH(version 10.0)将有效序列按97%的相似度进行操作分类单元(operational taxonomic units,OTU)聚类,即分子水平的“种”[11]。在每个OTU中选取一条代表序列,通过UNITE(v.8.0)数据库进行物种注释[11]。
1.3.4 酒醅真菌菌群多样性分析和统计分析
采用Mothur(http://www.mothur.org//wiki/Main_Page)计算α-多样性指数(香农(Shannon)指数和超1(Chao 1)指数)[13]。使用QIIME软件进行β-多样性分析[13]。利用edge R软件进行统计分析。根据各个物种在各个样品中的丰度以及变化情况,进行斯皮尔曼(Spearman)秩相关分析,并筛选相关性>0.1且P<0.05的数据构建物种相关性网络图。
2 结果与分析
2.1 两种工艺酒醅样品中真菌菌群的高通量测序结果及OTU分析
两种工艺酒醅样品中真菌菌群的原始序列数、有效序列数和OTU数见表1。由表1可知,怀仁醋酿造工艺酒醅样品真菌菌群的有效序列数及OTU数均高于山西老陈醋工艺酒醅样品,说明怀仁醋酿造工艺酒醅样品的真菌种类更多。
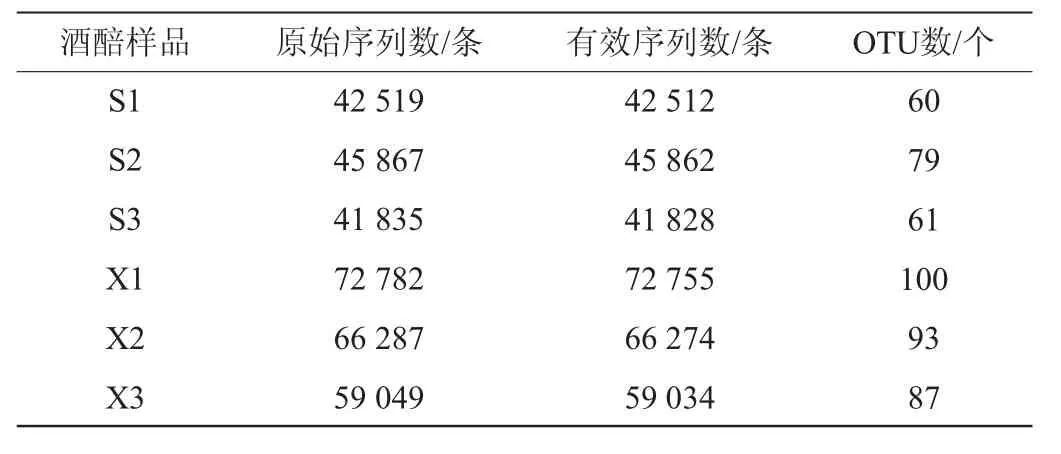
表1 两种工艺酒醅样品中真菌菌群高通量测序结果及OTU数Table 1 High-throughput sequencing results and OTU number of fungal flora in fermented grains samples of two processes
两种工艺酒醅样品真菌菌群OTU的韦恩图见图1。
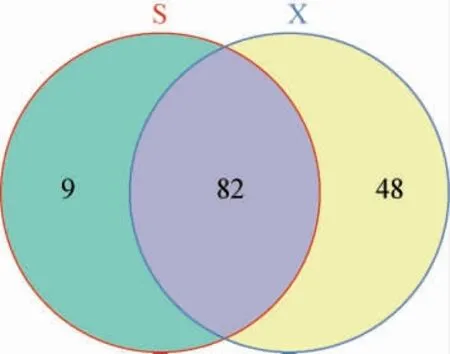
图1 两种工艺酒醅样品真菌菌群OTU的韦恩图Fig. 1 OTU Venn diagram of fungal flora in fermented grain samples from two kinds of processes
由图1可知,两种工艺酒醅样品的共有OTU数有82个;山西老陈醋工艺酒醅样品特有的OTU数仅为9个,而怀仁醋酿造工艺酒醅样品特有的OTU数多达48个,说明真菌物种的数量受酿造工艺的影响较大。
对山西老陈醋工艺和怀仁醋酿造工艺得到的酒醅样品的真菌菌群绘制稀释曲线和丰度等级曲线,结果见图2。

图2 两种工艺酒醅样品中真菌菌群的稀释曲线(a)及丰度等级曲线(b)Fig. 2 Rarefaction curves (a) and Rank-abundance curves (b) of fungal flora in fermented grain samples from two kinds of processes
稀释曲线反映测序数据量的饱和度,当曲线趋向平坦时,说明测序数量达到要求[1]。丰度等级曲线可直观地反映样本中物种的丰富度和均匀度,在横轴方向,曲线的跨度越大,表示物种的丰富度越高;在纵轴方向上,曲线越平缓,表示物种分布越均匀[14]。由图2a可知,随着测序深度的增加,两种工艺酒醅样品真菌菌群的稀释曲线呈逐渐平坦趋势,说明本研究测序深度可以较全面地覆盖酒醅的物种。由图2b可知,怀仁醋酿造工艺的酒醅样品真菌菌群的物种丰富度更高,而山西老陈醋工艺酒醅样品真菌菌群的物种分布更均匀。
2.2 两种工艺酒醅样品中真菌菌群的多样性
2.2.1α-多样性分析
Coverage是测序的库容指标,数值越大,表明测序量越大,测序结果越可信;香农(Shannon)指数可以反映样品的物种多样性,其值越大,说明样品的物种多样性越高;超1(Chao1)指数即物种丰富度指数,可以预测样品中真菌的总物种数,其值越高,丰富度越大[15]。两种工艺酒醅样品中真菌菌群的α-多样性分析结果见表2。由表2可知,山西老陈醋和怀仁醋酿造工艺酒醅样品的Coverage均>0.99,说明库容均达到了要求,测序结果可信。就香农指数而言,怀仁醋酿造工艺酒醅样品的数值高于山西老陈醋工艺酒醅样品,说明怀仁醋酿造工艺提高了真菌菌群的α-多样性。与香农指数结果类似,怀仁醋酿造工艺酒醅样品的Chao1指数更高,表明怀仁醋酿造工艺有利于酒醅真菌菌群丰富度的提高。

表2 两种工艺酒醅样品中真菌菌群的α-多样性分析结果Table 2 Results of α-diversity analysis of fungal flora in fermented grain samples from two kinds of processes
2.2.2β-多样性分析
主成分分析(principal component analysis,PCA)是一种对多维数据进行降维后提取出最主要元素的方法,结果以二维坐标图反映,组成越相似的样品在图中的距离则越近[16]。基于真菌属相对丰度对不同工艺酒醅样品进行PCA,结果见图3。由图3可知,主成分1和主成分2对酒醅样品中真菌菌群差异的方差贡献率分别为98.96%和0.94%,累计方差贡献率为99.90%,说明该结果包含了99.90%的原始信息,结果可信;两种工艺酒醅样品相距甚远,说明二者的真菌菌群组成相差很大。
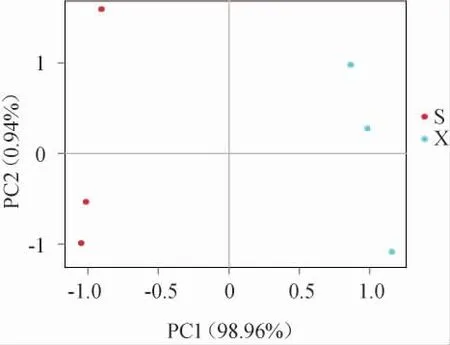
图3 基于真菌属相对丰度两种工艺酒醅样品的主成分分析结果Fig. 3 Principal component analysis results of fermented grain samples from two kinds of processes based on the relative abundance at genus level
2.3 两种工艺酒醅样品中真菌菌群结构分析
2.3.1 基于门水平的真菌群落结构
采用扩增序列变体(amplicon sequence variants,ASVs)分析从山西老陈醋工艺和怀仁醋酿造工艺酒醅样品分别注释到4个真菌门和5个真菌门,结果见图4。
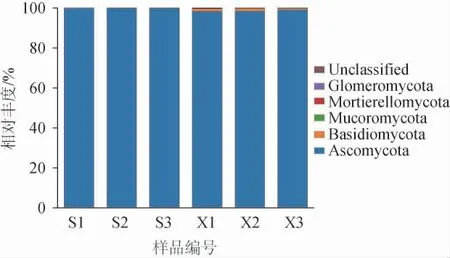
图4 基于门水平两种工艺酒醅样品真菌菌群结构Fig. 4 Fungi community structure of fermented grain samples from two kinds of processes at phylum level
由图4可知,两种工艺酒醅样品中共有的真菌有子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、毛霉门(Mucoromycota)、被孢霉门(Mortierellomycota)及未确定分类地位的类群(Unclassified),怀仁醋酿造工艺酒醅样品特有的真菌门为球囊菌门(Glomeromycota)。子囊菌门在两种工艺酒醅样品中占绝对优势,在山西老陈醋工艺酒醅样品中的平均相对丰度为99.86%,而在怀仁醋酿造工艺酒醅样品中的平均相对丰度则为98.63%。魏莎莎[17]研究发现,紫林、东湖、通宝、四眼井、灯山井、山河、格万、晋源、双楼、玉根和宁化府大曲的绝对优势真菌门均为子囊菌门;陈旭峰等[18]也研究发现,山西福源昌老陈醋大曲中子囊菌门为优势菌门(94.74%)。这就很好地解释了子囊菌门在酒精发酵初期酒醅中相对丰度最高的原因。其余真菌门相对丰度较小,山西老陈醋工艺酒醅样品中担子菌门、Unclassified、毛霉门、被孢霉门的平均相对丰度分别为0.07%、0.04%、0.03%、8.04×10-6%;而在怀仁醋酿造工艺酒醅样品中担子菌门、Unclassified、毛霉门、被孢霉门及球囊菌门的平均相对丰度分别为1.11%、0.13%、0.07%、0.05%、7.88×10-5%。
2.3.2 基于属水平的真菌群落结构
从山西老陈醋工艺和怀仁醋酿造工艺酒醅样品分别注释到46个属和64个属。由图5可知,两种工艺酒醅样品的真菌组成差别非常大。在山西老陈醋工艺酒醅样品中的第一优势真菌属为未确定分类地位类群(Unclassified)(82.82%),其次是维克汉姆酵母属(Wickerhamomyces)(7.40%),之后是红曲霉属(Monascus)(3.12%)、念珠菌属(Candida)(2.91%)、曲霉属(Aspergillus)(1.96%)、嗜热子囊菌属(Thermoascus)(0.59%)、Others(0.51%)、哈萨克斯坦酵母属(Kazachstania)(0.44%)、链格孢属(Alternaria)(0.18%)、枝孢霉属(Cladosporium)(0.04%)等。而在怀仁醋酿造工艺酒醅样品中,第一优势真菌属则是哈萨克斯坦酵母属(75.08%),其次是Unclassified(14.21%),之后是曲霉属(3.48%)、念珠菌属(1.95%)、青霉属(1.35%)、Cystofilobasidium(0.96%)、嗜热子囊菌属(0.46%)、维克汉姆酵母属(0.39%)、枝孢霉属(0.24%)、Pseudallescheria(0.23%)等。范三红等[2]研究发现,伊萨酵母属(Issatchenkia)和曲霉属是山西陈醋酒精发酵阶段的优势真菌属;在发酵第3天,伊萨酵母属的相对丰度达到67.2%。与本研究结果有很大区别,造成这些差异可能与生产工艺、原料、地理位置、气候等多种因素有关。
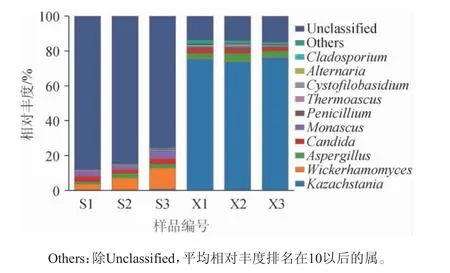
图5 基于属水平两种工艺酒醅样品中真菌菌群结构Fig. 5 Fungi community structure of fermented grain samples from two kinds of processes at genus level
作为山西老陈醋工艺酒醅样品中的第二优势真菌属,维克汉姆酵母属在提升红心曲糖化力、液化力和酒体风味方面起到正向作用[19]。第三优势真菌属—红曲霉能分泌酶、脂肪酸、有机酸等多种物质[20-21]。而怀仁醋酿造工艺酒醅样品中第一优势真菌属—哈萨克斯坦酵母属被证实与清香型白酒酒醅中酸类代谢呈正相关,而与酯类代谢呈负相关[22]。第二优势真菌属—曲霉属有很强的糖化酶和淀粉酶活力[23-24],还与酸性蛋白酶和纤维素酶活力呈正相关[25],也与异戊醇、异丁醇、乙酸乙酯等风味成分的形成有关[26],还与特香型大曲的酸度和品温呈正相关[27]。第三优势真菌属—念珠菌属,是浓香型大曲制备初始阶段的差异真菌[25],在特香型大曲中与酯化力、糖化力和液化力呈正相关[27]。由此可见,两种酿造工艺酒醅样品中优势真菌属的作用不同,从而导致成品食醋口感和风味的差异。
一般认为,大曲是食醋发酵过程中真菌种群的主要来源。本研究中山西老陈醋的大曲与汾酒大曲一脉相连。甄攀等[28]研究发现,汾酒大曲的优势真菌属是毕赤酵母属(Pichia)和覆膜孢酵母属(Saccharomycopsis)。罗惠波等[29]基于ITS基因文库法研究发现,汾酒大曲的优势真菌为毕赤酵母属、根霉属和横梗霉属(Lichtheimia)。综上可知,不同醋厂的大曲中主要真菌差异较大。而本研究的怀仁醋酿造工艺中除使用灯山井大曲外,还额外添加了糖化酶与酵母菌。这就从源头上造成了山西老陈醋工艺酒醅与怀仁醋酿造工艺酒醅中真菌群落结构的区别。
2.4 基于属水平两种工艺酒醅样品中真菌菌群的方差分析
山西老陈醋工艺和怀仁醋酿造工艺酒醅样品中真菌菌群在属水平(P值最小的前20个物种)的组间方差分析结果见表3。由表3可知,在两种工艺酒醅样品中平均相对丰度差异极显著的真菌属有:Unclassifed、毕赤酵母属、哈萨克斯坦酵母属、Cystofilobasidium、Cladosporium和被孢霉属(Mortierella)(P<0.01)。
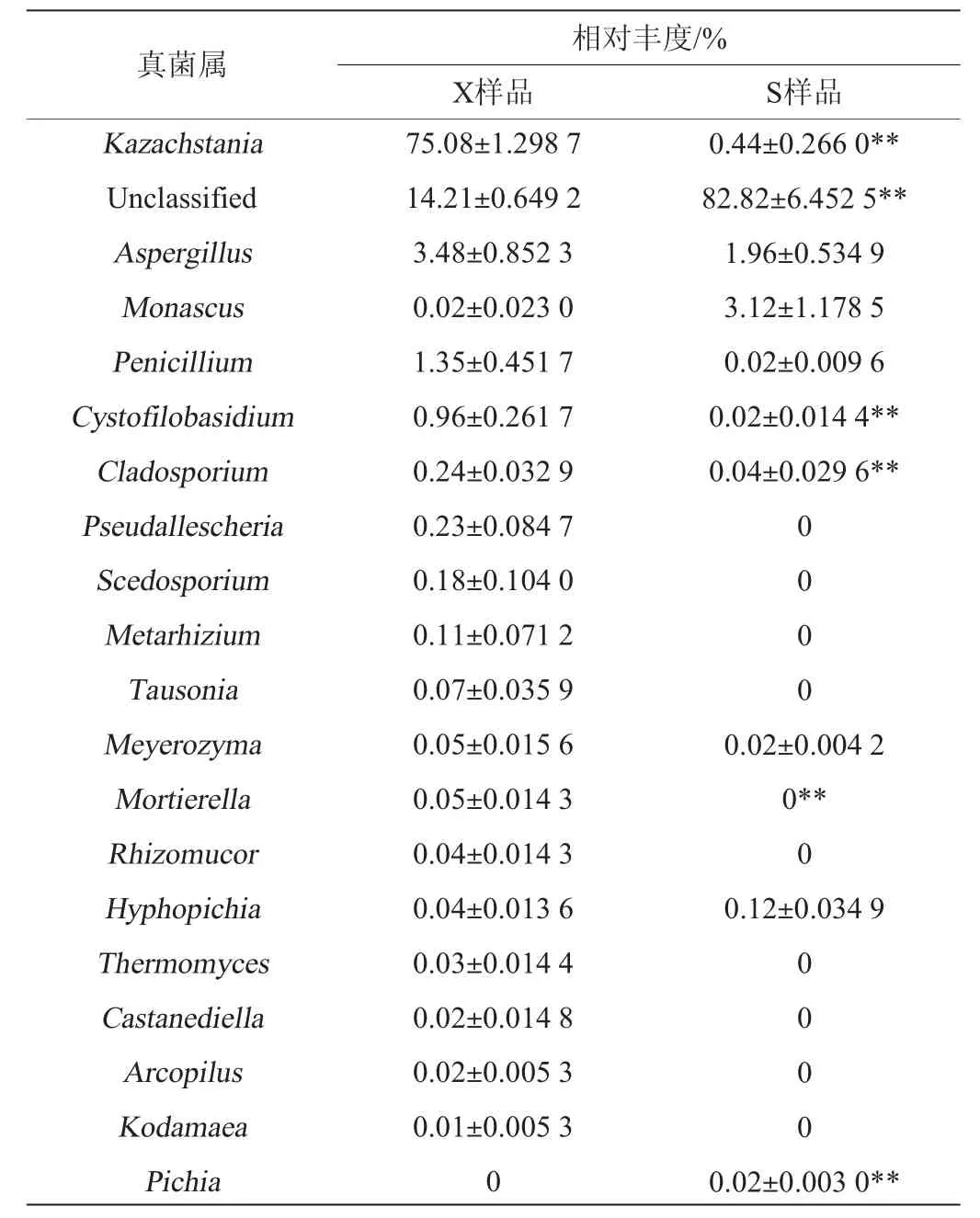
表3 基于属水平两种工艺酒醅样品中真菌菌群的方差分析结果Table 3 Results of variance analysis of fungi community in fermented grain samples from two kinds of processes at genus level
Unclassifed在山西老陈醋工艺酒醅样品中的平均相对丰度(82.82%)极显著高于怀仁醋工艺酒醅样品的平均相对丰度(14.21%)(P<0.01)。毕赤酵母属(Pichia)在山西老陈醋工艺酒醅样品中的平均相对丰度为0.02%,而在怀仁醋酿造工艺酒醅样品中未发现。而哈萨克斯坦酵母属、Cystofilobasidium、Cladosporium、被孢霉属则正好相反,在山西老陈醋工艺酒醅样品中的平均相对丰度(0.44%、0.02%、0.04%、0)极显著低于怀仁醋酿造工艺酒醅样品的相对丰度(75.08%、0.96%、0.24%、0.05%)(P<0.01)。NIEZ Q等[10]对山西老陈醋的研究发现,Cladosporium在酒精发酵初期未检测到,只出现在醋酸发酵初期。
2.5 基于属水平两种工艺酒醅样品中真菌菌群的相关性分析
物种相关性网络图是根据每个样品中每个真菌属的丰度及变化情况绘制的,可直观明确物种在环境中的共存关系[30],正相关的物种间是互利共生关系[31],而负相关的物种间是竞争关系[32]。对山西老陈醋和怀仁醋两种工艺酒醅样品真菌中相关性最高的前50个真菌属(P<0.05)绘制相关性网络图,结果见图6。
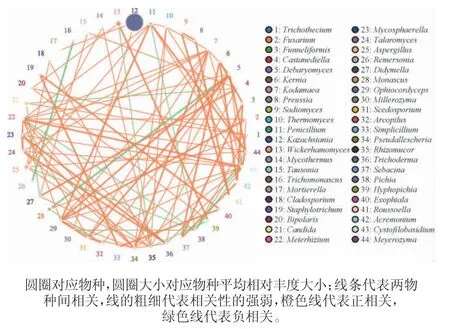
图6 基于属水平两种工艺酒醅样品中真菌菌群间的相关性分析网络图Fig. 6 Network diagram of correlation analysis between fungi community in fermented grain samples from two kinds of processes at genus level
由图6可知,与其他物种联系度居首的是Cystofilobasidium,联系度排第二的是Metarhizium,联系度排第三的是Kodamaea、Pseduallescheria和Rhizomucor。在山西老陈醋工艺酒醅样品中,仅次于Unclassified、平均相对丰度排第二的维克汉姆酵母属,与丝孢毕赤酵母属(Hyphopichia)呈高度正相关,与离蠕孢属(Bipolaris)呈正相关;而与Rhizomucor呈负相关。丝孢毕赤酵母属在特香型大曲中与酯化力、糖化力、酸度和品温呈正相关;Rhizomucor与特香型大曲的酸度和品温呈正相关[27]。平均相对丰度排第三的红曲霉属与单端孢属(Trichothecium)呈正相关,单端孢属是浓香型白酒新窖泥的优势真菌属[34];而与Arcopilus呈高度负相关,与德巴利酵母属(Debaryomyces)呈负相关,德巴利酵母属是酱香型青稞大曲中的优势属[35]。在怀仁醋酿造工艺的酒醅中,平均相对丰度排第一的哈萨克斯坦酵母属与被孢霉呈高度正相关,与Millerozyma呈正相关;平均相对丰度排第二的曲霉属与嗜热链球菌属(Mycothermus)呈高度正相关,与枝孢霉属、青霉属、Meyerozyma和Rhizomucor呈正相关;而与毕赤酵母属呈负相关。平均相对丰度第三的念珠菌属与单端孢属呈正相关;而与Didymella和Castanediella呈负相关。
综上,食醋酿造过程中真菌类群的变化会对相关酶系的活力、大曲的理化性质造成直接影响,从而进一步影响发酵产物的质量。因此,后续研究食醋酿造过程中的真菌之间的作用方式对食醋酿造工艺的改进具有直接指导意义。
3 结论
本研究利用高通量测序技术对山西老陈醋工艺和怀仁醋酿造工艺酒精发酵初期酒醅样品的真菌菌群多样性及组成进行分析。结果发现,怀仁醋酿造工艺酒醅样品的真菌菌群多样性及丰富度更高。两种工艺酒醅样品的真菌菌群组成有较大差异,山西老陈醋工艺酒醅样品的优势类群分别是未确定分类地位(Unclassified)、维克汉姆酵母属、红曲霉属等;而在怀仁醋酿造工艺酒醅样品中的优势类群则分别是哈萨克斯坦酵母属、Unclassified、曲霉属等。在两种工艺酒醅样品中差异显著的真菌类群为Unclassifed、毕赤酵母属、哈萨克斯坦酵母属、Cystofilobasidium、Cladosporium和被孢霉属。物种相关性分析表明,Cystofilobasidium、Metarhizium、Kodamaea、Pseduallescheria和Rhizomucor与其他物种联系密切。

