基于指纹图谱和多成分定量结合化学模式识别的莲房药材质量评价
黄 雅,王保锦,王 乐,高 晔,崔艺彤,王朝慧,刘宇琦,常子豪,刘 越,张兰珍
基于指纹图谱和多成分定量结合化学模式识别的莲房药材质量评价
黄 雅,王保锦,王 乐,高 晔,崔艺彤,王朝慧,刘宇琦,常子豪,刘 越*,张兰珍*
北京中医药大学中药学院北京 102488
建立不同产地莲房的HPLC指纹图谱及多成分含量测定方法,结合化学模式识别法评价不同产地莲房药材质量。采用Welch Ultimate®Polar-RP(250 mmÍ4.6 mm,3 μm)色谱柱,以甲醇-乙腈(1∶2,A)-0.2%甲酸水溶液(B)为流动相,柱温40 ℃,体积流量0.6 mL/min,检测波长270 nm,绘制20批不同产地的莲房药材的指纹图谱,应用SPSS 26.0和SIMCA 14.1软件结合化学模式识别,聚类分析(cluster analysis,CA)、主成分分析(principal component analysis,PCA)、正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)、优劣解距离法(technique for order preference by similarity to ideal solution,TOPSIS)对不同产地莲房样品进行质量评价,并测定6种主要成分的含量。20批HPLC指纹图谱共匹配出17个共有峰,分别指认出儿茶素、荷叶碱、-去甲荷叶碱、金丝桃苷、异槲皮苷、槲皮素-3--葡萄糖醛酸苷和紫云英苷7个成分;指纹图谱相似度在0.546~0.991,CA将20批莲房分为3类;PCA、OPLS-DA与TOPSIS分析结果为产于安徽芜湖、江西赣州、山东微山湖的药材质量较好;并分析筛选出荷叶碱、-去甲荷叶碱和儿茶素等5个成分为引起不同产地质量差异的标志性成分。莲房中6个主要成分儿茶素、荷叶碱、-去甲荷叶碱、金丝桃苷、异槲皮苷和槲皮素-3--葡萄糖醛酸苷的质量分数分别为0.029%~0.958%、0.007%~0.137%、0.013%~0.104%、0.015%~0.282%、0.008%~0.110%、0.027%~0.541%。建立的莲房HPLC指纹图谱操作简便、结果可靠,儿茶素、荷叶碱、-去甲荷叶碱、金丝桃苷、异槲皮苷和槲皮素-3--葡萄糖醛酸苷可以作为莲房质量评价的主要指标性成分。
莲房;化学模式识别;含量测定;儿茶素;荷叶碱;-去甲荷叶碱;金丝桃苷;异槲皮苷;槲皮素-3--葡萄糖醛酸苷
莲房为睡莲科植物莲Gaertn.的干燥花托,性温、味苦、涩,归肝经。具有化瘀止血功能,主治崩漏、尿血、痔疮出血、产后瘀阻、恶露不尽等症[1]。现代研究表明,莲房中含有黄酮类、生物碱类、酚酸类、原花青素类和有机酸类等成分,具有抗氧化、抗炎、抗肿瘤、抗辐射、保护心脏和肝脏等作用[2-3]。
目前报道的莲房药材质量研究仅有HPLC法测定黄酮类化合物槲皮素和金丝桃苷含量[4],HPLC法测定荷叶碱的含量[5],且《中国药典》2020年版中无含量测定项。为了有效控制莲房药材的质量,本研究建立20批莲房药材HPLC指纹图谱,结合聚类分析(cluster analysis,CA)、主成分分析(principal component analysis,PCA)、正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)等化学模式识别技术对不同产地莲房样品进行质量评价,并对莲房6个主要成分包括4个黄酮类成分儿茶素、金丝桃苷、异槲皮苷、槲皮素-3--葡萄糖醛酸苷和2个生物碱成分荷叶碱和-去甲荷叶碱进行HPLC含量测定,为莲房药材质量控制提供参考。
1 材料
1.1 仪器
Waters Alliance e2695 高效液相色谱仪(美国Waters公司);Empower 3色谱工作站;2998型PDA紫外检测器;Welch Ultimate® Polar-RP(250 mm Í4.6 mm,3μm)色谱柱;Sartorious BT25S型电子天平(十万分之一,北京赛多利斯仪器系统有限公司);OHAUS AX124ZH电子天平(万分之一,常州奥豪斯仪器有限公司);KQ5200E型超声波清洗器(昆山市超声仪器有限公司)。
1.2 试剂
对照品金丝桃苷(批号D22041511,质量分数≥98%)购自南京狄尔格医药科技有限公司;异槲皮苷对照品(批号PS011802,质量分数≥98%)购自成都普思生物科技股份有限公司;槲皮素-3--葡萄糖醛酸苷对照品(批号ST78770120,质量分数≥98%)购自上海诗丹德标准技术服务有限公司;紫云英苷(批号20010763,质量分数≥98%)购自北京倍特仁康生物科技有限公司;荷叶碱(批号N06GB166466,质量分数≥98%)、-去甲荷叶碱对照品(批号P10N11L126430,质量分数≥98%)购自上海源叶生物科技有限公司,乙腈(美国Fisher公司,色谱纯)、甲醇(美国Fisher公司,色谱纯),无水乙醇(色谱纯,天津市大茂化学试剂厂)、甲酸(色谱纯,天津市大茂化学试剂厂)。
20批莲房药材产地来源见表1,经北京中医药大学张媛教授鉴定为莲Gaertn.的干燥花托,样品购买后,密封保存,粉碎后过3号筛后,置于干燥器中备用。
2 方法与结果
2.1 溶液制备
2.1.1 供试品溶液的制备 称取莲房药材粉末(粉碎后过3号筛)0.5 g,精密称定,置具塞锥形瓶中,精密加入70%甲醇50 mL,称定质量,超声处理60 min,放冷,再称定质量,用70%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。进样前经0.22 μm微孔滤膜滤过。
2.1.2 对照品溶液的制备 分别精密称取对照品儿茶素、金丝桃苷、异槲皮苷、槲皮素-3--葡萄糖醛酸苷、荷叶碱、-去甲荷叶碱和紫云英苷适量,分别放入10 mL量瓶中,甲醇溶解稀释至刻度,得到儿茶素(0.527 mg/mL)、金丝桃苷(0.49 mg/mL),异槲皮苷(0.512 mg/mL)、槲皮素-3--葡萄糖醛酸苷(0.52 mg/mL)、荷叶碱(0.525 mg/mL)、-去甲荷叶碱(0.568 mg/mL)和紫云英苷(0.31 mg/mL)。
2.2 指纹图谱的建立
2.2.1 色谱条件 Welch Ultimate® Polar-RP(250 mmÍ4.6 mm,3μm)色谱柱,流动相为甲醇-乙腈(1∶2,A)-0.2%甲酸水溶液(B),洗脱梯度:0~15 min,5%~12.5% A;15~35 min,12.5%~20%A;35~75 min,20%~35% A;75~85 min,35%~80% A;体积流量0.6 mL/min;检测波长270 nm;柱温40 ℃;进样量20 μL。
2.2.2 精密度试验 取样品(S20),按照“2.1.1”项下方法制备,得到莲房供试品溶液,连续进样6次,以N-去甲荷叶碱(7号峰)为参照峰,测得莲房中共有峰的相对保留峰面积RSD值小于2.89%,共有峰的相对保留时间RSD值小于0.10%,表明仪器精密度良好。
2.2.3 重复性试验 取样品(S20),按照“2.1.1”项下方法制备,制备莲房供试品溶液6份,分别进样,以-去甲荷叶碱(7号峰)为参照峰,测得莲房中共有峰的相对保留峰面积RSD值小于2.98%,共有峰的相对保留时间RSD值小于0.34%,表明该方法重复性良好。
2.2.4 稳定性试验 取样品(S20),按照“2.1.1”项下方法制备莲房供试品溶液,分别于制备后0、4、8、12、24 h进行测定,以-去甲荷叶碱(7号峰)为参照峰,测得莲房中共有峰的相对保留峰面积RSD值小于2.77%,共有峰的相对保留时间RSD值小于0.35%,表明样品稳定性良好。
2.2.5 HPLC指纹图谱的建立和共有峰的指认 将HPLC数据导入软件《中药色谱指纹图谱相似度评价系统》(Version 2012.130723,中国国家药典委员会),建立HPLC指纹图谱并进行相似度分析,以S1为参照图谱,采用平均数法,时间窗宽度为0.1,经过多点校正,生成指纹图谱,其中,标定出17个共有峰,指认了7个峰,依次为儿茶素(4号峰)、荷叶碱(6号峰)、-去甲荷叶碱(7号峰)、金丝桃苷(9号峰),异槲皮苷(10号峰),槲皮素-3--葡萄糖醛酸苷(11号峰)和紫云英苷(15号峰),20批莲房的HPLC叠加指纹图谱、混合对照品和对照指纹图谱(R)的HPLC见图1和图2。
2.2.6 指纹图谱相似度评价 采用中药色谱指纹图谱相似度评价系统对莲房进行相似度分析,相似度评价结果见表2,莲房样品中7号峰(-去甲荷叶碱)的出峰时间相对稳定,分离度较好,是莲房药材的指标性成分。所以选择7号峰(-去甲荷叶碱)作为参照峰,计算得到20批药材的共有峰的相对保留时间和相对保留峰面积。结果表明,共有峰的相对保留峰面积存在巨大的差异,但是共有峰的相对保留时间的RSD<3%,样品相似度为0.546~0.991,其中有5批药材的相似度小于0.9,分别为S6、S7、S9、S11、S18,其余15批相似度评价结果均在0.9以上,表明莲房药材在市面上的质量存在一定的差异。

图1 20批次不同产地莲房HPLC叠加指纹图谱和对照指纹图谱(R)
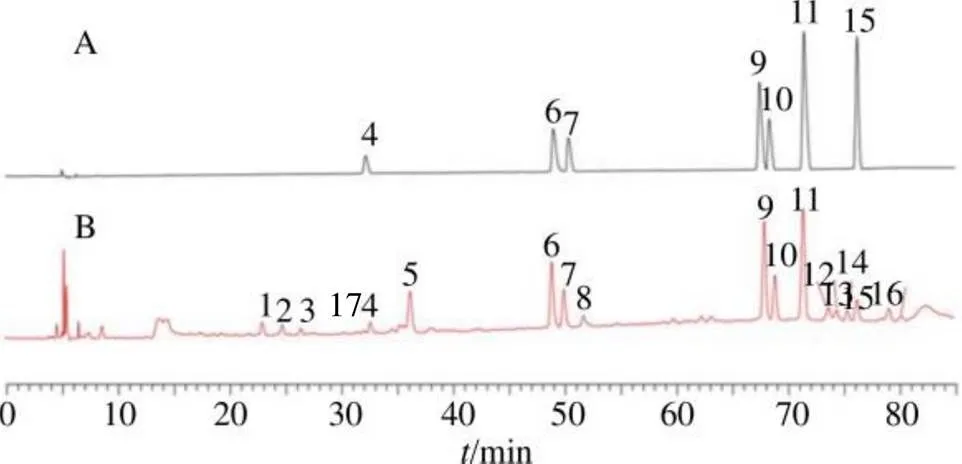
4-儿茶素;6-荷叶碱;7-N-去甲荷叶碱;9-金丝桃苷;10-异槲皮苷; 11-槲皮素-3-O-葡萄糖醛酸苷;15-紫云英苷。
2.3 化学模式识别
2.3.1 HCA 以20批莲房药材共有峰的峰面积作为变量,将色谱数据导入SPSS 26.0软件中,采用组间连接,平方欧式距离法进行系统聚类分析,结果如图3所示,当欧氏距离为20时,所有莲房样品可以聚为3类,从结果可以看出,S1(安徽芜湖)单独聚为一类,其共有峰峰面积为所有批次中最大,聚为第1类,S15(江西鄱阳),S17(山东微山湖),共有峰峰面积较其他批次大,仅小于S1,故聚为第2类,S2~S14、S16共有峰峰面积无较大差异,则聚为第3类。
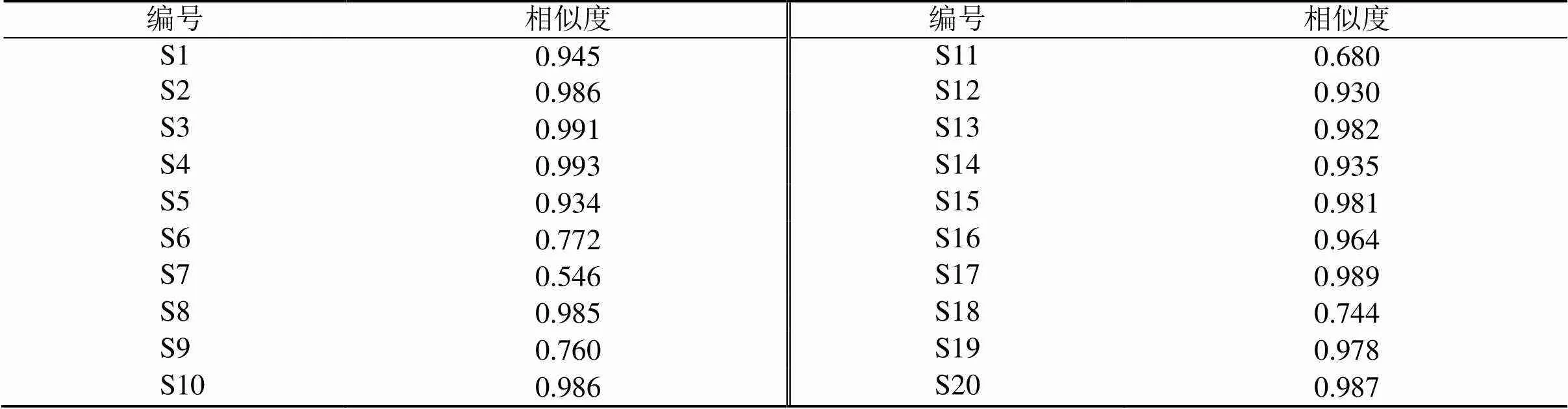
表2 20批莲房药材相似度评价结果

图3 20批莲房药材系统聚类分析图
2.3.2 PCA 将20批莲房的共有峰的峰面积导入SPSS 26.0和SIMCA14.1软件,对药材进行主成分分析[6]。从Bartlett球形检定显示显著性<0.05说明研究数据适合进行主成分分析,以主成分特征值>1作为提取标准,得到相关性矩阵共提取得到3个主成分碎石图见图4,其累积方差贡献率为85.539%,说明可以使用这3个成分的含量来对莲房进行质量评价,其特征值与贡献率见表3。
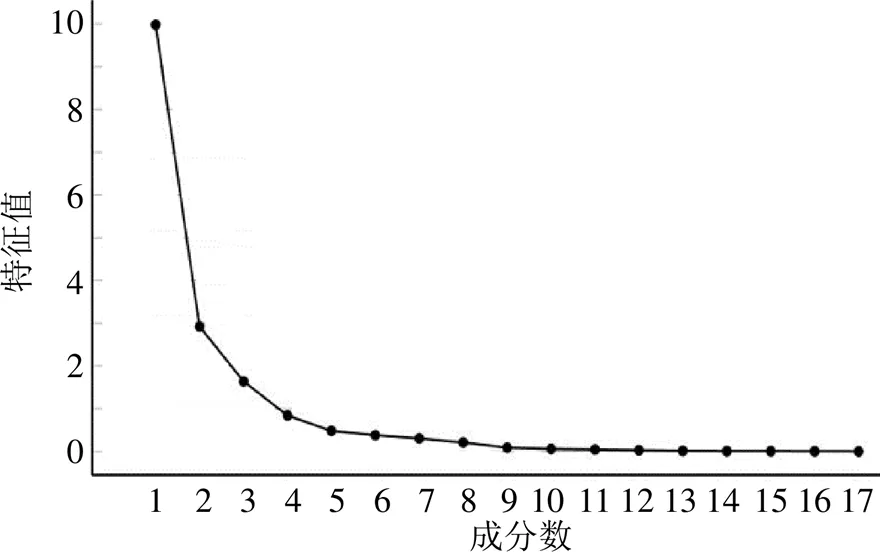
图4 莲房药材PCA碎石图

表3 特征值与方差贡献率
从因子载荷矩阵(表4)可以得知,主成分1主要反应了色谱峰1、2、3、4、5、6、8的信息、主成分2主要反应了色谱峰10、11、12、14、15的信息,主成分3主要反应了峰7、9、13、16、17的信息。
运用SPSS 26.0软件计算20批莲房样品的主成分得分,以各成分所对应的贡献率作为权重进行排序,计算综合得分并进行排序,结果见表5,主成分排名最高的3个批次,分别是S15、S1、S17,也是所有批次中峰面积最高的3个批次成分。
将20批莲房样品的17个共有峰峰面积导入SIMCA 14.1,经分析得到PCA得分图,由图5可知,所有数据均在置信区间内,结果可以得知S1、S15、S17、与其他批次有区分明显,其中S1位于第4象限,而S15与S17位于第2象限,表明这3批中S15与S17样本相似性更大,其结果与聚类分析结果基本一致。

表5 20批莲房的主成分得分和排序
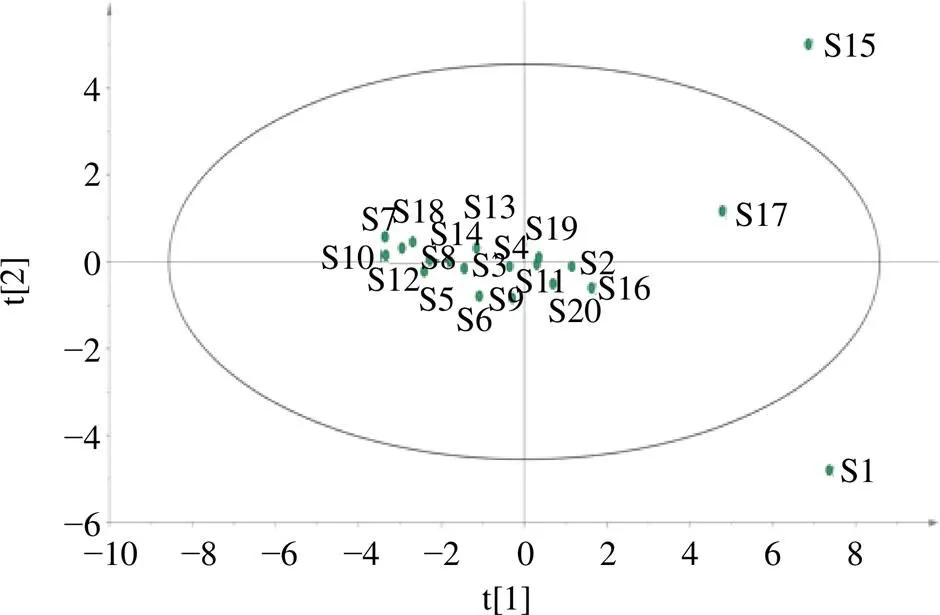
图5 20批莲房PCA得分图
2.3.3 OPLS-DA OPLS-DA分析能够更好的体现不同样本之间的差异,筛选出对组件差异具有较大贡献率的成分,采用SIMCA 14.1软件,将莲房共有峰峰面积作为变量导入软件,进行建模分析,模型得分见图6。本次分析中自变量拟合指数(2)为0.820,因变量拟合指数(2)为0.954,模型预测指数(2)为0.506,2与2均大于0.5表示模型可接受,经过200次置换实验[7],置换检验图如图7所示,2与纵轴的相交点为负值,表明模型不存在过拟合现象,模型验证有效。在置信区间内,根据OPLS-DA模型中得到的VIP值,VIP得分图如图8所示,筛选出VIP值大于1的成分,按照大小排序分别为15(紫云英苷)、6(荷叶碱)、8、12号峰、7(-去甲荷叶碱),表明5个成分在批次中差异较大。
2.3.4 优劣解距离法(technique for order preference by similarity to ideal solution,TOPSIS)分析 将20批莲房样品的17个共有峰峰面积作为原始数据,采用熵权法作为变量权重,TOPSIS权重计算结果和TOPSIS评价计算结果[8]见表6、7,TOPSIS分析结果显示在17个峰中权重排名前3的峰为15(紫云英苷)、6(荷叶碱)和4(儿茶素),表明这3个成分对批次差异的贡献率较高,在评价计算结果中,S1(安徽芜湖)、S15(江西赣州)、S17(山东微山湖)排名前3,与所收集的其他批次区分开来。
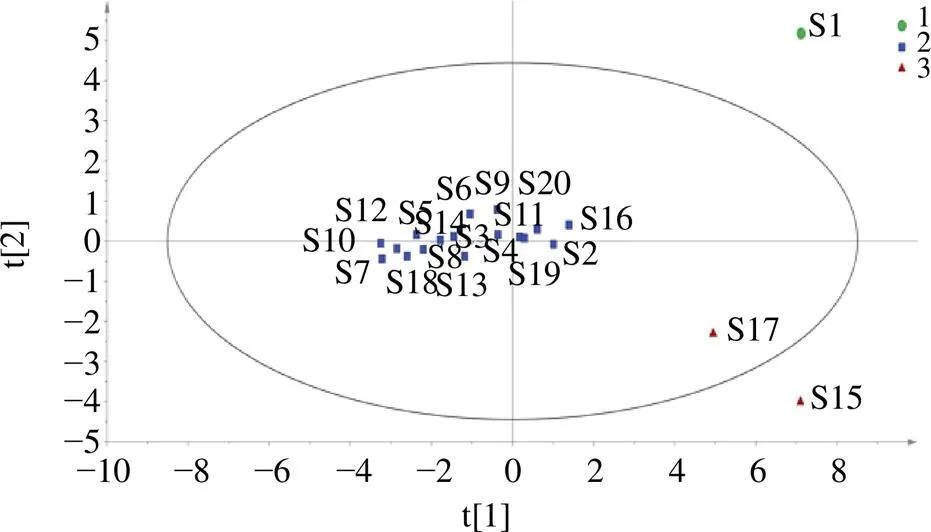
图6 20批莲房OPLS-DA得分图
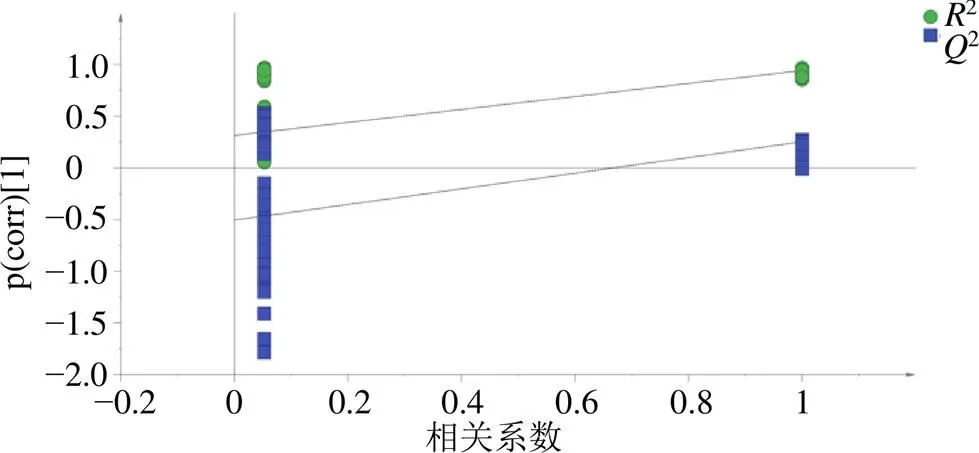
图7 20批莲房OPLS-DA置换检验
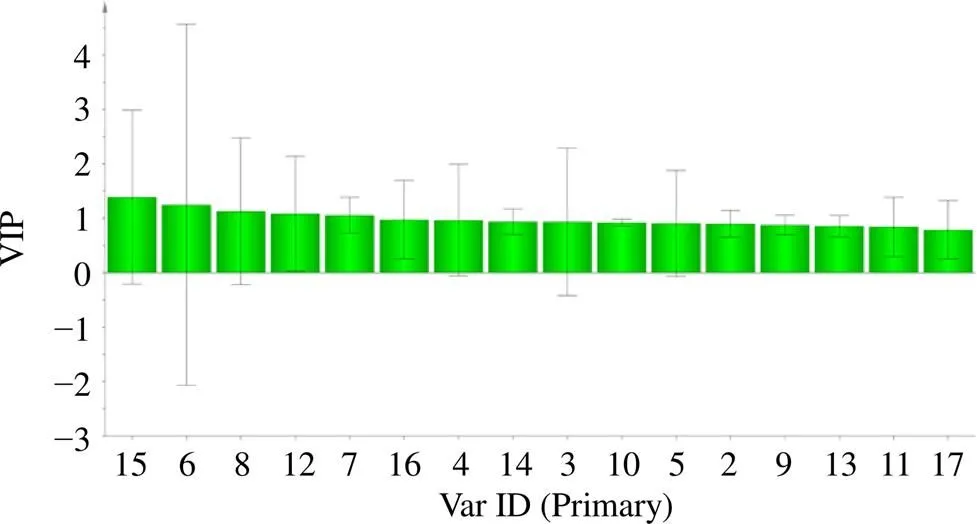
图8 20批莲房VIP得分图
2.4 莲房主要成分含量测定
基于化学模式识别分析,筛选得到造成产地质量差异的主要成分,同时,根据中药质量标志物(Q-marker)确定的原则[9],Q-marker为药材中存在的与功效相关的标志性成分,其中有研究表明金丝桃苷和异槲皮苷[10]对体外凝血功能具有一定的影响,槲皮素-3--葡萄糖醛酸苷对体内血小板具有一定的调节作用[11],因此确定荷叶碱、-去甲荷叶碱、儿茶素、金丝桃苷,异槲皮苷和槲皮素-3--葡萄糖醛酸苷为莲房中潜在的Q-marker,建立含量测定方法,并对来自于不同产地莲房中的6个成分进行含量测定[12]

表6 TOPSIS权重计算结果
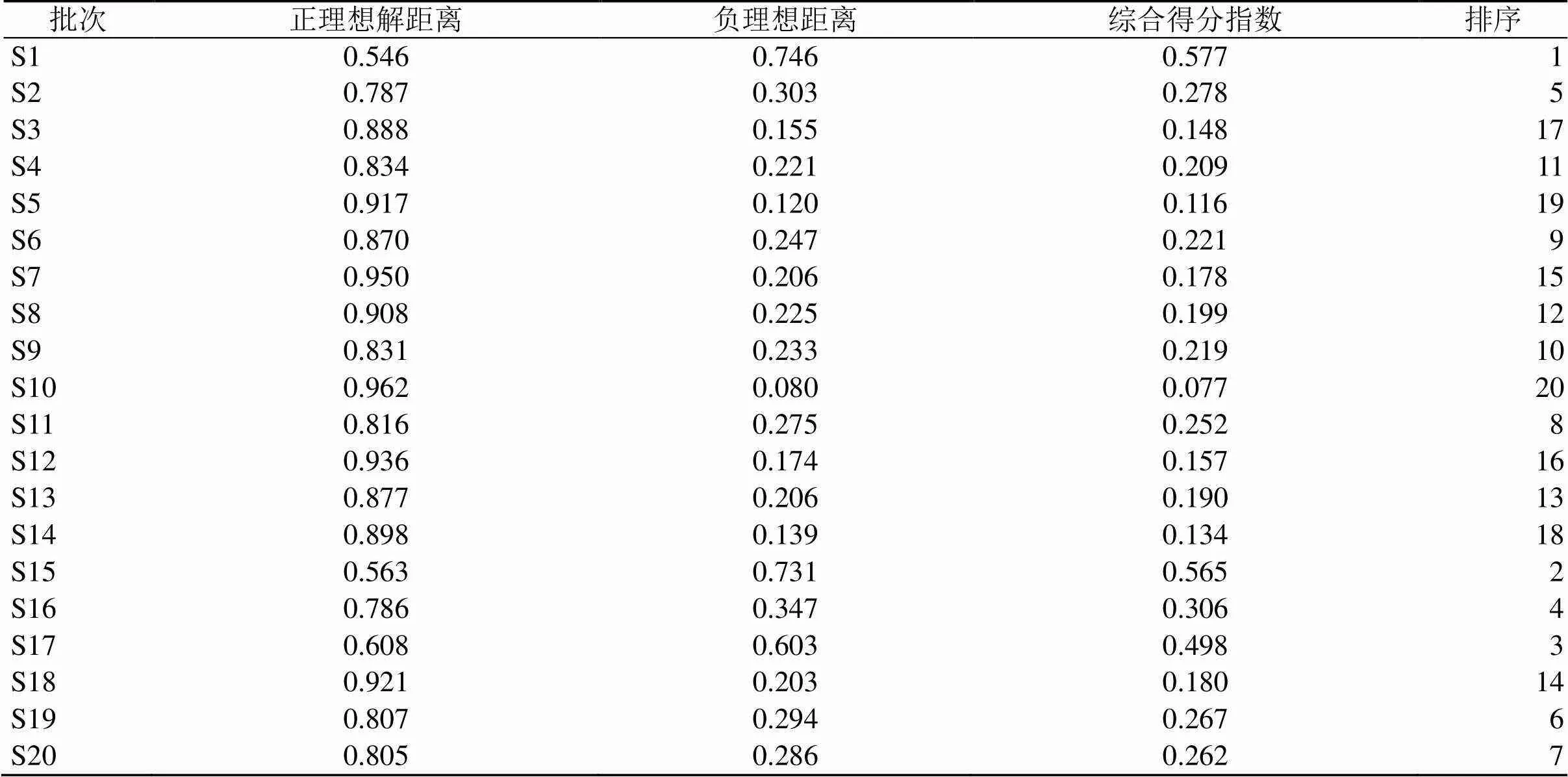
表7 TOPSIS评价计算结果
2.4.1 色谱条件 Welch Ultimate®Polar-RP(250 mmÍ4.6 mm,3 μm)色谱柱,流动相为甲醇-乙腈(1∶2)(A)-0.2%甲酸(B),洗脱梯度:0~8 min,10%~20% A;8~50 min,20%~35% A,50~55 min,35%~50% A,体积流量0.6 mL/min;检测波长270 nm;柱温40 ℃;进样量20 μL。按照“2.1”项制备方法制备样品。
2.4.2 专属性考察 取“2.1”项下对照品及供试品溶液,按照“2.4.1”项下色谱条件进样分析,供试品与对照品色谱峰保留时间基本一致,说明该方法专属性良好,色谱图见图9。
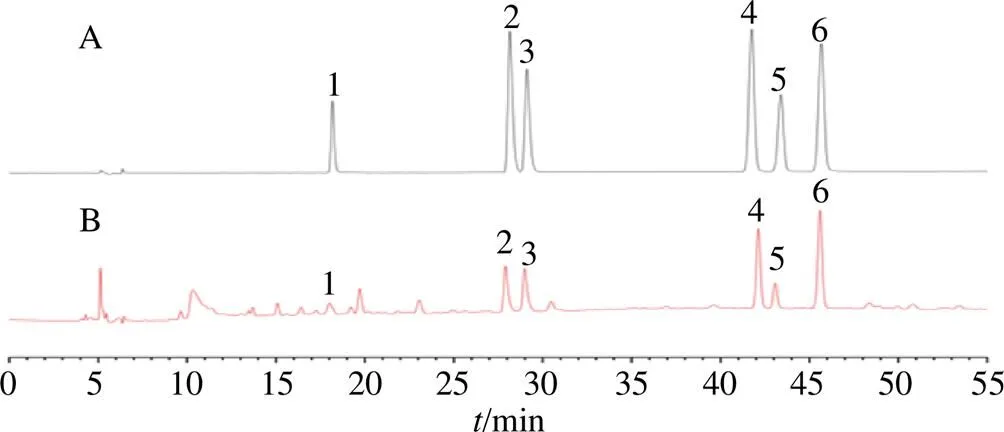
1-儿茶素;2-荷叶碱;3-N-去甲荷叶碱;4-金丝桃苷;5-异槲皮苷;6-槲皮素-3-O-葡萄糖醛酸苷。
2.4.3 线性关系考察 分别精密量取“2.1.2”项下对照品溶液适量,加甲醇定量稀释,稀释成含有金丝桃苷1.568、3.92、7.84、15.68、31.36、62.72 μg/mL,异槲皮苷0.813、2.0323、4.064、8.129、16.258、32.516 μg/mL,槲皮素-3--葡萄糖醛酸苷2.60、5.20、10.40、20.80、41.60、83.20 μg/mL,荷叶碱0.42、2.10、4.20、8.40、16.80、33.60 μg/mL,-去甲荷叶碱1.136、2.272、4.544、9.088、18.17、36.34 μg/mL,按“2.4.1”项下色谱条件进样测定,以质量浓度为横坐标(),色谱峰峰面积为纵坐标(),分别绘制标准曲线并进行线性回归,结果见表8。
2.4.4 检测限(LOD)与定量限(LOQ) LOD和LOQ根据以下公式计算:LOD=3 σ/S,LOQ=10 σ/S,其中σ是线性回归方程标准曲线的截距的标准偏差,S是线性回归方程标准曲线的斜率,计算结果见表9。
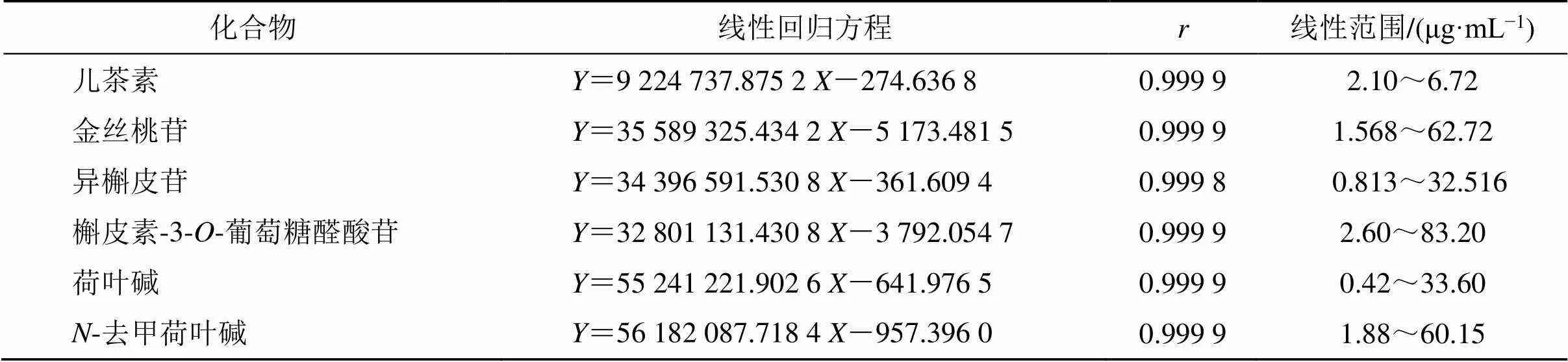
表8 6种成分线性关系及相关系数
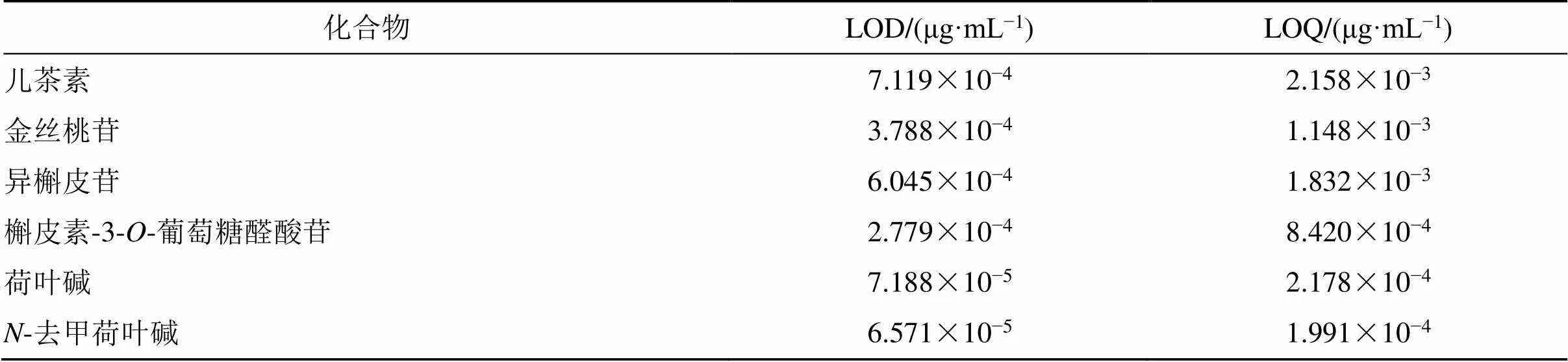
表9 6种成分的检测限和定量限
2.4.5 精密度考察 取批号S20的莲房药材供试品溶液,按照“2.1.1”项下方法备莲房供试品溶液,按照“2.4.1”项下的色谱条件进样测定,连续测定6次,记录峰面积,分别计算RSD,结果显示儿茶素、荷叶碱、-去甲荷叶碱、金丝桃苷,异槲皮苷和槲皮素-3--葡萄糖醛酸苷的峰面积RSD值分别为2.43%、1.27%、1.32%、1.49%、2.06%、1.42%,表明该仪器精密度良好。
2.4.6 重复性考察 取批号S20的莲房药材粉末按照“2.1.1”项下的莲房供试品制备方法制备6份供试品溶液,按照“2.4.1”项下色谱条件进样,计算各成分RSD,结果显示儿茶素、荷叶碱、-去甲荷叶碱、金丝桃苷、异槲皮苷和槲皮素-3--葡萄糖醛酸苷的峰面积RSD值分别为2.14%、1.13%、1.61%、1.93%、2.40%、1.73%,表明该检测方法重复性良好。
2.4.7 稳定性考察 取样品(S20)的莲房药材粉末,按照“2.1.1”项下方法备莲房供试品溶液,分别于0、2、4、8、12、24 h按照“2.4.1”项下色谱条件进样,分别计算各成分RSD,结果显示儿茶素、荷叶碱、N-去甲荷叶碱、金丝桃苷,异槲皮苷和槲皮素-3--葡萄糖醛酸苷的峰面积RSD值分别为2.75%、2.30%、2.94%、1.90%、2.51%、1.46%,表明该检测方法在24 h内稳定性较为良好。
2.4.8 加样回收率试验 取样品(S20)的莲房药材粉末250 mg,精密称定,共6份,分别精密加入适量对照品溶液,每份加入对照品儿茶素(0.110 mg/mL)、荷叶碱(0.062 5 mg/mL)、-去甲荷叶碱(0.046 mg/mL)、金丝桃苷(0.169 mg/mL)、异槲皮苷(0.070 mg/mL)和槲皮素-3--葡萄糖醛酸苷(0.367 mg/mL)各1 mL,按“2.1.1”项下方法制备供试品溶液,测定各化合物峰面积,各成分的平均回收率为102.96%、102.25%、99.55%、100.28%、99.42%、99.50%,RSD值分别为2.08%、1.52%、2.06%、1.31%、1.67%、2.28%。表明该检测方法准确度符合要求。
2.4.9 样品含量测定 取20个产地莲房药材粉末0.5 g,精密称定,平行制备3份,按照本节“2.1.1”项下制备方法得到供试液,按照“2.4.1”项下色谱条件进样检验,计算儿茶素、金丝桃苷、异槲皮苷,槲皮素-3--葡萄糖醛酸苷、荷叶碱、-去甲荷叶碱的含量,结果见表10,其中20批药材中儿茶素、荷叶碱、-去甲荷叶碱、金丝桃苷、异槲皮苷和槲皮素-3--葡萄糖醛酸苷的平均质量分数为0.143%、0.044%、0.034%、0.123%、0.044%、0.228%;儿茶素分布在0.029%~0.958%、荷叶碱分布在0.007%~0.137%、-去甲荷叶碱分布在0.013%~0.104%、金丝桃苷分布在0.015%~0.282%、异槲皮苷分布在0.008%~0.110%、槲皮素-3--葡萄糖醛酸苷分布在0.027%~0.541%。
含量测定结果表明来自S1(安徽芜湖)、S15(江西赣州)、S17(山东微山湖)3个批次标志性成分含量值和排名前3,按照标志性成分含量之和高低顺序排列S15>S17>S1>S3>S14>S16>S6>S18>S20>S11>S4>S12>S8>S2>S13>S5>S10>S19>S9>S7,标志性成分含量较高的批次在PCA、OPLS-DA与TOPSIS分析中排名也较高,进一步提示儿茶素、荷叶碱、-去甲荷叶碱、金丝桃苷、异槲皮苷和槲皮素-3--葡萄糖醛酸苷可以作为莲房质量评价的指标成分。
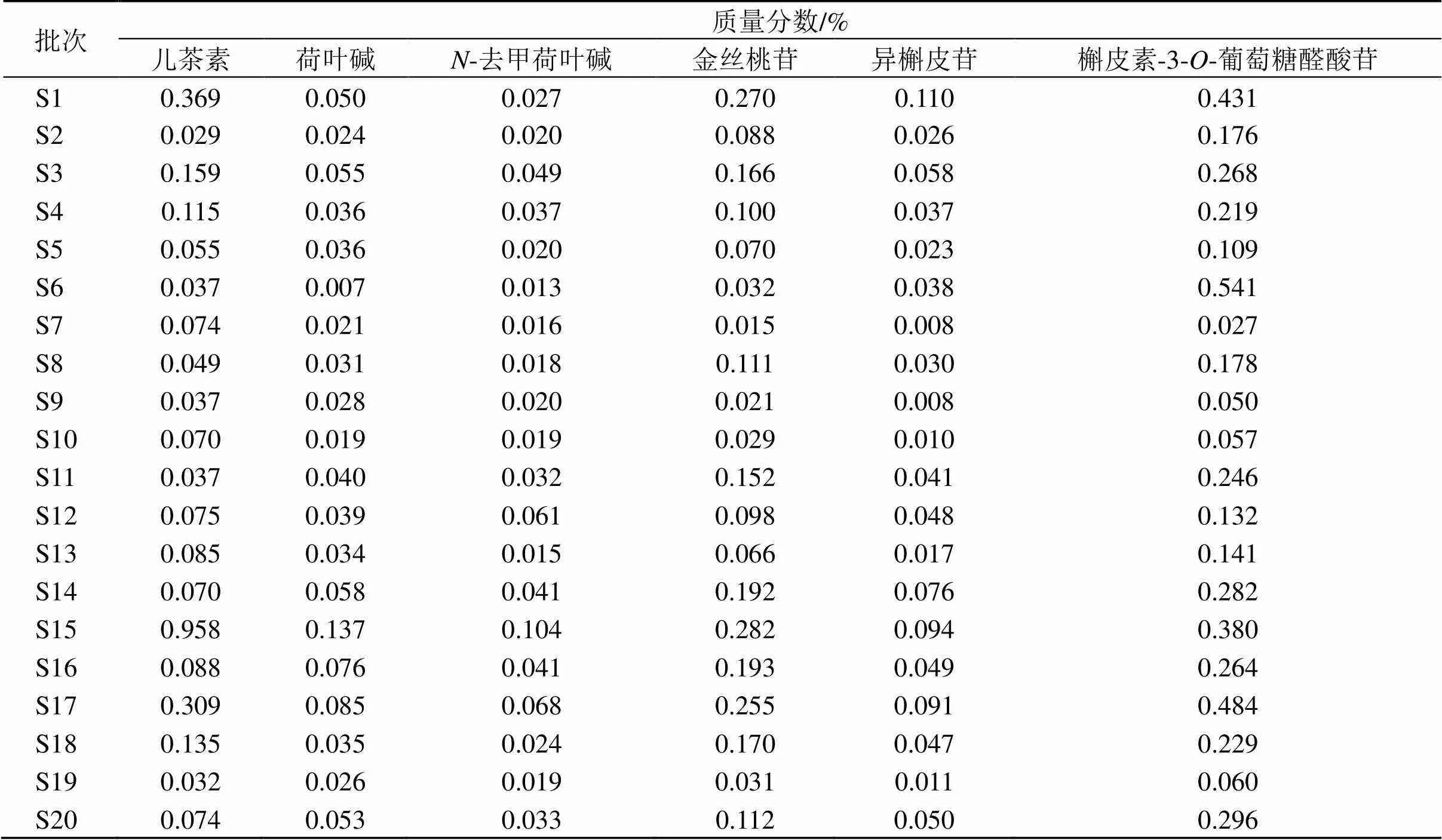
表10 20批莲房药材6种成分的平均含量(n=3)
3 讨论
供试品制备考察了不同提取溶剂(水、50%甲醇、70%甲醇和100%甲醇)、提取方式(超声提取法和加热回流提取法)、提取时间(30、45、60 min)、溶剂提取倍数(0.5 g∶25 mL、0.5 g∶50 mL和0.5 g∶100 mL),检测波长(254、260、270、320 nm)等条件,确定了供试品制备方法,在270 nm下所检测的图谱分离度较好,色谱峰数量较多,可满足分析要求。
本研究建立了不同产地莲房药材HPLC指纹图谱,标定出17个共有峰,相似度大于0.9的有15批样品,小于0.9的有5批样品,表明不同批次药材质量存在一定的差异。通过化学模式识别,得到各批次间含量差异较大的标志性成分。其中,安徽芜湖、山东微山湖和江西赣州的药材与其他批次很易区分开,质量较好。对标志性成分的含量测定方法重复性好,操作简便,方法稳定,可用于莲房药材的质量评价。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 286.
[2] Wang Y F, Shen Z C, Li J,. Phytochemicals, biological activity, and industrial application of lotus seedpod (): A review [J]., 2022, 9: 1022794.
[3] 黄秀琼, 卿志星, 曾建国. 莲不同部位化学成分及药理作用研究进展 [J]. 中草药, 2019, 50(24): 6162-6180.
[4] 吴梅青, 罗栩强, 陈丹, 等. HPLC法同时测定莲房中金丝桃苷和槲皮素的含量 [J]. 广东化工, 2022, 49(12): 192-194.
[5] 杨鹏. HPLC法测定荷叶与莲房中荷叶碱的含量 [J]. 药学研究, 2014, 33(4): 208-209.
[6] 周雯雯, 史银基, 何江, 等. HPLC指纹图谱和多成分定量结合化学模式识别法评价不同生长期刺山柑果质量 [J]. 中草药, 2023, 54(7): 2235-2242.
[7] 杜倩倩, 张铁军, 谢冬梅, 等. 基于指纹图谱结合化学模式识别法对不同种质白芍质量评价 [J]. 中草药, 2023, 54(10): 3292-3301.
[8] 贾银芝, 吴琦, 杨绪芳, 等. 基于灰色关联-TOPSIS法评价不同产地山楂质量 [J]. 中草药, 2021, 52(23): 7317-7322.
[9] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[10] 刘洋, 张学兰, 李慧芬, 等. 荷叶不同饮片黄酮和生物碱类成分对兔体外凝血功能影响的比较 [J]. 中成药, 2014, 36(4): 842-845.
[11] Yu H P, Xia L M, Zhang A P,. Quercetin-3--β--glucuronide inhibits mitochondria pathway-mediated platelet apoptosis via the phosphatidylinositol-3-kinase/AKT pathway in immunological bone marrow failure [J]., 2022, 8(1): 115.
[12] 田盛, 姜璐, 吴婷, 等. 荷叶生物活性效应标志成分分析 [J]. 食品安全质量检测学报, 2022, 13(7): 2105-2112.
Quality evaluation ofbased on fingerprint and multi-component quantification combined with chemical pattern recognition
HUANG Ya, WANG Baojin, WANG Le, GAO Ye, CUI Yitong, WANG Zhaohui, LIU Yuqi, CHANG Zihao, LIU Yue, ZHANG Lanzhen
School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 102488, China
To establish HPLC fingerprint and multi-component content determination method combined with chemical pattern recognition method and evaluate the quality of Lianfang () from different regions.A Welch Ultimate® Polar-RP (250 mm × 4.6 mm, 3 μm) column was used with methanol: acetonitrile =1∶2 (A) -0.2% formic acid aqueous solution (B) as the mobile phase, column temperature 40℃, volume flow rate 0.6 mL/min, detection wavelength 270 nm, and the fingerprint of 20 batches offrom different regions was drawn. SPSS 26.0 and SIMCA 14.1 software combined with chemical pattern recognition, cluster analysis (HCA), principal component analysis (PCA), orthogonal partial least squares discriminant analysis (OPLS-DA) and TOPSIS were used to evaluate the quality ofsamples from different habitats, and the content of six main components was determined..A total of 17 common peaks were matched in 20 batches of HPLC fingerprints, and seven components were identified, namely catechin, nuciferine,-nornuciferine, hyperoside, isoquercitrin, quercitin-3--glucuronide and astragalin. The similarity of fingerprints ranged from 0.546 to 0.991. The 20 batches ofwere divided into three categories by cluster analysis. PCA, OPLS-DA and TOPSIS analysis showed that the medicinal materials from Wuhu of Anhui Province, Ganzhou of Jiangxi province and Weishanhu of Shandong Province were of good quality. Five marker components, including nuciferine,-nornuciferine and catechin, which caused the quality difference in different areas were analyzed and screened. The contents of catechin, nuciferine,-nornuciferine, hyperoside, isoquercitrin and quercetin-3--glucuronide inwere 0.029%—0.958%, 0.007%—0.137%, 0.013%—0.104%, 0.015%—0.282% and 0.008%—0.110%, 0.027%—0.541%.The HPLC fingerprint ofis simple and reliable. Catechin, nuciferine,-nornuciferine, hyperoside, isoquercitrin and quercetin-3--glucuronide can be used as the main index components for the quality evaluation of.
;chemical pattern recognition; catechin; nuciferine;-nornuciferine; hyperoside; isoquercitrin; quercitin-3--glucuronide
R286.2
A
0253 - 2670(2024)09 - 3098 - 09
10.7501/j.issn.0253-2670.2024.09.023
2023-11-02
北京中医药大学纵向科研发展基金项目(2024-ZXFZJJ-JW-010)
黄 雅,女,硕士研究生,研究方向为药效物质基础及其药理作用。E-mail: hya9993@163.com
通信作者:张兰珍,研究员,主要从事中药药效物质与质量控制工作。E-mail: zhanglanzhen01@126.com
刘 越,讲师,主要从事中药药效物质基础及质量控制。E-mail: liuyuebei_002@163.com
[责任编辑 时圣明]

