多组学分析揭示溃疡性结肠炎缓解期脾虚湿困证与活动期湿热阻滞证间的潜在分子机制及靶向中药预测
黎祖鸣,封杰妮,陈雪如,陈剑坤,卢 月,李际强,冯 艳
多组学分析揭示溃疡性结肠炎缓解期脾虚湿困证与活动期湿热阻滞证间的潜在分子机制及靶向中药预测
黎祖鸣1,封杰妮1,陈雪如1,陈剑坤2,卢 月2,李际强2*,冯 艳2*
1. 广州中医药大学第二临床医学院,广东 广州 510405 2. 广州中医药大学第二附属医院(广东省中医院),广东 广州 510006
综合分析溃疡性结肠炎(ulcerative colitis,UC)相关scRNA-seq和RNA-seq数据集,探讨UC缓解期脾虚湿困证与活动期湿热阻滞证间的潜在分子机制,并挖掘潜在干预中药。运用差异基因表达分析和韦恩图鉴定出UC缓解期脾虚湿困证和活动期湿热阻滞证相关基因及两者间的对话基因。通过京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)、基因集变异分析(gene set variation analysis,GSVA)及Spearman相关性分析深入探讨对话基因参与的生物过程及潜在功能。通过单细胞转录组分析探讨UC缓解期与活动期的差异情况及对话基因在其中的作用。基于循环算法构建UC缓解期脾虚湿困证向活动期湿热阻滞证发生发展的风险预测模型。运用外部数据集、动物实验与实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-PCR)进一步验证对话基因的表达情况。借助SoFDA数据库构建“基因-中医症状/现代医学症状”网络;借助TCMIP和COREMINE数据库预测对话基因的潜在靶向中药。鉴定出31个UC缓解期脾虚湿困证相关基因,其主要富集在代谢相关途径;鉴定出160个UC活动期湿热阻滞证相关基因,其主要富集在炎症免疫相关途径。鉴定出22个UC缓解期脾虚湿困证与活动期湿热阻滞证之间的对话基因,上调对话基因与炎症免疫相关途径呈显著相关性,下调对话基因与代谢途径呈显著相关性。单细胞转录组分析显示,相比于正常对照及UC缓解期,UC活动期中B细胞占比上调;B细胞在UC活动期湿热阻滞证中作用贡献较大,而在UC缓解期脾虚湿困证中的作用贡献较小;UC活动期B细胞的受体信号通路活性明显高于UC缓解期;上调的对话基因CD55在B细胞中表达水平较高,CD55+B细胞与CD55−B细胞之间存在差异的细胞通讯及细胞代谢水平。6个风险预测基因(、、、、、)可以较为准确预测UC缓解期脾虚湿困证向UC活动期湿热阻滞证发展,动物实验及RT-PCR验证了其表达水平。通过数据库检索得到人参、黄芪、枸杞子等45味潜在靶向中药。鉴定出22个关键对话基因,它们可能通过影响炎症免疫和代谢相关途径诱导UC缓解期脾虚湿困证向UC活动期湿热阻滞证发展。B细胞在UC缓解期脾虚湿困证向活动期湿热阻滞证发生发展过程中发挥重要作用。CD55可能通过影响炎症免疫和代谢相关途径,促进B细胞活性,从而促进UC缓解期脾虚湿困证向活动期湿热阻滞证发展。22个关键对话基因与UC相关中医症状和现代医学症状关联密切。
溃疡性结肠炎;单细胞转录组;转录组;缓解期;脾虚湿困证;活动期;湿热阻滞证;人参;黄芪;枸杞子
溃疡性结肠炎(ulcerative colitis,UC)是一种影响直肠和结肠的终身炎症性疾病。2023年,全球UC的患病人数估计为500万例,且发病率呈上升趋势[1]。UC是炎症性肠病(inflammatory bowel disease,IBD)的2种类型之一,其特点是从直肠到近端结肠的慢性炎症,该病病程缠绵,活动期与缓解期常交替出现,活动期以腹痛腹泻、黏液脓血便为主要临床表现[2]。祖国医学认为,UC属于“泄泻”“痢疾”和“腹痛”等范畴,脾虚湿困证和湿热阻滞证是UC的两大基本病因病机[3],UC缓解期以脾虚湿困证为主[4],在脾胃虚弱湿邪内蕴的基础上会产生诸多变证[3]。UC活动期以湿热阻滞证为主,大肠湿热易导致血瘀肠络,最后累及脾阳肾阳[3,5]。虽然这些理论已经过临床实践检验,但UC缓解期脾虚湿困证向UC活动期湿热阻滞证的发生发展机制尚不清楚,证候作为中医理论的核心,其生物学基础不清、病证关联机制不明是制约中医药现代化发展的一大瓶颈[6]。
采用现代技术阐述中医证候病理机制,有助于中医药科学内涵的阐释。转录组测序(transcriptome,RNA-seq)是在总体水平上研究细胞中所有基因的转录调节,是基因组遗传信息和生物功能之间的重要桥梁[7],其有利于解释疾病发展过程中某一阶段病理概括的发生发展机制[8]。单细胞转录组测序(single cell transcriptome sequencing,scRNA-seq)已经成为一种研究单细胞分辨率的复杂生物系统的强大技术,其出现使得在单细胞水平上对特定细胞群进行分析成为可能[9]。单细胞测序用于中医辨证分型的研究,不仅能阐释其科学性,还能使其更加规范化与标准化[10]。因此,借助现代科技手段深入研究UC缓解期脾虚湿困证向活动期湿热阻滞证的发生发展,了解其潜在分子机制,对于发现新的UC临床治疗方案具有重要意义。
为探讨UC缓解期脾虚湿困证与活动期湿热阻滞证之间的潜在关联机制,本研究综合分析了UC相关RNA-seq和scRNA-seq数据,以期找到UC缓解期脾虚湿困证向活动期湿热阻滞证发生发展过程中的关键分子,并对这些分子在疾病进程中的作用进行深入探讨,同时关联了核心基因相关的中医症状和现代医学症状,并且得到其潜在靶向中药,为UC的临床治疗和中药新药开发提供新思路。
1 资料与方法
1.1 数据来源与处理
从基因表达综合数据库(https://www.ncbi. nlm.nih.gov/geo/)下载了3个UC相关RNA-seq数据集GSE75214[11]、GSE53306[12]和GSE38713[13]。GSE75214包括74个UC活动期样本、23个UC缓解期样本和11个正常对照样本;GSE53306包括16个UC活动期样本、12个UC缓解期样本和12个正常对照样本;GSE38713包括15个UC活动期样本、15个UC缓解期样本和13个正常对照样本。其中,GSE75214作为训练集,GSE53306和GSE38713作为验证集。另外,检索得到UC相关scRNA-seq数据集GSE231993[14],该数据集包含4个UC患者炎症反应活跃处的肠黏膜样本、4个上述UC患者其自身非炎症反应活跃处的肠黏膜样本和4个正常对照的肠黏膜样本,将炎症反应活跃处的肠黏膜样本作为活动期样本、非炎症反应活跃处的肠黏膜样本作为缓解期样本进行后续分析。使用R 4.2.1中的“Seurat”[15]R包对GSE231993进行处理,使用CreateSeuratObject创建seurat对象,检测到200<基因<4 000且线粒体基因<20%的细胞被保留用于后续分析。为了可视化和统计分析scRNA-seq数据集,该研究测试了26个主成分并将其用于均匀流形逼近和投影图(uniform manifold approximation and projection,UMAP)分析。使用聚类分辨率为0.5的FindNeighbors和FindClusters函数进行细胞簇聚类分析。通过“singleR”包及人工校正的方式对细胞簇进行注释。
1.2 UC缓解期脾虚湿困证与UC活动期湿热阻滞证之间潜在共享基因的鉴定
使用“limma”[16]R包对UC缓解期与正常对照样本进行差异表达基因(differentially expressed genes,DEGs)分析,UC缓解期DEGs筛选标准为<0.05和|log2FC|>0.585。同理得到UC活动期DEGs。通过中医证候本体及多维定量关联计算平台(SoFDA,http://www.tcmip.cn/Syndrome/front/#/)[17]分别搜集脾虚湿困证和湿热阻滞证的主次症状相关基因集,共获得脾虚湿困证相关基因558个和湿热阻滞证相关基因608个。SoFDA是一个中医证候本体论、证候分类工具以及与疾病相关的特征关联的数据库,可用于研究病理联系和治疗机制[17]。将UC缓解期DEGs与脾虚湿困证相关基因取交集得到UC缓解期脾虚湿困证相关基因;将UC活动期DEGs与湿热阻滞证相关基因取交集得到UC活动期湿热阻滞证相关基因。将UC缓解期脾虚湿困证相关基因与UC活动期湿热阻滞证相关基因取交集,得到UC缓解期脾虚湿困证与UC活动期湿热阻滞证之间潜在共享基因(以下称“对话基因”)。
1.3 功能富集分析
为进一步探讨UC缓解期脾虚湿困证相关基因和UC活动期湿热阻滞证相关基因的功能,分别对其进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析,校正后<0.05被认为具有显著性。基因集变异分析(gene set variation analysis,GSVA)是一种非参数和非线性的算法,可用于评估基因表达微阵列中的富集数据。基于GSVA包,使用GSVA定量通路和生物学过程的活性[18],并比较UC活动期、UC缓解期和正常对照样本之间的通路活性。为进一步理解UC缓解期脾虚湿困证与UC活动期湿热阻滞证之间的潜在发展机制,将对话基因与差异通路活性评分进行Spearman相关性分析。
1.4 UC缓解期/活动期各类型细胞对脾虚湿困证/湿热阻滞证表型的作用活性评分
利用“Seurat”包中的“AddModuleScore”功能定量每个细胞中特定基因组的活性[19]。基于UC缓解期脾虚湿困证相关基因,对UC缓解期中的每个细胞进行打分并比较各类细胞对UC缓解期脾虚湿困证的作用贡献;相同的方法用于分析UC活动期中各类细胞对UC活动期湿热阻滞证的作用贡献。
1.5 CD55+B细胞和CD55−B细胞的细胞通讯及细胞代谢分析
使用“CellChat”[20]包分别在UC缓解期和UC活动期样本中进行细胞通讯分析,比较CD55+B细胞和CD55−B细胞与其他微环境细胞之间的串扰,使用CellChatDB.huma作为配体-受体相互作用参考数据库。<0.05被认为细胞-细胞相互作用具有统计学意义。计算簇中平均受体表达水平和相互作用簇中平均配体表达水平,使用点图来说明配体-受体相互作用的平均值之间的差异。同时,在单细胞水平上使用“scMetabolism”包[21]评估细胞的代谢特征。“scMetabolism”包可在单细胞水平量化代谢,该包以常规单细胞矩阵文件为基础,采用VISION算法对每个细胞进行评分,从而得到细胞在每条代谢通路中的活性得分[21]。
1.6 外部数据集验证
基于2个外部数据集GSE53306和GSE38713验证对话基因在UC活动期、UC缓解期和正常对照样本之间的表达水平,使用箱图和小提琴图实现可视化。
1.7 UC缓解期脾虚湿困证向活动期湿热阻滞证发展的风险预测模型的构建及验证
综合上述分析,最后基于对话基因进行循环算法分析,以确定最佳的UC缓解期脾虚湿困证向活动期湿热阻滞证发展的风险预测模型[22-23]。在每个循环中,从16个特征基因中随机选择15个基因的组合。然后,使用“Cancerclass”[24]R包来估计合并数据集中的曲线下面积(area under curve,AUC),并检查每种组合的预测准确度。在16种组合中,将具有最高AUC(genelistmax AUC)的基因组合进行筛选并应用于下一个周期。重复该循环,直到剩下不超过3种不同的基因组合。最后,选择所有循环中AUC值最高且值最显著的基因组来构建预测模型,其中GSE75214作为训练集,GSE53306和GSE38713作为验证集。
1.8 风险预测基因在UC与正常组织中的表达情况分析
1.8.1 仪器与试剂 衰变加速因子(decay-accelerating factor,CD55)、神经内分泌转化酶1(neuroendocrine convertase 1,PCSK1)、血浆蛋白酶C1抑制剂(plasma protease C1 inhibitor,SERPING1)、乙酰辅酶A乙酰转移酶1(acetyl-CoA acetyltransferase 1,ACAT1)、溶质载体系列26成员2(solute carrier family 26 member 2,SLC26A2)、3-羟基-3-甲基戊二酰辅酶A合酶2(3-hydroxy-3-methylglutaryl-CoA synthase 2,HMGCS2)PCR引物由美国Invitrogen公司设计合成;葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)购自美国MP Biomedical公司(批号S8634)。电泳仪及电泳槽(Bio-rad公司);RNA抽提试剂盒、反转录试剂盒(日本Takara公司);PCR扩增仪(美国Applied Biosystems公司)。
1.8.2 动物模型制备 10只SPF级雄性C57BL/6小鼠,6~8周龄,体质量(20±2)g,购自北京维通利华有限公司,实验动物生产许可证号SCXK(京)2021-0006。饲养环境湿度保持在(55±2)%,12 h黑夜和12 h白天循环。动物实验均按广州中医药大学中药学院实验动物伦理委员会批准方案进行,动物实验伦理批号ZYD-2023-153。小鼠适应性饲养1周后,将10只小鼠随机分为正常组与模型组,每组5只。模型组连续7 d自由饮用3% DSS制备UC模型,正常组予正常饮用水。
1.8.3 实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-PCR)分析 RT-PCR检测风险预测基因在模型组结肠黏膜组织与正常组结肠黏膜组织中的表达水平。使用TRIzol试剂提取总RNA进行逆转录;使用TBgreen(RR420)染料按照10 μL体系进行循环扩增,引物序列见表1。通过2−∆∆Ct方法测定基因相对表达量,数据标准化以3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,)为管家基因。
1.9 “基因-中医症状/现代医学症状”和“基因-中药”关联网络的构建
将对话基因导入SoFDA平台[17],对其相关中医症状与现代医学症状进行富集分析,以挖掘其对应的UC相关中医症状及现代医学症状。通过中医药整合药理学研究平台v2.0(TCMIP,http://www.tcmip. cn/TCMIP/index.php/Home/)[25]寻找靶向对话基因的中药。由于CD55在TCMIP数据库中没有找到靶向中药,故在COREMINE数据库(https://www. coremine.com/)中预测相关靶向中药,<0.05作为筛选标准。使用Cytoscape软件构建“基因-中医症状/现代医学症状”和“基因-中药”关联网络。

表1 基因引物序列
1.10 统计学分析
采用GraphPad Prism 9.0软件进行数据分析,两组间比较采用检验,多组间比较采用单因素方差分析,<0.05被认为具有统计学差异。
2 结果
2.1 UC缓解期脾虚湿困证相关基因和UC活动期湿热阻滞证相关基因的鉴定及功能富集分析
共鉴定出UC缓解期DEGs 582个,其中上调基因289个,下调基因293个,见图1-A。将UC缓解期DEGs与脾虚湿困证相关基因取交集得到31个UC缓解期脾虚湿困证相关基因,见图1-C。共鉴定出UC活动期DEGs 2 780个,其中上调基因1 557个,下调基因1 223,见图1-B。将UC活动期DEGs与湿热阻滞证相关基因取交集得到160个UC活动期湿热阻滞证相关基因,见图1-D。KEGG富集分析显示,UC缓解期脾虚湿困证相关基因主要富集在代谢相关通路,包括过氧化物酶体增殖物活化受体(peroxisome proliferator activates receptor,PPAR)信号通路,脂肪酸降解,缬氨酸、亮氨酸和异亮氨酸降解,脂肪酸代谢,萜类骨架生物合成、丁酸代谢等,见图1-E;UC活动期湿热阻滞证相关基因主要富集在免疫相关通路,包括炎性肠病、辅助性T细胞1型(T helper cell 1,Th1)和Th2细胞分化、Th17细胞分化、原发性免疫缺陷、磷脂酰肌醇-3-羟激酶(phosphatidylinositol-3-hydroxy kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路、核转录因子-κB(nuclear factor-kappa B,NF-κB)信号通路、细胞因子-细胞因子受体相互作用和肠道免疫网络等,见图1-F。
2.2 UC缓解期脾虚湿困证与UC活动期湿热阻滞证之间潜在对话基因的鉴定及功能相关性分析
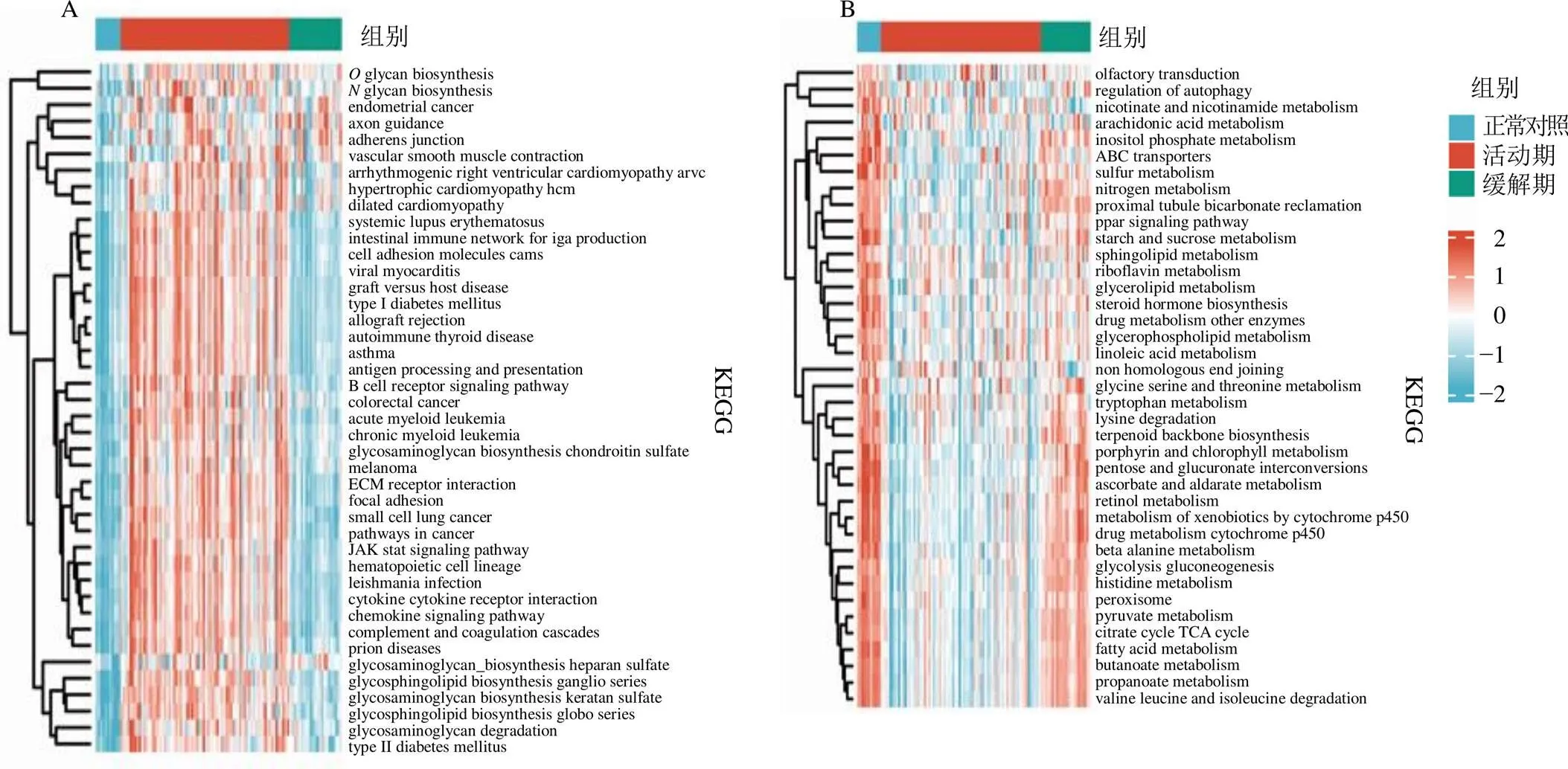
将31个UC缓解期脾虚湿困证相关基因与160个UC活动期湿热阻滞证相关基因取交集,得到22个两者潜在对话基因,其中11个上调对话基因和11个下调对话基因,见图2,差异表达情况见表2。GSVA结果显示,相比于正常对照和UC缓解期,代谢相关通路在UC活动期中明显下调,包括甘油脂代谢,花生四烯酸酸代谢,甘氨酸、丝氨酸、苏氨酸代谢和组氨酸代谢等,见图3-A;相比于正常对照和UC缓解期,炎症免疫相关通路在UC活动期中明显上调,包括B细胞受体信号通路、系统性狼疮红斑、自身免疫甲状腺疾病、利什曼感染、趋化因子信号通路和抗原处理和呈现等,见图3-B。Spearman相关性分析显示,、白细胞介素7受体(interleukin 7 receptor,)和补体成分4A(complement component 4A,)等上调基因与炎症免疫相关通路呈显著正相关,见图4-A;ATP结合盒亚家族B成员11(ATP binding cassette subfamily B member 11,ABCB11)、酰基辅酶A脱氢酶中链(acyl-CoA dehydrogenase medium chain,ACADM)和肉毒碱棕榈酰转移酶1A(carnitine palmitoyl-transferase 1A,CPT1A)等下调基因与代谢相关通路呈显著正相关,见图4-B。
2.3 B细胞可能是UC缓解期脾虚湿困证向UC活动期湿热阻滞证发展的关键免疫细胞
分析来自GSE231993数据集的单细胞测序样本,通过质量控制排除低质量线粒体细胞后,选择45 579个细胞用于后续分析。通过UMAP算法对细胞进行聚类得到26个细胞簇。进一步通过“singleR”包及人工注释将26个细胞簇分为8种细胞类型:B细胞、T细胞、巨噬细胞、上皮细胞、内皮细胞、平滑肌细胞、成纤维细胞和肥大细胞,见图5-A。细胞类型占比分析显示,相比于正常对照及UC缓解期,UC活动期中B细胞占比上调,见图5-B。为探讨UC缓解期各类型细胞对脾虚湿困证表型的作用活性,基于31个UC缓解期脾虚湿困证相关基因,使用“Seurat”包的AddModuleScore功能对UC缓解期中的每个细胞进行评分并对各类型细胞进行比较,结果显示B细胞、T细胞和肥大细胞的得分较低,上皮细胞、内皮细胞、成纤维细胞、巨噬细胞和平滑肌细胞的得分较高;同理,基于160个UC活动期湿热阻滞证相关基因,对UC活动期中每个细胞进行评分并对各类型细胞进行比较,结果显示B细胞和巨噬细胞的得分较高,而其他细胞的得分较低,见图6。进一步比较了B细胞受体信号通路活性在UC缓解期B细胞和UC活动期B细胞的差异,结果显示UC活动期B细胞的受体信号通路活性明显高于UC缓解期,见图7。因此,推测B细胞可能在UC缓解期脾虚湿困证向UC活动期湿热阻滞证发展过程中发挥重要作用。
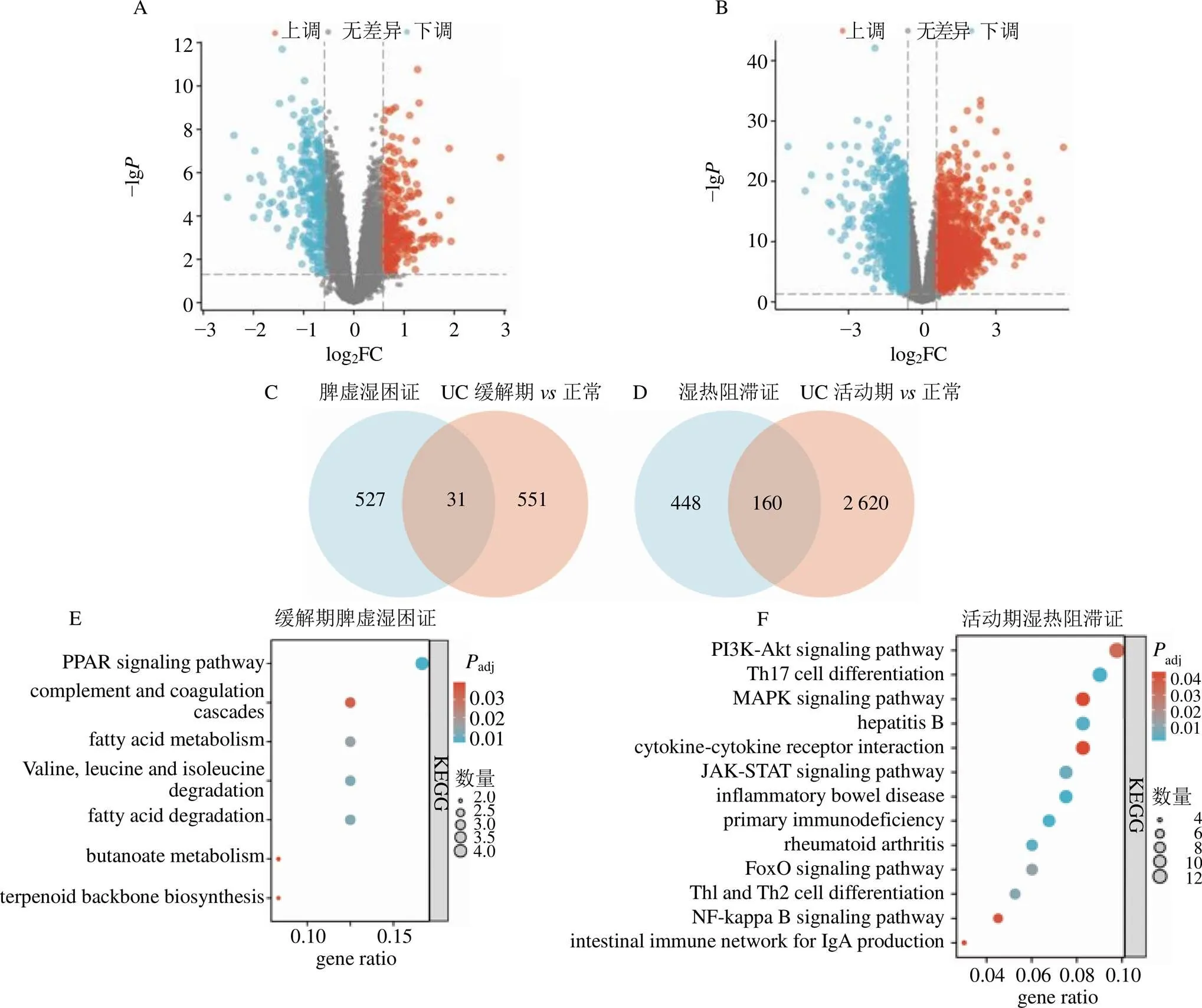
A-UC缓解期vs正常对照火山图;B-UC活动期vs正常对照火山图;C-UC缓解期脾虚湿困证相关基因的鉴定;D-UC活动期湿热阻滞证相关基因的鉴定;E-UC缓解期脾虚湿困证相关基因的KEGG富集分析;F-UC活动期湿热阻滞证相关基因的KEGG富集分析。

图2 对话基因的鉴定
A-相对于正常对照组,UC缓解期与UC活动期上调的通路;B-相对于正常对照组,UC缓解期与UC活动期下调的通路。
2.4 CD55+B细胞和CD55−细胞的细胞通讯及细胞代谢分析
在单细胞数据中,分析了11个上调对话基因在各类型细胞的表达水平,发现CD55在B细胞中高表达,见图8-A。接着,分别在UC缓解期和UC活动期单细胞样本中对CD55+B细胞和CD55−B细胞进行了细胞通讯及细胞代谢分析。细胞通讯结果显示,在UC缓解期样本中,CD55+B细胞和CD55−B细胞的细胞通讯较为一致,见图8-B;而在UC活动期样本中,相比于CD55−B细胞,CD55+B细胞在免疫细胞微环境中与其他类型细胞的交互通讯更为密切且强度更大,见图8-C。细胞代谢结果显示,UC活动期中的B细胞代谢相关途径活性明显高于UC缓解期,且在UC缓解期和活动期中,CD55+B细胞代谢相关途径活性明显高于CD55−B细胞,见图9。由此,推测CD55可能通过影响代谢相关途径,促进B细胞活性,从而促进UC缓解期脾虚湿困证向活动期湿热阻滞证发展。

图4 11个上调对话基因与炎症免疫相关通路活性(A) 和11个下调对话基因与代谢相关通路活性(B) 的相关性分析
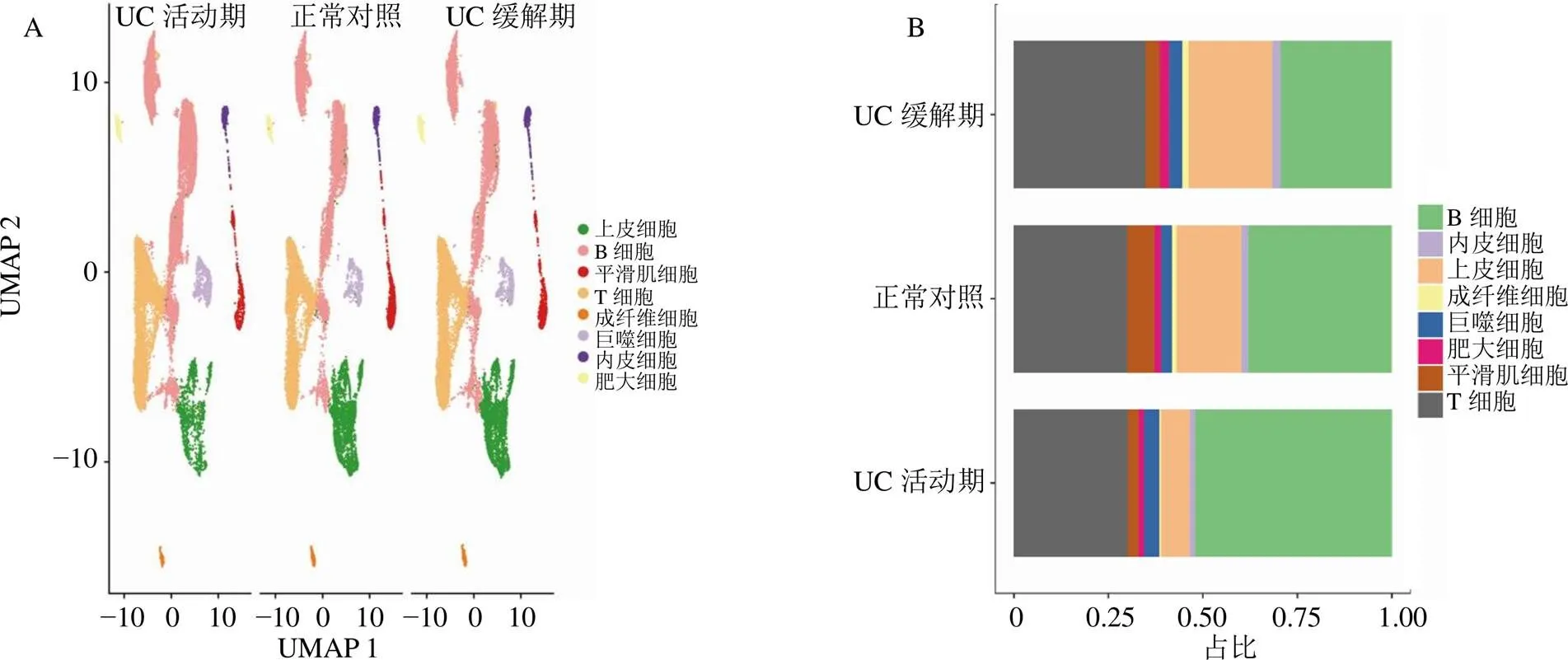
图5 UC活动期、UC缓解期和正常对照样本之间所有细胞数据的UMAP散点图(A) 和细胞亚群占比图(B)

图6 不同类型细胞对UC缓解期脾虚湿困证和UC活动期湿热阻滞证表型的作用活性评分及比较
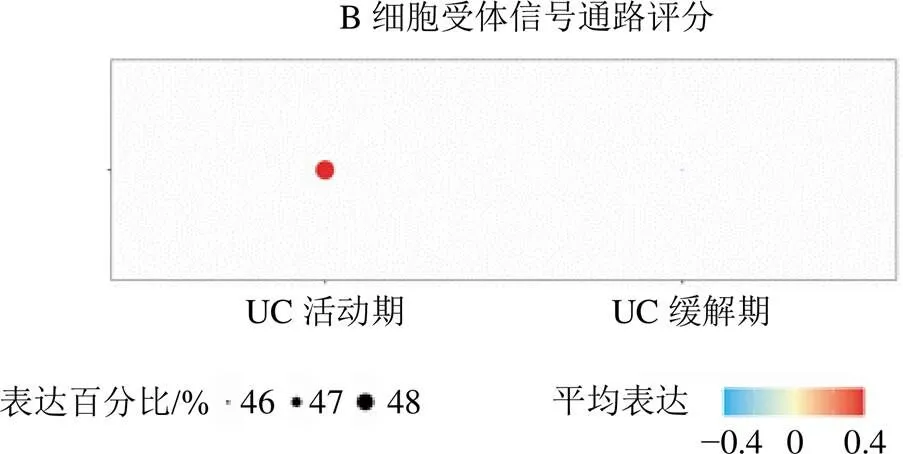
图7 UC活动期与UC缓解期之间B细胞受体信号通路活性的比较
2.5 外部数据集验证
基于2个外部数据集GSE53306和GSE38713验证了22个对话基因,发现除了窖蛋白-1(caveolin 1,)、细丝蛋白A(filamin A,)、、原癌基因蛋白(MYC proto-oncogene, BHLH transcription factor,)以外,其他基因的表达水平均与训练集一致:相对于正常对照,在UC缓解期和活动期中、、、、、转录因子4(transcription factor 4,)、丝氨酸肽酶抑制剂Kazal 1型(serine peptidase inhibitor kazal type 1,)、线粒体RNA加工的RNA组分核糖核酸内切酶(RNA component of mitochondrial RNA processing endoribonuclease,)存在不同程度的上调趋势,而、、琥珀酰辅酶A: 戊二酸辅酶A转移酶(succinyl-CoA: glutarate-CoA transferase,)、、电子转移黄素蛋白脱氢酶(electron transfer flavoprotein dehydrogenase,)、细胞周期蛋白依赖性激酶抑制剂2B(cyclin dependent kinase inhibitor 2B,)、3β-羟基-δ5-类固醇脱氢酶2型(3β-hydroxy-δ5-steroid dehydrogenase type 2,)、溶质载体家族22成员5(solute carrier family 22 member 5,)、和存在不同程度的下调趋势,见图10、11。
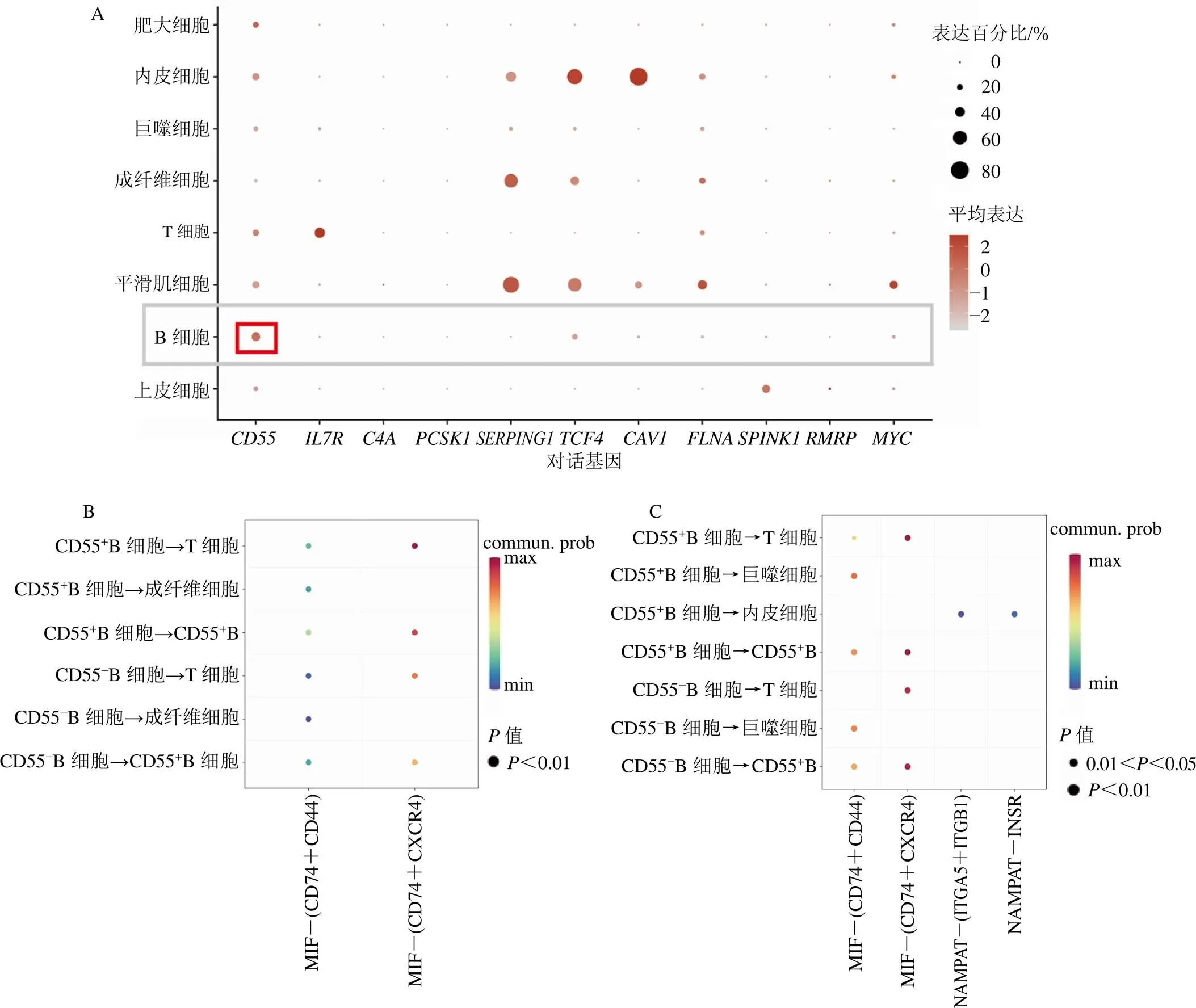
图8 11个上调潜在对话基因在不同类型细胞的表达水平(A) 及UC缓解期(B) 和UC活动期(C) 中CD55+B细胞和CD55−B细胞的细胞通讯分析

图9 UC缓解期(A) 和UC活动期(B) 中CD55+B细胞和CD55−B细胞的细胞代谢分析
2.6 UC缓解期脾虚湿困证向UC活动期湿热阻滞证发展的风险预测模型的构建
综合上述分析,对16个UC缓解期脾虚湿困证与UC活动期湿热阻滞证之间潜在关键对话基因(、、、、、、、、、、、、、、、)进行循环算法分析,以确定最佳的预测模型,循环算法流程见图12-A。纳入循环算法构建风险预测模型的基因是训练数据集与验证数据集共有的基因,且这些基因经过训练数据集与验证数据集的验证,在UC活动期样本中均存在上调/下调趋势。在GSE75214中,6个基因(、、、、、)的组合呈现AUC峰值,见图12-B。6个基因的组合可以较为准确预测UC缓解期脾虚湿困证向UC活动期湿热阻滞证发展,AUC为0.99,95% CI:0.98~1.00,=1.4×10−6,见图12-C。在GSE53306中6个基因的组合AUC为0.78,95% CI:0.69~0.86,=0.11,见图12-D。在GSE38713中6个基因的组合AUC为0.99,95% CI:0.96~1.00,=0.003 8,见图12-E。

*P < 0.05 **P < 0.01 ***P < 0.001
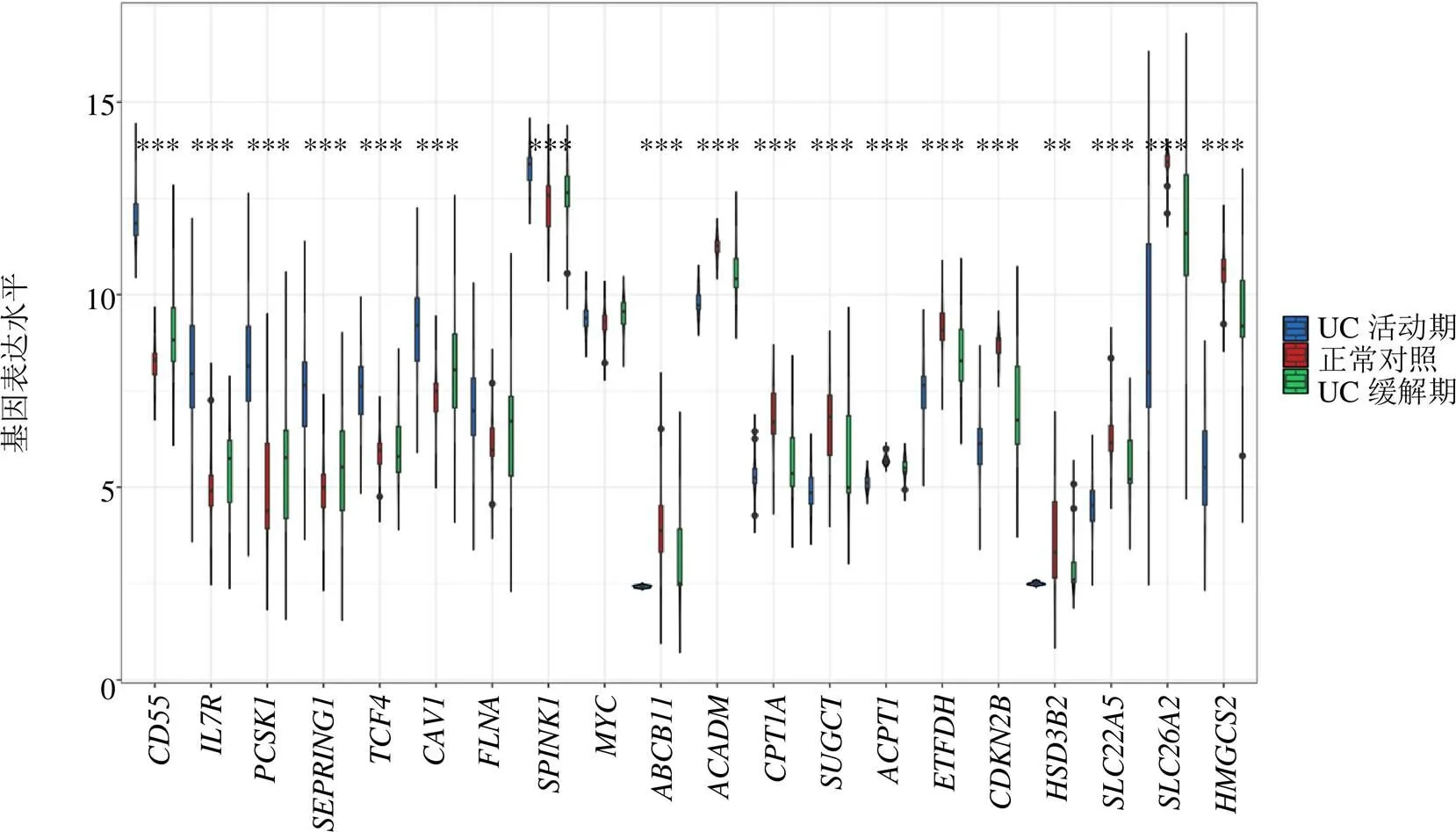
图11 基于GSE38713数据集验证22个对话基因的表达水平
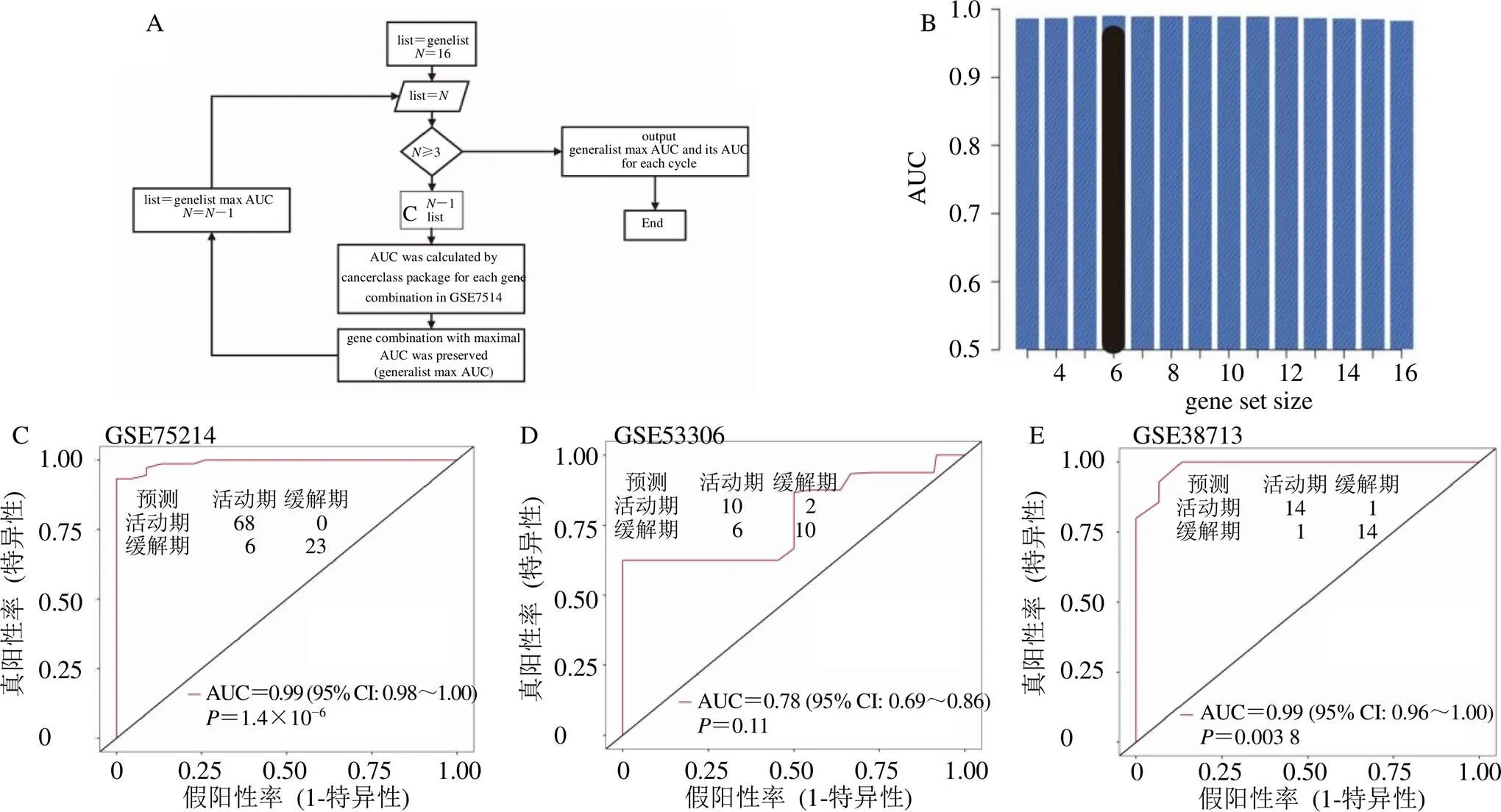
A-循环算法流程;B-条形图,显示基因组合的AUC,每个循环的最大AUC(不同的基因数目组合);C~E-6基因组合对于预测UC缓解期脾虚湿困证向UC活动期湿热阻滞证发展具有较高的预测性能。
2.7 风险预测基因在UC和正常对照组织中的表达验证
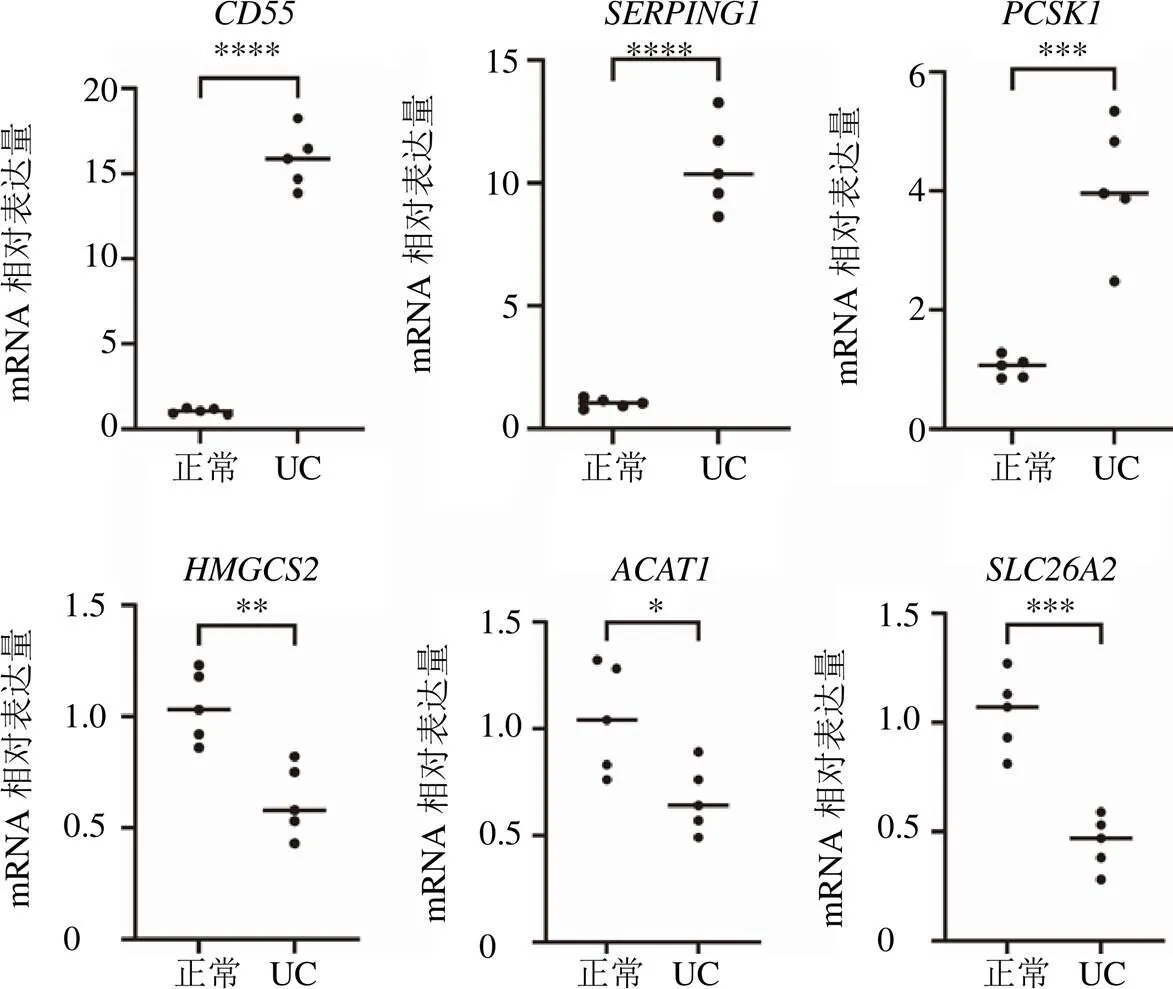
对疾病组与正常组的结肠组织进行HE染色以确保模型复刻成功。由结肠病理图所示,正常组小鼠的结肠结构完整,肠腺整齐排列,上皮细胞之间紧密相连。与正常组比较,模型组小鼠结肠出现明显溃疡,结肠上皮细胞大量脱落,腺体排列紊乱,黏膜层和黏膜下层有大量炎性细胞浸润,见图13。RT-PCR结果显示,、、在UC组织中表达显著升高(<0.05),、、在UC组织中表达显著降低(<0.05),见图14。6个风险预测基因与上述分析结果一致。
2.8 “基因-中医症状/现代医学症状”和“基因-中药”关联网络的构建
22个对话基因与5个UC相关中医症状和5个UC相关现代医学症状密切相关,见图15、16。通过TCMIP和COREMINE数据库共获得人参、黄芪、枸杞子等45味中药,靶向8个UC缓解期脾虚湿困证与UC活动期湿热阻滞证之间潜在对话基因,见图17。
3 讨论
3.1 代谢和炎症免疫相关途径在UC缓解期脾虚湿困证向活动期湿热阻滞证发生发展过程发挥重要作用
KEGG富集分析显示,UC缓解期脾虚湿困证相关基因主要富集在脂肪酸降解,缬氨酸、亮氨酸和异亮氨酸降解,脂肪酸代谢,萜类骨架生物合成,丁酸代谢等代谢相关途径。Wu等[26]研究发现,IBD脾虚证与IBD湿热证之间存在多种显著血浆差异代谢物,包括甘油磷脂、脂肪酰基和宿主共生肠道菌群氨基酸等。前期研究表明,脂质代谢物在IBD炎症过程中起着关键作用[27]。氨基酸是几乎所有类型细胞的基本代谢产物,在维持肠道健康方面发挥着重要作用。在IBD患者中,氨基酸在肠道屏障和抗炎细胞因子产生中具有突出的地位,它们还与紧密连接蛋白、氧化应激、肠上皮细胞凋亡和消化道炎症中产生的促炎细胞因子有关[28]。UC活动期湿热阻滞证相关基因主要富集在炎性肠病、Th1和Th2细胞分化、Th17细胞分化、细胞因子-细胞因子受体相互作用和肠道免疫网络等炎症免疫相关途径。UC起源于宿主黏膜免疫和肠道细菌菌群之间平衡的破坏,导致对共生非致病菌的异常免疫反应[1]。与健康对照组相比,IBD患者的肠黏膜和固有层中含有更高水平的Th17细胞、IL-17和IL-23。在UC模型小鼠中,IL-17A和IL-17F的缺陷显示对结肠炎具有保护作用[29]。CD4+T细胞和自然杀伤T细胞可促进Th2相关细胞因子和Th17相关促炎细胞因子的释放,加重UC肠道炎症反应[1]。越来越多的证据表明细胞因子及趋化因子信号在UC中的作用[30]。脾虚湿困证是指脾气不足、运化失健、聚湿生痰、湿浊内蕴导致的一系列证候,湿郁日久易化热,湿邪和热邪相互交织,导致身体内湿与热同时存在,并形成阻滞的一种病理状态。炎症反应是指身体对外部刺激或病原体进行防御反应的过程。一方面,湿邪和热邪都会刺激身体内的免疫系统,导致炎症反应的发生;另一方面,湿热阻滞证可能会影响身体内部的代谢过程,导致身体内部的炎症反应加剧。
*P < 0.05 **P < 0.01 ***P <0.001 ****P<0.000 1
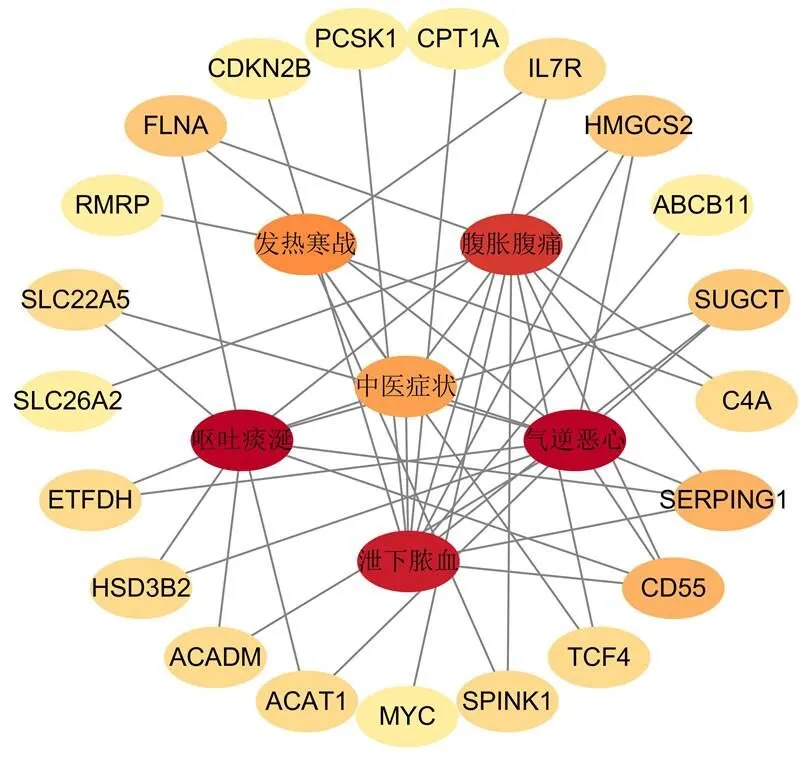
图15 “基因-中医症状”关联网络
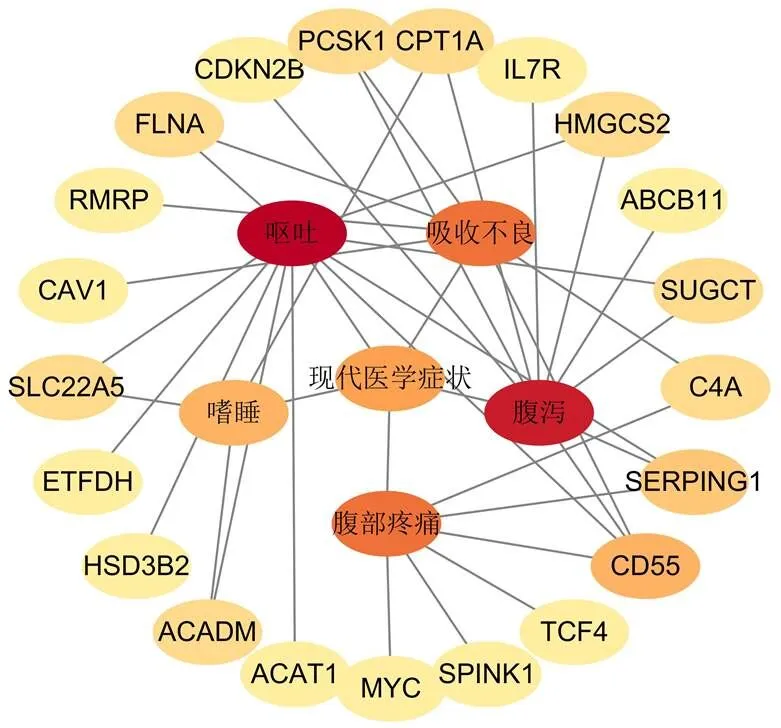
图16 “基因-现代医学症状”关联网络

图17 “基因-中药”关联网络
3.2 B细胞在UC缓解期脾虚湿困证向UC活动期湿热阻滞证发展过程中扮演重要角色
研究发现,B细胞对UC缓解期脾虚湿困证表型的作用贡献较小,而对UC活动期湿热阻滞证表型的作用贡献较大,且UC活动期B细胞受体信号通路活性明显上调,提示B细胞可能在UC缓解期脾虚湿困证向UC活动期湿热阻滞证发展过程中发挥重要作用。B细胞在UC炎症发生期间大幅扩增[31],成为结肠组织中最主要的免疫细胞类型,是UC肠道炎症发作和进展相关的适应性免疫疾病的标志[32]。抗原激活记忆B细胞,促使它们向浆细胞分化并产生引发UC发病机制的抗原特异性免疫球蛋白G(immunoglobulin G,IgG)[33]。B细胞在炎症性肠病组织愈合中同样发挥重要作用,活化的B细胞在一定程度上干扰了基质-上皮细胞间的相互作用,不利于肠黏膜的修复过程[31],B细胞耗竭在炎症性肠病的黏膜愈合前期具有积极作用。此外,本研究发现上调对话基因,在B细胞中表达水平较高,且与B细胞信号通路活性呈正相关,CD55+B细胞在免疫细胞微环境中与其他类型细胞的交互通讯更为密切且强度更大,CD55+B细胞代谢相关途径活性明显高于CD55−B细胞。CD55是保护自身免疫细胞免受补体介导裂解的关键分子,作为一种免疫调节分子,在炎症免疫反应中,CD55可以与免疫细胞表面的受体结合,通过调节细胞内的信号转导通路来发挥其作用[34-35]。因此,本研究推测CD55在介导B细胞活化过程中发挥重要作用,CD55可能通过影响炎症免疫和代谢相关途径,促进B细胞活性,从而促进UC缓解期脾虚湿困证向活动期湿热阻滞证发展,但仍需通过实验研究进一步挖掘其潜在机制。
3.3 6个风险预测基因可预测UC缓解期脾虚湿困证向活动期湿热阻滞证发生发展
本研究使用循环算法以构建更准确的UC缓解期脾虚湿困证向活动期湿热阻滞证发生发展的预测模型,结果显示,6个基因(、、、、、)的组合呈现AUC峰值且值最显著,提示其在疾病发展中的重要意义。既往研究显示,UC患者疾病活动性粪便、结肠黏膜和外周血白细胞中的表达增加[36-38],其与黏膜炎症的严重程度密切相关。本研究发现酮体相关限速酶基因和在UC组织中下调,酮体在肠道稳态中发挥重要作用,外源性补充β-羟基丁酸(机体含量最多的酮体)可有效缓解DSS诱导的结肠炎[39]。阻断UC的“炎-癌”转化是临床防治UC的核心问题[40],综合前人的研究结果发现,相比于正常组织,在UC和结直肠癌中均明显上调,高表达的直肠癌患者具有较差的疾病特异性生存期、局部无复发生存期和无转移生存期[41];在UC和结直肠癌中均明显下调[42-43],低表达与体外结肠癌细胞增殖快速发展有关[44],同时对于肿瘤细胞在体内组织中迁移也十分重要[42]。在UC组织中显著上调,目前没有直接证据表明基因与UC有联系,但发现其与炎症免疫相关途径呈正相关,可能在炎症反应和免疫调节中发挥重要作用。
3.4 靶向预测的中药是干预UC缓解期脾虚湿困证向活动期湿热阻滞证发展的潜在药物
本研究对22个对话基因进行了靶向中药预测,其中人参、黄芪、枳壳、半夏、枸杞子等中药在“基因-中药”调控网络中的连接度较高。人参-黄芪药对重在益气健脾,UC的发病与脾虚关系密切,而脾虚往往与气虚有关,因此,治疗UC需要从补气、健脾、利湿等方面入手。人参和黄芪的主要成分为皂苷类化合物,其具有抗炎及调节免疫稳态的作用,尤其是对于与肠道炎症相关的消化系统疾病而言[45]。人参皂苷Rg3可通过抑制NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体激活和调节肠道菌群稳态来改善DSS诱导的结肠炎[46]。黄芪皂苷IV通过重塑Th17/Treg细胞稳态和抗氧化应激有效预防和减轻UC[47]。半夏降逆止呕、散结除痞,为燥湿化痰之要药,配伍枳壳理气宽中、行滞消胀,可有效改善UC气逆呕吐、腹胀腹痛等症状。研究表明,半夏泻心汤可通过降低UC患者血清炎症因子水平、抑制UC模型大鼠细胞焦亡、改善肠道黏膜屏障功能等达到改善UC的作用[45]。枸杞子可减轻肠道杯状细胞群受损并增强黏液层,枸杞子多糖对氧化应激、炎症和神经退行性变具有保护作用[48]。
4 结论
本研究通过分析UC相关scRNA-seq和RNA-seq数据初步揭示了UC缓解期脾虚湿困证与活动期湿热阻滞证之间的潜在分子机制,外部数据集和动物实验表明关键对话基因其具有良好的临床辨证效能,相关结果有助于提高UC核心证候临床精准化诊断的水平和证候客观化研究的深度。通过TCMIP和COREMINE数据库得到了靶向对话基因的潜在关键中药,后续仍需进一步体内或体外实验验证其干预机制。
利益冲突 所有作者均声明不存在利益冲突
[1] Le Berre C, Honap S, Peyrin-Biroulet L. Ulcerative colitis [J]., 2023, 402(10401): 571-584.
[2] 龚卓之, 曹增, 姚梦茜, 等. 从铁死亡探讨溃疡性结肠炎不同时期的发病机制及相关天然药物筛选 [J]. 中草药, 2023, 54(7): 2187-2196.
[3] 简钰乘, 唐海怡, 余芷莹, 等. 中医药治疗溃疡性结肠炎核心证型及治法的研究进展 [J]. 现代诊断与治疗, 2023, 34(6): 831-834.
[4] 李玉玲, 杜念龙, 黄穗平, 等. 溃疡性结肠炎缓解期中医证候规律及其相关性 [J]. 吉林中医药, 2019, 39(8): 1055-1058.
[5] 龚立平, 鲜于俊杰, 朱晓敏, 等. 溃疡性结肠炎-辨治方药功效特征与药理机制研究进展 [J]. 中草药, 2023, 54(8): 2618-2635.
[6] 陈文佳, 巩勋, 刘蔚翔, 等. 应用“GSEA-WGCNA-验证”整合策略分析类风湿关节炎肝肾亏虚证的生物标志物研究 [J]. 北京中医药大学学报, 2023, 46(5): 599-606.
[7] 张改君, 苗静, 郭丽颖, 等. 多组学联用在中药作用机制研究中的应用 [J]. 中草药, 2021, 52(10): 3112-3120.
[8] 何浩强, 陈光, 高嘉良, 等. 中医证候的转录组学研究进展与探析 [J]. 世界科学技术—中医药现代化, 2018, 20(1): 1-6.
[9] Yang S Y, Corbett S E, Koga Y,. Decontamination of ambient RNA in single-cell RNA-seq with DecontX [J]., 2020, 21(1): 57.
[10] 李捷, 唐勇, 刘洁. 单细胞测序技术与中医药前沿研究 [J]. 世界中医药, 2020, 15(11): 1513-1519.
[11] Vancamelbeke M, Vanuytsel T, Farré R,. Genetic and transcriptomic bases of intestinal epithelial barrier dysfunction in inflammatory bowel disease [J]., 2017, 23(10): 1718-1729.
[12] Zhao X M, Fan J S, Zhi F C,. Mobilization of epithelial mesenchymal transition genes distinguishes active from inactive lesional tissue in patients with ulcerative colitis [J]., 2015, 24(16): 4615-4624.
[13] Planell N, Lozano J J, Mora-Buch R,. Transcriptional analysis of the intestinal mucosa of patients with ulcerative colitis in remission reveals lasting epithelial cell alterations [J]., 2013, 62(7): 967-976.
[14] Du J, Zhang J L, Wang L,. Selective oxidative protection leads to tissue topological changes orchestrated by macrophage during ulcerative colitis [J]., 2023, 14(1): 3675.
[15] Hao Y H, Hao S, Andersen-Nissen E,. Integrated analysis of multimodal single-cell data [J]., 2021, 184(13): 3573-3587.
[16] Ritchie M E, Phipson B, Wu D,. Limma powers differential expression analyses for RNA-sequencing and microarray studies [J]., 2015, 43(7): e47.
[17] Zhang Y Q, Wang N, Du X,. SoFDA: An integrated web platform from syndrome ontology to network-based evaluation of disease-syndrome-formula associations for precision medicine [J]., 2022, 67(11): 1097-1101.
[18] Hänzelmann S, Castelo R, Guinney J. GSVA: Gene set variation analysis for microarray and RNA-seq data [J]., 2013, 14: 7.
[19] Liu J S, Shi Y J, Zhang Y X. Multi-omics identification of an immunogenic cell death-related signature for clear cell renal cell carcinoma in the context of 3P medicine and based on a 101-combination machine learning computational framework [J]., 2023, 14(2): 275-305.
[20] Jin S Q, Guerrero-Juarez C F, Zhang L H,. Inference and analysis of cell-cell communication using CellChat [J]., 2021, 12(1): 1088.
[21] Wu Y C, Yang S X, Ma J Q,. Spatiotemporal immune landscape of colorectal cancer liver metastasis at single-cell level [J]., 2022, 12(1): 134-153.
[22] Sun H R, Kong X J, Wei K M,. Risk prediction model construction for post myocardial infarction heart failure by blood immune B cells [J]., 2023, 14: 1163350.
[23] Zheng K, Gao L C, Hao J,. An immunotherapy response prediction model derived from proliferative CD4+T cells and antigen-presenting monocytes in ccRCC [J]., 2022, 13: 972227.
[24] Budczies J, Kosztyla D, von Törne C,. Cancerclass: An Rpackage for development and validation of diagnostic tests from high-dimensional molecular data [J]., 2014, 59(1): 1-19.
[25] Zhang Y Q, Li X, Shi Y L,. ETCM v2.0: An update with comprehensive resource and rich annotations for traditional Chinese medicine [J]., 2023, 13(6): 2559-2571.
[26] Wu X X, Liu K X, Wu Q,. Biomarkers of metabolomics in inflammatory bowel disease and damp-heat syndrome: A preliminary study [J]., 2022, 2022: 3319646.
[27] Fan F L, Mundra P A, Fang L,. Lipidomic profiling in inflammatory bowel disease: Comparison between ulcerative colitis and Crohn’s disease [J]., 2015, 21(7): 1511-1518.
[28] He F, Wu C L, Li P,. Functions and signaling pathways of amino acids in intestinal inflammation [J]., 2018, 2018: 9171905.
[29] Nanki K, Fujii M, Shimokawa M,. Somatic inflammatory gene mutations in human ulcerative colitis epithelium [J]., 2020, 577(7789): 254-259.
[30] Lu Q, Yang M F, Liang Y J,. Immunology of inflammatory bowel disease: Molecular mechanisms and therapeutics [J]., 2022, 15: 1825-1844.
[31] Frede A, Czarnewski P, Monasterio G,. B cell expansion hinders the stroma-epithelium regenerative cross talk during mucosal healing [J]., 2022, 55(12): 2336-2351.
[32] Boland B S, He Z R, Tsai M S,. Heterogeneity and clonal relationships of adaptive immune cells in ulcerative colitis revealed by single-cell analyses [J]., 2020, 5(50): eabb4432.
[33] Wang X R, Jiang Y F, Zhu Y G,. Circulating memory B cells and plasmablasts are associated with the levels of serum immunoglobulin in patients with ulcerative colitis [J]., 2016, 20(5): 804-814.
[34] Saygin C, Wiechert A, Rao V S,. CD55 regulates self-renewal and cisplatin resistance in endometrioid tumors [J]., 2017, 214(9): 2715-2732.
[35] Lukacik P, Roversi P, White J,. Complement regulation at the molecular level: The structure of decay-accelerating factor [J]., 2004, 101(5): 1279-1284.
[36] Inaba T, Mizuno M, Ohya S,. Decay-accelerating factor (DAF) in stool specimens as a marker of disease activity in patients with ulcerative colitis (UC) [J]., 1998, 112(2): 237-241.
[37] Makidono C, Mizuno M, Nasu J,. Increased serum concentrations and surface expression on peripheral white blood cells of decay-accelerating factor (CD55) in patients with active ulcerative colitis [J]., 2004, 143(3): 152-158.
[38] Nasu J, Mizuno M, Uesu T,. Cytokine-stimulated release of decay-accelerating factor (DAF; CD55) from HT-29 human intestinal epithelial cells [J]., 1998, 113(3): 379-385.
[39] 黄重洋. 酮体β羟基丁酸通过STAT6信号通路促进巨噬细胞M2型极化改善小鼠结肠炎的机制研究 [D]. 广州: 南方医科大学, 2022.
[40] Yang Y F, Wang Y, Zhao L,. Chinese herbal medicines for treating ulcerative colitis via regulating gut microbiota-intestinal immunity axis [J]., 2023, 15(2): 181-200.
[41] Chou C L, Chen T J, Lin C Y,. PCSK1 overexpression in rectal cancer correlates with poor response to preoperative chemoradiotherapy and prognosis [J]., 2020, 13: 3141-3150.
[42] Pitule P, Vycital O, Bruha J,. Differential expression and prognostic role of selected genes in colorectal cancer patients [J]., 2013, 33(11): 4855-4865.
[43] Bjerrum J T, Nyberg C, Olsen J,. Assessment of the validity of a multigene analysis in the diagnostics of inflammatory bowel disease [J]., 2014, 275(5): 484-493.
[44] Yusa A, Miyazaki K, Kimura N,. Epigenetic silencing of the sulfate transporter geneinduces sialyl Lewisx expression and accelerates proliferation of colon cancer cells [J]., 2010, 70(10): 4064-4073.
[45] 孟欢, 侯晓婷, 张华敏, 等. 中药天然产物治疗炎症性肠病的研究进展 [J]. 中草药, 2023, 54(10): 3349-3369.
[46] Liu D C, Tian Q Q, Liu K J,. Ginsenoside Rg3ameliorates DSS-induced colitis by inhibiting NLRP3 inflammasome activation and regulating microbial homeostasis [J]., 2023, 71(7): 3472-3483.
[47] Zhong Y B, Liu W J, Xiong Y X,. Astragaloside Ⅳ alleviates ulcerative colitis by regulating the balance of Th17/Treg cells [J]., 2022, 104: 154287.
[48] Sun Q, Du M, Kang Y,. Prebiotic effects of goji berry in protection against inflammatory bowel disease [J]., 2023, 63(21): 5206-5230.
Revelation of potential molecular mechanism between spleen deficiency and dampness-stagnation syndrome in remission stage and damp-heat stagnation syndrome in active stage of ulcerative colitis based on multiomics analysis and prediction of targeted traditional Chinese medicine
LI Zuming1, FENG Jieni1, CHEN Xueru1, CHEN Jiankun2, LU Yue2, LI Jiqiang2, FENG Yan2
1. The Second Clinical Medical College, Guangzhou University of Chinese Medicine, Guangzhou 510405, China 2. The Second Affiliated Hospital of Guangzhou University of Chinese Medicine (Guangdong Hospital of Traditional Chinese Medicine), Guangzhou 510006, China
To explore the potential molecular mechanism between spleen deficiency and dampness-stagnation syndrome in remission stage and dampness-heat stagnation syndrome in active stage of ulcerative colitis (UC) by comprehensively analyzing the scRNA-seq and RNA-seq data sets related to UC, and to explore the potential intervention of traditional Chinese medicine (TCM).Differential gene expression analysis and venn diagram analysis were used to identify the related genes of spleen deficiency and dampness-stagnation syndrome in remission stage of UC, dampness-heat stagnation syndrome in active stage of UC and the crosstalk genes between them. Enrichment analysis of Kyoto encyclopedia of genes and genomes (KEGG) and gene set variation analysis(GSVA) and Spearman correlation analysis were used to explore the biological processes involved in crosstalk genes and their potential functions. Based on single-cell transcriptome analysis, we explored the differences between remission and active phases of UC and the role of crosstalk genes in them. Based on the circulation algorithm, a risk prediction model for the occurrence and development of UC from spleen deficiency and dampness-stagnation syndrome in remission stage to dampness-heat stagnation syndrome in active stage was constructed. Extraneous data, animal experiments and real-time quantitative polymerase chain reaction (RT-PCR) were used to further verify the expression of crosstalk genes. Based on SoFDA database, we constructed “gene-TCM symptom/modern medical symptom” network. Potential target traditional Chinese medicines (TCMs) of crosstalk genes were predicted by TCMIP and COREMINE databases.A total of 31 genes related to spleen deficiency and dampness-stagnation syndrome in remission stage of UC were identified, which were mainly enriched in metabolism-related pathways; A total of 160 genes related to dampness-heat stagnation syndrome in active stage of UC were identified, which were mainly enriched in inflammatory immune-related pathways. A total of 22 crosstalk genes were identified between spleen deficiency and dampness-stagnation syndrome in remission stage and dampness-heat stagnation syndrome in active stage of UC. Upregulating crosstalk genes were significantly correlated with inflammatory immune pathways, and downregulating crosstalk genes were significantly correlated with metabolism-related pathways. Single-cell transcriptome analysis revealed the proportion of B cells in the active phase was upregulated compared to normal controls and remission phases; B cells play a greater role in dampness-heat stagnation syndrome in active stage of UC than that in spleen deficiency and dampness-stagnation syndrome in remission stage. The receptor signaling pathway activity of B cells in UC active stage was significantly higher than that in UC remission stage. CD55, an up-regulated crosstalk gene, was highly expressed in B cells. There were differences in cell-to-cell communication and cellular metabolism between CD55+B cells and CD55−B cells. Six risk predict genes (,,,,,) can accurately predict the development from spleen deficiency and dampness-stagnation syndrome in remission stage to dampness-heat stagnation syndrome in active stage of UC. Animal experiments and RT-PCR confirmed their expression. A total of 45 potential targeted TCMs such as Renshen (et), Huangqi () and Gouqizi () through database retrieval were obtained.This study identified 22 key crosstalk genes, which may induce the development of spleen deficiency and dampness-stagnation syndrome in remission stage to dampness-heat stagnation syndrome in active stage of UC by influencing inflammatory immune and metabolic related pathways. B cells play an important role in the occurrence and development process from spleen deficiency and dampness-stagnation syndrome in remission stage to dampness-heat stagnation syndrome in active stage of UC. CD55 may promote B cell activity by affecting inflammatory immune and metabolic pathway, thus promoting the development of spleen deficiency and dampness-stagnation syndrome in remission stage of UC to dampness-heat stagnation syndrome in active stage. A total of 22 key crosstalk genes are closely related to UC-related Chinese medicine symptoms and modern medical symptoms.
ulcerative colitis; single cell transcriptome; transcriptome; remission stage; spleen deficiency and dampness-stagnation syndrome; active stage; damp-heat stagnation syndrome;et;;
R285
A
0253 - 2670(2024)09 - 3041 - 16
10.7501/j.issn.0253-2670.2024.09.018
2023-12-11
广州市科技计划⁃市校(院)联合资助基础与应用基础研究项目(2023A03J0738);广东省中医院朝阳人才科研专项资助(ZY2022KY10,ZY2022YL04)
黎祖鸣,本科。E-mail: gzylizuming@126.com
通信作者:冯 艳,副主任医师。E-mail: gonggongshiyongyx@163.com
李际强,主任医师。E-mail: lijiqiangjizhen@163.com
[责任编辑 潘明佳]

