基于血清代谢组学探究山茱萸多糖对2型糖尿病大鼠的干预机制
崔永霞,尚子慧,侯亚迪,王利丽,孙孝亚,吴明侠*,陈随清, 2*
基于血清代谢组学探究山茱萸多糖对2型糖尿病大鼠的干预机制
崔永霞1,尚子慧1,侯亚迪1,王利丽1,孙孝亚1,吴明侠1*,陈随清1, 2*
1. 河南中医药大学药学院,河南 郑州 450046 2. 河南中医药大学豫药全产业链研发河南省协同创新中心,河南 郑州 450046
基于代谢组学探究山茱萸多糖干预2型糖尿病(type 2 diabetes mellitus,T2DM)大鼠的作用机制。取10只SD雄性大鼠作为对照组,其余大鼠采用高糖高脂饲料结合ip链脲佐菌素(streptozocin,STZ)诱导构建T2DM模型。造模成功的大鼠随机分为模型组、二甲双胍(200 mg/kg)组和山茱萸多糖低、中、高剂量(75、150、300 mg/kg)组,各组大鼠每天上午ig药物,连续给药4周。末次给药前大鼠禁食10 h,麻醉后腹主动脉取血并分离血清,同时取肝脏组织。采用试剂盒检测大鼠血清中总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、丙二醛(malondialdehyde,MDA)水平和丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、超氧化物歧化酶(superoxide dismutase,SOD)活性;采用苏木素-伊红(HE)染色观察肝脏组织病理变化;采用超高效液相色谱-线性离子阱串联静电场轨道高分辨质谱(UHPLC-LTQ-Orbitrap-MS/MS)技术检测大鼠血清内源性代谢物水平,并结合主成分分析和正交偏最小二乘法-判别分析对差异代谢物进行筛选和鉴定,利用MetaboAnalyst平台进行代谢通路分析。与模型组比较,山茱萸多糖给药组大鼠体质量和血糖水平均降低,肝损伤明显改善;血清中TC、TG、LDL-C、IL-6、IL-1β、TNF-α、MDA水平和AST、ALT活性均显著降低(<0.05、0.01),HDL-C水平和SOD活性显著升高(<0.05)。血清代谢组学共筛选出35个与T2DM相关的潜在生物标志物,山茱萸多糖给药组可回调29个生物标志物,主要涉及苯丙氨酸的代谢和生物合成、牛磺酸和次牛磺酸代谢、醚脂质代谢和丙酮酸代谢等22条代谢通路。山茱萸多糖能有效改善T2DM引起的糖脂代谢紊乱,减轻肝损伤,达到治疗T2DM作用,可能与调节氨基酸代谢、糖代谢、脂质代谢等多条代谢通路有关。
山茱萸多糖;2型糖尿病;UHPLC-LTQ-Orbitrap-MS/MS;代谢组学;氨基酸代谢;糖代谢;脂质代谢
2型糖尿病(type 2 diabetes mellitus,T2DM)是以糖脂代谢紊乱为特征的慢性疾病,主要由环境及遗传因素引起,其主要发病机制为胰岛素抵抗和胰岛β细胞功能障碍[1-2]。中医药防治糖尿病的应用历史已有数千年,尤其在T2DM及其并发症的防控中独具优势[3]。中医学将糖尿病归属于“消渴症”范畴,其主要病机是阴液亏损、燥热偏盛,临床表现为阴气虚弱、气火旺盛、津伤燥结、瘀积气血等。山茱萸为山茱萸科植物山茱萸Sieb. et Zucc.的干燥成熟果肉,性酸、涩,微温,归肝、肾经,有滋补活络、涩精固脱的功效。多糖是山茱萸的主要生物活性成分之一,其降血糖的活性关注度较高,但多局限于药效指标的测定,未能全面阐述山茱萸多糖干预T2DM的作用机制。研究发现,山茱萸多糖对链脲佐菌素(streptozocin,STZ)诱导的糖尿病大鼠具有降糖、调血脂的作用,可用于治疗糖尿病及其并发症,但其潜在作用机制尚未明确[4]。本研究采用高脂饲料结合ip STZ的方法诱导构建T2DM大鼠模型,通过检测大鼠血糖、血脂、肝功能、炎症及抗氧化水平结合肝脏病理形态学观察,初步评价山茱萸多糖对T2DM大鼠的药效作用;并利用UHPLC-MS技术进行血清代谢组学研究,揭示山茱萸多糖治疗T2DM的作用机制。
1 材料
1.1 动物
SPF级SD雄性大鼠,体质量110~130 g,购自浙江维通利华实验动物技术有限公司,合格证号SCXK(浙)2019-0001。大鼠饲养于河南中医药大学实验动物中心,温度(25±2)℃,相对湿度50%~60%,12 h明暗交替,大鼠自由进食饮水。动物实验经河南中医药大学实验动物伦理委员会批准(批准号DWLL202206094)。
1.2 药材
山茱萸产自河南西峡,经河南中医药大学药学院王利丽副教授鉴定为山茱萸科植物山茱萸Sieb. et Zucc.的干燥成熟果肉,符合《中国药典》2020年版规定。
1.3 药品与试剂
高脂饲料(批号20220617)购自江苏省协同医药生物工程有限责任公司;STZ(批号S-0130-5G)购自美国Sigma公司;盐酸二甲双胍片(国药准字H20023370,批号ACD2130)购自中美上海施贵宝制药有限公司;总胆固醇(total cholesterol,TC)检测试剂盒(批号A111-1-1)、三酰甘油(triglyceride,TG)检测试剂盒(批号A110-1-1)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)检测试剂盒(批号A113-1-1)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)检测试剂盒(批号A112-1-1)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)检测试剂盒(批号C009-2-1)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)检测试剂盒(批号C010-2-1)、白细胞介素-1β(interleukin-1β,IL-1β)检测试剂盒(批号H002-1-2)、IL-6检测试剂盒(批号H007-1-2)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒(批号H052-1-2)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(批号A001-3)、丙二醛(malondialdehyde,MDA)检测试剂盒(批号A003-1)购自南京建成生物工程研究所;甲醇、乙腈、甲酸(色谱级)购自美国Thermo Fisher Scientific公司。
1.4 仪器
Ultimate 3000型超高效液相色谱仪、LTQ-Orbitrap XL质谱仪、Varioskan LUX多功能酶标仪、SPD2020-230型真空浓缩仪(美国Thermo Fisher Scientific公司);FSU-1200型冷冻干燥机(上海爱朗仪器有限公司);IW-3021HR型高速离心机(安徽嘉文仪器装备有限公司);Milli-QPOD型超纯水制备仪(美国Millipore公司);罗氏卓越金采血糖仪(罗氏血糖健康医护公司)。
2 方法
2.1 山茱萸多糖的制备
将适量山茱萸药材在50~60 ℃烘箱中干燥2 h,粉碎成粗粉,精密称定,置圆底烧瓶中,加入8倍量95%乙醇,90 ℃加热回流4 h,滤出残渣,并挥去残余乙醇。残渣再加10倍量蒸馏水,90 ℃加热回流4 h,滤过,滤液浓缩到1/4体积。取浓缩液,采用Sevag法除蛋白。将脱蛋白后的溶液,加入4倍量95%乙醇搅拌均匀,静置12 h,滤过,收集沉淀物,冷冻干燥即得山茱萸多糖[5]。采用苯酚-硫酸法测定山茱萸多糖的含量,得山茱萸多糖质量分数大于60%。
2.2 T2DM大鼠模型的建立
70只SD雄性大鼠适应性饲养1周后,随机选取10只作为对照组,给予普通饲料,其余60只作为造模组,连续4周给予高脂高糖饲料后,所有大鼠禁食不禁水12 h,造模组大鼠ip 30 mg/kgSTZ溶液,对照组大鼠ip等体积柠檬酸盐缓冲液[6]。分别于注射后第3、6天,大鼠禁食不禁水8 h,尾尖采血测空腹血糖,以连续2次测定血糖值>11.1 mmol/L同时伴有多饮、多食、多尿、体质量下降等症状,视为造模成功。
2.3 分组及给药
造模成功的大鼠随机分为模型组、二甲双胍(200 mg/kg)[7]组和山茱萸多糖低、中、高剂量(75、150、300 mg/kg)组。各给药组大鼠每日上午ig相应药物,对照组和模型组ig生理盐水(10 mL/kg),1次/d,连续给药4周。实验期间,对照组给予普通饲料,其余各组给予高糖高脂饲料。每日观察大鼠日常状况。
2.4 检测指标
2.4.1 体质量、血糖记录 每周称定并记录大鼠体质量,并测定大鼠血糖值。末次给药前禁食12 h,称定各组大鼠体质量,测定大鼠空腹血糖值。
2.4.2 生化指标检测 末次给药后1 h麻醉,腹主动脉取血,3 000 r/min离心10 min取上层血清分装,置于−80 ℃保存备用。将−80 ℃冻存的血清样品取出,4 ℃复溶,按照试剂盒说明书测定血清中血脂指标(TC、TG、LDL-C、HDL-C),肝功能指标(ALT、AST),炎症因子(IL-1β、IL-6、TNF-α),抗氧化指标(SOD、MDA)水平。
2.4.3 肝脏指数测定 迅速取出大鼠肝脏组织,冷生理盐水漂洗,肝脏称定质量后,部分组织固定于4%多聚甲醛中,计算肝脏指数。
肝脏指数=肝脏质量/体质量
2.4.4 肝脏组织病理学观察 各组大鼠肝脏组织经4%多聚甲醛固定,乙醇脱水后石蜡包埋,切片,用苏木素-伊红(HE)染色,光学显微镜下观察肝脏组织病理学变化。
2.5 代谢组学分析
2.5.1 大鼠血清样品的制备 将储存于−80 ℃冰箱中的血清取出,4 ℃解冻。精密吸取每个血清样品各100 μL置于1.5 mL离心管中,加入900 μL甲醇-乙腈(1∶1)于混悬振荡器上,2 000 r/min涡旋5 min,4 ℃、13 600 r/min离心10 min,取上清液900 μL,置于真空浓缩仪干燥4 h,取出,加入50 μL 80%甲醇复溶,涡旋5 min,4 ℃、13 600 r/min离心10 min,取上清液,待测。
2.5.2 质控样本的制备 每组抽取2个血清样本,分别吸取100 μL置于同一离心管中,涡旋混匀,按照“2.5.1”项下方法处理,用于血清代谢组学样品测定系统稳定性的考察。
2.5.3 色谱及质谱条件
(1)色谱条件:Poroshell 120 SB-Aq预柱(100 mm×2.1 mm,1.9 μm),Poroshell 120 SB-Aq预柱(5 mm×2.1 mm,2.7 μm);流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱:0~5 min,2% B;5~7 min,2%~60% B;7~12 min,60%~100% B;12~15 min,100% B;15~17 min,100%~2% B;17~20 min,2% B;柱温35 ℃;体积流量0.3 mL/min;进样量1 μL。
(2)质谱条件:采用ESI电喷雾离子源,扫描模式Full Mass,分辨率为50 000;扫描模式Dependent-MS2,分辨率为60 000,碰撞能量为25%,扫描范围均为/50~1 000。正离子模式:鞘气体积流量40 arb;辅助气体积流量10 arb;离子喷射电压4.2 kV;离子传输管温度300 ℃;毛细管电压23 V;管镜电压90 V。负离子模式:鞘气体积流量40 arb;辅助气体积流量10 arb;离子喷射电压3.5 kV;离子传输管温度300 ℃;毛细管电压−35 V;管镜电压−78.2 V。
2.5.4 系统稳定性考察 系统稳定性采用质控样本进行评价。序列进样前先连续进6针质控样本以平衡系统,然后每6针样品运行1针质控样本,考察系统稳定性。
2.5.5 数据处理及分析 将原始数据导入MSDIAL软件进行预处理,包括峰识别、峰提取、保留时间对齐、缺失值填充、归一化以及背景扣除等,得到质荷比、保留时间、分组信息以及归一化峰面积的数据矩阵。将数据矩阵导入SIMCA-P 14.1进行主成分分析(principal component analysis,PCA)和正交偏最小二乘法-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)。根据差异变量权重值(variable important in projection,VIP)大于1.0、组间变化倍数(fold change,FC)<0.8或>1.2且<0.05筛选差异性代谢物。根据HMDB、Mzcloud、PubChem、MassBank数据库鉴定差异代谢物,比较质谱的质荷比或者精确相对分子质量,误差限0.01,将鉴定得到的差异代谢物导入MetaboAnalyst 5.0在线网址(https://www. metaboanalyst.ca/)中进行代谢通路富集分析。
2.6 统计学分析
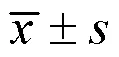
3 结果
3.1 大鼠一般状态观察
实验过程中观察大鼠,发现对照组大鼠精神状态良好、毛发正常、活动自如、饮食饮水正常且体质量持续增加;造模后模型组大鼠精神逐渐萎靡、毛发逐渐暗黄,失去光泽,活动量减少,进食饮水量明显增加,尿量增加且体质量下降。给药干预后,大鼠上述状态得到明显改善。
3.2 山茱萸多糖对T2DM大鼠体质量和血糖的影响
如图1所示,造模后,与对照组比较,模型组大鼠体质量有下降趋势,血糖显著升高(<0.01);连续给药4周后,与模型组比较,各给药组大鼠体质量升高,血糖有所下降,但均无显著性差异。
3.3 山茱萸多糖对T2DM大鼠血脂和肝功能的影响
如表1所示,与对照组比较,模型组大鼠血清中TC、TG、LDL-C水平及AST、ALT活性均显著升高(<0.01),HDL-C水平显著降低(<0.05),肝脏指数显著升高(<0.01)。与模型组比较,各给药组TC、TG水平和ALT活性均显著降低(<0.05、0.01);二甲双胍组和山茱萸多糖中、高剂量组LDL-C水平和肝脏指数均显著降低(<0.05、0.01);山茱萸多糖低剂量组HDL-C水平显著升高(<0.05);二甲双胍组和山茱萸多糖低、高剂量组AST活性显著降低(<0.05、0.01)。
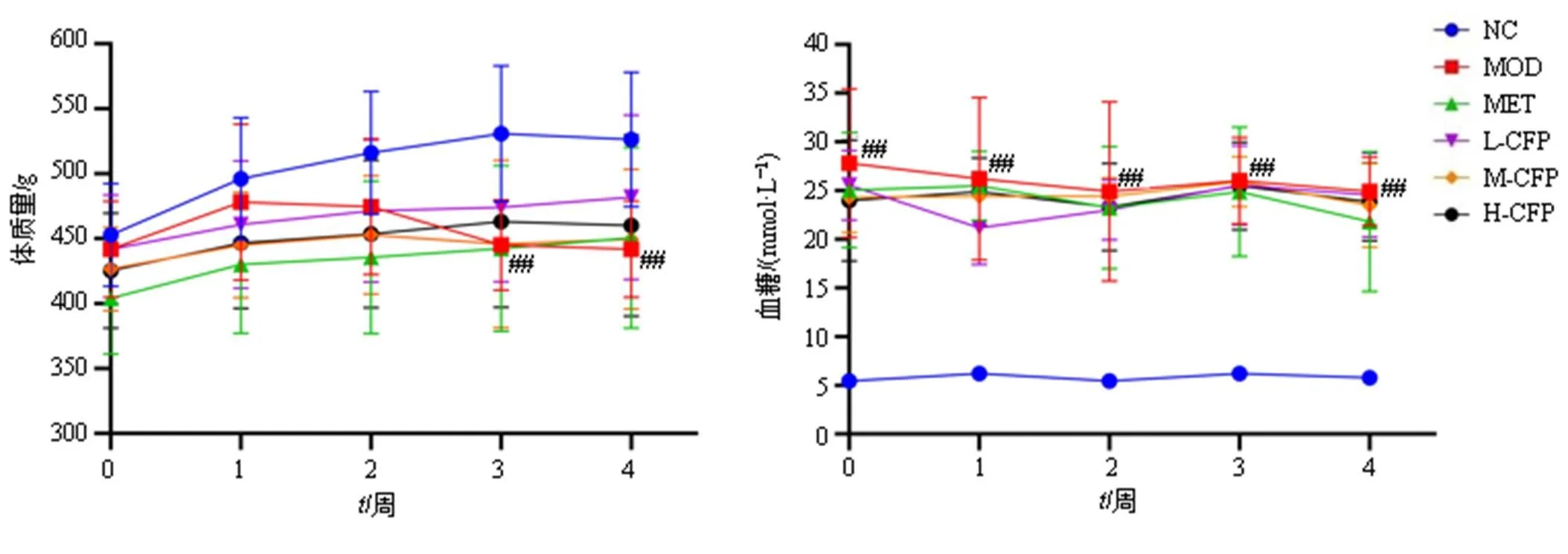
与对照组比较:##P<0.01;NC-对照组;MOD-模型组;MET-二甲双胍组;L-CFP-山茱萸低剂量组;M-CFP-山茱萸中剂量组;H-CFP-山茱萸高剂量组,下图同。
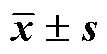
表1 山茱萸多糖对T2DM大鼠血脂和肝功能的影响(, n = 6)
与对照组比较:#<0.05##<0.01;与模型组比较:*<0.05**<0.01,表2同。
#< 0.05##< 0.01control group;*< 0.05**< 0.01model group, same as Table 2.
3.4 山茱萸多糖对T2DM大鼠炎症因子及氧化应激指标的影响
如表2所示,与对照组比较,模型组大鼠血清中IL-6、IL-1β、TNF-α和MDA水平显著升高(<0.01),SOD活性显著降低(<0.01)。与模型组比较,二甲双胍组血清中IL-6、IL-1β、TNF-α和MDA水平显著降低(<0.05、0.01),SOD水平显著升高(<0.05);山茱萸多糖低剂量组血清中IL-1β、TNF-α和MDA水平显著降低(<0.05);山茱萸多糖中剂量组IL-1β水平显著降低(<0.01);山茱萸多糖高剂量组IL-6、IL-1β和MDA水平显著降低(<0.05),SOD活性显著升高(<0.05)。
3.5 山茱萸多糖对T2DM大鼠肝脏组织病理变化的影响
如图2所示,对照组大鼠肝小叶组织结构完整,肝细胞形态正常,轮廓清晰,肝索呈放射状分布。模型组大鼠肝小叶和肝索结构被破坏,肝细胞排列散乱,细胞内存在大量脂滴空泡,可见炎症细胞浸润。与模型组比较,二甲双胍组大鼠肝组织结构有明显改善,肝细胞排列趋向整齐;山茱萸多糖各剂量组大鼠肝组织上述病变情况均得到不同程度的改善。
3.6 大鼠血清代谢组学分析
3.6.1 代谢图谱 采用UPLC-MS进行血清样品的分离和数据采集,各组样品在正、负离子模式下的总离子流图见图3。各组样品总离子流图基本相似,但各组峰形及峰面积存在一定差异,表明大鼠体内部分代谢物发生变化。
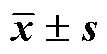
表2 山茱萸多糖对T2DM大鼠炎症因子及氧化应激指标的影响(, n = 6)
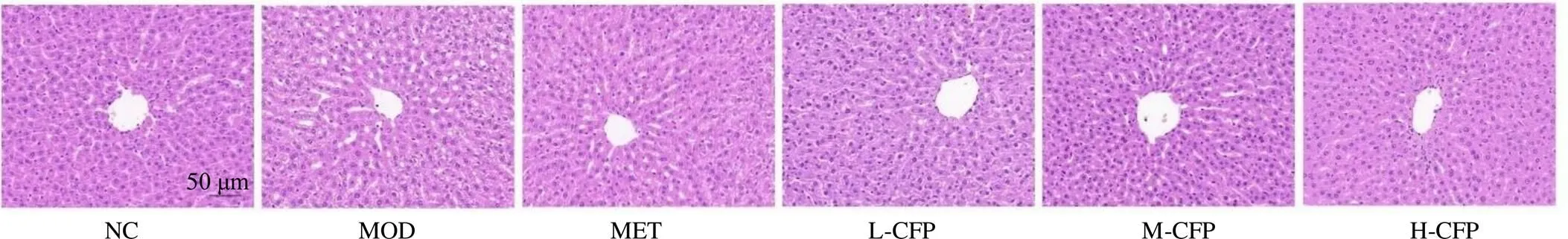
图2 山茱萸多糖对T2DM大鼠肝脏组织病理变化的影响(HE, ×20)
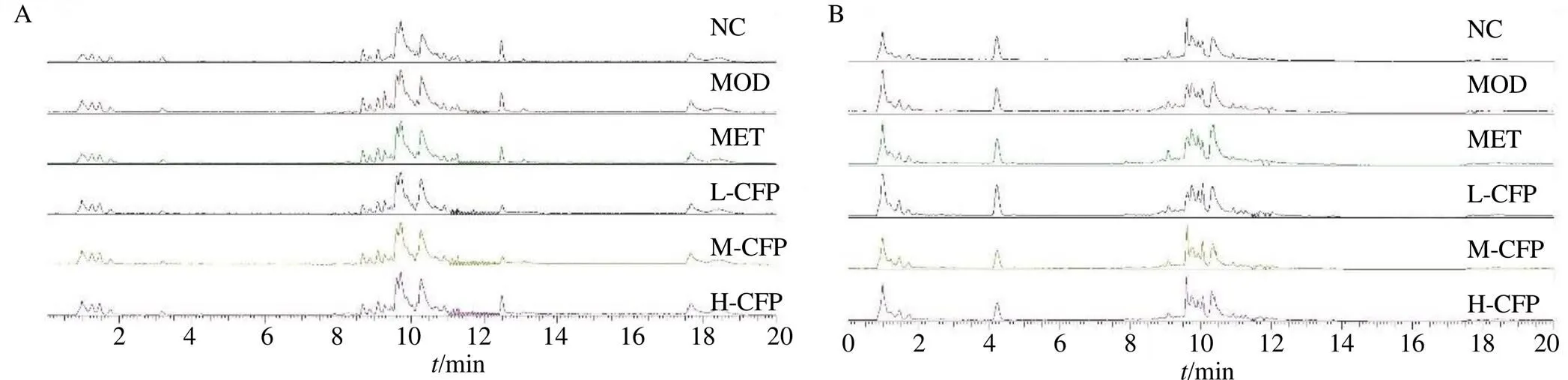
图3 血清样本在正(A)、负(B) 离子模式下的总离子流图
3.6.2 多元统计分析 PCA是一种无监督性的模型分析方法,它可以根据数据的相似性对其进行归类,能够更真实地反映组间差异,识别组内变异。各组大鼠的血清PCA图见图4。在正、负离子模式下,质控样本均聚集良好,说明系统稳定,数据可靠。各组样本在95%的置信区间内均可以较好地聚为一类,且各组之间有明显的离散。
为了更直观反映各组间的差异,进一步进行有监督模式的OPLS-DA。OPLS-DA得分图(图5)显示,对照组和模型组呈现明显分离趋势,说明T2DM大鼠血清代谢轮廓发生了显著变化;山茱萸多糖各给药组远离模型组,逐渐向对照组趋近,说明山茱萸多糖给药组干预的T2DM大鼠血清代谢物有向正常水平恢复的趋势,表明山茱萸多糖对T2DM大鼠机体代谢有一定的正向调控作用。OPLS-DA模型中,2和2用于表示数据对模型的解释能力,正离子模式下2=0.487,2=0.721,2=0.592;负离子模式下2=0.551,2=0.869,2=0.544,均说明模型有良好的预测能力。对OPLS-DA模型进行200次置换检验,所有的2值均低于右侧原点,且2的回归线在纵坐标上的截距小于0,可认为模型没有出现过拟合。
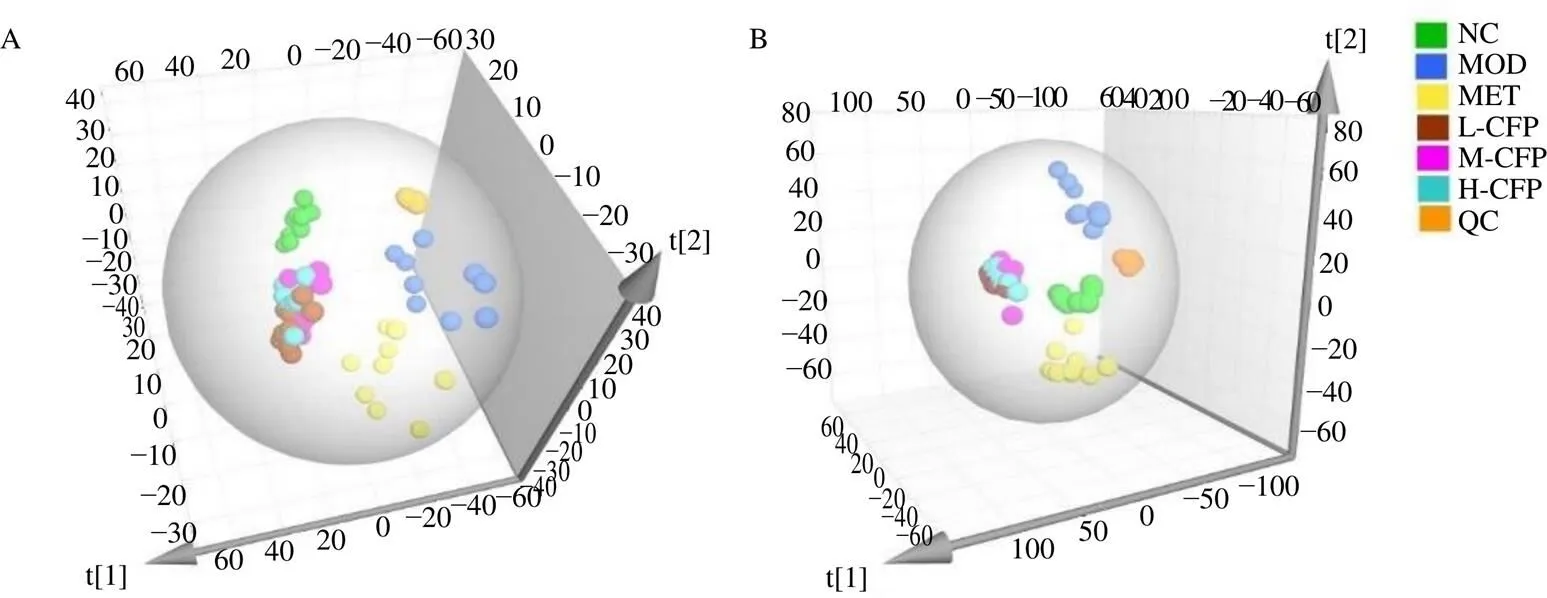
QC-质控样本。
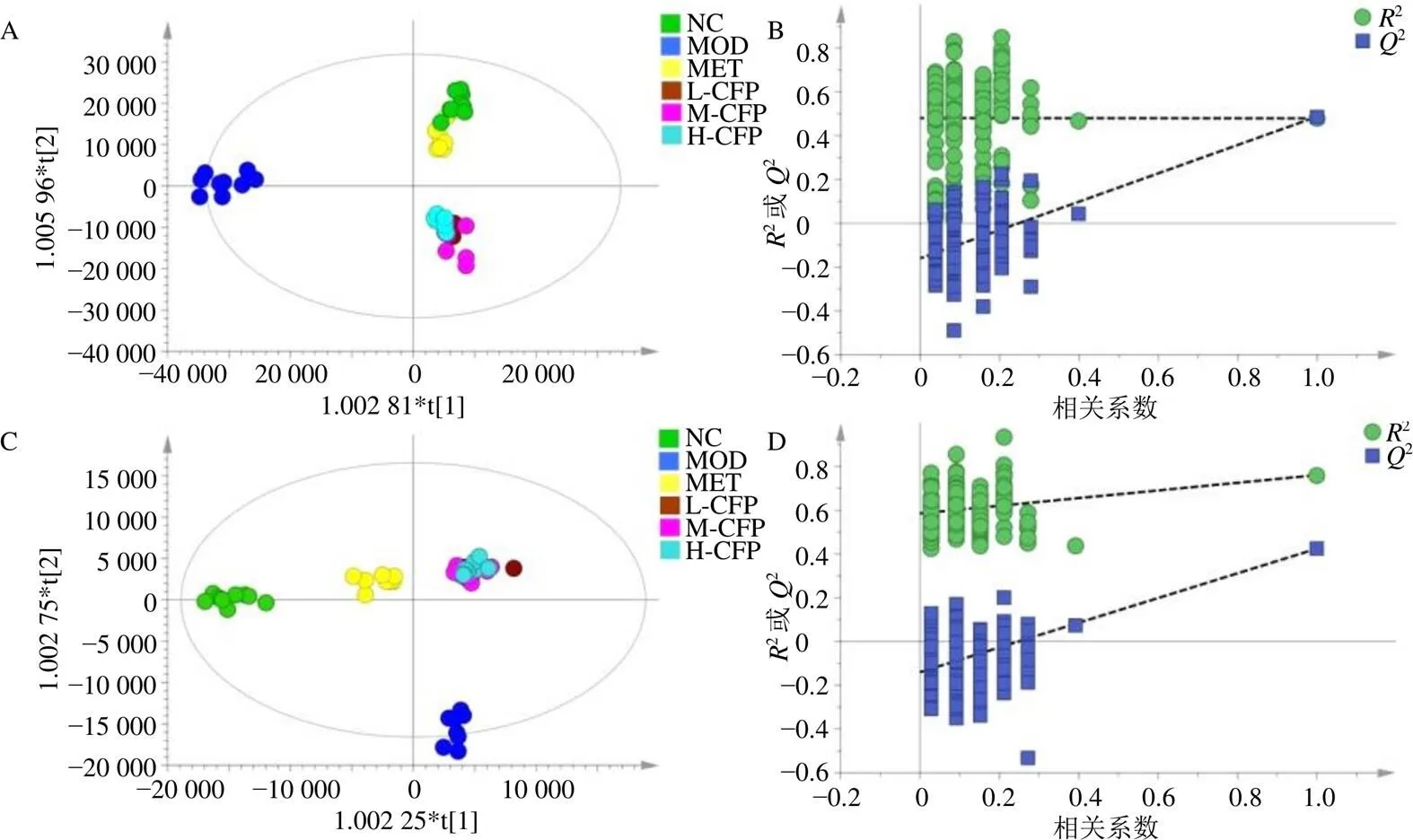
A、B-正离子模式;C、D-负离子模式。
3.6.3 差异代谢物的筛选和鉴定 基于OPLS-DA模型,以VIP>1.0、FC<0.8或>1.2且<0.05为条件筛选差异代谢物,并绘制火山图,见图6。通过检索HMDB等数据库结合二级碎片离子信息对差异代谢物进行鉴定。最终得到血清中有35个与T2DM风险相关的生物标志物,其中正离子模式下有18个,负离子模式下有17个,结果见表3。对比山茱萸多糖给药组与模型组中生物标志物的含量,发现山茱萸低剂量组可显著回调17种,与模型组有26个共同代谢物;山茱萸中剂量组可显著回调14种,与模型组有28个共同代谢物;山茱萸高剂量组可显著回调17种,与模型组有29个共同代谢物。为了更直观地比较生物标志物在各组的含量变化,将样品含量转化成可视化的热图见图7。水平轴和垂直轴分别代表样本与生物标志物,颜色深浅反映变量值,红色表示物质相对含量上调,蓝色表示物质相对含量下调。
3.6.4 代谢通路分析 将T2DM大鼠血清生物标志物,以及山茱萸多糖各给药组可回调的生物标志物,分别导入MetaboAnalyst 5.0网站进行相关的代谢通路分析。选取Impact>0.1的代谢通路进行分析,见图8,T2DM大鼠血清中苯丙氨酸代谢、苯丙氨酸、酪氨酸和色氨酸的生物合成、牛磺酸和次牛磺酸代谢、醚脂质代谢、抗坏血酸和醛酸代谢、丙酮酸代谢、色氨酸代谢和糖酵解/糖异生等23条代谢通路发生紊乱,山茱萸多糖能改善其中22条代谢通路。
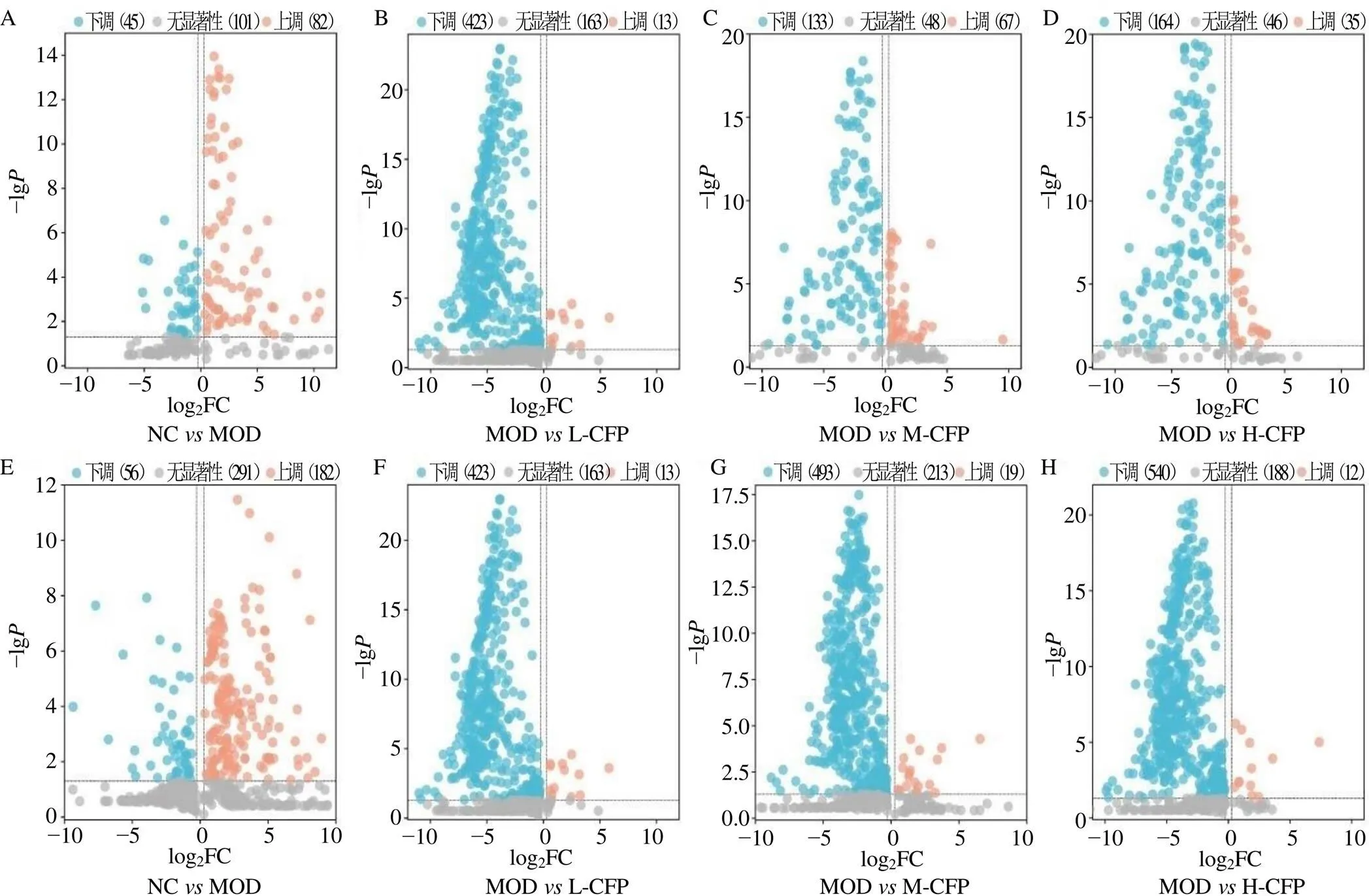
A~D-正离子模式;E~H-负离子模式。
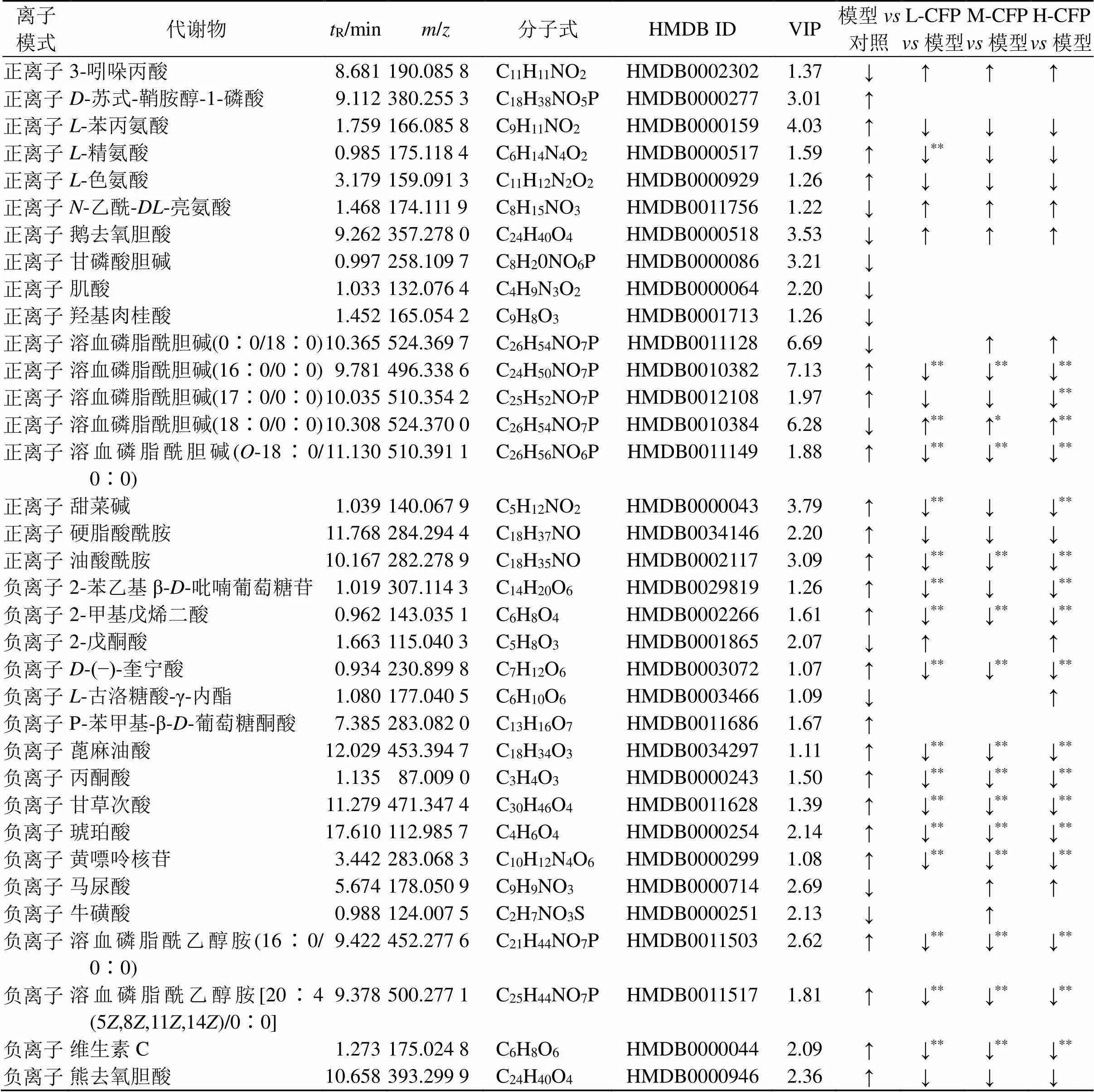
表3 T2DM大鼠血清生物标志物
↑表示上调,↓表示下调;与模型组比较:*<0.05**<0.01;L-CFP-山茱萸低剂量组;M-CFP-山茱萸中剂量组;H-CFP-山茱萸高剂量组。
↑ means up-regulated, ↓ means down-regulated;*< 0.05**< 0.01model group; L-CFP-polysaccharides low-dose group; M-CFP-polysaccharides medium-dose group; H-CFP-polysaccharides high-dose group.
4 讨论
高血糖、血脂异常和慢性低度炎症反应是T2DM进展的重要因素[8]。糖尿病患者在临床上初期表现为“三多一少”,后期会逐步发展成为血脂紊乱;糖脂代谢紊乱会导致大量脂质堆积在肝脏,从而使肝脏细胞内产生氧化应激反应和炎症反应,引起肝脏损伤;同时,炎症反应可以通过各种转录因子介导的分子途径、氧化应激反应等激活各种促炎症介质,这些介质通过血液或旁分泌作用干扰胰岛素信号通路的传导,从而诱导胰岛素抵抗,导致糖尿病及脂质代谢紊乱的发生[9-10]。而肝脏受损和胰岛素抵抗可进一步加重糖脂代谢紊乱,当糖脂升高,胰岛素分泌不足时,又可诱导氧化应激的产生,加速糖尿病的发展恶化,二者相互影响,导致恶性循环[11],因此改善糖脂代谢紊乱对于治疗T2DM有重要意义。本研究结果显示,给药前T2DM大鼠进食饮水量和尿量明显增多,体质量下降,血糖升高。给予药物干预后,上述症状均有不同程度的改善;同时检测大鼠血清中相关生化指标,结果显示山茱萸多糖能显著降低TC、TG、LDL-C、AST、ALT、IL-6、IL-1β、TNF-α和MDA水平,升高HDL-C水平,提高SOD活性;通过观察肝脏病理切片,发现T2DM大鼠存在肝损伤情况,给药干预后,大鼠肝脏的病理形态有所改善。表明山茱萸多糖可以通过降低T2DM大鼠的血糖血脂水平和体内炎症反应,抑制氧化应激反应,以及改善肝损伤情况,进而调控大鼠体内糖脂代谢紊乱,减轻胰岛素抵抗来发挥降糖作用。

图7 各组大鼠血清生物标志物聚类分析热图
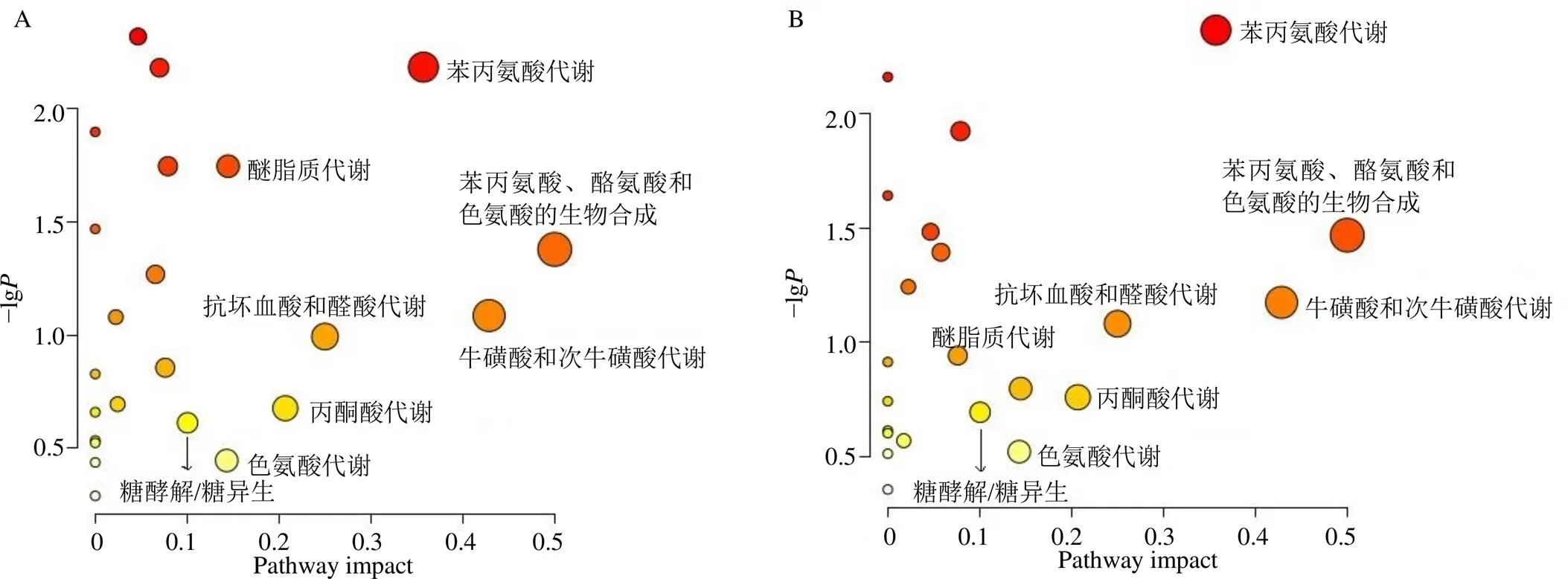
A-与T2DM相关通路;B-山茱萸多糖干预的通路。
为进一步探究山茱萸多糖治疗T2DM的作用机制,本研究采用非靶向代谢组学方法,用UHPLC-MS技术检测对照组、模型组、二甲双胍组和山茱萸多糖低、中、高剂量组大鼠血清内源性代谢物的变化。与对照组比较,模型组大鼠体内-苯丙氨酸、-色氨酸、牛磺酸、马尿酸、溶血磷脂酰胆碱(-18∶0/0∶0)、丙酮酸、抗坏血酸、-古洛糖酸-γ-内酯等35个代谢物发生显著性改变;给予山茱萸多糖干预后,其代谢产物有明显回调趋势,主要涉及到氨基酸代谢、糖代谢、脂质代谢等代谢途径。
氨基酸是T2DM的潜在生物标志物,T2DM的发生与血浆芳香氨基酸(苯丙氨酸、酪氨酸、色氨酸)水平呈正相关,胰岛素抵抗可导致体内芳香氨基酸水平升高[12-13]。苯丙氨酸和色氨酸均是人体必需氨基酸,苯丙氨酸的代谢特征可预测糖尿病的发展,高浓度的苯丙氨酸会破坏胰岛素信号传导,抑制葡萄糖摄取,降低糖尿病患者的胰岛素敏感性[14]。色氨酸作为抗自由基活性最强的氨基酸[15],是犬尿氨酸途径的来源,犬尿氨酸通路参与免疫激活和炎症调节,与肥胖和胰岛素抵抗有关。此外,色氨酸还被肠道菌群分解代谢,产生多种吲哚衍生物[16]。研究发现色氨酸代谢物能抑制胰岛素原合成及胰岛素的释放,降低T2DM的发生风险[17]。本研究实验结果显示,T2DM大鼠血清的-苯丙氨酸和-色氨酸水平显著升高,色氨酸的吲哚代谢物3-吲哚丙酸含量降低;给予山茱萸多糖干预后,代谢物均有回调趋势,表明山茱萸多糖可能通过调节氨基酸代谢发挥抗T2DM作用。
脂质代谢异常通常表现为与高血脂相关的脂质异常升高。溶血磷脂酰胆碱(-18∶0/0∶0)是甘油磷脂的代谢产物,研究发现脂质中间产物与糖尿病并发的炎症、氧化应激等密切相关[18]。牛磺酸是一种条件必需氨基酸,不参与蛋白质合成,大量研究表明牛磺酸可以从抗氧化、抗炎、保护胰岛β细胞、促进胰岛素分泌、改善胰岛素抵抗等多方面发挥降血糖作[19]。佟季航[20]发现牛磺酸能够改善肥胖T2DM大鼠糖脂代谢,减轻肝脏的脂肪变性,缓解大鼠肝脏的氧化应激和炎症反应。曹志龙等[21]发现牛磺酸可能通过降低细胞内活性氧水平、提升抗氧化酶的活性,从而减轻氧化应激损伤和胰岛素抵抗。本研究结果显示,T2DM大鼠血清中溶血磷脂酰胆碱(-18∶0/0∶0)水平显著升高,牛磺酸含量显著降低;山茱萸多糖干预后,代谢物水平均有回调趋势,且大鼠血清中LDL-C显著回调,肝组织切片结果显示脂肪浸润得到了明显改善,说明山茱萸多糖对T2DM的脂质代谢紊乱具有调节作用。
丙酮酸是糖酵解的最终产物,可以通过线粒体丙酮酸转运载体(mitochondrial pyruvate carrier,MPC)进入线粒体,是线粒体氧化代谢的燃料。MPC介导的丙酮酸代谢在T2DM的病理生理过程中发挥重要作用。Zhu等[22]发现在新冠病毒感染肥胖小鼠模型中,MPC抑制剂可降低血糖血脂水平、减轻肺组织炎症反应。抗坏血酸主要在肝细胞中合成,它能够通过戊糖磷酸途径在不同细胞中到达糖酵解/糖异生途径,是糖酵解/糖异生的底物。Shen等[23]发现Akkermansia能通过调节抗坏血酸和醛酸代谢途径降低糖尿病肾病大鼠的血糖,减轻炎症和氧化应激反应。实验结果显示山茱萸多糖能显著降低T2DM大鼠血清中丙酮酸和抗坏血酸代谢物含量,说明山茱萸多糖能通过调节糖代谢改善T2DM。
代谢组学具有系统性、动态性的特点,与中药的“整体观”“辩证观”相吻合,被广泛应用于中药的作用机制研究[24]。本研究首次利用UHPLC-MS的非靶向代谢组学方法对山茱萸多糖治疗T2DM大鼠的作用机制进行研究,结果表明山茱萸多糖可能通过调节氨基酸代谢、糖代谢、脂质代谢等代谢途径,从而改善糖脂代谢紊乱及肝损伤情况,达到治疗T2DM的作用,为后续山茱萸多糖的临床开发与应用提供了实验参考依据。
本研究虽然已筛选出与T2DM相关的生物标志物及代谢通路,但T2DM病因复杂,仅采用非靶向血清代谢组学得出的结果缺乏特征性和专属性,难以全面阐释山茱萸多糖抗T2DM的作用机制,在后续的研究过程中,可以利用靶向代谢组学及肠道菌群深入探究山茱萸多糖干预T2DM的确切机制。
利益冲突 所有作者均声明不存在利益冲突
[1] 田文国, 刘毅, 盖晓红, 等. 地黄治疗2型糖尿病作用机制的研究进展 [J]. 中草药, 2022, 53(23): 7575-7584.
[2] Pan X F, Chen Z Z, Wang T J,. Plasma metabolomic signatures of obesity and risk of type 2 diabetes [J]., 2022, 30(11): 2294-2306.
[3] 胡佳卉, 钱会南, 白雪芳, 等. 不同中成药联合二甲双胍治疗2型糖尿病有效性的网状Meta分析 [J]. 中医杂志, 2020, 61(24): 2163-2173.
[4] Wang D Y, Li C X, Fan W C,. Hypoglycemic and hypolipidemic effects of a polysaccharide fromin streptozotocin-induced diabetic rats [J]., 2019, 133: 420-427.
[5] 朱丽芳, 陈露. 山茱萸多糖的提取和多糖降解研究进展 [J]. 现代盐化工, 2022, 49(5): 7-9.
[6] 李金菊, 吴迪, 方朝晖. 桑叶红茶片对2型糖尿病模型大鼠糖脂代谢及炎症因子的影响[J]. 中医药临床杂志, 2022, 34(4): 707-711.
[7] 邓龙飞, 张建伟, 刘海燕, 等. 地麦活性糖改善II型糖尿病大鼠药效学研究 [J]. 辽宁中医药大学学报, 2021, 23(9): 41-46.
[8] Krause M, de Vito G. Type 1 and type 2 diabetes mellitus: Commonalities, differences and the importance of exercise and nutrition [J]., 2023, 15(19): 4279.
[9] 阮鸿娇, 葛婷, 胡万祥, 等. 线粒体动力学、炎症与2型糖尿病[J]. 承德医学院学报, 2021, 38(3): 234-239.
[10] Degirmenci I, Ozbayer C, Kebapci M N,. Common variants of genes encoding TLR4 and TLR4 pathway members TIRAP and IRAK1 are effective on MCP1, IL6, IL1β, and TNFα levels in type 2 diabetes and insulin resistance [J]., 2019, 68(9): 801-814.
[11] 曾梦莹. 牛磺酸干预对2型DM大鼠糖脂代谢及氧化应激的调节作用研究[D]. 新疆: 新疆医科大学, 2019.
[12] Jin Q, Ma R C W. Metabolomics in diabetes and diabetic complications: Insights from epidemiological studies [J]., 2021, 10(11): 2832.
[13] Li H S, Fang Q Y, Nie Q X,. Hypoglycemic and hypolipidemic mechanism of tea polysaccharides on type 2 diabetic rats via gut microbiota and metabolism alteration [J]., 2020, 68(37): 10015-10028.
[14] 郭慧琴. 燕麦β-葡聚糖改善糖尿病及糖尿病肾病作用机制研究 [D]. 太原: 山西大学, 2023.
[15] Rombauts A, Abelenda-Alonso G, Cuervo G,. Role of the inflammatory response in community-acquired pneumonia: Clinical implications [J]., 2022, 20(10): 1261-1274.
[16] Qi Q B, Li J, Yu B,. Host and gut microbial tryptophan metabolism and type 2 diabetes: An integrative analysis of host genetics, diet, gut microbiome and circulating metabolites in cohort studies [J]., 2022, 71(6): 1095-1105.
[17] Vangipurapu J, Fernandes Silva L, Kuulasmaa T,. Microbiota-related metabolites and the risk of type 2 diabetes [J]., 2020, 43(6): 1319-1325.
[18] 时正媛, 李京峰, 宝丽, 等. 金芪降糖片治疗2型糖尿病大鼠的血清代谢组学研究 [J]. 世界中医药, 2022, 17(8): 1081-1085.
[19] 赵玉星, 郭俊霞, 陈文. 牛磺酸改善糖代谢的量效分析 [J]. 食品工业科技, 2017, 38(21): 295-301.
[20] 佟季航. 牛磺酸和牛磺胆酸对肥胖II型糖尿病大鼠肝脏氧化应激和炎症反应的影响[D]. 沈阳: 沈阳农业大学, 2023.
[21] 曹志龙, 李德龙, 陈冰婷, 等. 牛磺酸对胰岛素抵抗HepG2细胞氧化应激的保护作用及机制研究 [J]. 现代医药卫生, 2021, 37(13): 2157-2160.
[22] Zhu B B, Wei X Q, Narasimhan H,. Inhibition of the mitochondrial pyruvate carrier simultaneously mitigates hyperinflammation and hyperglycemia in COVID-19 [J]., 2023, 8(82): eadf0348.
[23] Shen Z, Cui T, Liu Y,.andameliorate diabetic kidney disease via the “gut-kidney axis” [J]., 2023, 121: 155129.
[24] 张雨馨, 陈碧莹, 王丽明, 等. 代谢组学在中药作用机制研究中的应用 [J]. 中南药学, 2023, 21(7): 1712-1719.
Mechanism of intervention of Corni Fructus polysaccharides in type 2 diabetes mellitus rats based on serum metabolomics
CUI Yongxia1, SHANG Zihui1, HOU Yadi1, WANG Lili1, SUN Xiaoya1, WU Mingxia1, CHEN Suiqing1, 2
1. College of Pharmacy, Henan University of Chinese Medicine, Zhengzhou 450046, China 2. Collaborative Innovation Center of Research and Development on the Whole Industry Chain of Yu-Yao, Henan University of Chinese Medicine, Zhengzhou 450046, China
To explore the mechanism of intervention of Shanzhuyu () polysaccharides in type 2 diabetes mellitus (T2DM) rats based on metabolomics.A total of 10 male SD rats were selected as the control group, while the remaining rats were induced to construct a T2DM model using a high sugar and high-fat diet combined with streptozocin (STZ). The successfully modeled rats were randomly divided into model group, metformin (200 mg/kg) group, andpolysaccharides low-, medium-, and high-dose (75, 150, 300 mg/kg) groups, rats in each group were given drugs in the morning for four consecutive weeks. Before the last administration, the rats were fasted for 10 h. After anesthesia, blood was collected from the abdominal aorta and serum was separated, while liver tissue was taken. Kit was used to detect levels of total cholesterol (TC), triglyceride (TG), low density lipoprotein cholesterol (LDL-C), high density lipoprotein cholesterol (HDL-C), interleukin-1β (IL-1β), IL-6, tumor necrosis factor-α (TNF-α), malondialdehyde (MDA) and activities of alanine aminotransferase (ALT), aspartate aminotransferase (AST), superoxide dismutase (SOD). Hematoxylin-eosin (HE) staining was used to observe the pathological changes of liver tissue. Ultra-high performance liquid chromatography linear ion trap orbital trap tandem mass spectrometry (UHPLC-LTQ-Orbitrap-MS/MS) technology was used to detect the level of endogenous metabolites in serum of rats, and principal component analysis (PCA) and orthogonal partial least squares-discriminant analysis were used to screen and identify differential metabolites. MetaboAnalyst platform was used for metabolic pathway analysis.Compared with model group, the body weight and blood glucose levels of rats inpolysaccharides administration group were reduced, and the liver injury was significantly improved. The levels of TC, TG, LDL-C, IL-6, IL-1β, TNF-α, MDA and activities of AST, ALT in serum were decreased (< 0.05, 0.01), HDL-C level and SOD activity were increased (< 0.05). A total of 35 potential biomarkers related to T2DM were screened by serum metabolomics, and 29 biomarkers were regulated inpolysaccharides administration group, which mainly involved 22 metabolic pathways including phenylalanine metabolism and biosynthesis, taurine and hypotaurine metabolism, ether lipid metabolism and pyruvate metabolism.polysaccharides can effectively improve the glucose and lipid metabolism disorders caused by T2DM, alleviate liver damage, and achieve the effect of treating T2DM, which may be related to the regulation of amino acid metabolism, glucose metabolism, lipid metabolism and other metabolic pathways.
polysaccharides; type 2 diabetes mellitus; UHPLC-LTQ-Orbitrap-MS/MS; metabolomics; amino acid metabolism; glucose metabolism; lipid metabolism
R285.5
A
0253 - 2670(2024)09 - 2976 - 11
10.7501/j.issn.0253-2670.2024.09.012
2023-12-22
河南省重大科技专项(221100310400);河南省科技攻关项目(242102310524);郑州市科技协同创新项目(2023XTCX053);河南中医药大学博士科研基金项目(BSJJ2022-04)
崔永霞,副教授,从事中药质量控制及药效物质基础研究。E-mail: 1020076356@qq.com
通信作者:吴明侠,副教授,从事中药质量控制及药效物质基础研究。E-mail: mxwu711@163.com
陈随清,教授,博士生导师,从事中药品种整理与质量标准研究工作。E-mail: suiqingchen0371@163.com
[责任编辑 李亚楠]

