野黄芩素纳米晶体的制备及治疗慢性瘙痒模型药效评价
刘新颖,王富江,葛海涛*
野黄芩素纳米晶体的制备及治疗慢性瘙痒模型药效评价
刘新颖1, 2,王富江2*,葛海涛1, 2*
1. 南京中医药大学,江苏 南京 210023 2. 江苏苏中药业研究院有限公司,江苏 南京 210031
制备野黄芩素纳米晶体(scutellarein nanocrystals,Scu-NCs),进行药剂学性质研究,并考察其对小鼠皮肤干燥瘙痒模型的治疗效果。采用反溶剂沉淀技术制备Scu-NCs,并通过冷冻干燥技术将其固化成固体粉末;测定Scu-NCs的平均粒径、分散系数、ζ电位并观察其微观结构;差示扫描量热法(differential scanning calorimetry,DSC)及傅里叶变换红外光谱法(Fourier transform infrared spectroscopy,FTIR)分析其晶型及化学结构的变化;测试其体外药物溶出速率和其凝胶剂的体外释放度;评价野黄芩素及Scu-NCs凝胶剂经皮给药对丙酮/乙醚和水(acetone-ether-water,AEW)诱导的小鼠干皮瘙痒模型的止痒作用。制备得到的Scu-NCs平均粒径为(379.1±1.7)nm,多分散系数(polydispersity index,PDI)值为0.238±0.081,ζ电位为(25.50±0.25)mV;野黄芩素纳米化后野黄芩素的晶型和化学结构未发生明显变化;Scu-NCs冷冻干燥后粒径无明显变化;野黄芩素纳米化后提高了药物2 h内的溶出速率、溶出度及Scu-NCs凝胶剂6 h内的体外释放度;与AEW模型组相比,野黄芩素、Scu-NCs凝胶剂给药组可明显降低小鼠1 h内抓挠次数,抑制颈背部表皮增厚及皮肤中白细胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的表达,且Scu-NCs对AEW模型抑制效果更明显。Scu-NCs粒径较小且均匀,其纳米化后晶型和化学结构没有发生明显改变;将野黄芩素制备成纳米晶体后,可明显改善药物的溶出度与体外释放度,对皮肤局部慢性瘙痒具有更好的治疗效果。
野黄芩素;纳米晶体;凝胶;慢性瘙痒;外用制剂;反溶剂沉淀技术;冷冻干燥技术;白细胞介素;肿瘤坏死因子-α
黄芩是一种被广泛应用于呼吸道感染、肝脏炎症、皮肤特别是上皮组织炎症性疾病的传统中药[1]。野黄芩素是黄芩Georgi中的主要黄酮类化合物之一,此外,野黄芩素也富含于治疗皮肤炎症性疾病的传统中药灯盏细辛(Vant.) -Mazz.和木蝴蝶(L.) Vent中[2-3],因此推测野黄芩素对皮肤炎症及瘙痒具有一定的治疗效果。但是,野黄芩素水溶性差、吸收率低、生物利用度极低[4-5],因此限制了其在经皮给药领域的应用。剂型研究发现,纳米混悬液(又称纳米晶体、纳米结晶)载药量高、生物相容性好,可改善难溶性药物的溶解度和生物利用度[6-7]。
慢性瘙痒是皮肤科疾病最常见的临床症状,常与特应性皮炎等病理性干燥皮肤病和肾病等系统性疾病有关,目前对其发病机制尚不十分清楚,且缺乏便捷有效的治疗方法[8-10]。通过对小鼠采用丙酮/乙醚和水(acetone/ethyl ether and water,AEW)贯序涂抹的实验方法,可破坏皮肤屏障、增加经皮水分损失,引起皮肤干燥、瘙痒,这也是目前研究慢性瘙痒疾病比较经典的模型之一[11-12]。
本研究采用反溶剂沉淀技术制备野黄芩素纳米晶体(scutellarein nanocrystals,Scu-NCs)混悬液[13],将其冷冻干燥形成固体粉末后作为制剂中间体,并进行凝胶化,并考察Scu-NCs对小鼠AEW模型的治疗效果。
1 仪器与材料
1.1 主要仪器
Scientz-10N/D−80 ℃型冷冻干燥机,宁波新芝生物科技股份有限公司;Talos F200X G2型透射电子显微镜(TEM)、Vanquish Core型高效液相色谱仪,赛默飞世尔科技公司;RYJ-12B型智能透皮仪,上海黄海药检仪器有限公司;Nano-ZS型纳米激光粒度仪,英国马尔文仪器有限公司;TGL-16c型台式离心机,上海安亭科学仪器厂;KH7200DB型数控超声波清洗机,昆山禾创超声仪器有限公司;ZKT-18F型智能溶出仪,上海富科思分析仪器有限公司;RT-6100型酶标分析仪,深圳雷杜生命科学股份有限公司;Q2000型差示扫描量热仪,美国TA仪器公司;Alpha II型傅里叶红外光谱仪,北京布鲁克科技有限公司。
1.2 实验药品
野黄芩素原料药,批号047-09-20,质量分数96.7%,江苏苏中药业研究院有限公司;卡泊三醇倍他米松软膏(calcipotriol betamethasone,Cal B),批号C81922,爱尔兰利奥制药有限公司;泊洛沙姆(Poloxamer 188,P188,批号N20220205)、聚山梨酯80(Tween-80,T80,批号20210904-01),南京威尔药业集团股份有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS),批号C2131028,阿拉丁试剂(上海)有限公司;大豆卵磷脂,批号202206041,上海太伟药业股份有限公司;聚乙烯吡咯烷酮(polyvinyl pyrrolidone K30,PVP K30),批号210601,安徽山河药用辅料有限公司;,-二甲基甲酰胺(,-dimethylformamide,DMF,批号K95760602)、甲醇(批号L121907224),西格玛奥德里奇(上海)贸易有限公司;无水乙醚(批号20220630)、丙酮(批号20180606),国药集团化学试剂有限公司;羟丙甲基纤维素(hydroxypropyl methyl cellulose,HPMC),批号PDR504180,卡乐康包衣技术(上海)有限公司。
1.3 动物
SPF级雄性C57BL/6小鼠50只,6周龄,体质量(20±2)g,购自北京斯贝福生物技术有限公司;生产许可证号SCXK(京)2019-0010。实验动物饲养于江苏苏中药业集团生物制药有限公司动物房,饲养环境温度(22±2)℃,相对湿度50%~80%,所有动物均正常饲养,自由饮水、进食。本研究经过江苏苏中生物制药有限公司实验动物伦理委员会批准,伦理审查批号为SZSW-2023050901。
2 方法与结果
2.1 Scu-NCs冻干粉的制备
采用反溶剂沉淀技术制备Scu-NCs。精密称取处方量的野黄芩素原料药于烧杯中,加入一定质量的DMF充分溶解,另外称取处方量的卵磷脂加入到同一烧杯中,加入一定质量的甲醇充分溶解卵磷脂,取完全溶解的SCU和卵磷脂混合溶液过0.22mm滤膜,作为有机相;取处方量的稳定剂溶解于纯水中,充分溶胀后过0.22mm滤膜,作为水相。将18 mL水相置于冰水浴中,在超声的条件下,将2 mL有机相匀速滴入水相中,加入过程中持续搅拌,超声频率为40 kHz,超声时间为2 min,即得到Scu-NCs混悬液。
取上述Scu-NCs混悬液,于−80 ℃冷冻干燥机中预冻12 h后,继续减压干燥48 h,即得到Scu-NCs冻干粉。
2.2 Scu-NCs制备条件优化
2.2.1 稳定剂种类筛选 在“2.1”项工艺条件下,将质量分数0.2%的稳定剂(Poloxamer 188、HPMC、SDS、Tween-80、PVP K30)引入水相,单因素考察不同稳定剂对纳米晶体粒径及多分散系数(polydispersity index,PDI)的影响,筛选纳米晶体制备时所用稳定剂种类。稳定剂种类筛选结果见表1,当选用稳定剂为Poloxamer 188时,所制得Scu-NCs平均粒径较小[(501.3±1.4)nm]的同时PDI值较低(0.265±0.016)。
2.2.2 正交试验优化处方 结合稳定剂种类筛选结果与预实验中纳米晶体制备过程中对粒径影响较大因素,以水相中稳定剂的质量分数(B),有机相中野黄芩素质量分数(A)、卵磷脂的质量分数(C),有机相中DMF与甲醇(DMF/甲醇)的体积比(D)为4个因素,每个因素设置3个水平,以平均粒径为筛选指标,按L9(34)正交表设计实验方案,进行Scu-NCs制备处方筛选。正交试验因素与水平及试验结果见表2,方差分析结果见表3。
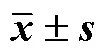
表1 稳定剂种类对Scu-NCs的粒径、PDI的影响(, n = 3)
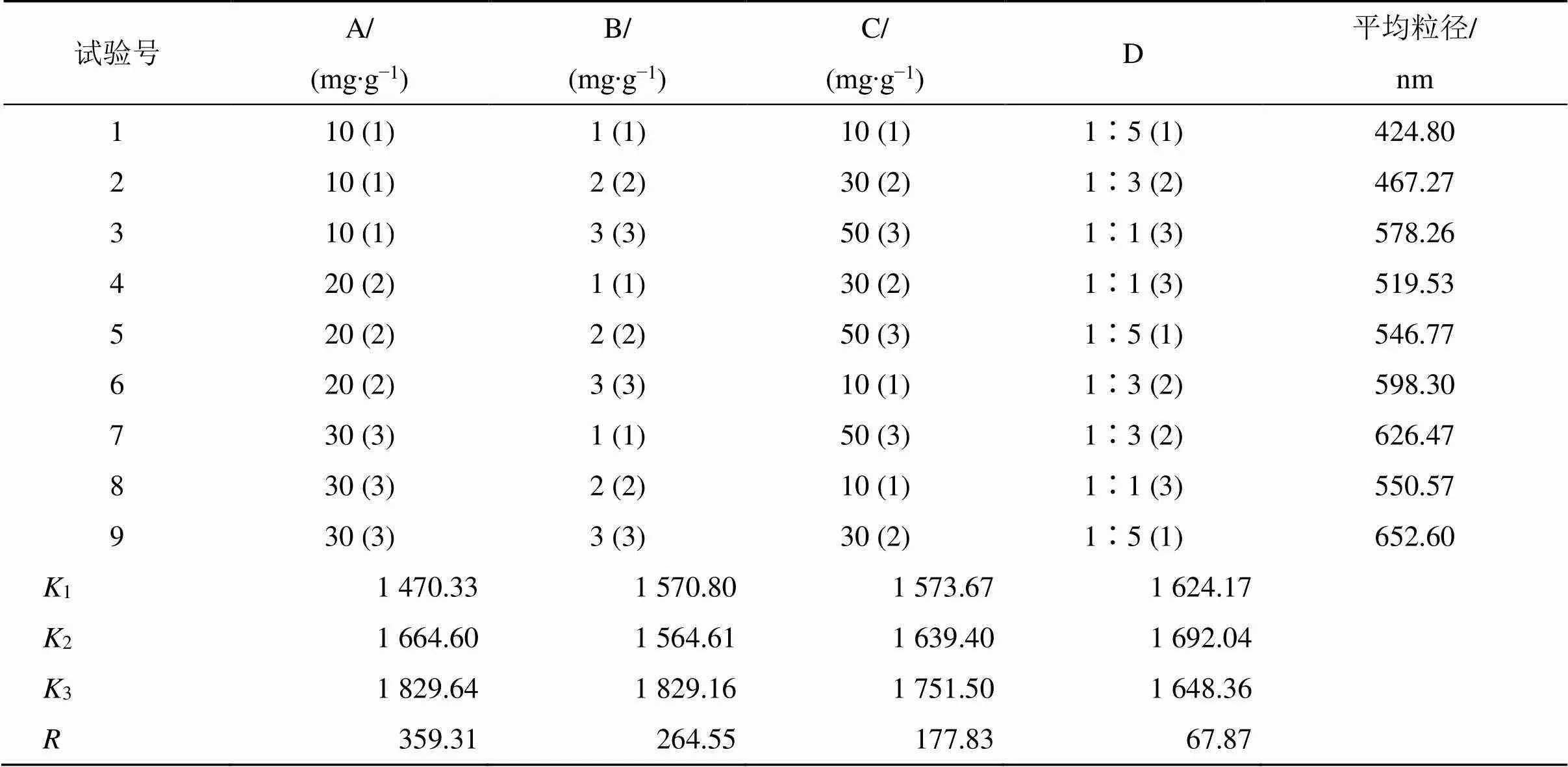
表2 正交试验设计与结果
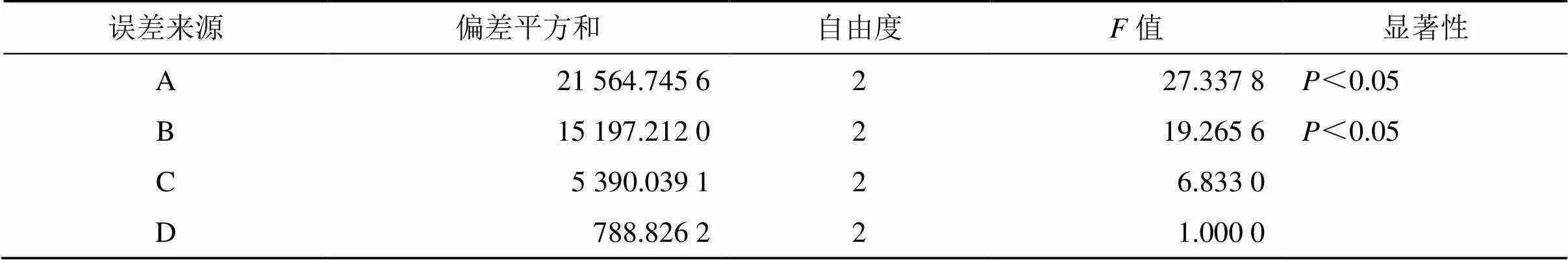
表3 方差分析
0.05(2, 2)=19.000.01(2, 2)=99.00。
根据表2中极差值可知,各因素对Scu-NCs平均粒径影响的顺序为A>B>C>D,说明有机相中野黄芩素质量分数对Scu-NCs粒径影响最大。根据考察指标平均粒径,选择平均粒径小的处方,即A1B2C1D1,正交试验所得最佳工艺参数为水相中P188质量分数为2 mg/g,有机相中野黄芩素、卵磷脂质量分数为10 mg/g,有机相中DMF/甲醇比例为1∶5。
2.2.3 处方工艺验证 采用“2.2.2”项下确定的处方制备Scu-NCs混悬液及冻干粉各3批,分别将新制备的Scu-NCs混悬液及复溶后的Scu-NCs冻干粉稀释10倍,使用激光粒度仪测定平均粒径,分散系数及ζ电位。测定参数:室温;水折光率1.33;野黄芩素折光率1.59。由检测结果可知,Scu-NCs混悬液冻干前后平均粒径及分散系数变化不大,多分散系数均<0.30,表明Scu-NCs粒度分布较窄,分散性良好,黏附和聚集情况较少[14];Scu-NCs混悬液冻干后ζ电位变小,但均>20 mV,表明Scu-NCs稳定性较好[15]。粒径、PDI、ζ电位检测结果显示,3批Scu-NCs混悬液及冻干粉制备处方工艺稳定,重复性良好,实验结果见表4。
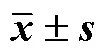
表4 Scu-NCs混悬液及冻干粉粒径、分散系数及ζ电位(, n = 3)
2.3 外观形态观察
将1滴Scu-NCs悬浮液滴加在铜网上,用2%磷钨酸染色2 min,在TEM下观察Scu-NCs的大小和形态。由图1可知,Scu-NCs呈棒状规则晶体形态,分散性良好,其粒径相比于野黄芩素原料药显著减小,在300~500 nm。
2.4 晶形及结构
2.4.1 差示扫描量热分析(differential scanning calorimetry,DSC) 将野黄芩素、Scu-NCs、空白辅料及处方量比例的野黄芩素、泊洛沙姆、卵磷脂物理混合物用差示扫描量热仪分别测定其吸热峰。测定条件:参比物Al2O3;气氛:N2;升温程序:初温25 ℃,终温280 ℃,升温速率10 ℃/min。DSC图谱见图2,由图可知,野黄芩素原料药无明显峰,空白辅料在50 ℃左右有1个吸热峰,野黄芩素物理混合物及Scu-NCs除50 ℃左右空白辅料吸热峰外无特别明显的峰。结果表明,野黄芩素纳米晶体化后晶型没有发生明显变化,仍以晶体形式存在。

图1 野黄芩素原料药(a) 和Scu-NCs (b) 的微观形貌
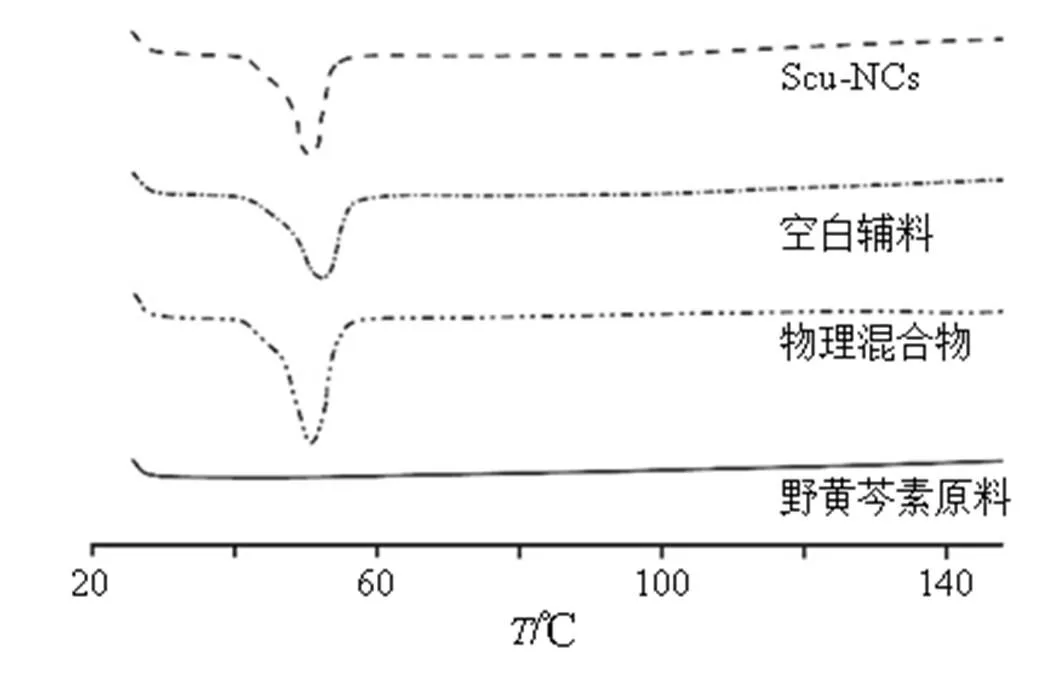
图2 野黄芩素、Scu-NCs、野黄芩素物理混合物及空白辅料DSC图谱
2.4.2 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析 将野黄芩素和Scu-NCs压片后分别用红外光谱仪进行测定。取少量待测样品,碾碎后加入溴化钾(KBr)混合均匀、研磨后压片。红外光谱测定扫描范围4 000~500 cm−1。分别对野黄芩素、Scu-NCs进行红外光谱分析,检测结果如图3所示,Scu-NCs的酚羟基(OH伸缩振动峰,3 294.10、2 888.74、2 360.13 cm−1)发生了一定程度的蓝移,推测是由于Scu-NCs形成过称中,野黄芩素与辅料分子之间形成氢键作用。此外,Scu-NCs相较野黄芩素其他特征峰的峰形和位置基本相似,说明野黄芩素纳米化后化学结构没有发生明显改变。
2.5 溶出度考察
2.5.1 野黄芩素含量测定方法
(1)色谱条件:Agilent C18色谱柱(250 mm×4.6 mm,5mm);流动相为乙腈-磷酸盐水溶液(pH 3.0的0.02 mol/L磷酸二氢钠溶液)(25∶75);柱温35 ℃;检测波长336 nm;体积流量1.0 mL/min;进样体积20mL。
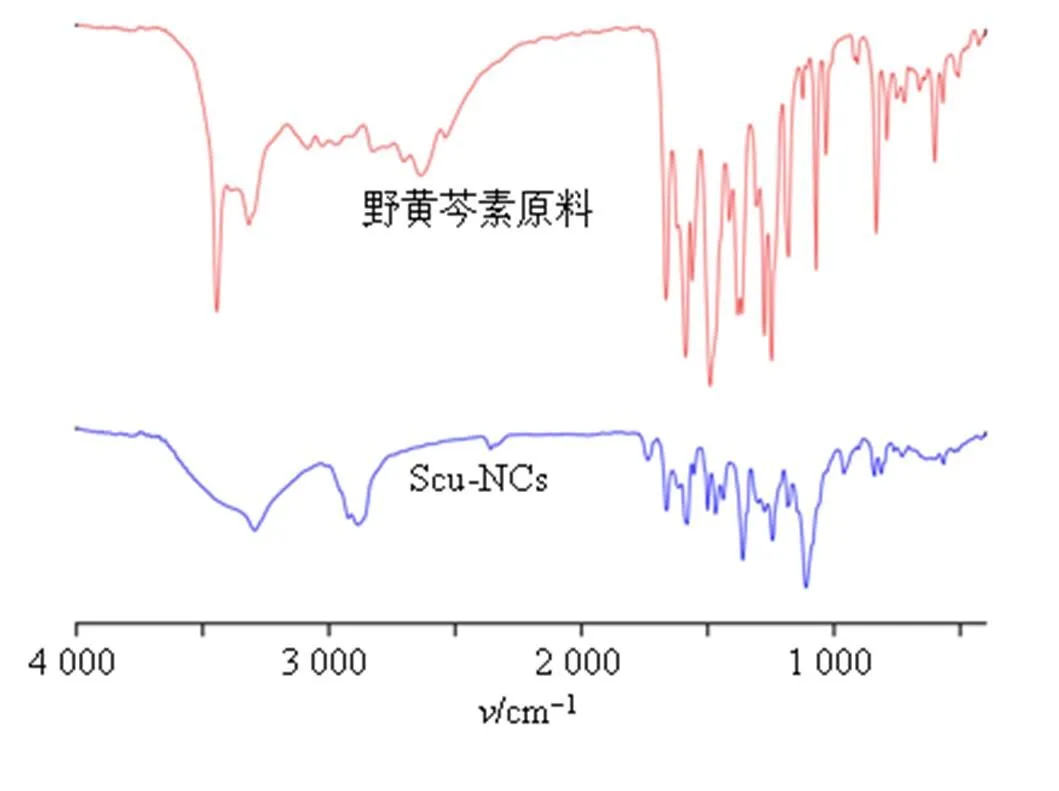
图3 野黄芩素、Scu-NCs的FTIR图
(2)线性关系考察:精密称取野黄芩素对照品20 mg于量瓶中,加入甲醇超声溶解后定容摇匀,用甲醇将对照品溶液稀释成质量浓度分别为12、16、20、24、28mg/mL的系列梯度溶液。精密称取上述不同质量浓度梯度溶液,HPLC测定含量,以峰面积()为纵坐标,质量浓度()为横坐标,得标准曲线方程=0.960 8-0.338 1,=0.999 7,线性范围为12~28mg/mL。
2.5.2 溶出度检测方法 分别称取Scu-NCs冻干粉与相同处方物理混合物,选择桨法评价其体外溶出行为[16],转速为100 r/min,溶出介质为含SDS浓度为10 mg/mL的pH 6.8磷酸盐水溶液,溶出体积为900 mL,温度为(37.0±0.5)℃。分别于第5、15、30、45、60、90、120分钟取10 mL溶出介质,同时补充等体积等温度空白介质。取样后用0.22mm滤膜滤过,用HPLC法计算药物溶出度,绘制溶出度-时间曲线。结果如图4所示,与野黄芩素相比,Scu-NCs溶出速率显著增加,2 h内溶出度显著增加。Scu-NCs在5 min时累积溶出度达到72.50%,15 min时累积溶出度达到83.89%,而野黄芩素原料药5、15 min累积溶出度分别为10.39%、21.84%。120 min时野黄芩素原料药累积溶出度只有30.50%,而Scu-NCs可达到85.64%,是野黄芩素原料的2.8倍。结果表明,野黄芩素制备成纳米晶体可明显改善药物的溶出度,提高药物溶出速率。
2.6 野黄芩素凝胶的制备
2.6.1 Scu-NCs凝胶及野黄芩素凝胶制备 称取0.3%的卡波姆于适量纯化水溶胀24 h,称取不同浓度的Scu-NCs及野黄芩素于适量纯化水中分散均匀后加入到溶胀后的卡波姆中,加入8%丙二醇、0.3%三乙醇胺、10%甘油、0.1%羟苯甲酯及处方量纯化水后搅拌均匀,即得到野黄芩素质量分数为10、20、40 mg/g的Scu-NCs凝胶和野黄芩素凝胶。

图4 野黄芩素物理混合物和Scu-NCs溶出曲线(, n = 6)
2.6.2 体外释放度考察 使用Franz扩散池在35 ℃条件下考察野黄芩素、Scu-NCs凝胶剂及Scu-NCs纯水混悬液通过尼龙膜(0.22mm)的体外释放度[16]。扩散面积为2.2 cm2,接收池体积为8.0 mL,使用pH 6.8磷酸盐水溶液/PEG400(体积比1∶1)的混合物作为渗透介质,磁力搅拌器的转速为500 r/min。精密称取野黄芩素及Scu-NCs制备的凝胶剂200 mg涂敷于尼龙膜上,于实验开始后1、2、3、4、5、6 h于接收池中取样150mL,并同时补充等体积等温度空白介质。用HPLC法计算药物释放度,绘制累积释放度曲线。图5显示了3种制剂6 h内体外释放曲线,Scu-NCs混悬液组体外释放速度于实验开始2 h内较快,3 h左右变得缓慢;Scu-NCs凝胶组体外释放速度1~6 h内较均匀;Scu-NCs混悬液及Scu-NCs凝胶剂实验6 h内累积释放度分别为162.38、152.46mg/cm2,而野黄芩素凝胶剂渗透非常缓慢,6 h内累积释放度为0.94mg/cm2。结果表明,未经处理过的野黄芩素粗粉体外释放效率低,药物纳米结晶化可增加药物体外释放度,Scu-NCs凝胶化有助于延缓药物的释放,起到缓释作用。
2.7 药效考察
2.7.1 动物分组、建立模型与给药 50只BALB/c小鼠随机分为空白组,模型组,空白凝胶组,阳性药组,野黄芩素凝胶1%、2%、4%剂量组,Scu-NCs凝胶1%、2%、4%剂量组,每组5只。实验前2 d剃除小鼠颈背部约2 cm×3 cm面积区域毛发。空白组除外,其余各组于每天8:00时和16:00时用浸泡过丙酮乙醚混合液(acetone and ethyl ether,AE,丙酮-乙醚1∶1)的棉片于小鼠剃毛区域涂敷15 s,再使用浸泡过超纯水的面片于同一部位涂敷30 s,空白组小鼠使用纯水进行处理,每天2次,连续7 d[17];下午造膜处理90 min后,各剂量给药组分别给予含量1%、2%、4%野黄芩素凝胶及野黄芩素纳米结晶凝胶60 mg,阳性药组给予卡泊三醇倍他米松软膏60 mg,空白凝胶组给予空白凝胶60 mg,空白组使用纯水涂抹小鼠皮肤,连续处理7 d。

图5 野黄芩素、Scu-NCs凝胶剂及Scu-NCs混悬液体外渗透曲线(, n = 6)
2.7.2 各组小鼠背部皮肤观察 各组小鼠实验第7天造模及给药区域皮肤皮损情况见图6,对比发现,空白对照组小鼠背部皮肤较光滑,AEW组及空白凝胶组相较于空白对照组出现严重的皮肤干燥、结痂、鳞屑,阳性药及各给药组较模型组皮损情况有所减轻,相较于各浓度野黄芩素凝胶组,阳性药组及1%、2%、4% Scu-NCs凝胶组皮肤结痂及鳞屑较少。
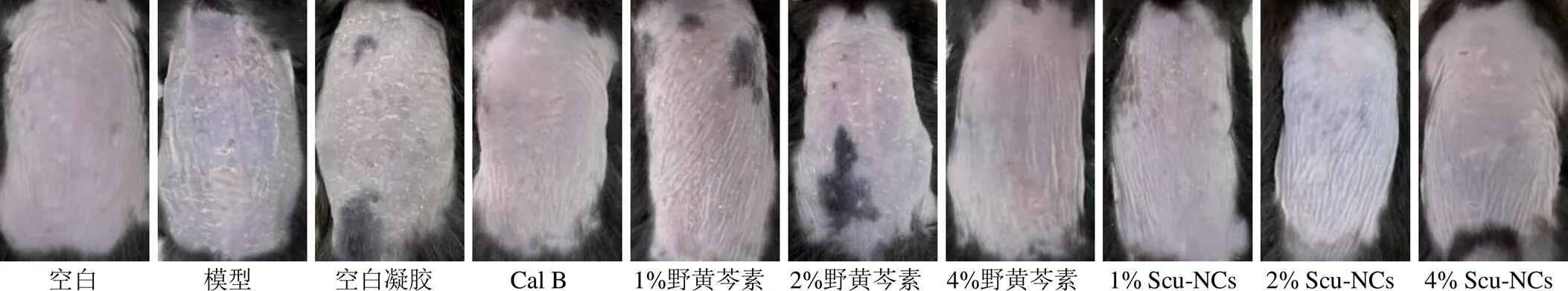
图6 实验第7天各组小鼠背部皮肤情况
2.7.3 小鼠瘙痒行为学观察 通过小鼠1 h内抓挠行为次数的对比来评价瘙痒的严重程度。实验第7天上午10:00时,将各只小鼠单独放置于透明观察笼内,等待20 min让小鼠适应陌生环境。通过摄像记录小鼠1 h内的抓挠行为,由不知情人员统计小鼠的抓挠次数。一次抓挠行为指的是小鼠抬起后爪抓挠颈背部造膜及给药部位的一次或多次动作,前爪及后爪对其他部位的抓挠动作不计。小鼠1 h内抓挠次数,如表5所示,与空白对照组相比,AEW模型组及空白凝胶组由瘙痒引起的抓挠行为显著增加(<0.001)。相较于AEW模型组,阳性药组及低、中、高剂量野黄芩素、Scu-NCs凝胶组由瘙痒引起的抓挠行为显著减少(<0.001)。进一步比较相同浓度Scu-NCs凝胶组与野黄芩素凝胶组小鼠,1 h内Scu-NCs凝胶组抓挠次数明显减少。
表5 小鼠抓挠行为学观察(, n = 5)
与空白组比较:###<0.001;与模型组比较:***<0.001;Scu-NCs组与相同浓度野黄芩素组比较:D<0.05。
###< 0.001blank group;***< 0.001model group;D< 0.05the same concentration of scutellarein in the Scu-NCs group.
2.7.4 皮肤组织病理检测 实验第8天,颈椎脱臼法处死各组小鼠,取小鼠颈背部造膜区域皮肤,10%福尔马林溶液固定48 h以上,常规脱水处理、石蜡包埋并进行3mm切片,进行苏木精-伊红(hematoxylin-eosin,H&E)染色,光学显微镜下观察皮肤组织病理变化,拍照后应用Image J软件分析表皮厚度。由图7可知,空白组小鼠背部皮肤结构较完整,角质层、表皮层无增厚,表皮平坦,真皮层炎症细胞浸润较少;模型组出现了明显的表皮层增厚,角质层广泛角化过度及角化不全,表皮不平坦,呈波浪状起伏,炎症细胞浸润增多现象;各给药组表皮层增厚现象减轻,表皮较平坦,除低剂量给药组,其余给药组炎症细胞浸润减少。
表皮厚度的增加是AEW模型成功的标志。由表6可知,AEW、blank gel、1%野黄芩素、2%野黄芩素组与空白对照组表皮厚度相比具有统计学差异(<0.05、0.01、0.001),其余各组与空白对照组相比无统计学差异;与野黄芩素组相比,相同浓度下Scu-NCs组表皮厚度较小但无统计学差异;浓度为1% Scu-NCs组与浓度为4%野黄芩素组表皮厚度相当;在浓度为4%时,Scu-NCs组表皮厚度小于阳性对照组。这表明,野黄芩素原料药制成纳米晶体后药效更好,与阳性对照药相当。
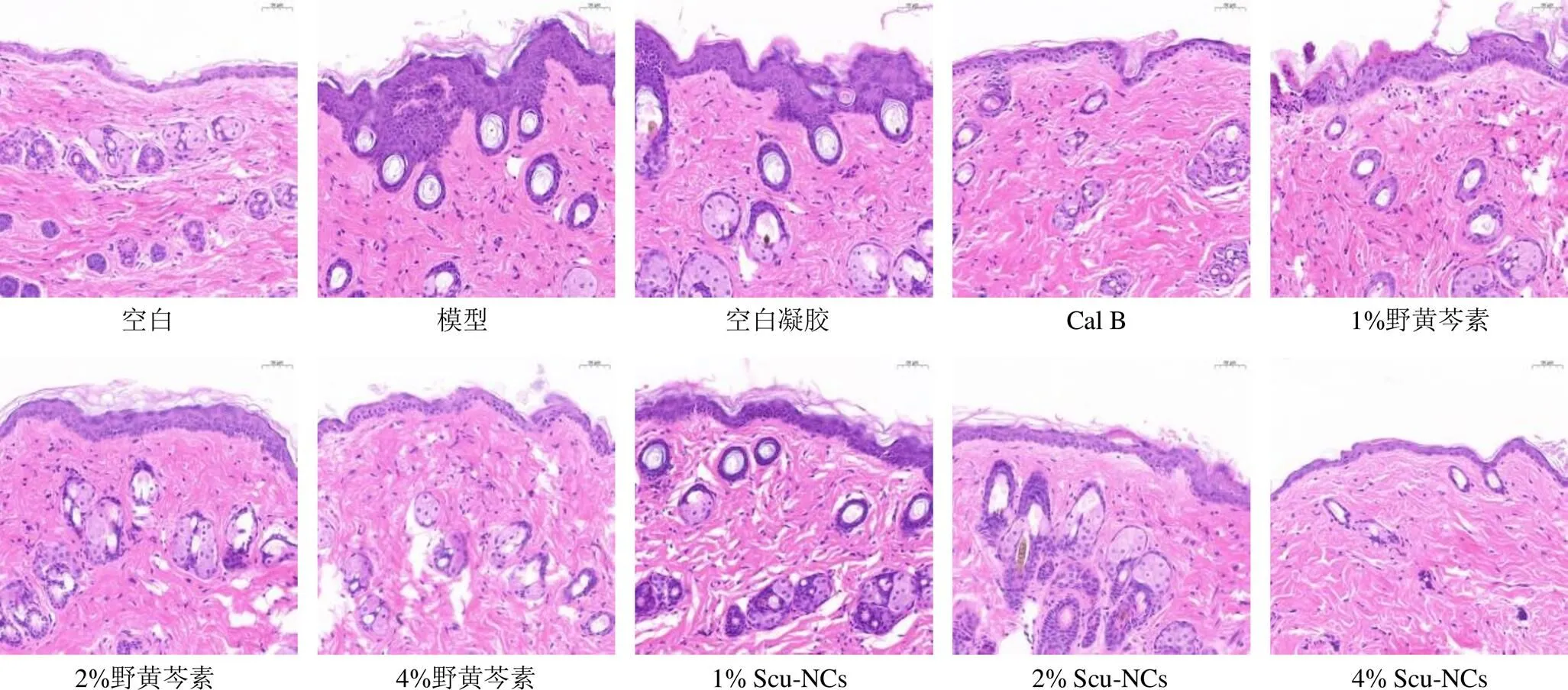
图7 小鼠颈背部皮肤病理学切片(HE, ×200)
表6 小鼠颈背部皮肤表皮厚度统计(, n = 5)
与空白组比较:#<0.05##<0.01###<0.001;与模型组比较:***<0.001。
#< 0.05##< 0.01###< 0.001blank group;***< 0.001model group.
2.7.5 炎症因子水平检测 取适量小鼠颈背部造膜区域皮肤制成匀浆,2 000~3 000 r/min离心取上清液,按照ELISA试剂盒说明书操作,检测各组小鼠背皮中IL-6、IL-1b、TNF-α炎症因子水平。与空白对照都相比,AEW模型组炎症因子IL-6、IL-1β、TNF-α表达水平显著升高(<0.001);与模型组相比,阳性药组、1%、2%、4%浓度野黄芩素组及Scu-NCs组炎症因子IL-6、IL-1β、TNF-α表达水平降低(<0.05、0.01、0.001)。相同浓度Scu-NCs凝胶组较野黄芩素凝胶组炎症因子IL-6、IL-1β、TNF-α表达较低(<0.05、0.01),结果见表7。相同药物浓度下,背部皮肤中IL-6表达水平在Scu-NCs组表达均低于野黄芩素组,1%低剂量Scu-NCs组IL-6水平甚至低于4%高剂量野黄芩素组。背部皮肤中IL-1β表达水平在Scu-NCs组表达均低于野黄芩素组,4% Scu-NCs组甚至低于阳性对照组。背部皮肤中TNF-α表达水平在Scu-NCs组表达均低于野黄芩素组,1%低剂量Scu-NCs组TNF-α表达水平甚至低于4%高剂量野黄芩素组,4% Scu-NCs组低于阳性药组与空白对照组。这表明,野黄芩素纳米晶体对炎症因子的降低具有更好的效果。
表7 各组小鼠颈背部皮肤炎症因子表达水平(, n = 5)
与空白组比较:###<0.001;与模型组比较:*<0.05**<0.01***<0.001;Scu-NCs组与相同浓度野黄芩素组比较:D<0.05DD<0.01。
###< 0.001blank group;*< 0.05**< 0.01***< 0.001model group;D< 0.05DD< 0.01the same concentration of scutellarein in the Scu-NCs group.
3 讨论
为防止药物聚集、晶体长大,通常使用适量的稳定剂来抑制纳米晶体粒子的成长速率。良好的稳定剂能够有效的与药物纳米晶体的疏水性表面吸附,提供给纳米晶体粒子足够的空间位阻或静电排斥力,以防止粒子聚集[18]。实验结果表明,稳定剂种类、浓度对Scu-NCs粒径有一定的影响。
通过正交试验筛选得到最佳工艺参数后,制得的Scu-NCs粒径远小于原料药,且分布均匀,晶型及结构并未发生明显变化。纳米晶体其具有较大的比表面积和较高的表观溶解度,因此,具有较大的溶出度[19]。本研究通过浆法证明Scu-NCs体外溶出度远高于原料药,通过扩散池法证明Scu-NCs凝胶体外扩散度远高于野黄芩素普通凝胶。
野黄芩素可抑制银屑病、特异性皮炎等皮肤病引起的瘙痒[20],Wang等[21]和Um等[22]的研究已证实野黄芩素可以通过选择性抑制瞬时受体电位离子通道香草素3(transient receptor potential vanilloid-3,Trpv3)来减轻特异性皮炎症状,sc野黄芩素可以抑制香芹酚诱导的小鼠皮肤瘙痒、增生和炎症。而IL-6、IL-1β、TNF-α是参与慢性瘙痒发生的重要炎症因子[23-24],本研究将Scu-NCs、野黄芩素制备成皮肤外用凝胶剂应用于AWE小鼠模型,药效实验表明,Scu-NCs及野黄芩素均可明显降低小鼠抓挠次数、颈背部表皮增厚及炎症因子IL-6、IL-1β、TNF-α水平,说明二者对AEW模型均有一定的治疗效果。
纳米晶体在经皮给药后可以在皮肤表面形成较高的浓度梯度;此外,纳米晶体较小的粒径可以蓄积在毛囊中,且具有好的生物黏附性,可延长其在皮肤表面的滞留时间[25],因此,药物纳米晶体化是促进难溶药物经皮转运的重要途经。对原料药和纳米晶体药效比较,Scu-NCs体现出更好的止痒药效,与阳性对照药卡泊三醇倍他米松相比无统计学差异,说明野黄芩素纳米结晶化可改善其经皮给药作用效果。
纳米晶体技术用于难溶性药物经皮给药,具有良好的临床应用前景,由于载药量大,其经皮递药能力比传统纳米载体更具优势。本研究为Scu-NCs应用于外用制剂领域提供了重要参考,但本研究仍具有一定的局限性,如Scu-NCs治疗干皮性慢性瘙痒模型的具体机制及Scu-NCs的促渗机制需进一步考察。
利益冲突 所有作者均声明不存在利益冲突
[1] Liao H F, Ye J, Gao L L,. The main bioactive compounds ofGeorgi. for alleviation of inflammatory cytokines: A comprehensive review [J]., 2021, 133: 110917.
[2] Shi X J, Chen G F, Liu X Q,. Scutellarein inhibits cancer cell metastasisand attenuates the development of fibrosarcoma[J]., 2015, 35(1): 31-38.
[3] 张人伟, 赵尔跃, 樊献俄. 高纯度灯盏花乙素原料药的制备工艺: 中国, CN101735291B [P]. 2011-11-30.
[4] Sun Z H, Xu W Q, Yuan Y,. Scutellarein stimulates human sperm function by increasing the levels of intracellular calcium and tyrosine phosphorylation [J]., 2022, 54(11): e14625.
[5] Shi Z H, Li N G, Shi Q P,. Synthesis of scutellarein derivatives to increase biological activity and water solubility [J]., 2015, 23(21): 6875-6884.
[6] Quinn H L, Kearney M C, Courtenay A J,. The role of microneedles for drug and vaccine delivery [J]., 2014, 11(11): 1769-1780.
[7] Ita K. Dissolving microneedles for transdermal drug delivery: Advances and challenges [J]., 2017, 93: 1116-1127.
[8] Roh Y S, Choi J, Sutaria N,. Itch: Epidemiology, clinical presentation, and diagnostic workup [J]., 2022, 86(1): 1-14.
[9] Tominaga M, Takamori K. Peripheral itch sensitization in atopic dermatitis [J]., 2022, 71(3): 265-277.
[10] 朱佳. 含β-葡聚糖和泛醇的喷雾剂对小鼠AEW模型修复皮肤屏障、缓解炎症及瘙痒的作用 [D]. 北京: 北京协和医学院, 2022.
[11] Moniaga C S, Tominaga M, Takamori K. Mechanisms and management of itch in dry skin [J]., 2020, 100(2): adv00024.
[12] 金锦花, 李科岩, 王玉慧, 等. 皮肤干燥症瘙痒小鼠模型的建立 [J]. 中华实用诊断与治疗杂志, 2020, 34(3): 246-249.
[13] Yang X, Miao X Q, Cao F R,. Nanosuspension development of scutellarein as an active and rapid orally absorbed precursor of its BCS class IV glycoside scutellarin [J]., 2014, 103(11): 3576-3584.
[14] Luo Z M, Sun W J, Fang J,. Biodegradable gelatin methacryloyl microneedles for transdermal drug delivery [J]., 2019, 8(3): e1801054.
[15] Scholz P, Keck C M. Nanoemulsions produced by rotor-stator high speed stirring [J]., 2015, 482(1/2): 110-117.
[16] 中国药典[S]. 四部. 2020: 132-137.
[17] 刘丽娟, 吴亚运, 赵亚, 等. 和肤止痒方对AEW诱导的慢性瘙痒小鼠皮肤屏障功能及AQP3、Caspase-14蛋白表达的影响 [J]. 中华中医药杂志, 2023, 38(1): 347-351.
[18] 刘阳, 谢锦, 许俊男, 等. 药物固体纳米晶体稳定性关键影响因素的研究进展 [J]. 中国医药工业杂志, 2018, 49(8): 1073-1082.
[19] Pireddu R, Caddeo C, Valenti D,. Diclofenac acid nanocrystals as an effective strategy to reduceskin inflammation by improving dermal drug bioavailability [J]., 2016, 143: 64-70.
[20] 栾冰. 从中药组分对HUVECs模型的影响探索化瘀通络中药抑制银屑病血管新生机制[D]. 北京: 中国中医科学院, 2021.
[21] Wang Y J, Tan L X, Jiao K J,. Scutellarein attenuates atopic dermatitis by selectively inhibiting transient receptor potential vanilloid 3 channels [J]., 2022, 179(20): 4792-4808.
[22] Um J Y, Kim H B, Kim J C,. TRPV3 and itch: The role of TRPV3 in chronic pruritus according to clinical and experimental evidence [J]., 2022, 23(23): 14962.
[23] 刘雪婷, 曾丽萍, 邹泽红, 等. 促炎和抗炎细胞因子及VEGF在AEW诱发的干皮症痒模型小鼠脊髓水平的表达 [J]. 中国皮肤性病学杂志, 2018, 32(4): 401-405.
[24] Du B, Bian Z X, Xu B J. Skin health promotion effects of natural beta-glucan derived from cereals and microorganisms: A review [J]., 2014, 28(2): 159-166.
[25] Shen C, Shen B, Shen G,. Therapeutic effects of nanogel containing triterpenoids isolated from(GLT) using therapeutic ultrasound (TUS) for frostbite in rats [J]., 2016, 23(8): 2643-2650.
Preparation of scutellarein nanocrystals and evaluation of its efficacy in treatment of chronic pruritus model
LIU Xinying1, 2, WANG Fujiang2, GE Haitao1, 2
1. Nanjing University of Chinese Medicine, Nanjing 210023, China 2. Jiangsu Suzhong Pharmaceutical Research Institute Co., Ltd., Nanjing 210031, China
To prepare scutellarein nanocrystals (Scu-NCs), investigate their pharmaceutical characteristics and their therapeutic effects on a mouse model of dry and itchy skin.The Scu-NCs were prepared by anti-solvent precipitation technique and solidified into solid powder by freeze-drying technique; The average particle size, dispersion coefficient, ζ potential, and microstructure of Scu-NCs were determined; Differential scanning calorimetry (DSC) and Fourier transform infrared spectroscopy (FTIR) were used to analyze the changes in crystalline shape and chemical structure of Scu-NCs; The dissolution rate of the drug and the release degree of the gelwere tested; and the itch-relieving effects of the transdermal administration of scutellarein and Scu-NCs gel on the mouse model of dry and itchy skin induced by acetone/ethyl ether and water (AEW) were evaluated.The average particle size of the prepared Scu-NCs was (379.1 ± 1.7) nm, the polydispersity index (PDI) value was 0.238 ± 0.081, and the ζ potential was (25.50 ± 0.25) mV; The crystalline shape and chemical structure of scutellarein after nano conversion did not change significantly; There was no significant change in the particle size of Scu-NCs after freeze-drying; The nano conversion of scutellarein improved the drug dissolution rate within 2 h, dissolution degree and the release degree of the Scu-NCs gelwithin 6 h; Compared with the AEW model group, the scutellarein and Scu-NCs gel administration group could significantly reduce the number of scratching within 1 h, inhibit epidermal thickening of the nape of the neck and expression of interleukin-6 (IL-6), interleukin-1β (IL-1β), and tumor necrosis factor-α (TNF-α) in the skin, and the inhibitory effect of Scu-NCs was more obvious on the AEW model.The particle size of Scu-NCs was small and uniform, and there was no significant change in the crystal shape and chemical structure after its nano conversion; The preparation of scutellarein into nanocrystals significantly improved the dissolution andrelease degree of the drug, and provided a better therapeutic effect on local chronic itching of the skin.
scutellarein; nanocrystals; gel; chronic itching; external preparations; anti-solvent precipitation technique; freeze-drying technique; interleukin; tumor necrosis factor-α
R283.6
A
0253 - 2670(2024)09 - 2946 - 09
10.7501/j.issn.0253-2670.2024.09.009
2023-10-19
泰州市“凤城英才计划”青年科技人才托举工程;南京中医药大学自然科学基金项目(XZR2020099)
刘新颖(1999—),女,硕士,从事中药制药技术与产品开发研究。Tel: 13770824736 E-mail: liuxinying016@163.com
通信作者:葛海涛(1974—),男,博士,高级工程师,从事中药新药研究及中药大品种二次开发研究。Tel: 13851872795 E-mail: geht@suzhongyy.com
王富江,(1987—),男,博士,高级工程师,从事新药创新药研发研究。Tel: 18351834272 E-mail: wangfj@suzhongyy.com
[责任编辑 郑礼胜]

